Лекция-9_10_синтез олигонуклеотидов_аналогов.ppt
- Количество слайдов: 52
 ХИМИЧЕСКИЙ И ХИМИКО-ФЕРМЕНТАТИВНЫЙ СИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ И ИХ НЕПРИРОДНЫХ АНАЛОГОВ • • • Методы образования фосфодиэфирной связи: химические и ферментативные методы синтеза. Фосфодиэфирный и фосфотриэфирный методы синтеза олигонуклеотидов. Твердофазный фосфотриэфирный метод синтеза олигонуклеотидов (амидофосфитный вариант). Н-фосфонатный синтез олигорибонуклеотидов. Схема синтеза фосфодиэфирной связи твердофазным амидофосфитным методом. Образование связи между Р- и ОН-компонентами. Роль тетразола. Стадия кэпирование. Окисление фосфиттриэфирного фрагмента. Цикличность синтеза на полимере как основа для автоматизации. Выделение, очистка и идентификация синтетических олиго- и полинуклеотидов. Схема синтеза фосфодиэфирной связи твердофазным H-фосфонатным методом. Две стадии синтетического цикла: удаление диметокситритильной защиты и конденсация. Использование нуклеозидных H-фосфонатов в качестве строительных блоков, а пивалоилхлорида, 2, 4, 6 -триизопропилбензолсульфонилхлорида и других соединений – в качестве активаторов. Окисление H-фосфонатной диэфирной связи между нуклеозидами в фосфодиэфирные связи. Защита функциональных групп. Характер защитных групп при химическом синтезе олигонуклеотидов. Основные требования к защитным группам. Блокирование и деблокирование аминогрупп гетероциклических оснований: ацетильная, бензоильная, изобутирильная и N, N-диметилформамидодиметилацетильная защиты. Основные способы введения и удаления защитных групп, механизмы соответствующих процессов. Блокирование и деблокирование гидроксильных групп остатков пентозы: диметокситритильная защита (5’-ОН-группы); ацильная (3’-ОНгруппы); трет-бутилдиметилсилильная и триизопропилсилилоксиметильная защиты (2’-ОН-группы). Основные способы введения и удаления защитных групп, механизмы соответствующих процессов.
ХИМИЧЕСКИЙ И ХИМИКО-ФЕРМЕНТАТИВНЫЙ СИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ И ИХ НЕПРИРОДНЫХ АНАЛОГОВ • • • Методы образования фосфодиэфирной связи: химические и ферментативные методы синтеза. Фосфодиэфирный и фосфотриэфирный методы синтеза олигонуклеотидов. Твердофазный фосфотриэфирный метод синтеза олигонуклеотидов (амидофосфитный вариант). Н-фосфонатный синтез олигорибонуклеотидов. Схема синтеза фосфодиэфирной связи твердофазным амидофосфитным методом. Образование связи между Р- и ОН-компонентами. Роль тетразола. Стадия кэпирование. Окисление фосфиттриэфирного фрагмента. Цикличность синтеза на полимере как основа для автоматизации. Выделение, очистка и идентификация синтетических олиго- и полинуклеотидов. Схема синтеза фосфодиэфирной связи твердофазным H-фосфонатным методом. Две стадии синтетического цикла: удаление диметокситритильной защиты и конденсация. Использование нуклеозидных H-фосфонатов в качестве строительных блоков, а пивалоилхлорида, 2, 4, 6 -триизопропилбензолсульфонилхлорида и других соединений – в качестве активаторов. Окисление H-фосфонатной диэфирной связи между нуклеозидами в фосфодиэфирные связи. Защита функциональных групп. Характер защитных групп при химическом синтезе олигонуклеотидов. Основные требования к защитным группам. Блокирование и деблокирование аминогрупп гетероциклических оснований: ацетильная, бензоильная, изобутирильная и N, N-диметилформамидодиметилацетильная защиты. Основные способы введения и удаления защитных групп, механизмы соответствующих процессов. Блокирование и деблокирование гидроксильных групп остатков пентозы: диметокситритильная защита (5’-ОН-группы); ацильная (3’-ОНгруппы); трет-бутилдиметилсилильная и триизопропилсилилоксиметильная защиты (2’-ОН-группы). Основные способы введения и удаления защитных групп, механизмы соответствующих процессов.
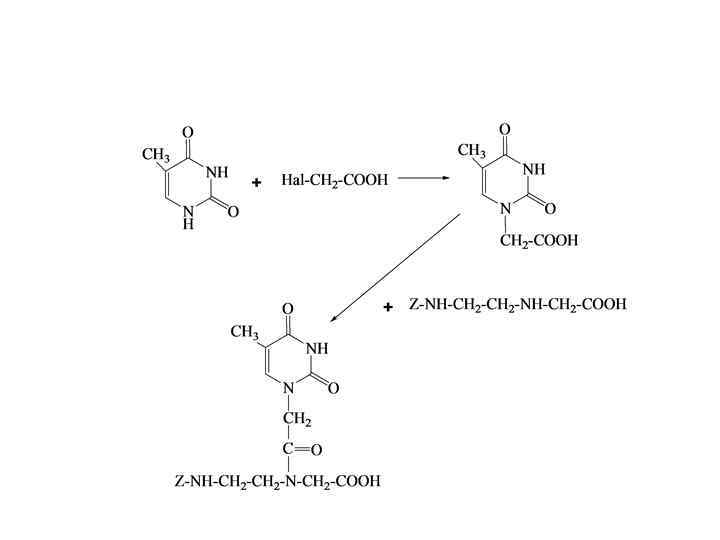
 ХИМИЧЕСКИЙ И ХИМИКО-ФЕРМЕНТАТИВНЫЙ СИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ И ИХ НЕПРИРОДНЫХ АНАЛОГОВ • • • Приготовление нуклеозидного (ОН-компонента) и нуклеотидного (Р-компонента) компонентов. Введение защитных групп в нуклеозиды. Получение нуклеотидного компонента через фосфорилирвание нуклеозида соединениями трехвалентного фосфора. Ненуклеозидные амидофосфиты для введения в олигонуклеотиды различных групп: 5'-фосфата, аминогруппы, меркаптогруппы, альдегидной и карбоксильной групп, алкиновых фрагментов, флуоресцентных красителей и тушителей, гидрофильных и гидрофобных модификаций, биотина. Способы присоединения первого нуклеозидного остатка к полимерному носителю и снятия синтезированного олигонуклеотида с полимера. Универсальные, нуклеозидные и специальные носители. Тиофосфатные олигонуклеотиды. Схема синтеза твердофазным H-фосфонатным методом. Реакции кэпирования и сульфурирования. Пептидные, морфолиновые и конформационно-ограниченные аналоги олигонуклеотидов. Схемы синтезов. Стадии для получения мономеров аналогов олигонуклеотидов, у которых углеводный фрагмент заменен на кольцо морфолина: последовательное окисление цис-диольной группы периодатом, обработка аммиаком для замыкания в морфолиновый цикл, восстановление вторичных ОНгрупп боргидридом натрия, защита атома N-морфилинового цикла тритильной группой, введение по первичной ОН-группе хлордиметиламидофосфорильной группы. Селективное алкилирование по атомам азота в пуринах и пиримидинах и последующее ацилирование – ключевые шаги в синтезе пептидных аналогов.
ХИМИЧЕСКИЙ И ХИМИКО-ФЕРМЕНТАТИВНЫЙ СИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ И ИХ НЕПРИРОДНЫХ АНАЛОГОВ • • • Приготовление нуклеозидного (ОН-компонента) и нуклеотидного (Р-компонента) компонентов. Введение защитных групп в нуклеозиды. Получение нуклеотидного компонента через фосфорилирвание нуклеозида соединениями трехвалентного фосфора. Ненуклеозидные амидофосфиты для введения в олигонуклеотиды различных групп: 5'-фосфата, аминогруппы, меркаптогруппы, альдегидной и карбоксильной групп, алкиновых фрагментов, флуоресцентных красителей и тушителей, гидрофильных и гидрофобных модификаций, биотина. Способы присоединения первого нуклеозидного остатка к полимерному носителю и снятия синтезированного олигонуклеотида с полимера. Универсальные, нуклеозидные и специальные носители. Тиофосфатные олигонуклеотиды. Схема синтеза твердофазным H-фосфонатным методом. Реакции кэпирования и сульфурирования. Пептидные, морфолиновые и конформационно-ограниченные аналоги олигонуклеотидов. Схемы синтезов. Стадии для получения мономеров аналогов олигонуклеотидов, у которых углеводный фрагмент заменен на кольцо морфолина: последовательное окисление цис-диольной группы периодатом, обработка аммиаком для замыкания в морфолиновый цикл, восстановление вторичных ОНгрупп боргидридом натрия, защита атома N-морфилинового цикла тритильной группой, введение по первичной ОН-группе хлордиметиламидофосфорильной группы. Селективное алкилирование по атомам азота в пуринах и пиримидинах и последующее ацилирование – ключевые шаги в синтезе пептидных аналогов.
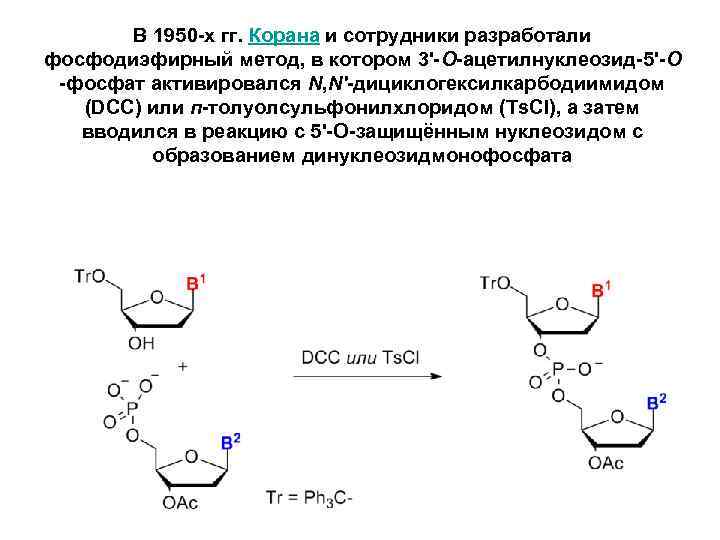 В 1950 -х гг. Корана и сотрудники разработали фосфодиэфирный метод, в котором 3'-O-ацетилнуклеозид-5'-O -фосфат активировался N, N'-дициклогексилкарбодиимидом (DCC) или п-толуолсульфонилхлоридом (Ts. Cl), а затем вводился в реакцию с 5'-O-защищённым нуклеозидом с образованием динуклеозидмонофосфата
В 1950 -х гг. Корана и сотрудники разработали фосфодиэфирный метод, в котором 3'-O-ацетилнуклеозид-5'-O -фосфат активировался N, N'-дициклогексилкарбодиимидом (DCC) или п-толуолсульфонилхлоридом (Ts. Cl), а затем вводился в реакцию с 5'-O-защищённым нуклеозидом с образованием динуклеозидмонофосфата
 Фосфодиэфирный метод • С использованием фосфодиэфирного метода были синтезированы наборы три- и тетрадезоксирибонуклеотидов, которые затем были превращены в более длинные олигонуклеотиды, позволившие расшифровать генетический код. Главным ограничением метода является образование пирофосфатных олигомеров и олигонуклеотидов, разветвлённых у межнуклеозидной фосфатной группы. Отсутствие удобной стратегии защиты потребовала отказа от данного метода.
Фосфодиэфирный метод • С использованием фосфодиэфирного метода были синтезированы наборы три- и тетрадезоксирибонуклеотидов, которые затем были превращены в более длинные олигонуклеотиды, позволившие расшифровать генетический код. Главным ограничением метода является образование пирофосфатных олигомеров и олигонуклеотидов, разветвлённых у межнуклеозидной фосфатной группы. Отсутствие удобной стратегии защиты потребовала отказа от данного метода.
 Фосфотриэфирный метод синтеза олигонуклеотидов • Ключевой стадией химического синтеза олигонуклеотидов является создание фосфодиэфирной связи между нуклеотидами. Один из основных подходов к решению этой задачи использует в качестве источника фосфатной группы диэтерифицированные фосфаты (фосфодиэфиры). В этом случае при химическом синтезе получается триэфир фосфорной кислоты, который затем при полном деблокировании превращается в диэфир. Поэтому метод носит название фосфотриэфирного. Одним из распространенных вариантов фосфотриэфирного метода является фосфитный метод, в котором на первом этапе образуется фосфитный эфир, окисляющийся затем в триэфир фосфорной кислоты.
Фосфотриэфирный метод синтеза олигонуклеотидов • Ключевой стадией химического синтеза олигонуклеотидов является создание фосфодиэфирной связи между нуклеотидами. Один из основных подходов к решению этой задачи использует в качестве источника фосфатной группы диэтерифицированные фосфаты (фосфодиэфиры). В этом случае при химическом синтезе получается триэфир фосфорной кислоты, который затем при полном деблокировании превращается в диэфир. Поэтому метод носит название фосфотриэфирного. Одним из распространенных вариантов фосфотриэфирного метода является фосфитный метод, в котором на первом этапе образуется фосфитный эфир, окисляющийся затем в триэфир фосфорной кислоты.
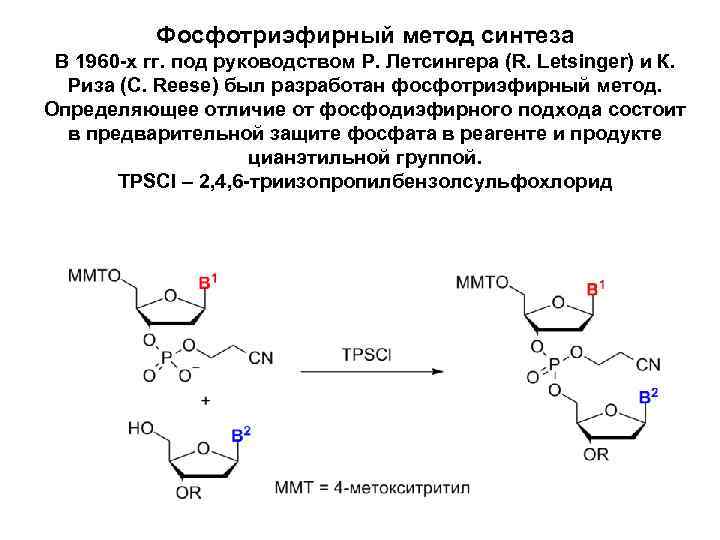 Фосфотриэфирный метод синтеза В 1960 -х гг. под руководством Р. Летсингера (R. Letsinger) и К. Риза (C. Reese) был разработан фосфотриэфирный метод. Определяющее отличие от фосфодиэфирного подхода состоит в предварительной защите фосфата в реагенте и продукте цианэтильной группой. TPSCl – 2, 4, 6 -триизопропилбензолсульфохлорид
Фосфотриэфирный метод синтеза В 1960 -х гг. под руководством Р. Летсингера (R. Letsinger) и К. Риза (C. Reese) был разработан фосфотриэфирный метод. Определяющее отличие от фосфодиэфирного подхода состоит в предварительной защите фосфата в реагенте и продукте цианэтильной группой. TPSCl – 2, 4, 6 -триизопропилбензолсульфохлорид
 Фосфотриэфирный метод синтеза • Предварительная защита фосфата в реагенте и продукте цианэтильной группой исключила возможность образования олигонуклеотидов с разветвлением у фосфатных групп. Бо льшая селективность метода позволила использовать более реакционноспособные конденсирующие реагенты и катализаторы, которые значительно уменьшили продолжительность синтеза. Метод, изначально разработанный для синтеза в растворе, был также применен и в твердофазном синтезе, первоначально на полистироле с низкой степенью сшивки, что инициировало широкий научный поиск в твердофазном синтезе олигонуклеотидов и в конечном итоге привело к автоматизации синтеза.
Фосфотриэфирный метод синтеза • Предварительная защита фосфата в реагенте и продукте цианэтильной группой исключила возможность образования олигонуклеотидов с разветвлением у фосфатных групп. Бо льшая селективность метода позволила использовать более реакционноспособные конденсирующие реагенты и катализаторы, которые значительно уменьшили продолжительность синтеза. Метод, изначально разработанный для синтеза в растворе, был также применен и в твердофазном синтезе, первоначально на полистироле с низкой степенью сшивки, что инициировало широкий научный поиск в твердофазном синтезе олигонуклеотидов и в конечном итоге привело к автоматизации синтеза.
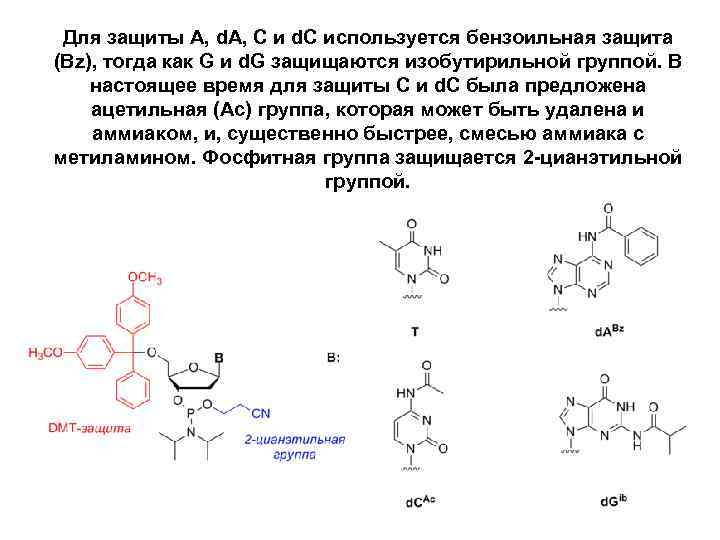 Для защиты A, d. A, C и d. C используется бензоильная защита (Bz), тогда как G и d. G защищаются изобутирильной группой. В настоящее время для защиты C и d. C была предложена ацетильная (Ac) группа, которая может быть удалена и аммиаком, и, существенно быстрее, смесью аммиака с метиламином. Фосфитная группа защищается 2 -цианэтильной группой.
Для защиты A, d. A, C и d. C используется бензоильная защита (Bz), тогда как G и d. G защищаются изобутирильной группой. В настоящее время для защиты C и d. C была предложена ацетильная (Ac) группа, которая может быть удалена и аммиаком, и, существенно быстрее, смесью аммиака с метиламином. Фосфитная группа защищается 2 -цианэтильной группой.
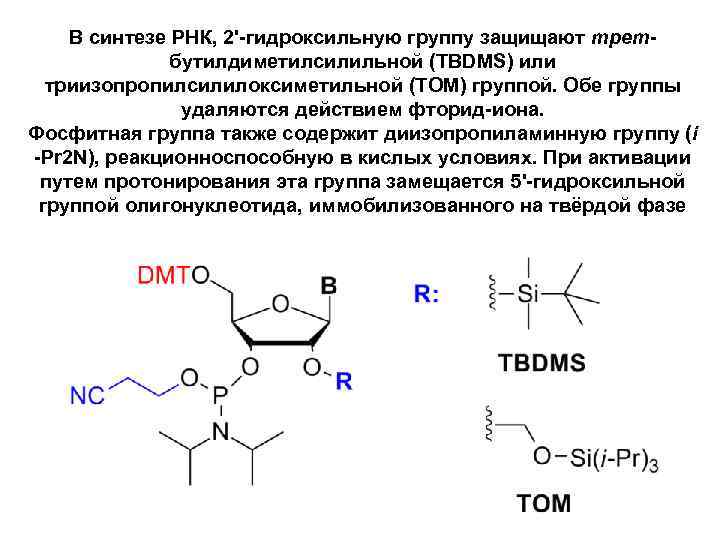 В синтезе РНК, 2'-гидроксильную группу защищают третбутилдиметилсилильной (TBDMS) или триизопропилсилилоксиметильной (TOM) группой. Обе группы удаляются действием фторид-иона. Фосфитная группа также содержит диизопропиламинную группу (i -Pr 2 N), реакционноспособную в кислых условиях. При активации путем протонирования эта группа замещается 5'-гидроксильной группой олигонуклеотида, иммобилизованного на твёрдой фазе
В синтезе РНК, 2'-гидроксильную группу защищают третбутилдиметилсилильной (TBDMS) или триизопропилсилилоксиметильной (TOM) группой. Обе группы удаляются действием фторид-иона. Фосфитная группа также содержит диизопропиламинную группу (i -Pr 2 N), реакционноспособную в кислых условиях. При активации путем протонирования эта группа замещается 5'-гидроксильной группой олигонуклеотида, иммобилизованного на твёрдой фазе
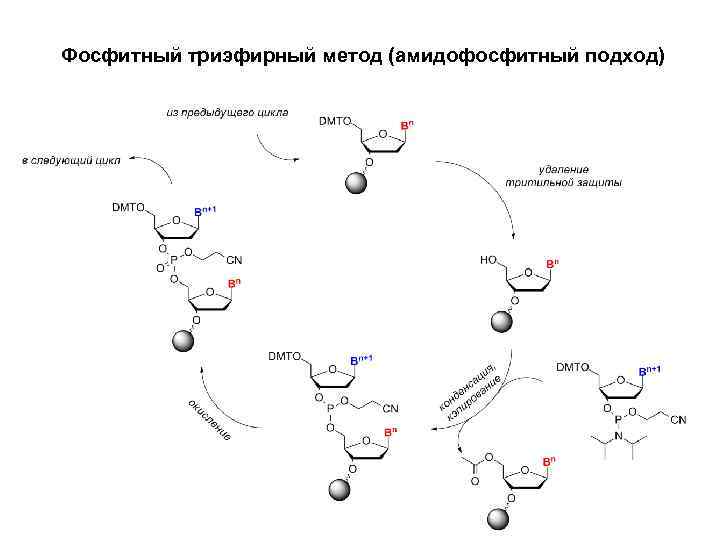 Фосфитный триэфирный метод (амидофосфитный подход)
Фосфитный триэфирный метод (амидофосфитный подход)
 Этапы синтеза • Стадия 1: Удаление тритильной защиты • Защитная группа DMT снимается раствором кислоты, например, 2%-ой трихлоруксусной или 3%-ой дихлоруксусной кислотой в инертном растворителе (хлористый метилен или толуол). Образующийся диметокситритильный катион оранжевого цвета вымывается из системы. В результате образуется закреплённый на твердофазном носителе предшественник олигонуклеотида со свободной 5'-гидроксильной группой. Проведение процесса в течение более длительного времени или с использованием более концентрированных растворов кислоты приводит к отщеплению пуриновых оснований от остатка сахара.
Этапы синтеза • Стадия 1: Удаление тритильной защиты • Защитная группа DMT снимается раствором кислоты, например, 2%-ой трихлоруксусной или 3%-ой дихлоруксусной кислотой в инертном растворителе (хлористый метилен или толуол). Образующийся диметокситритильный катион оранжевого цвета вымывается из системы. В результате образуется закреплённый на твердофазном носителе предшественник олигонуклеотида со свободной 5'-гидроксильной группой. Проведение процесса в течение более длительного времени или с использованием более концентрированных растворов кислоты приводит к отщеплению пуриновых оснований от остатка сахара.
 ЭТАПЫ СИНТЕЗА • • Стадия 2: Конденсация Раствор нуклеозидного амидофосфита (0, 02 -0, 2 М) или смеси нескольких амидофосфитов в ацетонитриле активируют 0, 2 -0, 7 М раствором катализатора на основе азола, например, 1 Н-тетразола. Смешение компонентов происходит в коммуникационных линиях синтезатора в процессе доставки реагентов в реактор, содержащий твердофазный носитель. Активированный амидофосфит в 1, 5 -20 кратном избытке приводится во взаимодействие с исходным носителем (первая конденсация) или предшественником олигонуклеотида на носителе (последующие конденсации), 5'гидроксильная группа которого реагирует с активированной амидофосфитной группой с образованием фосфитной триэфирной связи. Конденсация амидофосфитов 2'-дезоксинуклеозидов протекает очень быстро и в небольшом масштабе занимает, как правило, около 20 с. Пространственно-затрудненные амидофосфиты рибонуклеозидов реагируют значительно медленнее (5 -15 мин). Реакция весьма чувствительна к присутствию воды, особенно при использовании разбавленных растворов амидофосфитов, поэтому она проводится в безводном растворителе, обычно, ацетонитриле. При увеличении масштабов синтеза используют меньшие избытки и более концентрированные растворы амидофосфитов. После завершения реакции избыток реагентов и побочные продукты удаляются из реактора промыванием.
ЭТАПЫ СИНТЕЗА • • Стадия 2: Конденсация Раствор нуклеозидного амидофосфита (0, 02 -0, 2 М) или смеси нескольких амидофосфитов в ацетонитриле активируют 0, 2 -0, 7 М раствором катализатора на основе азола, например, 1 Н-тетразола. Смешение компонентов происходит в коммуникационных линиях синтезатора в процессе доставки реагентов в реактор, содержащий твердофазный носитель. Активированный амидофосфит в 1, 5 -20 кратном избытке приводится во взаимодействие с исходным носителем (первая конденсация) или предшественником олигонуклеотида на носителе (последующие конденсации), 5'гидроксильная группа которого реагирует с активированной амидофосфитной группой с образованием фосфитной триэфирной связи. Конденсация амидофосфитов 2'-дезоксинуклеозидов протекает очень быстро и в небольшом масштабе занимает, как правило, около 20 с. Пространственно-затрудненные амидофосфиты рибонуклеозидов реагируют значительно медленнее (5 -15 мин). Реакция весьма чувствительна к присутствию воды, особенно при использовании разбавленных растворов амидофосфитов, поэтому она проводится в безводном растворителе, обычно, ацетонитриле. При увеличении масштабов синтеза используют меньшие избытки и более концентрированные растворы амидофосфитов. После завершения реакции избыток реагентов и побочные продукты удаляются из реактора промыванием.
 ЭТАПЫ СИНТЕЗА • • Стадия 3. Кэпирование. Проводится путём обработки твердофазного носителя смесью уксусного ангидрида и 1 -метилимидазола (реже – N, Nдиметиламинопиридина) в качестве катализатора. В рамках амидофосфитного синтеза эта стадия служит двум целям: 1) После завершения стадии конденсации небольшая доля 5'-гидроксильных групп (0, 1 -1 %) остаётся непрореагировавшими и должна быть выведена из процесса дальнейшего удлинения цепи, чтобы предотвратить образование олигонуклеотидов с недостающими нуклеотидныим остатками внутри цепи. С этой целью оставшиеся гидроксильные группы защищаются ацетильными группами, устойчивыми к действию растворов кислот, используемых для снятия DMT-защиты. 2) Сообщалось также, что амидофосфиты, активированные 1 H-тетразолом, с невысоким выходом реагируют с кислородом карбонильной группы в O 6 -положении гуанозина. При окислении смесью I 2/вода этот побочный продукт претерпевает отщепление пуринового основания. Образующиеся апуриновые сайты легко гидролизуются в ходе конечного снятия защитных групп олигонуклеотида, что приводит к образованию двух более коротких олигонуклеотидов и уменьшению выхода целевого продукта. O 6 модификации быстро удаляются под действием кэпирующего реагента, если кэпирование проводится перед стадией окисления.
ЭТАПЫ СИНТЕЗА • • Стадия 3. Кэпирование. Проводится путём обработки твердофазного носителя смесью уксусного ангидрида и 1 -метилимидазола (реже – N, Nдиметиламинопиридина) в качестве катализатора. В рамках амидофосфитного синтеза эта стадия служит двум целям: 1) После завершения стадии конденсации небольшая доля 5'-гидроксильных групп (0, 1 -1 %) остаётся непрореагировавшими и должна быть выведена из процесса дальнейшего удлинения цепи, чтобы предотвратить образование олигонуклеотидов с недостающими нуклеотидныим остатками внутри цепи. С этой целью оставшиеся гидроксильные группы защищаются ацетильными группами, устойчивыми к действию растворов кислот, используемых для снятия DMT-защиты. 2) Сообщалось также, что амидофосфиты, активированные 1 H-тетразолом, с невысоким выходом реагируют с кислородом карбонильной группы в O 6 -положении гуанозина. При окислении смесью I 2/вода этот побочный продукт претерпевает отщепление пуринового основания. Образующиеся апуриновые сайты легко гидролизуются в ходе конечного снятия защитных групп олигонуклеотида, что приводит к образованию двух более коротких олигонуклеотидов и уменьшению выхода целевого продукта. O 6 модификации быстро удаляются под действием кэпирующего реагента, если кэпирование проводится перед стадией окисления.
 ЭТАПЫ СИНТЕЗА • Стадия 4: Окисление • Полученная в результате конденсации межнуклеозидная трехкоординированная фосфитная группа не является природной и обладает ограниченной стабильностью в условиях синтеза. Обработка носителя йодом и водой в присутствии слабого основания (пиридина) окисляет фосфит в фосфотриэфир, предшественник природной фосфодиэфирной межнуклеозидной связи.
ЭТАПЫ СИНТЕЗА • Стадия 4: Окисление • Полученная в результате конденсации межнуклеозидная трехкоординированная фосфитная группа не является природной и обладает ограниченной стабильностью в условиях синтеза. Обработка носителя йодом и водой в присутствии слабого основания (пиридина) окисляет фосфит в фосфотриэфир, предшественник природной фосфодиэфирной межнуклеозидной связи.
 Наиболее часто употребимыми носителями являются CPG (controlled pore glass, стекло с регулируемым размером пор) и MPPS (макропористый полистирол). • Главной характеристикой CPG является размер пор. Для синтеза олигонуклеотидов длиной около 50, 80, 100, 150 и 200 оснований пользуются стеклом с размером пор 500, 1000, 1500, 2000 и 3000 Å соответственно. Для того, чтобы сделать такой носитель пригодным для синтеза, его обрабатывают (3 -аминопропил)триэтоксисиланом (APTES), получая аминопропильное CPG. Аминопропильный спейсер может быть существенно удлинен; полученные таким образом носители называют LCAA (long chain aminoalkyl) CPG. Аминогруппа на поверхности стекла далее используется как якорная группа для различных линкеров, используемых в химии олигонуклеотидов. • MPPS, используемый в синтезе олигонуклеотидов, - это слабонабухающий полистирол с высокой степенью сшивки, получаемый сополимеризацией дивинилбензола (минимум 60 %), стирола и 4 -хлорметилстирола. Получаемый при этом макропористый хлорметильный полистирол затем превращают в аминометильный MPPS.
Наиболее часто употребимыми носителями являются CPG (controlled pore glass, стекло с регулируемым размером пор) и MPPS (макропористый полистирол). • Главной характеристикой CPG является размер пор. Для синтеза олигонуклеотидов длиной около 50, 80, 100, 150 и 200 оснований пользуются стеклом с размером пор 500, 1000, 1500, 2000 и 3000 Å соответственно. Для того, чтобы сделать такой носитель пригодным для синтеза, его обрабатывают (3 -аминопропил)триэтоксисиланом (APTES), получая аминопропильное CPG. Аминопропильный спейсер может быть существенно удлинен; полученные таким образом носители называют LCAA (long chain aminoalkyl) CPG. Аминогруппа на поверхности стекла далее используется как якорная группа для различных линкеров, используемых в химии олигонуклеотидов. • MPPS, используемый в синтезе олигонуклеотидов, - это слабонабухающий полистирол с высокой степенью сшивки, получаемый сополимеризацией дивинилбензола (минимум 60 %), стирола и 4 -хлорметилстирола. Получаемый при этом макропористый хлорметильный полистирол затем превращают в аминометильный MPPS.
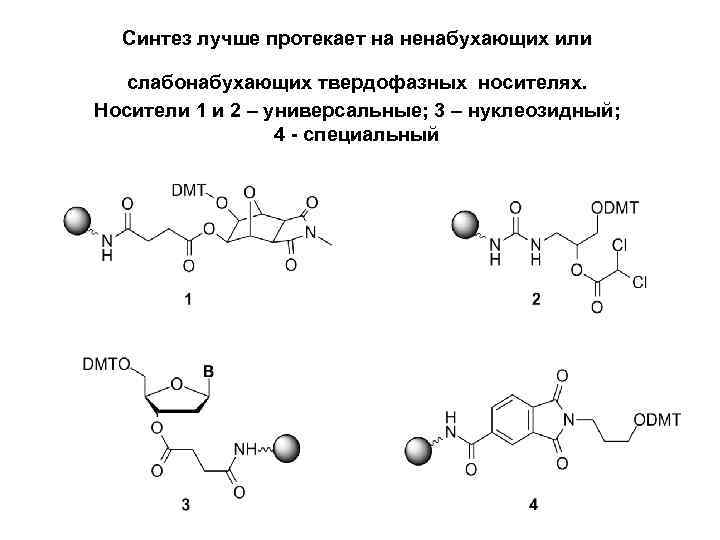 Синтез лучше протекает на ненабухающих или слабонабухающих твердофазных носителях. Носители 1 и 2 – универсальные; 3 – нуклеозидный; 4 - специальный
Синтез лучше протекает на ненабухающих или слабонабухающих твердофазных носителях. Носители 1 и 2 – универсальные; 3 – нуклеозидный; 4 - специальный
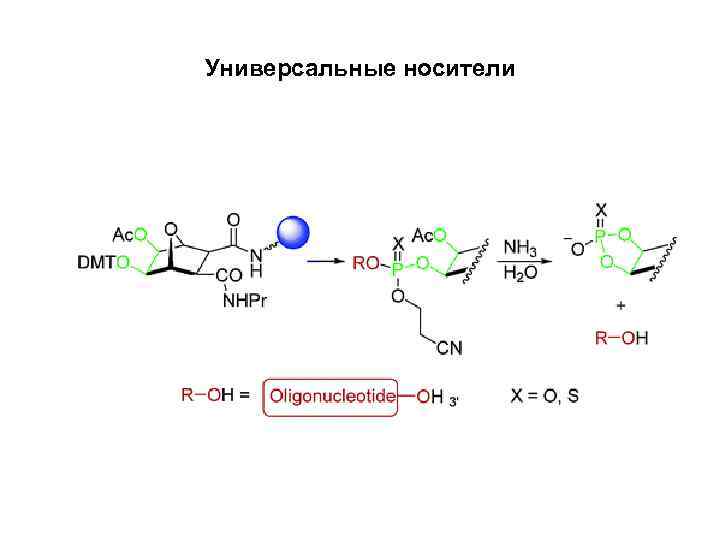 Универсальные носители
Универсальные носители
 Ссылка по просьбе • Universal Solid Supports for the Synthesis of Oligonucleotides via a Transesterification of Hphosphonate Diester Linkage • Fernando Ferreira , Albert Meyer , Jean-Jacques Vasseur , and François Morvan * • Laboratoire de Chimie Organique Biomoléculaire de Synthèse, UMR 5625 CNRS-UM II, ERT “Oligonucleotides: Methodologie Valorisation”, Université de Montpellier II, CC 008, Place E. Bataillon, 34095 Montpellier Cedex 5, France • J. Org. Chem. , 2005, 70 (23), pp 9198– 9206 • DOI: 10. 1021/jo 051172 n
Ссылка по просьбе • Universal Solid Supports for the Synthesis of Oligonucleotides via a Transesterification of Hphosphonate Diester Linkage • Fernando Ferreira , Albert Meyer , Jean-Jacques Vasseur , and François Morvan * • Laboratoire de Chimie Organique Biomoléculaire de Synthèse, UMR 5625 CNRS-UM II, ERT “Oligonucleotides: Methodologie Valorisation”, Université de Montpellier II, CC 008, Place E. Bataillon, 34095 Montpellier Cedex 5, France • J. Org. Chem. , 2005, 70 (23), pp 9198– 9206 • DOI: 10. 1021/jo 051172 n
 Универсальные носители • В более удобном методе синтез начинается с универсального носителя, к которому присоединён ненуклеозидный линкер. Амидофосфит, соответствующий 3'-терминальному нуклеозиду, присоединяется к универсальному носителю по стандартной методике в ходе первого синтетического цикла. Затем продолжается сборка требуемой последовательности, после чего олигонуклеотид снимается с поверхности носителя. Характерной особенностью универсальных носителей является то, что отщепление олигонуклеотида происходит путём гидролиза связи P-O, соединяющей 3'-O-атом 3'терминального олигонуклеотида с универсальным линкером. Преимущество данного подхода заключается в том, что единственный универсальный носитель может быть использован во всех синтезах независимо от того, какую последовательность необходимо синтезировать.
Универсальные носители • В более удобном методе синтез начинается с универсального носителя, к которому присоединён ненуклеозидный линкер. Амидофосфит, соответствующий 3'-терминальному нуклеозиду, присоединяется к универсальному носителю по стандартной методике в ходе первого синтетического цикла. Затем продолжается сборка требуемой последовательности, после чего олигонуклеотид снимается с поверхности носителя. Характерной особенностью универсальных носителей является то, что отщепление олигонуклеотида происходит путём гидролиза связи P-O, соединяющей 3'-O-атом 3'терминального олигонуклеотида с универсальным линкером. Преимущество данного подхода заключается в том, что единственный универсальный носитель может быть использован во всех синтезах независимо от того, какую последовательность необходимо синтезировать.
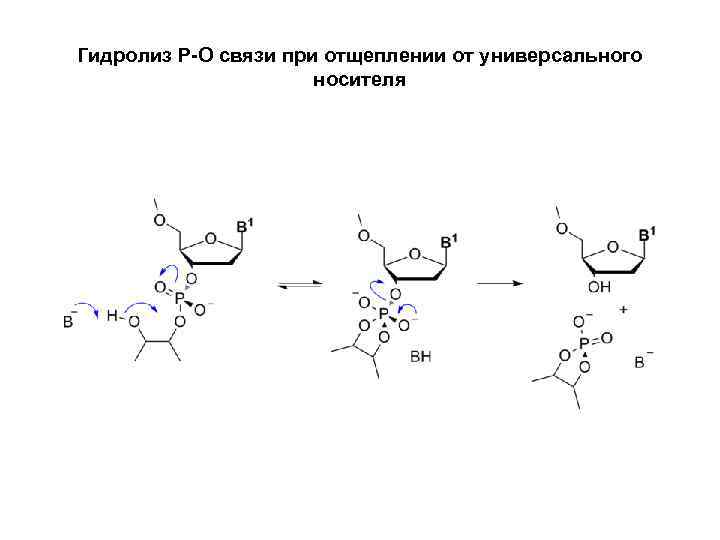 Гидролиз Р-О связи при отщеплении от универсального носителя
Гидролиз Р-О связи при отщеплении от универсального носителя
 Нуклеозидные носители • В исторически первом, хотя и менее популярном в настоящее время подходе, синтез олигонуклеотида проводится на носителе, к которому заранее, через фрагмент янтарной кислоты, ковалентно присоединён 3'-концевой нуклеозид. Соответственно, синтез начинается с присоединения амидофосфита, соответствующего не первому, а второму нуклеотиду, считая с 3'-конца. Недостатком такого носителя является то, что для синтеза определённого олигонуклеотида необходимо выбирать конкретный вариант нуклеозидного носителя, что уменьшает производительность синтетического процесса и увеличивает вероятность человеческой ошибки.
Нуклеозидные носители • В исторически первом, хотя и менее популярном в настоящее время подходе, синтез олигонуклеотида проводится на носителе, к которому заранее, через фрагмент янтарной кислоты, ковалентно присоединён 3'-концевой нуклеозид. Соответственно, синтез начинается с присоединения амидофосфита, соответствующего не первому, а второму нуклеотиду, считая с 3'-конца. Недостатком такого носителя является то, что для синтеза определённого олигонуклеотида необходимо выбирать конкретный вариант нуклеозидного носителя, что уменьшает производительность синтетического процесса и увеличивает вероятность человеческой ошибки.
 Специальные носители • используются для присоединения некоторой функциональной или репортерной группы к 3'-положению синтетических олигонуклеотидов. Коммерчески доступны носители для введения аминогрупп, меркаптогрупп, тушителей флуоресценции и др.
Специальные носители • используются для присоединения некоторой функциональной или репортерной группы к 3'-положению синтетических олигонуклеотидов. Коммерчески доступны носители для введения аминогрупп, меркаптогрупп, тушителей флуоресценции и др.
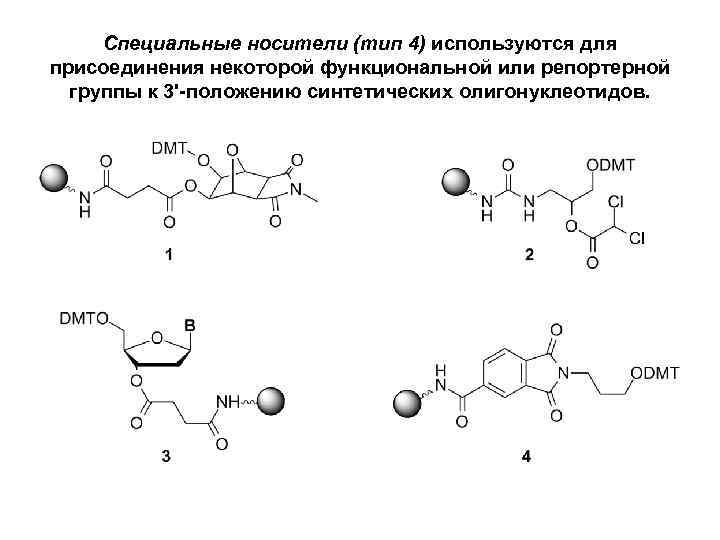 Специальные носители (тип 4) используются для присоединения некоторой функциональной или репортерной группы к 3'-положению синтетических олигонуклеотидов.
Специальные носители (тип 4) используются для присоединения некоторой функциональной или репортерной группы к 3'-положению синтетических олигонуклеотидов.
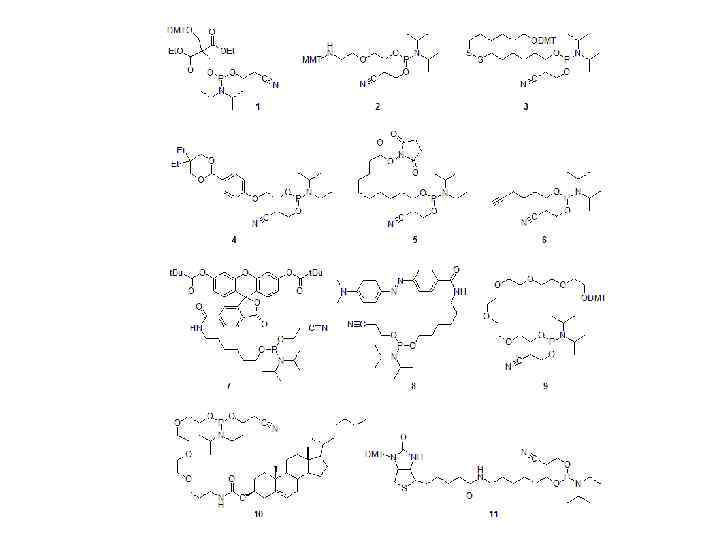
 • Ненуклеозидные амидофосфиты это амидофосфитные реагенты, разработанные для введения разнообразных функциональных групп в концевое положение олигонуклеотида или между нуклеотидными остатками посреди последовательности. Чтобы быть пригодным для введения в середину цепи, амидофосфит должен содержать, по крайней мере, две гидроксильные группы, одна из которых защищается DMT-группой, а вторая несёт реакционноспособную амидофосфитную группировку. • Ненуклеозидные амидофосфиты применяются для введения в олигонуклеотид различных групп, которые не встречаются в природных нуклеозидах. Синтезирован широкий спектр подобных реагентов, служащих, например, для введения 5'-фосфата, аминогруппы, меркаптогруппы, альдегидной и карбоксильной групп, алкиновых фрагментов, флуоресцентных красителей и тушителей, гидрофильных и гидрофобных модификаций, биотина.
• Ненуклеозидные амидофосфиты это амидофосфитные реагенты, разработанные для введения разнообразных функциональных групп в концевое положение олигонуклеотида или между нуклеотидными остатками посреди последовательности. Чтобы быть пригодным для введения в середину цепи, амидофосфит должен содержать, по крайней мере, две гидроксильные группы, одна из которых защищается DMT-группой, а вторая несёт реакционноспособную амидофосфитную группировку. • Ненуклеозидные амидофосфиты применяются для введения в олигонуклеотид различных групп, которые не встречаются в природных нуклеозидах. Синтезирован широкий спектр подобных реагентов, служащих, например, для введения 5'-фосфата, аминогруппы, меркаптогруппы, альдегидной и карбоксильной групп, алкиновых фрагментов, флуоресцентных красителей и тушителей, гидрофильных и гидрофобных модификаций, биотина.
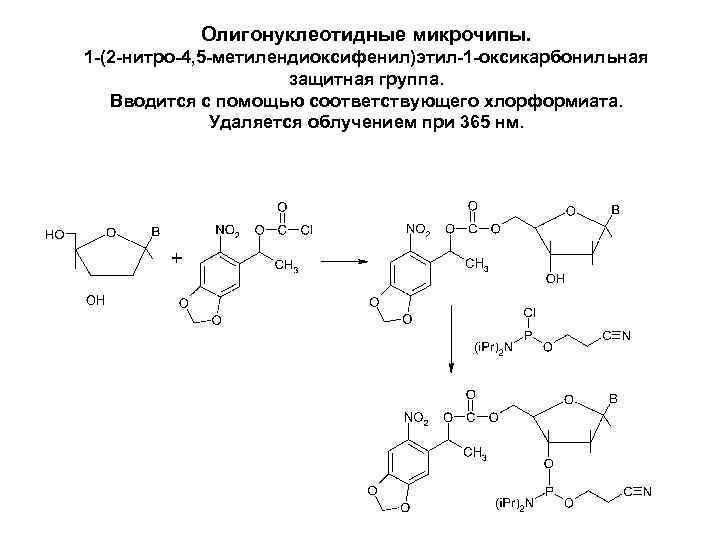 Олигонуклеотидные микрочипы. 1 -(2 -нитро-4, 5 -метилендиоксифенил)этил-1 -оксикарбонильная защитная группа. Вводится с помощью соответствующего хлорформиата. Удаляется облучением при 365 нм.
Олигонуклеотидные микрочипы. 1 -(2 -нитро-4, 5 -метилендиоксифенил)этил-1 -оксикарбонильная защитная группа. Вводится с помощью соответствующего хлорформиата. Удаляется облучением при 365 нм.
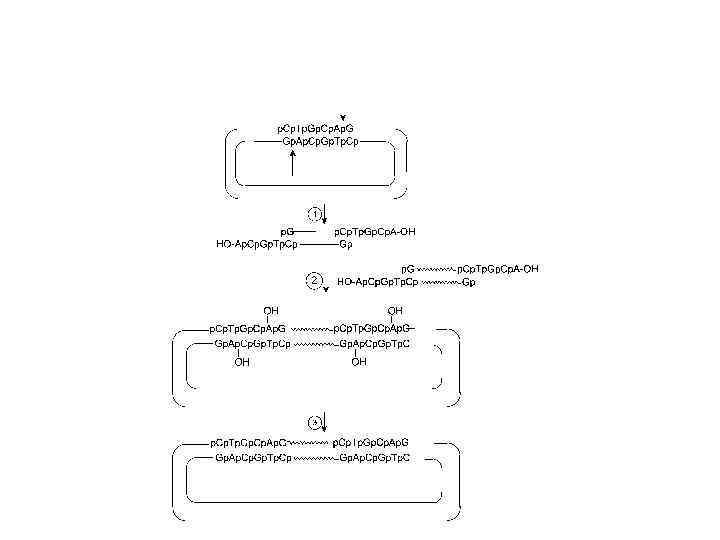
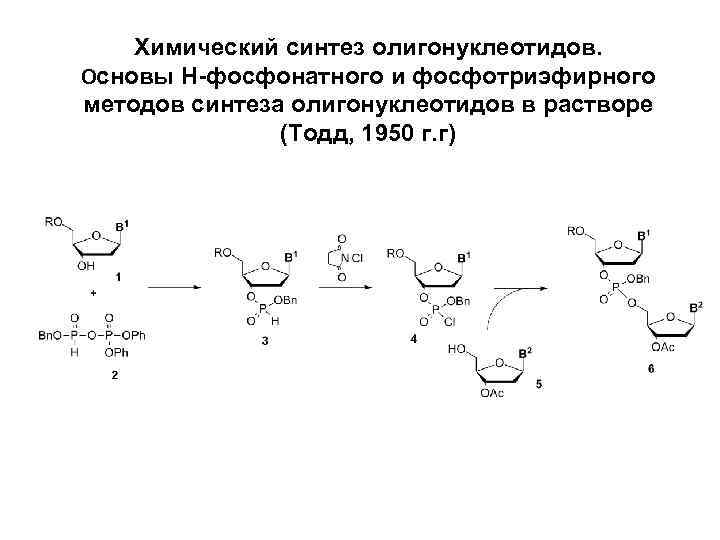 Химический синтез олигонуклеотидов. Основы H-фосфонатного и фосфотриэфирного методов синтеза олигонуклеотидов в растворе (Тодд, 1950 г. г)
Химический синтез олигонуклеотидов. Основы H-фосфонатного и фосфотриэфирного методов синтеза олигонуклеотидов в растворе (Тодд, 1950 г. г)
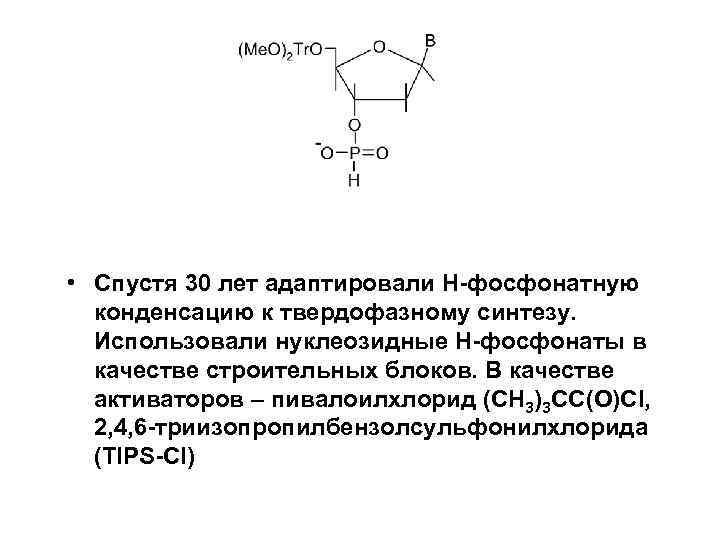 • Спустя 30 лет адаптировали H-фосфонатную конденсацию к твердофазному синтезу. Использовали нуклеозидные H-фосфонаты в качестве строительных блоков. В качестве активаторов – пивалоилхлорид (CH 3)3 CC(O)Cl, 2, 4, 6 -триизопропилбензолсульфонилхлорида (TIPS-Cl)
• Спустя 30 лет адаптировали H-фосфонатную конденсацию к твердофазному синтезу. Использовали нуклеозидные H-фосфонаты в качестве строительных блоков. В качестве активаторов – пивалоилхлорид (CH 3)3 CC(O)Cl, 2, 4, 6 -триизопропилбензолсульфонилхлорида (TIPS-Cl)
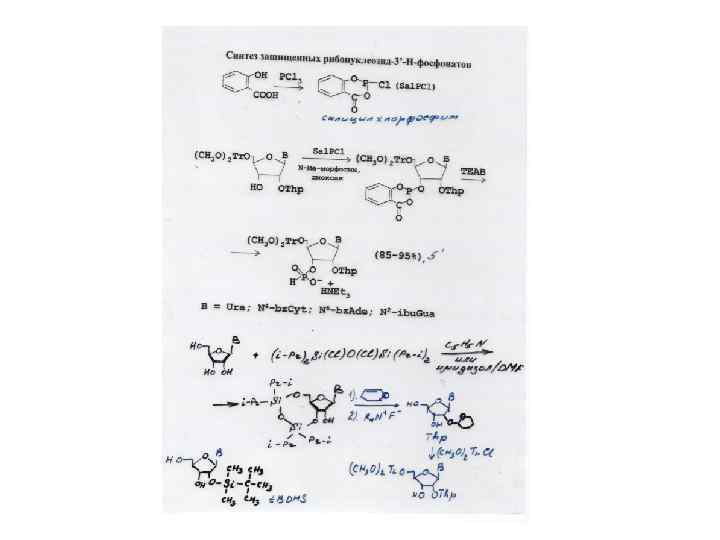
 Cинтез Н-фосфонатного синтона из нуклеозида и салицилхлорфосфита
Cинтез Н-фосфонатного синтона из нуклеозида и салицилхлорфосфита
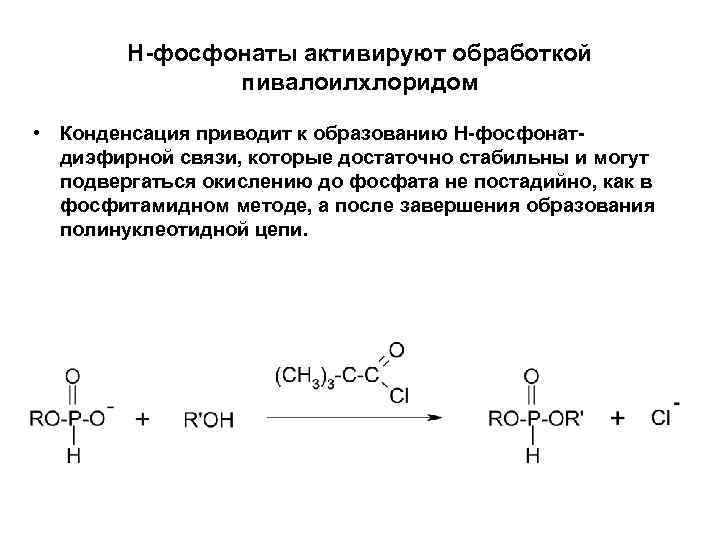 Н-фосфонаты активируют обработкой пивалоилхлоридом • Конденсация приводит к образованию Н-фосфонатдиэфирной связи, которые достаточно стабильны и могут подвергаться окислению до фосфата не постадийно, как в фосфитамидном методе, а после завершения образования полинуклеотидной цепи.
Н-фосфонаты активируют обработкой пивалоилхлоридом • Конденсация приводит к образованию Н-фосфонатдиэфирной связи, которые достаточно стабильны и могут подвергаться окислению до фосфата не постадийно, как в фосфитамидном методе, а после завершения образования полинуклеотидной цепи.
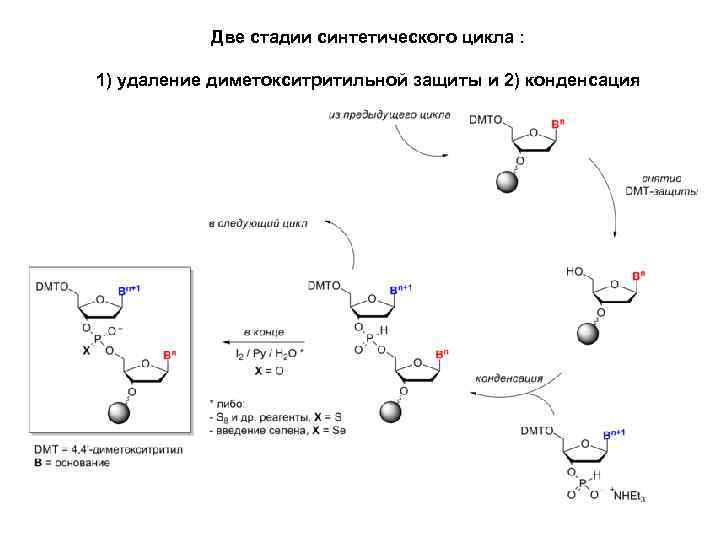 Две стадии синтетического цикла : 1) удаление диметокситритильной защиты и 2) конденсация
Две стадии синтетического цикла : 1) удаление диметокситритильной защиты и 2) конденсация

 Модификация по сахаро-фосфатному остову • Более 40 антисмысловых олигонуклеотидов и их аналогов находятся на различных стадиях доклинических испытаний, и более половины из них представляют собой фосфоротиоаты. К настоящему времени допущено на фармацевтический рынок США лекарство Vitravene. TM, которое представляет собой 21 -звенный фосфоротиоат [Yan. J. Chem. Perkin Trans. 2002]. Однако, как стало известно от А. Г. Веньяминовой, на данный момент использование данного препарата запретили.
Модификация по сахаро-фосфатному остову • Более 40 антисмысловых олигонуклеотидов и их аналогов находятся на различных стадиях доклинических испытаний, и более половины из них представляют собой фосфоротиоаты. К настоящему времени допущено на фармацевтический рынок США лекарство Vitravene. TM, которое представляет собой 21 -звенный фосфоротиоат [Yan. J. Chem. Perkin Trans. 2002]. Однако, как стало известно от А. Г. Веньяминовой, на данный момент использование данного препарата запретили.
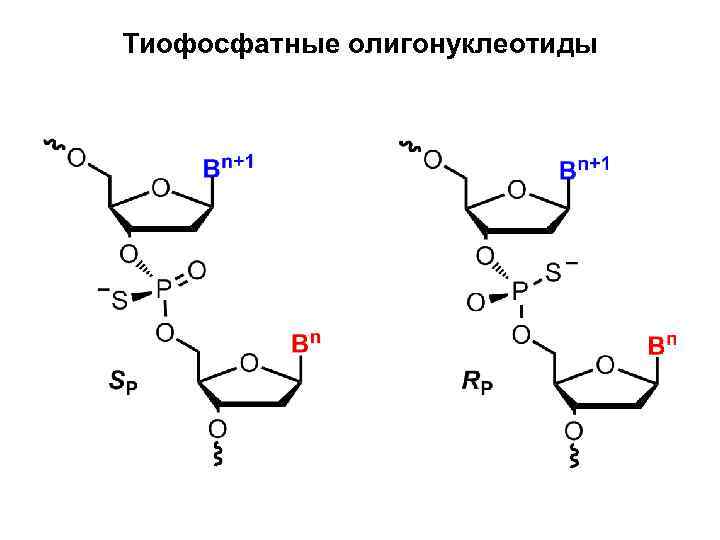 Тиофосфатные олигонуклеотиды
Тиофосфатные олигонуклеотиды
 Тиофосфатные олигонуклеотиды • Тиофосфатные олигонуклеотиды — это модифицированные олигонуклеотиды, в которых один из атомов кислорода в фосфатном остатке замещен на атом серы. Широко используются только те тиофосфаты, в которых сера не является связующим звеном между нуклеозидным остатком и атомом фосфора. В этом случае замена кислорода на серу приводит к образованию нового центра хиральности на атоме P(V), поэтому в простейшем случае динуклеотида образуются SP- и RPдиастереомеры. В n-мерном олигонуклеотиде, в котором все (n-1) межнуклеотидных связей являются тиофосфатными, число диастереомеров составляет 2(n-1).
Тиофосфатные олигонуклеотиды • Тиофосфатные олигонуклеотиды — это модифицированные олигонуклеотиды, в которых один из атомов кислорода в фосфатном остатке замещен на атом серы. Широко используются только те тиофосфаты, в которых сера не является связующим звеном между нуклеозидным остатком и атомом фосфора. В этом случае замена кислорода на серу приводит к образованию нового центра хиральности на атоме P(V), поэтому в простейшем случае динуклеотида образуются SP- и RPдиастереомеры. В n-мерном олигонуклеотиде, в котором все (n-1) межнуклеотидных связей являются тиофосфатными, число диастереомеров составляет 2(n-1).
 Тиофосфатные олигонуклеотиды • Будучи неприродными аналогами нуклеиновых кислот, олигонуклеотидные тиофосфаты значительно более устойчивы к гидролизу нуклеазами. Это свойство определяет использование тиофосфатов в качестве антисмысловых олигонуклеотидов в приложениях in vivo, где неизбежно воздействие нуклеаз. Подобным образом, чтобы увеличить стабильность в малых интерферирующих РНК, часто вводят, по крайней мере, одну тиофосфатную связь в 3'-положение смысловой и антисмысловой цепи. В оптически чистых олигонуклеотидных тиофосфатах диастереомеры, в которых все фосфорные центры имеют SPконфигурацию, более устойчивы к ферментативному гидролизу, чем их RP-аналоги. Однако, синтез оптически чистых тиофосфатов сложен. В лабораторной практике обычно пользуются смесями диастереомеров.
Тиофосфатные олигонуклеотиды • Будучи неприродными аналогами нуклеиновых кислот, олигонуклеотидные тиофосфаты значительно более устойчивы к гидролизу нуклеазами. Это свойство определяет использование тиофосфатов в качестве антисмысловых олигонуклеотидов в приложениях in vivo, где неизбежно воздействие нуклеаз. Подобным образом, чтобы увеличить стабильность в малых интерферирующих РНК, часто вводят, по крайней мере, одну тиофосфатную связь в 3'-положение смысловой и антисмысловой цепи. В оптически чистых олигонуклеотидных тиофосфатах диастереомеры, в которых все фосфорные центры имеют SPконфигурацию, более устойчивы к ферментативному гидролизу, чем их RP-аналоги. Однако, синтез оптически чистых тиофосфатов сложен. В лабораторной практике обычно пользуются смесями диастереомеров.
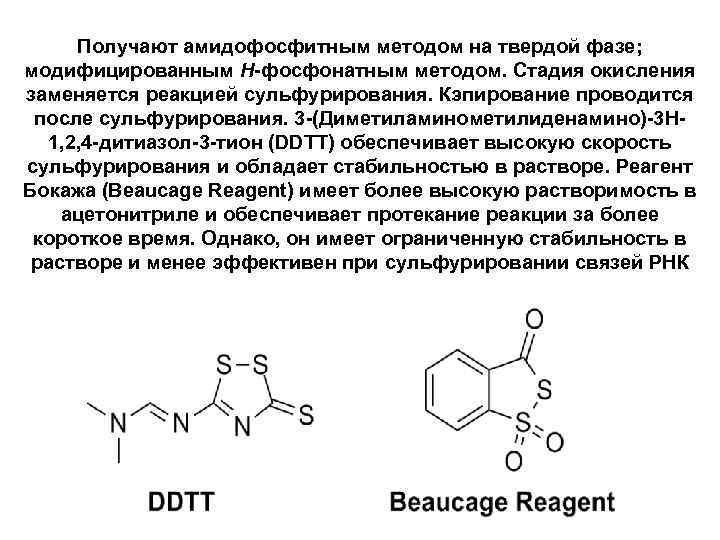 Получают амидофосфитным методом на твердой фазе; модифицированным Н-фосфонатным методом. Стадия окисления заменяется реакцией сульфурирования. Кэпирование проводится после сульфурирования. 3 -(Диметиламинометилиденамино)-3 H 1, 2, 4 -дитиазол-3 -тион (DDTT) обеспечивает высокую скорость сульфурирования и обладает стабильностью в растворе. Реагент Бокажа (Beaucage Reagent) имеет более высокую растворимость в ацетонитриле и обеспечивает протекание реакции за более короткое время. Однако, он имеет ограниченную стабильность в растворе и менее эффективен при сульфурировании связей РНК
Получают амидофосфитным методом на твердой фазе; модифицированным Н-фосфонатным методом. Стадия окисления заменяется реакцией сульфурирования. Кэпирование проводится после сульфурирования. 3 -(Диметиламинометилиденамино)-3 H 1, 2, 4 -дитиазол-3 -тион (DDTT) обеспечивает высокую скорость сульфурирования и обладает стабильностью в растворе. Реагент Бокажа (Beaucage Reagent) имеет более высокую растворимость в ацетонитриле и обеспечивает протекание реакции за более короткое время. Однако, он имеет ограниченную стабильность в растворе и менее эффективен при сульфурировании связей РНК
 Химический синтез олигонуклеотидов • Ключевой стадией химического синтеза олигонуклеотидов является создание фосфодиэфирной связи между нуклеотидами. Один из основных подходов к решению этой задачи использует в качестве источника фосфатной группы диэтерифицированные фосфаты (фосфодиэфиры). В этом случае при химическом синтезе получается триэфир фосфорной кислоты, который затем при полном деблокировании превращается в диэфир. Поэтому метод носит название фосфотриэфирного. Одним из распространенных вариантов фосфотриэфирного метода является фосфитный метод, в котором на первом этапе образуется фосфитный эфир, окисляющийся затем в триэфир фосфорной кислоты.
Химический синтез олигонуклеотидов • Ключевой стадией химического синтеза олигонуклеотидов является создание фосфодиэфирной связи между нуклеотидами. Один из основных подходов к решению этой задачи использует в качестве источника фосфатной группы диэтерифицированные фосфаты (фосфодиэфиры). В этом случае при химическом синтезе получается триэфир фосфорной кислоты, который затем при полном деблокировании превращается в диэфир. Поэтому метод носит название фосфотриэфирного. Одним из распространенных вариантов фосфотриэфирного метода является фосфитный метод, в котором на первом этапе образуется фосфитный эфир, окисляющийся затем в триэфир фосфорной кислоты.
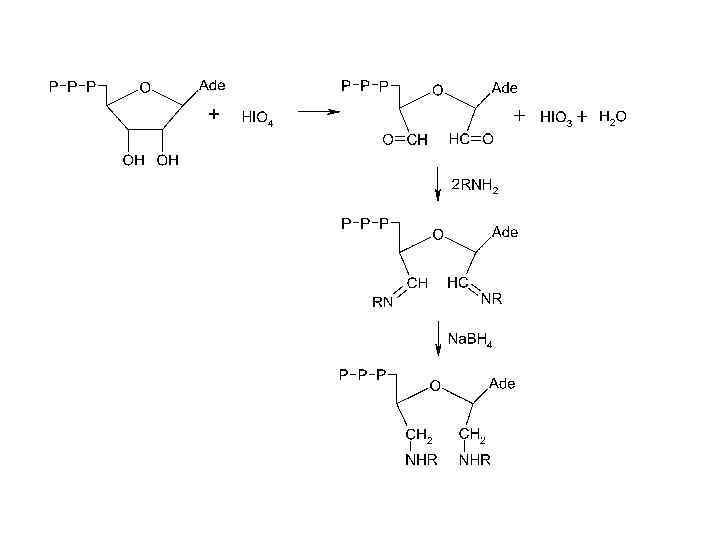
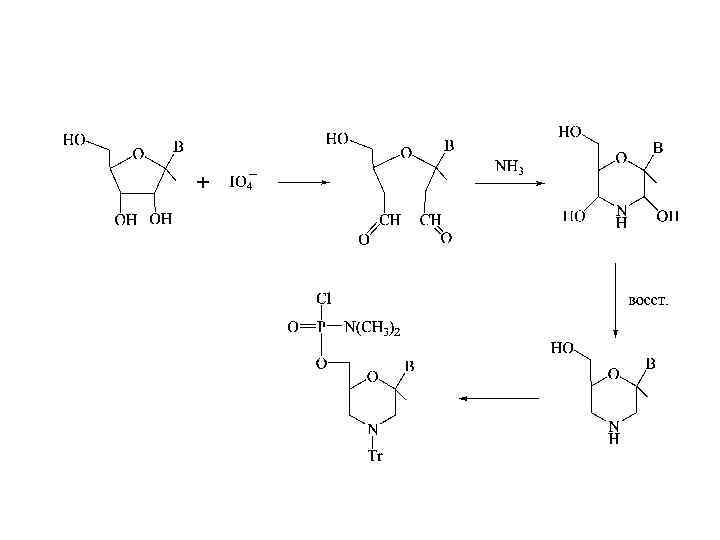
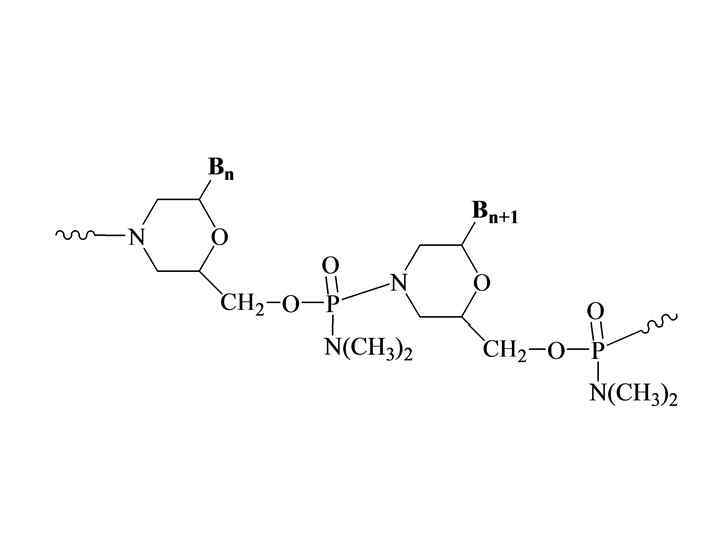
 Морфолиновые аналоги олигонуклеотидов • Диметиламиноморфолидофосфатные аналоги олигонуклеотидов - одни из самых успешных в области регуляции экспрессии генов с точки зрения эффективности синтеза, растворимости в воде, способности образовывать комплементарные комплексы с природными НК. Хотя в них имеется дополнительный хиральный атом фосора, вследствие чего олигомеры такого типа представляют рацемическую смесь 2 n диастереомеров, где n –число фосфатных групп. В настоящее время некоторые антисмысловые морфолиновые аналоги проходят клинические испытания.
Морфолиновые аналоги олигонуклеотидов • Диметиламиноморфолидофосфатные аналоги олигонуклеотидов - одни из самых успешных в области регуляции экспрессии генов с точки зрения эффективности синтеза, растворимости в воде, способности образовывать комплементарные комплексы с природными НК. Хотя в них имеется дополнительный хиральный атом фосора, вследствие чего олигомеры такого типа представляют рацемическую смесь 2 n диастереомеров, где n –число фосфатных групп. В настоящее время некоторые антисмысловые морфолиновые аналоги проходят клинические испытания.
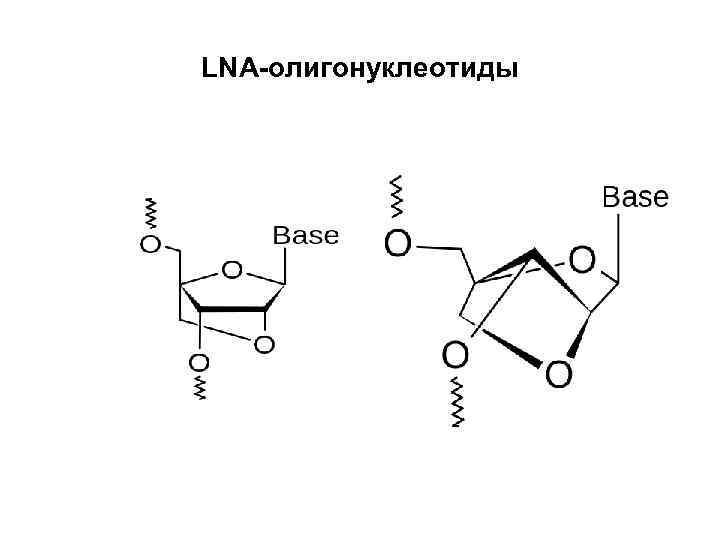 LNA-олигонуклеотиды
LNA-олигонуклеотиды
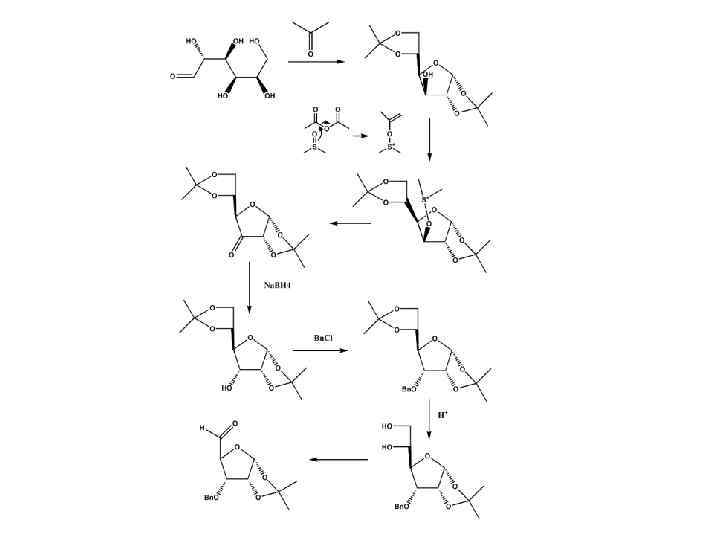
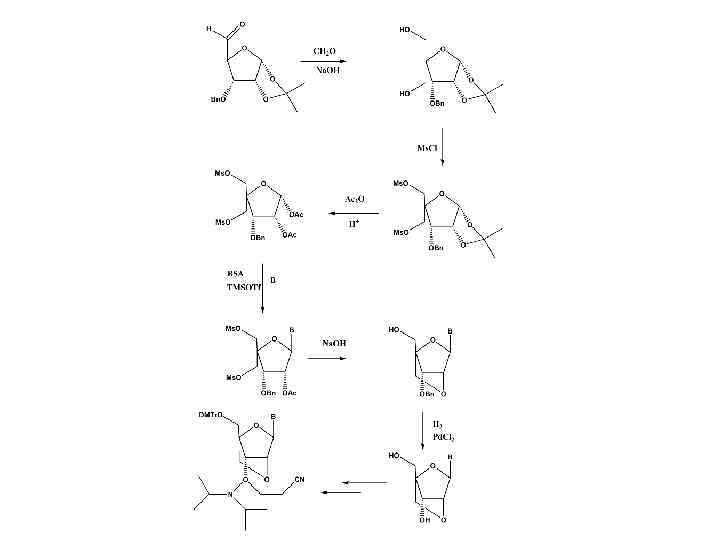
 • Бис-(триметилсилил)ацетамид • триметилсилилтрифторметансульфокислота
• Бис-(триметилсилил)ацетамид • триметилсилилтрифторметансульфокислота
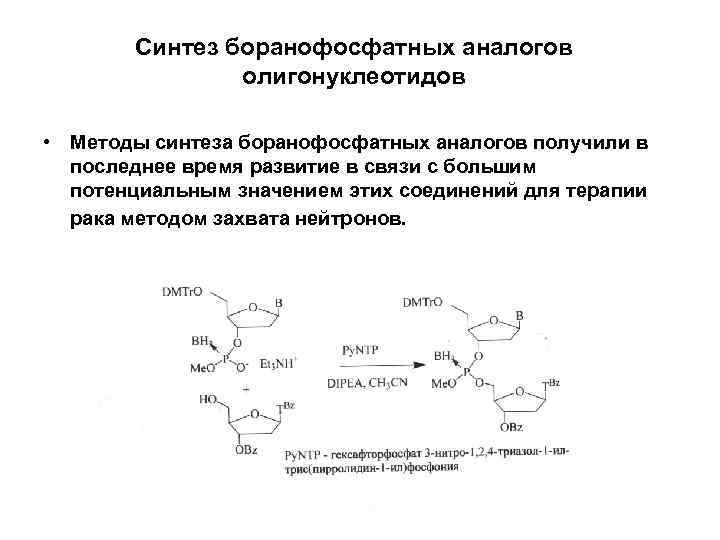 Синтез боранофосфатных аналогов олигонуклеотидов • Методы синтеза боранофосфатных аналогов получили в последнее время развитие в связи с большим потенциальным значением этих соединений для терапии рака методом захвата нейтронов.
Синтез боранофосфатных аналогов олигонуклеотидов • Методы синтеза боранофосфатных аналогов получили в последнее время развитие в связи с большим потенциальным значением этих соединений для терапии рака методом захвата нейтронов.


