 ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
 Химические свойства алкенов Присоединение Полимеризация Гидрирование Окисление Каталитическое окисление Галогенирование Горение Гидрогалогенирование Гидратация Качественные реакции
Химические свойства алкенов Присоединение Полимеризация Гидрирование Окисление Каталитическое окисление Галогенирование Горение Гидрогалогенирование Гидратация Качественные реакции
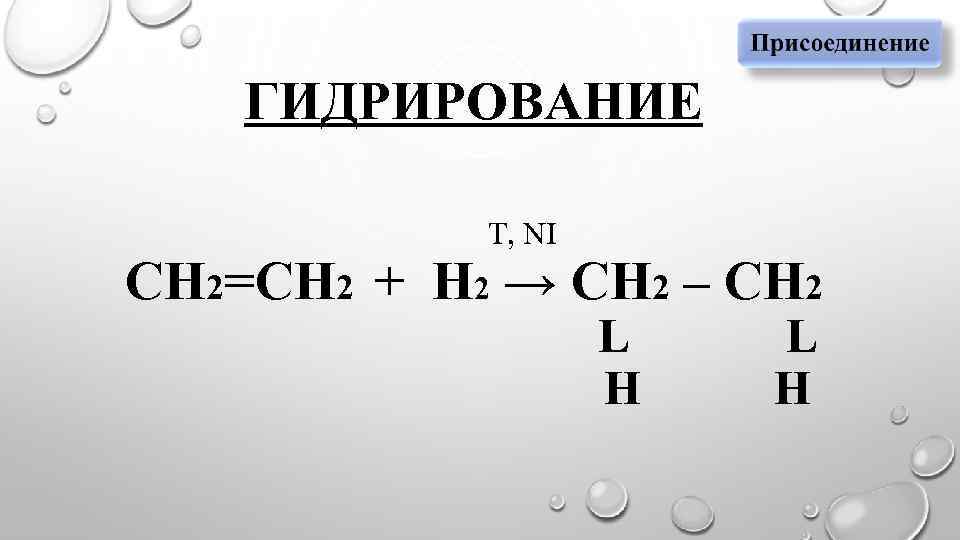 ГИДРИРОВАНИЕ T, NI СН 2=СН 2 + Н 2 → СН 2 – СН 2 L Н
ГИДРИРОВАНИЕ T, NI СН 2=СН 2 + Н 2 → СН 2 – СН 2 L Н
 ГАЛОГЕНИРОВАНИЕ СН 2=СН 2 + CI 2 (ВОДНЫЙ РАСТВОР) → СН 2 – СН 2 L L CI CI ДИХЛОРЭТАН
ГАЛОГЕНИРОВАНИЕ СН 2=СН 2 + CI 2 (ВОДНЫЙ РАСТВОР) → СН 2 – СН 2 L L CI CI ДИХЛОРЭТАН
 ГИДРОГАЛОГЕНИРОВАНИЕ СН 3–СН=СН 2 + Н: CI→ СН 3–СН–СН 2 L L Н CI 1 -ХЛОРПРОПАН ПРАВИЛО МАРКОВНИКОВА ПРИСОЕДИНЕНИЕ ВОДОРОДА ПРОИСХОДИТ К НАИБОЛЕЕ ГИДРИРОВАННОМУ АТОМУ УГЛЕРОДА ПРИ ДВОЙНОЙ УГЛЕРОД-УГЛЕРОДНОЙ СВЯЗИ.
ГИДРОГАЛОГЕНИРОВАНИЕ СН 3–СН=СН 2 + Н: CI→ СН 3–СН–СН 2 L L Н CI 1 -ХЛОРПРОПАН ПРАВИЛО МАРКОВНИКОВА ПРИСОЕДИНЕНИЕ ВОДОРОДА ПРОИСХОДИТ К НАИБОЛЕЕ ГИДРИРОВАННОМУ АТОМУ УГЛЕРОДА ПРИ ДВОЙНОЙ УГЛЕРОД-УГЛЕРОДНОЙ СВЯЗИ.
 ГИДРАТАЦИЯ T, H 3 PO 4 СН 2=СН 2 + НОН → СН 2 – СН 2 L L Н ОН ПРАВИЛО МАРКОВНИКОВА
ГИДРАТАЦИЯ T, H 3 PO 4 СН 2=СН 2 + НОН → СН 2 – СН 2 L L Н ОН ПРАВИЛО МАРКОВНИКОВА
 РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ кat, t, p n(СН 2 = СН 2) → (- СН 2 – СН 2 -)n этилен полиэтилен мономер структурное звено полимера
РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ кat, t, p n(СН 2 = СН 2) → (- СН 2 – СН 2 -)n этилен полиэтилен мономер структурное звено полимера
 КАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕ 1. В ПРИСУТСТВИИ ХЛОРИДОВ МЕДИ И ПАЛЛАДИЯ: КАТ. 2 СН 2=СН 2 + О 2 → 2 СН 3–СОН 2. В ПРИСУТСТВИИ СЕРЕБРА, ПРИ T 150 -350 С КАТ. 2 СН 2=СН 2 + О 2 → 2 СН 2–СН 2 О
КАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕ 1. В ПРИСУТСТВИИ ХЛОРИДОВ МЕДИ И ПАЛЛАДИЯ: КАТ. 2 СН 2=СН 2 + О 2 → 2 СН 3–СОН 2. В ПРИСУТСТВИИ СЕРЕБРА, ПРИ T 150 -350 С КАТ. 2 СН 2=СН 2 + О 2 → 2 СН 2–СН 2 О
 РЕАКЦИЯ ВАГНЕРА 3 СН 2=СН 2 + 4 Н 2 О + 2 KMNO 4 3 СН 2 OH-СН 2 OH +2 MNO 2 + 2 KOH ЭТИЛЕНГЛИКОЛЬ КАЧЕСТВЕННАЯ РЕАКЦИЯ НА КРАТНУЮ СВЯЗЬ – ОБЕСЦВЕЧИВАНИЕ ВОДНОГО РАСТВОРА ПЕРМАНГАНАТА КАЛИЯ (ОТКРЫТА Е. Е. ВАГНЕРОМ В 1888 Г)
РЕАКЦИЯ ВАГНЕРА 3 СН 2=СН 2 + 4 Н 2 О + 2 KMNO 4 3 СН 2 OH-СН 2 OH +2 MNO 2 + 2 KOH ЭТИЛЕНГЛИКОЛЬ КАЧЕСТВЕННАЯ РЕАКЦИЯ НА КРАТНУЮ СВЯЗЬ – ОБЕСЦВЕЧИВАНИЕ ВОДНОГО РАСТВОРА ПЕРМАНГАНАТА КАЛИЯ (ОТКРЫТА Е. Е. ВАГНЕРОМ В 1888 Г)
 СН 2=СН 2 + BR 2 → СН 2–СН 2 L L BR BR ДИБРОМЭТАН БРОМНАЯ ВОДА, ИМЕЮЩАЯ ЖЕЛТУЮ ОКРАСКУ ОБЕСЦВЕЧИВАЕТСЯ
СН 2=СН 2 + BR 2 → СН 2–СН 2 L L BR BR ДИБРОМЭТАН БРОМНАЯ ВОДА, ИМЕЮЩАЯ ЖЕЛТУЮ ОКРАСКУ ОБЕСЦВЕЧИВАЕТСЯ
 3, 3 - ДИМЕТИЛПЕНТЕН-1 2, 4 -ДИМЕТИЛГЕКСЕН-2 2, 4, 4 -ТРИМЕТИЛПЕНТЕН-2
3, 3 - ДИМЕТИЛПЕНТЕН-1 2, 4 -ДИМЕТИЛГЕКСЕН-2 2, 4, 4 -ТРИМЕТИЛПЕНТЕН-2
 2, 3, 4, 6 -ТЕТРАМЕТИЛ-2, 7 -ДИХЛОР 5, 6 -ДИЭТИЛОКТЕН-4 2, 8, 8 -ТРИБРОМ-3, 9, 9 -ТРИМЕТИЛ-5 ИЗОПРОПИЛ-6 -ХЛОРДЕЦЕН-1
2, 3, 4, 6 -ТЕТРАМЕТИЛ-2, 7 -ДИХЛОР 5, 6 -ДИЭТИЛОКТЕН-4 2, 8, 8 -ТРИБРОМ-3, 9, 9 -ТРИМЕТИЛ-5 ИЗОПРОПИЛ-6 -ХЛОРДЕЦЕН-1
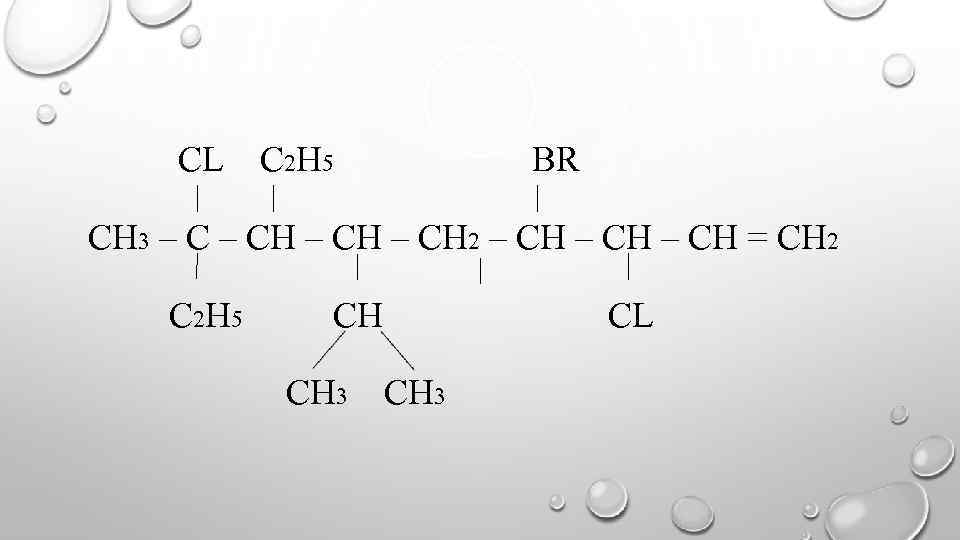 CL C 2 H 5 BR СH 3 – СH 2 – СH = СH 2 C 2 H 5 CH CH 3 CL CH 3
CL C 2 H 5 BR СH 3 – СH 2 – СH = СH 2 C 2 H 5 CH CH 3 CL CH 3
 4 -МЕТИЛ-3, 3 -ДИЭТИЛПЕНТЕН-1 2 -БРОМБУТЕН-2 2, 4 -ДИБРОМ- 3, 5 - ДИМЕТИЛ- 4 ЭТИЛГЕНСЕН-1
4 -МЕТИЛ-3, 3 -ДИЭТИЛПЕНТЕН-1 2 -БРОМБУТЕН-2 2, 4 -ДИБРОМ- 3, 5 - ДИМЕТИЛ- 4 ЭТИЛГЕНСЕН-1