Как правильно определить продукты реакции (АЕ) (3).pptx
- Количество слайдов: 29
 Химические свойства алкенов I. Реакции электрофильного присоединения
Химические свойства алкенов I. Реакции электрофильного присоединения
 I. Реакции электрофильного присоединения 1. Гидробромирование
I. Реакции электрофильного присоединения 1. Гидробромирование
 Механизм реакции АЕ I этап – диссоциация несимметричной молекулы H−X по гетеролитическому типу – генерация электрофильной частицы II этап – электрофильная атака на повышенную электронную плотность π−связи – образование π−комплекса III этап – гетеролиз π−связи – превращение π−комплекса в σ−комплекс, называемый карбокатионом IV – нуклеофильная атака на карбокатион – образование продукта реакции
Механизм реакции АЕ I этап – диссоциация несимметричной молекулы H−X по гетеролитическому типу – генерация электрофильной частицы II этап – электрофильная атака на повышенную электронную плотность π−связи – образование π−комплекса III этап – гетеролиз π−связи – превращение π−комплекса в σ−комплекс, называемый карбокатионом IV – нуклеофильная атака на карбокатион – образование продукта реакции
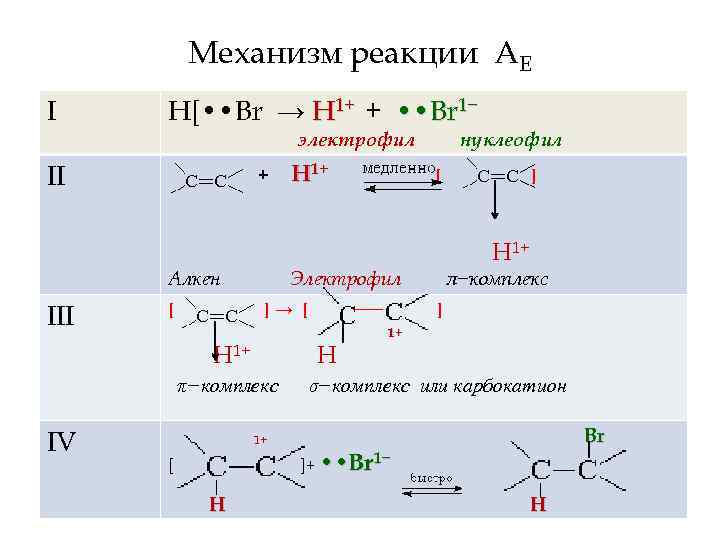 Механизм реакции АЕ I Н[ • • Br → H 1+ + • • Br 1− электрофил II + Алкен III [ [ ]→ [ −−− Н π−комплекс ] Н 1+ Электрофил Н 1+ IV H 1+ нуклеофил π−комплекс ] 1+ σ−комплекс или карбокатион Br 1+ ]+ • • Br 1− [ Н Н
Механизм реакции АЕ I Н[ • • Br → H 1+ + • • Br 1− электрофил II + Алкен III [ [ ]→ [ −−− Н π−комплекс ] Н 1+ Электрофил Н 1+ IV H 1+ нуклеофил π−комплекс ] 1+ σ−комплекс или карбокатион Br 1+ ]+ • • Br 1− [ Н Н
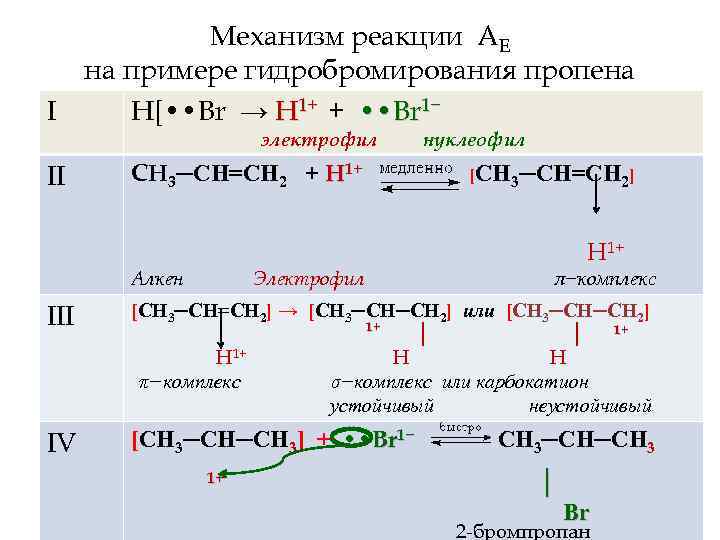 I II Механизм реакции АЕ на примере гидробромирования пропена Н[ • • Br → H 1+ + • • Br 1− электрофил СН 3─СН=СН 2 + H 1+ Алкен Электрофил нуклеофил [СН 3─СН=СН 2] Н 1+ π−комплекс III [СН 3─СН=СН 2] → [СН 3─СН─СН 2] или [СН 3─СН─СН 2] 1+ 1+ │ │ Н 1+ Н Н π−комплекс σ−комплекс или карбокатион устойчивый неустойчивый IV [СН 3─СН─СН 3] + • • Br 1− 1+ СН 3─СН─СН 3 │ Br 2 -бромпропан
I II Механизм реакции АЕ на примере гидробромирования пропена Н[ • • Br → H 1+ + • • Br 1− электрофил СН 3─СН=СН 2 + H 1+ Алкен Электрофил нуклеофил [СН 3─СН=СН 2] Н 1+ π−комплекс III [СН 3─СН=СН 2] → [СН 3─СН─СН 2] или [СН 3─СН─СН 2] 1+ 1+ │ │ Н 1+ Н Н π−комплекс σ−комплекс или карбокатион устойчивый неустойчивый IV [СН 3─СН─СН 3] + • • Br 1− 1+ СН 3─СН─СН 3 │ Br 2 -бромпропан
 Как правильно определить продукты реакции (АЕ) электрофильного присоединения Правило Марковникова В реакциях присоединения полярных молекул Н–X (галогеноводородов, воды и других) к несимметричным алкенам атом водорода присоединяется к наиболее гидрогенизированному атому углерода двойной связи
Как правильно определить продукты реакции (АЕ) электрофильного присоединения Правило Марковникова В реакциях присоединения полярных молекул Н–X (галогеноводородов, воды и других) к несимметричным алкенам атом водорода присоединяется к наиболее гидрогенизированному атому углерода двойной связи
 Как правильно определить продукты реакции (АЕ) электрофильного присоединения Правило Марковникова При присоединении несимметричной молекулы Н–X к несимметричной кратной связи атом Нδ+ молекулы Н–X направляется к атому Сδ− кратной связи, группа Xδ− молекулы Н–X ─ к атому Сδ+ кратной связи
Как правильно определить продукты реакции (АЕ) электрофильного присоединения Правило Марковникова При присоединении несимметричной молекулы Н–X к несимметричной кратной связи атом Нδ+ молекулы Н–X направляется к атому Сδ− кратной связи, группа Xδ− молекулы Н–X ─ к атому Сδ+ кратной связи
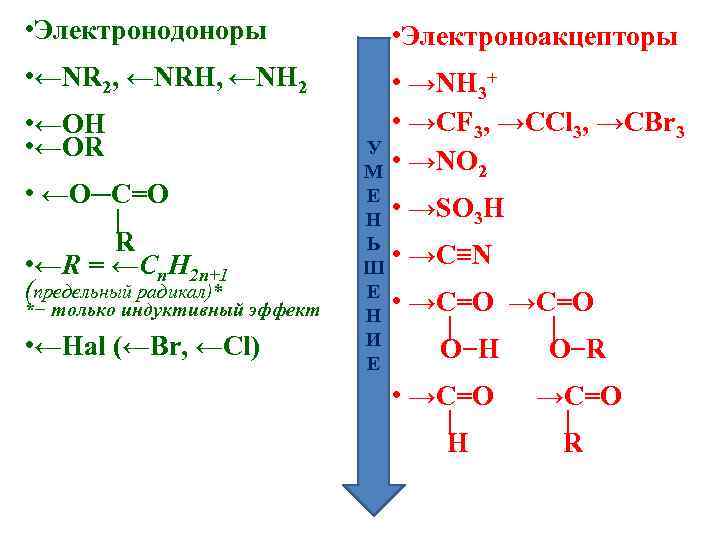 • Электронодоноры • ←NR 2, ←NRH, ←NH 2 • ←OH • ←OR • ←O─C=O | R • ←R = ←Сn. H 2 n+1 (предельный радикал)* *− только индуктивный эффект • ←Hal (←Br, ←Cl) • Электроноакцепторы • →NH 3+ • →CF 3, →CCl 3, →CBr 3 У М • →NO 2 Е Н Ь Ш Е Н И Е • →SO 3 H • →C≡N • →C=O | | O−H O−R • →C=O | H →C=O | R
• Электронодоноры • ←NR 2, ←NRH, ←NH 2 • ←OH • ←OR • ←O─C=O | R • ←R = ←Сn. H 2 n+1 (предельный радикал)* *− только индуктивный эффект • ←Hal (←Br, ←Cl) • Электроноакцепторы • →NH 3+ • →CF 3, →CCl 3, →CBr 3 У М • →NO 2 Е Н Ь Ш Е Н И Е • →SO 3 H • →C≡N • →C=O | | O−H O−R • →C=O | H →C=O | R
 Установление характера двойной связи Характер двойной Пример соединения связи симметричная СН 3→СН=СН←СН 3 бутен-2 нет смещения электронной плотности двойной связи несимметричная СН 2=СН←СН 2─СН 3 бутен-1 δ− δ+ есть четкое смещение электронной плотности двойной связи «псевдосимметричная» СН 3→СН=СН←СН 2─СН 3 пентен-2 нет четкого смещения электронной плотности двойной связи
Установление характера двойной связи Характер двойной Пример соединения связи симметричная СН 3→СН=СН←СН 3 бутен-2 нет смещения электронной плотности двойной связи несимметричная СН 2=СН←СН 2─СН 3 бутен-1 δ− δ+ есть четкое смещение электронной плотности двойной связи «псевдосимметричная» СН 3→СН=СН←СН 2─СН 3 пентен-2 нет четкого смещения электронной плотности двойной связи
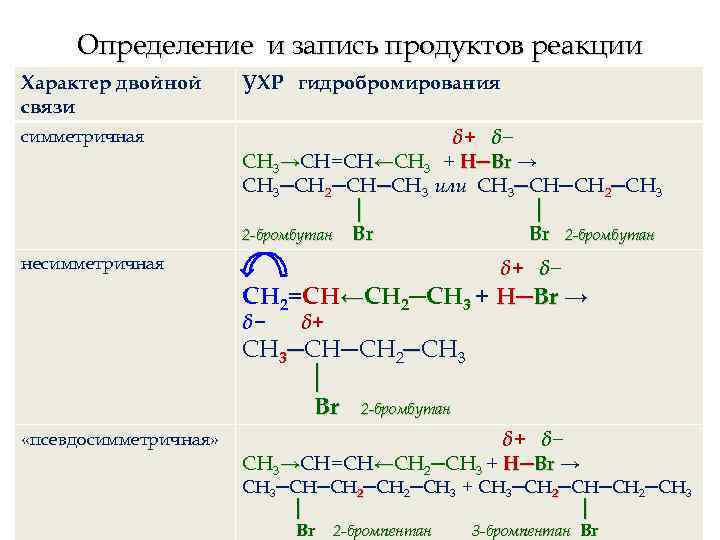 Определение и запись продуктов реакции Характер двойной связи УХР гидробромирования симметричная δ+ δ− СН 3→СН=СН←СН 3 + H─Br → СН 3─СН 2─СН─СН 3 или СН 3─СН─СН 2─СН 3 │ │ 2 -бромбутан Br Br 2 -бромбутан несимметричная δ+ δ− СН 2=СН←СН 2─СН 3 + H─Br → δ− δ+ СН 3─СН─СН 2─СН 3 │ Br 2 -бромбутан «псевдосимметричная» δ+ δ− СН 3→СН=СН←СН 2─СН 3 + H─Br → СН 3─СН─СН 2─СН 3 + СН 3─СН 2─СН 3 │ │ Br 2 -бромпентан 3 -бромпентан Br
Определение и запись продуктов реакции Характер двойной связи УХР гидробромирования симметричная δ+ δ− СН 3→СН=СН←СН 3 + H─Br → СН 3─СН 2─СН─СН 3 или СН 3─СН─СН 2─СН 3 │ │ 2 -бромбутан Br Br 2 -бромбутан несимметричная δ+ δ− СН 2=СН←СН 2─СН 3 + H─Br → δ− δ+ СН 3─СН─СН 2─СН 3 │ Br 2 -бромбутан «псевдосимметричная» δ+ δ− СН 3→СН=СН←СН 2─СН 3 + H─Br → СН 3─СН─СН 2─СН 3 + СН 3─СН 2─СН 3 │ │ Br 2 -бромпентан 3 -бромпентан Br
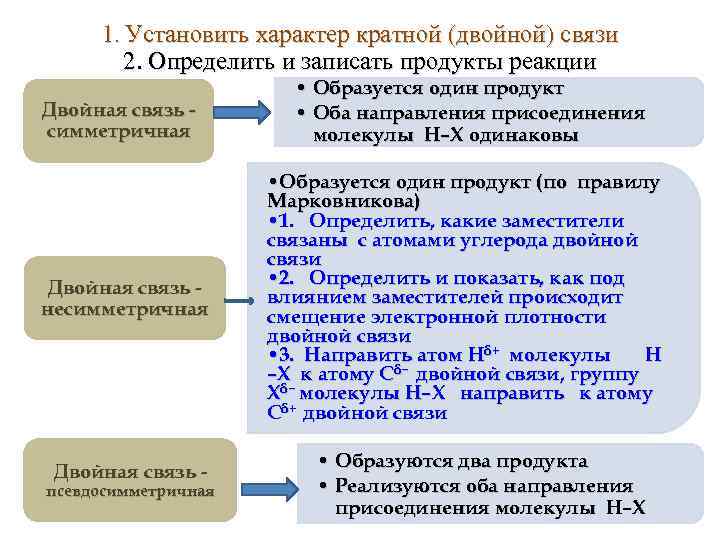 1. Установить характер кратной (двойной) связи 2. Определить и записать продукты реакции Двойная связь симметричная Двойная связь несимметричная Двойная связь - псевдосимметричная • Образуется один продукт • Оба направления присоединения молекулы Н–X одинаковы • Образуется один продукт (по правилу Марковникова) • 1. Определить, какие заместители связаны с атомами углерода двойной связи • 2. Определить и показать, как под влиянием заместителей происходит смещение электронной плотности двойной связи • 3. Направить атом Нδ+ молекулы Н δ− двойной связи, группу –X к атому С Xδ− молекулы Н–X направить к атому Сδ+ двойной связи • Образуются два продукта • Реализуются оба направления присоединения молекулы Н–X
1. Установить характер кратной (двойной) связи 2. Определить и записать продукты реакции Двойная связь симметричная Двойная связь несимметричная Двойная связь - псевдосимметричная • Образуется один продукт • Оба направления присоединения молекулы Н–X одинаковы • Образуется один продукт (по правилу Марковникова) • 1. Определить, какие заместители связаны с атомами углерода двойной связи • 2. Определить и показать, как под влиянием заместителей происходит смещение электронной плотности двойной связи • 3. Направить атом Нδ+ молекулы Н δ− двойной связи, группу –X к атому С Xδ− молекулы Н–X направить к атому Сδ+ двойной связи • Образуются два продукта • Реализуются оба направления присоединения молекулы Н–X
 Установление характера двойной связи. Определение и запись продуктов реакции. СН 3−СН 2→СН=СН 2 + H−Br → δ+ δ− СН 3−СН 2→СН=СН←СН 2−СН 3 + H−Br → СН 3→СН=СН→SO 3 H + H−Br → δ+ δ−
Установление характера двойной связи. Определение и запись продуктов реакции. СН 3−СН 2→СН=СН 2 + H−Br → δ+ δ− СН 3−СН 2→СН=СН←СН 2−СН 3 + H−Br → СН 3→СН=СН→SO 3 H + H−Br → δ+ δ−
 Напишите уравнения реакции гидробромирования следующих веществ Вариант Названия и формулы соединений 1 2 3 4 5 -метилгептен-1; СН 3─СН 2→СН=СН→NO 2 Гексен-1; СН 3─СН 2→СН=СН→C≡N 3 -метилпентен-1; СН 3─СН 2→СН=СН→CF 3 4 -метилпентен-1; СН 3─СН 2→СН=СН→C=O | H
Напишите уравнения реакции гидробромирования следующих веществ Вариант Названия и формулы соединений 1 2 3 4 5 -метилгептен-1; СН 3─СН 2→СН=СН→NO 2 Гексен-1; СН 3─СН 2→СН=СН→C≡N 3 -метилпентен-1; СН 3─СН 2→СН=СН→CF 3 4 -метилпентен-1; СН 3─СН 2→СН=СН→C=O | H
 2. Галогенирование (АЕ) а) Бромирование Br 2 (H 2 O), Br 2 (CCl 4), Br 2 (CHCl 3) Бромирование алкенов протекает в мягких условиях; Используется не чистый реагент, а раствор брома в каком-либо растворителе; Вид растворителя не влияет на характер получаемого продукта – бромирование алкенов в любом растворителе – образование дибромалканов; Характер связи не влияет на характер получаемого продукта; Обесцвечивание бромной воды – качественная реакция на кратную (двойную связь).
2. Галогенирование (АЕ) а) Бромирование Br 2 (H 2 O), Br 2 (CCl 4), Br 2 (CHCl 3) Бромирование алкенов протекает в мягких условиях; Используется не чистый реагент, а раствор брома в каком-либо растворителе; Вид растворителя не влияет на характер получаемого продукта – бромирование алкенов в любом растворителе – образование дибромалканов; Характер связи не влияет на характер получаемого продукта; Обесцвечивание бромной воды – качественная реакция на кратную (двойную связь).
 2. Галогенирование а) Бромирование Br 2 (H 2 O), Br 2 (CCl 4), Br 2 (CHCl 3) Характер двойной связи УХР симметричная СН 3→СН=СН←СН 3 + Br 2 (Н 2 О) СН 3─СН─СН─СН 3 │ │ Br Br 2, 3 -дибромбутан → несимметричная СН 2=СН←СН 2─СН 3 + Br 2 (CCl 4) СН 2─СН─СН 2─СН 3 │ │ Br Br 1, 2 -дибромбутан → «псевдосимметричная» СН 3→СН=СН←СН 2─СН 3 + Br 2 (CHCl 3) → СН 3─СН─СН─СН 2─СН 3 │ │ Br Br 2, 3 -дибромпентан
2. Галогенирование а) Бромирование Br 2 (H 2 O), Br 2 (CCl 4), Br 2 (CHCl 3) Характер двойной связи УХР симметричная СН 3→СН=СН←СН 3 + Br 2 (Н 2 О) СН 3─СН─СН─СН 3 │ │ Br Br 2, 3 -дибромбутан → несимметричная СН 2=СН←СН 2─СН 3 + Br 2 (CCl 4) СН 2─СН─СН 2─СН 3 │ │ Br Br 1, 2 -дибромбутан → «псевдосимметричная» СН 3→СН=СН←СН 2─СН 3 + Br 2 (CHCl 3) → СН 3─СН─СН─СН 2─СН 3 │ │ Br Br 2, 3 -дибромпентан
 2. Галогенирование (АЕ) б) Хлорирование Cl 2 (CCl 4), Cl 2 (CHCl 3) Хлорирование алкенов протекает в мягких условиях; Используется не чистый реагент, а раствор хлора в каком-либо растворителе; Вид растворителя определяет характер получаемого продукта, а именно: ü хлорирование алкенов в органическом растворителе Cl 2 (CCl 4), Cl 2 (CHCl 3) – образование дихлоралканов (по аналогии с процессом бромирования); ü характер связи не влияет на характер получаемого продукта при взаимодействии алкенов с раствором хлора в хлороформе или с раствором хлора в четыреххлористом углероде.
2. Галогенирование (АЕ) б) Хлорирование Cl 2 (CCl 4), Cl 2 (CHCl 3) Хлорирование алкенов протекает в мягких условиях; Используется не чистый реагент, а раствор хлора в каком-либо растворителе; Вид растворителя определяет характер получаемого продукта, а именно: ü хлорирование алкенов в органическом растворителе Cl 2 (CCl 4), Cl 2 (CHCl 3) – образование дихлоралканов (по аналогии с процессом бромирования); ü характер связи не влияет на характер получаемого продукта при взаимодействии алкенов с раствором хлора в хлороформе или с раствором хлора в четыреххлористом углероде.
 2. Галогенирование б) Хлорирование Cl 2 (CCl 4), Cl 2 (CHCl 3) Характер двойной связи УХР симметричная СН 3→СН=СН←СН 3 + Cl 2 (CCl 4) → СН 3─СН─СН─СН 3 │ │ Cl Cl 2, 3 -дихлорбутан несимметричная СН 2=СН←СН 2─СН 3 + Cl 2 (CHCl 3) → СН 2─СН─СН 2─СН 3 │ │ Cl Cl 1, 2 -дихлорбутан «псевдосимметричная» СН →СН=СН←СН ─СН + Cl (CHCl ) → 3 2 3 СН 3─СН─СН─СН 2─СН 3 │ │ Cl Cl 2, 3 -дихлорпентан
2. Галогенирование б) Хлорирование Cl 2 (CCl 4), Cl 2 (CHCl 3) Характер двойной связи УХР симметричная СН 3→СН=СН←СН 3 + Cl 2 (CCl 4) → СН 3─СН─СН─СН 3 │ │ Cl Cl 2, 3 -дихлорбутан несимметричная СН 2=СН←СН 2─СН 3 + Cl 2 (CHCl 3) → СН 2─СН─СН 2─СН 3 │ │ Cl Cl 1, 2 -дихлорбутан «псевдосимметричная» СН →СН=СН←СН ─СН + Cl (CHCl ) → 3 2 3 СН 3─СН─СН─СН 2─СН 3 │ │ Cl Cl 2, 3 -дихлорпентан
 2. Галогенирование (АЕ) б) Хлорирование Cl 2 (Н 2 О) Хлорирование алкенов протекает в мягких условиях; Используется не чистый реагент, а раствор хлора в каком-либо растворителе; Вид растворителя определяет характер получаемого продукта, а именно: ü хлорирование алкенов в воде – обработка хлорной водой Cl 2 (H 2 O) – образование хлоргидринов, ü взаимодействие хлора с водой − реакция диспропорционирования Cl 20 + H 2 O ⇄ H−Cl− 1 + HO−Cl+1 − образование соляной и хлорноватистой кислот, δ− δ+ HO−Cl ü характер связи влияет на характер получаемого продукта при взаимодействии алкенов с хлорной водой.
2. Галогенирование (АЕ) б) Хлорирование Cl 2 (Н 2 О) Хлорирование алкенов протекает в мягких условиях; Используется не чистый реагент, а раствор хлора в каком-либо растворителе; Вид растворителя определяет характер получаемого продукта, а именно: ü хлорирование алкенов в воде – обработка хлорной водой Cl 2 (H 2 O) – образование хлоргидринов, ü взаимодействие хлора с водой − реакция диспропорционирования Cl 20 + H 2 O ⇄ H−Cl− 1 + HO−Cl+1 − образование соляной и хлорноватистой кислот, δ− δ+ HO−Cl ü характер связи влияет на характер получаемого продукта при взаимодействии алкенов с хлорной водой.
 2. Галогенирование б) Хлорирование Cl 2 (Н 2 О) Характер двойной связи УХР симметричная СН 3→СН=СН←СН 3 + Cl 2 + H 2 O → HCl + δ− δ+ HO−Cl несимметричная δ− δ− δ+ HO−Cl СН 2=СН←СН 2─СН 3 + Cl 2 + H 2 O → СН 2─СН─СН 2─СН 3 + HCl │ │ Cl ОН 1 -хлорбутанол-2 «псевдосимметричная» СН 3→СН=СН←СН 2─СН 3 + Cl 2 + H 2 O → → HCl + δ− δ+ HO−Cl δ+
2. Галогенирование б) Хлорирование Cl 2 (Н 2 О) Характер двойной связи УХР симметричная СН 3→СН=СН←СН 3 + Cl 2 + H 2 O → HCl + δ− δ+ HO−Cl несимметричная δ− δ− δ+ HO−Cl СН 2=СН←СН 2─СН 3 + Cl 2 + H 2 O → СН 2─СН─СН 2─СН 3 + HCl │ │ Cl ОН 1 -хлорбутанол-2 «псевдосимметричная» СН 3→СН=СН←СН 2─СН 3 + Cl 2 + H 2 O → → HCl + δ− δ+ HO−Cl δ+
 2. Галогенирование б) Хлорирование Cl 2 (Н 2 О) Характер двойной связи УХР симметричная СН 3→СН=СН←СН 3 + Cl 2 + H 2 O → СН 3─СН─СН─СН 3 + HCl │ │ Cl ОН 3 -хлорбутанол-2 δ− δ+ HO−Cl несимметричная δ− δ− δ+ HO−Cl СН 2=СН←СН 2─СН 3 + Cl 2 + H 2 O → СН 2─СН─СН 2─СН 3 + HCl │ │ Cl ОН 1 -хлорбутанол-2 «псевдосимметричная» СН 3→СН=СН←СН 2─СН 3 + Cl 2 + H 2 O → HCl + δ− δ+ HO−Cl δ+ + СН 3─СН─СН─СН 2─СН 3 │ │ Cl ОН ОН Cl 2 -хлорпентанол-3 3 -хлорпентанол-2
2. Галогенирование б) Хлорирование Cl 2 (Н 2 О) Характер двойной связи УХР симметричная СН 3→СН=СН←СН 3 + Cl 2 + H 2 O → СН 3─СН─СН─СН 3 + HCl │ │ Cl ОН 3 -хлорбутанол-2 δ− δ+ HO−Cl несимметричная δ− δ− δ+ HO−Cl СН 2=СН←СН 2─СН 3 + Cl 2 + H 2 O → СН 2─СН─СН 2─СН 3 + HCl │ │ Cl ОН 1 -хлорбутанол-2 «псевдосимметричная» СН 3→СН=СН←СН 2─СН 3 + Cl 2 + H 2 O → HCl + δ− δ+ HO−Cl δ+ + СН 3─СН─СН─СН 2─СН 3 │ │ Cl ОН ОН Cl 2 -хлорпентанол-3 3 -хлорпентанол-2
 3. Гидратация (АЕ) Гидратация алкенов – процесс каталитический, протекающий при нагревании и под давлением (t°C¸ р); В качестве катализатора используется концентрированная серная кислота (H 2 SO 4 концентрированная ) или безводная фосфорная кислота (Н 3 РО 4 безводная); Характер связи влияет на характер получаемого продукта при взаимодействии алкенов с водой.
3. Гидратация (АЕ) Гидратация алкенов – процесс каталитический, протекающий при нагревании и под давлением (t°C¸ р); В качестве катализатора используется концентрированная серная кислота (H 2 SO 4 концентрированная ) или безводная фосфорная кислота (Н 3 РО 4 безводная); Характер связи влияет на характер получаемого продукта при взаимодействии алкенов с водой.
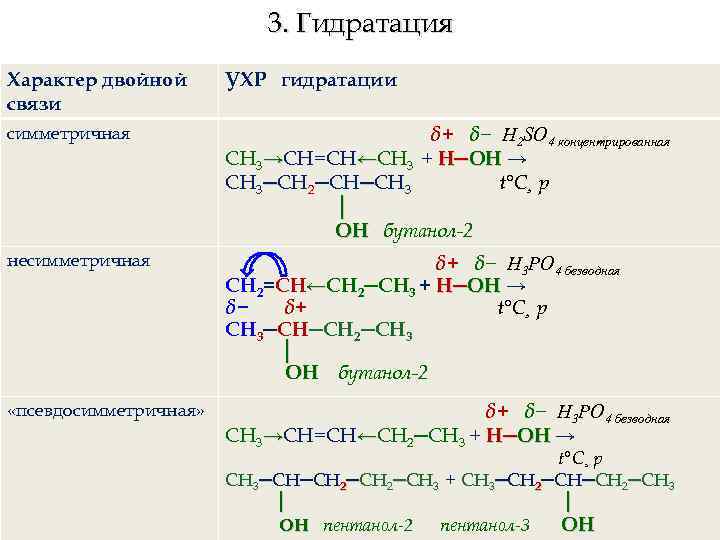 3. Гидратация Характер двойной связи УХР гидратации симметричная δ+ δ− H 2 SO 4 концентрированная СН 3→СН=СН←СН 3 + H─ОН → СН 3─СН 2─СН─СН 3 t°C¸ р │ ОН бутанол-2 несимметричная δ+ δ− Н 3 РО 4 безводная СН 2=СН←СН 2─СН 3 + H─ОН → δ− δ+ t°C¸ р СН 3─СН─СН 2─СН 3 │ ОН бутанол-2 «псевдосимметричная» δ+ δ− Н 3 РО 4 безводная СН 3→СН=СН←СН 2─СН 3 + H─ОН → t°C¸ р СН 3─СН─СН 2─СН 3 + СН 3─СН 2─СН 3 │ │ ОН пентанол-2 пентанол-3 ОН
3. Гидратация Характер двойной связи УХР гидратации симметричная δ+ δ− H 2 SO 4 концентрированная СН 3→СН=СН←СН 3 + H─ОН → СН 3─СН 2─СН─СН 3 t°C¸ р │ ОН бутанол-2 несимметричная δ+ δ− Н 3 РО 4 безводная СН 2=СН←СН 2─СН 3 + H─ОН → δ− δ+ t°C¸ р СН 3─СН─СН 2─СН 3 │ ОН бутанол-2 «псевдосимметричная» δ+ δ− Н 3 РО 4 безводная СН 3→СН=СН←СН 2─СН 3 + H─ОН → t°C¸ р СН 3─СН─СН 2─СН 3 + СН 3─СН 2─СН 3 │ │ ОН пентанол-2 пентанол-3 ОН
 4. Алкилирование бензола и его гомологов алкенами Алкилирование – процесс введения в молекулу органического субстрата углеводородного радикала, чаще всего, предельного; Алкилирование бензола и его гомологов алкенами может быть рассмотрен, как процесс ü АЕ − электрофильное присоединение бензола к алкенам (алкен – субстрат, бензол – реагент), ü SЕ − электрофильное замещение в молекуле бензола (бензол – субстрат, алкен – реагент); Алкилирование бензола и его гомологов алкенами – процесс каталитический; В качестве катализатора используется фторид бора (BF 3) или безводная фосфорная кислота (Н 3 РО 4 безводная); Характер связи влияет на характер получаемого продукта при взаимодействии алкенов с аренами.
4. Алкилирование бензола и его гомологов алкенами Алкилирование – процесс введения в молекулу органического субстрата углеводородного радикала, чаще всего, предельного; Алкилирование бензола и его гомологов алкенами может быть рассмотрен, как процесс ü АЕ − электрофильное присоединение бензола к алкенам (алкен – субстрат, бензол – реагент), ü SЕ − электрофильное замещение в молекуле бензола (бензол – субстрат, алкен – реагент); Алкилирование бензола и его гомологов алкенами – процесс каталитический; В качестве катализатора используется фторид бора (BF 3) или безводная фосфорная кислота (Н 3 РО 4 безводная); Характер связи влияет на характер получаемого продукта при взаимодействии алкенов с аренами.
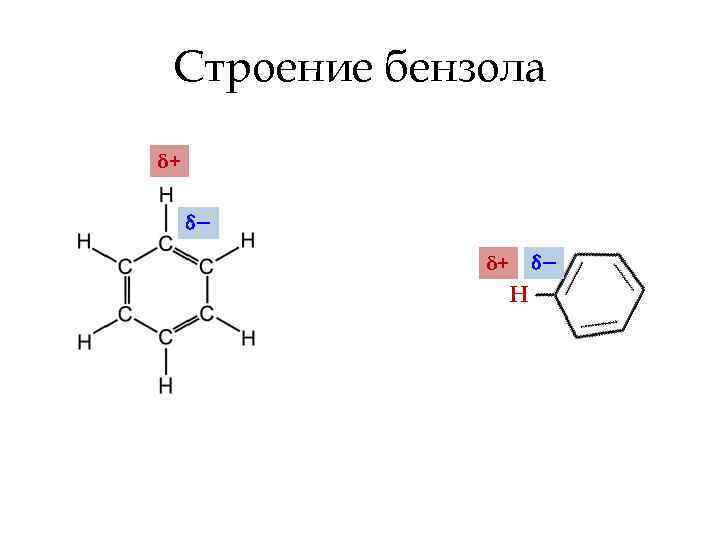 Строение бензола δ+ δ− δ+ Н δ−
Строение бензола δ+ δ− δ+ Н δ−
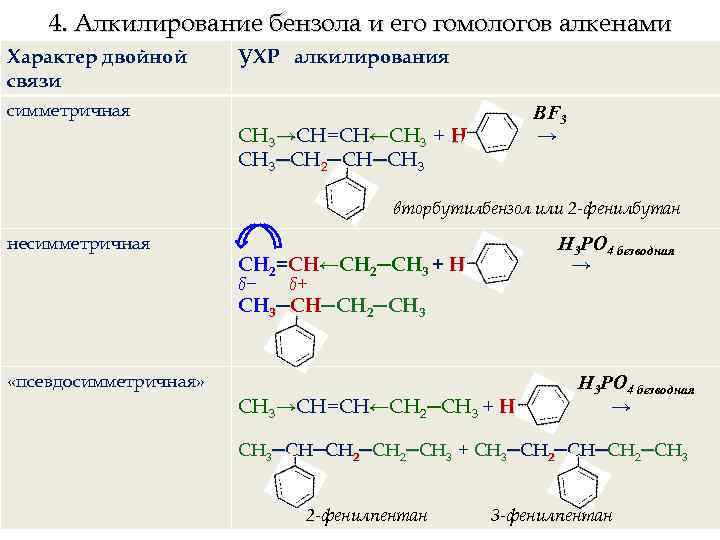 4. Алкилирование бензола и его гомологов алкенами Характер двойной связи УХР алкилирования симметричная BF 3 → СН 3→СН=СН←СН 3 + H СН 3─СН 2─СН─СН 3 вторбутилбензол или 2 -фенилбутан несимметричная Н 3 РО 4 безводная → СН 2=СН←СН 2─СН 3 + H δ− δ+ СН 3─СН─СН 2─СН 3 «псевдосимметричная» СН 3→СН=СН←СН 2─СН 3 + H Н 3 РО 4 безводная → СН 3─СН─СН 2─СН 3 + СН 3─СН 2─СН 3 2 -фенилпентан 3 -фенилпентан
4. Алкилирование бензола и его гомологов алкенами Характер двойной связи УХР алкилирования симметричная BF 3 → СН 3→СН=СН←СН 3 + H СН 3─СН 2─СН─СН 3 вторбутилбензол или 2 -фенилбутан несимметричная Н 3 РО 4 безводная → СН 2=СН←СН 2─СН 3 + H δ− δ+ СН 3─СН─СН 2─СН 3 «псевдосимметричная» СН 3→СН=СН←СН 2─СН 3 + H Н 3 РО 4 безводная → СН 3─СН─СН 2─СН 3 + СН 3─СН 2─СН 3 2 -фенилпентан 3 -фенилпентан
 5. Оксосинтез или синтез Реппе Две разновидности оксосинтеза а) гидроформилирование – введение в молекулу органического субстрата атома водорода (−Н) и альдегидной группы (−СН=О); б) гидроксилирование – введение в молекулу органического субстрата атома водорода (−Н) и карбоксильной группы (−СООН); Оксосинтез – процесс каталитический, протекающий в жестких условиях t°C = 100°C – 200°C ; р = 200 атм В качестве катализатора используется тетракарбонилникель [Ni(СО)4] или октакарбонилдикобальт [Со 2(СО)8] Характер связи влияет не на характер получаемого продукта, а на количество получаемых продуктов, а именно: из симметричных алкенов, образуется один продукт оксосинтеза, из любых других алкенов – два продукта.
5. Оксосинтез или синтез Реппе Две разновидности оксосинтеза а) гидроформилирование – введение в молекулу органического субстрата атома водорода (−Н) и альдегидной группы (−СН=О); б) гидроксилирование – введение в молекулу органического субстрата атома водорода (−Н) и карбоксильной группы (−СООН); Оксосинтез – процесс каталитический, протекающий в жестких условиях t°C = 100°C – 200°C ; р = 200 атм В качестве катализатора используется тетракарбонилникель [Ni(СО)4] или октакарбонилдикобальт [Со 2(СО)8] Характер связи влияет не на характер получаемого продукта, а на количество получаемых продуктов, а именно: из симметричных алкенов, образуется один продукт оксосинтеза, из любых других алкенов – два продукта.
 5. Оксосинтез (а) (гидроформилирование) Характер двойной связи симметричная −Н и ─СН=О УХР гидроформилирования 100°C− 200°C¸ 200 атм → СН 3─СН=СН─СН 3 + СО + Н 2 СН 3─СН 2─СН─СН 3 [Ni(СО)4] │ СН=О 2 -метилбутаналь 100°C− 200°C¸ 200 атм СН 2=СН 2 + СО + Н 2 СН 3─СН 2─СН=О пропаналь несимметричная или «псевдосимметричная» −Н и ─СН=О → [Ni(СО)4] 100°C− 200°C¸ 200 атм → СН 2=СН─СН 2─СН 3 + СО + Н 2 СН 3─СН─СН 2─СН 3 [Со 2(СО)8] │ СН=О 2 -метилбутаналь СН 3─СН 2─СН=О пентаналь
5. Оксосинтез (а) (гидроформилирование) Характер двойной связи симметричная −Н и ─СН=О УХР гидроформилирования 100°C− 200°C¸ 200 атм → СН 3─СН=СН─СН 3 + СО + Н 2 СН 3─СН 2─СН─СН 3 [Ni(СО)4] │ СН=О 2 -метилбутаналь 100°C− 200°C¸ 200 атм СН 2=СН 2 + СО + Н 2 СН 3─СН 2─СН=О пропаналь несимметричная или «псевдосимметричная» −Н и ─СН=О → [Ni(СО)4] 100°C− 200°C¸ 200 атм → СН 2=СН─СН 2─СН 3 + СО + Н 2 СН 3─СН─СН 2─СН 3 [Со 2(СО)8] │ СН=О 2 -метилбутаналь СН 3─СН 2─СН=О пентаналь
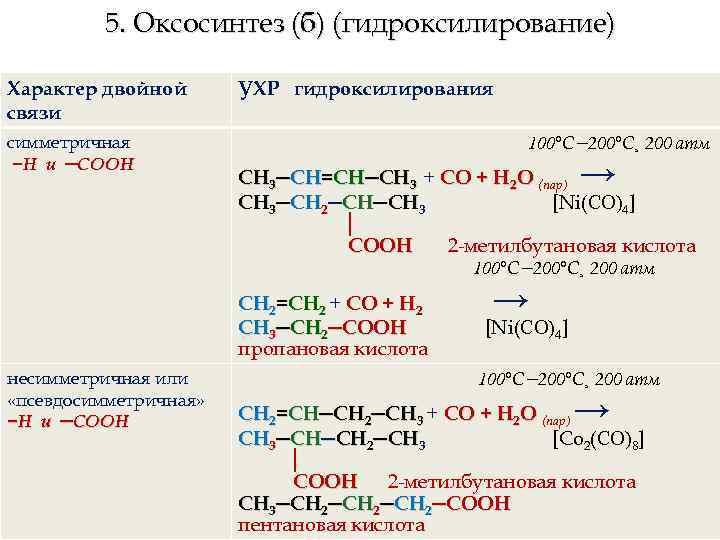 5. Оксосинтез (б) (гидроксилирование) Характер двойной связи симметричная −Н и ─СООН УХР гидроксилирования 100°C− 200°C¸ 200 атм → СН 3─СН=СН─СН 3 + СО + Н 2 О (пар) СН 3─СН 2─СН─СН 3 [Ni(СО)4] │ СООН 2 -метилбутановая кислота 100°C− 200°C¸ 200 атм СН 2=СН 2 + СО + Н 2 СН 3─СН 2─СООН пропановая кислота несимметричная или «псевдосимметричная» −Н и ─СООН → [Ni(СО)4] 100°C− 200°C¸ 200 атм → СН 2=СН─СН 2─СН 3 + СО + Н 2 О (пар) СН 3─СН─СН 2─СН 3 [Со 2(СО)8] │ СООН 2 -метилбутановая кислота СН 3─СН 2─СН 2─СООН пентановая кислота
5. Оксосинтез (б) (гидроксилирование) Характер двойной связи симметричная −Н и ─СООН УХР гидроксилирования 100°C− 200°C¸ 200 атм → СН 3─СН=СН─СН 3 + СО + Н 2 О (пар) СН 3─СН 2─СН─СН 3 [Ni(СО)4] │ СООН 2 -метилбутановая кислота 100°C− 200°C¸ 200 атм СН 2=СН 2 + СО + Н 2 СН 3─СН 2─СООН пропановая кислота несимметричная или «псевдосимметричная» −Н и ─СООН → [Ni(СО)4] 100°C− 200°C¸ 200 атм → СН 2=СН─СН 2─СН 3 + СО + Н 2 О (пар) СН 3─СН─СН 2─СН 3 [Со 2(СО)8] │ СООН 2 -метилбутановая кислота СН 3─СН 2─СН 2─СООН пентановая кислота
 6. Каталитическое гидрирование относится к реакциям присоединения, но не является электрофильным; При каталитическом гидрировании алкенов образуются алканы; Гидрирование – процесс каталитический, протекающий в жестких условиях t°C , р; В качестве катализатора используется Ni, Pd, Pt Характер связи не влияет на характер получаемого продукта. (самостоятельно напишите УХР гидрирования алкенов)
6. Каталитическое гидрирование относится к реакциям присоединения, но не является электрофильным; При каталитическом гидрировании алкенов образуются алканы; Гидрирование – процесс каталитический, протекающий в жестких условиях t°C , р; В качестве катализатора используется Ni, Pd, Pt Характер связи не влияет на характер получаемого продукта. (самостоятельно напишите УХР гидрирования алкенов)


