Химические свойства алканов.pptx
- Количество слайдов: 45
 Химические свойства алканов В молекуле алкана все атомы углерода находятся в наиболее устойчивом первом валентном состоянии – sp 3 -гибридизации; ü Алканы являются химически неактивными органическими соединениями; ü Все химические реакции с участием алканов протекают в жестких условиях: УФ−облучение (hν), t°С = 500°С – 600°С. ü
Химические свойства алканов В молекуле алкана все атомы углерода находятся в наиболее устойчивом первом валентном состоянии – sp 3 -гибридизации; ü Алканы являются химически неактивными органическими соединениями; ü Все химические реакции с участием алканов протекают в жестких условиях: УФ−облучение (hν), t°С = 500°С – 600°С. ü
 Химические свойства алканов I. Реакции свободно-радикального замещения (SR) – разрыв связи С−Н и образованием связи С−Э, где Э – гетероатом (S, N, Hal) II. Реакции дегидрирования и дегидроциклизации (Е) – разрыв связи С−Н, образование связи С−С III. Изомеризация (I), пиролиз и крекинг – разрыв связи С−Н, разрыв связи С−С, образование связи С−С, H−Н IV. Реакции окисления – разрыв связи С−Н, разрыв связи С−С, образование связи О−Н, образование связи О−С, образование связи O=C
Химические свойства алканов I. Реакции свободно-радикального замещения (SR) – разрыв связи С−Н и образованием связи С−Э, где Э – гетероатом (S, N, Hal) II. Реакции дегидрирования и дегидроциклизации (Е) – разрыв связи С−Н, образование связи С−С III. Изомеризация (I), пиролиз и крекинг – разрыв связи С−Н, разрыв связи С−С, образование связи С−С, H−Н IV. Реакции окисления – разрыв связи С−Н, разрыв связи С−С, образование связи О−Н, образование связи О−С, образование связи O=C
 I. Реакции свободно-радикального замещения SR S – substitution, R – radicalic Свободные радикалы – частицы (атомы, молекулы, ионы), имеющие неспаренные электроны и обладающие высокой химической активностью (высокой реакционной способностью) реакции с участием свободных радикалов протекают в жестких условиях (УФ-hν или t°C); имеют цепной (неконтролируемый) характер; сопровождаются гомолитическим разрывом связи или гомолизом связи А • • В → А • + • В
I. Реакции свободно-радикального замещения SR S – substitution, R – radicalic Свободные радикалы – частицы (атомы, молекулы, ионы), имеющие неспаренные электроны и обладающие высокой химической активностью (высокой реакционной способностью) реакции с участием свободных радикалов протекают в жестких условиях (УФ-hν или t°C); имеют цепной (неконтролируемый) характер; сопровождаются гомолитическим разрывом связи или гомолизом связи А • • В → А • + • В
 Механизм реакции SR I – инициирование или зарождение цепи Образование свободных радикалов из неактивной молекулы под действием энергии (hν или t°C) hν или 500°C Cl • • Cl → Cl● + ●Cl или hν или 500°C Cl • • Cl → 2 Cl●
Механизм реакции SR I – инициирование или зарождение цепи Образование свободных радикалов из неактивной молекулы под действием энергии (hν или t°C) hν или 500°C Cl • • Cl → Cl● + ●Cl или hν или 500°C Cl • • Cl → 2 Cl●
 Механизм реакции SR II этап – развитие или рост цепи Цепное взаимодействие радикалов и неактивных молекул, которое приводит к образованию нового радикала и новой молекулы ●Cl + Н • • CН 3 → H • • Cl + ●CH 3, Н • • CН 3 или CН 4 ●CH 3 + Cl • • Cl → CH 3 • • Cl + ●Cl, ●Cl + CH 3 Cl → H • • Cl + ●СH 2 Cl, ●СH 2 Cl + Cl • • Cl → Cl • • CH 2 Cl + ●Cl, ●Cl + CH 2 Cl 2 → H • • Cl + ●СHCl 2, ●СHCl 2 + Cl • • Cl → Cl • • CHCl 2 + ●Cl, ●Cl + CHCl 3 → H • • Cl + ●СCl 3, ●СCl 3 + Cl • • Cl → Cl • • CCl 3 + ●Cl …
Механизм реакции SR II этап – развитие или рост цепи Цепное взаимодействие радикалов и неактивных молекул, которое приводит к образованию нового радикала и новой молекулы ●Cl + Н • • CН 3 → H • • Cl + ●CH 3, Н • • CН 3 или CН 4 ●CH 3 + Cl • • Cl → CH 3 • • Cl + ●Cl, ●Cl + CH 3 Cl → H • • Cl + ●СH 2 Cl, ●СH 2 Cl + Cl • • Cl → Cl • • CH 2 Cl + ●Cl, ●Cl + CH 2 Cl 2 → H • • Cl + ●СHCl 2, ●СHCl 2 + Cl • • Cl → Cl • • CHCl 2 + ●Cl, ●Cl + CHCl 3 → H • • Cl + ●СCl 3, ●СCl 3 + Cl • • Cl → Cl • • CCl 3 + ●Cl …
 Механизм реакции SR III этап – обрыв цепи или рекомбинация радикалов Объединение свободных радикалов в неактивную молекулу ●Cl + ●Cl → Cl • • Cl , ●CH 3 + ●Cl → CH 3 • • Cl, ●СH 2 Cl + ●Cl → CH 2 Cl 2 или Cl • • CH 2 Cl, ●СHCl 2 + ●Cl → CHCl 3 или Cl • • CHCl 2 …
Механизм реакции SR III этап – обрыв цепи или рекомбинация радикалов Объединение свободных радикалов в неактивную молекулу ●Cl + ●Cl → Cl • • Cl , ●CH 3 + ●Cl → CH 3 • • Cl, ●СH 2 Cl + ●Cl → CH 2 Cl 2 или Cl • • CH 2 Cl, ●СHCl 2 + ●Cl → CHCl 3 или Cl • • CHCl 2 …
 Этапы реакции SR: I – инициирование или зарождение цепи II – развитие или рост цепи III – обрыв цепи или рекомбинация радикалов Продукты реакции хлорирования метана Формула Название по М. Н. Тривиальное название СН 3 Cl Хлорметан Метилхлорид СН 2 Cl 2 Дихлорметан Хлористый метилен СНCl 3 Трихлорметан Хлороформ СCl 4 Тетрахлорметан Четыреххлористый углерод
Этапы реакции SR: I – инициирование или зарождение цепи II – развитие или рост цепи III – обрыв цепи или рекомбинация радикалов Продукты реакции хлорирования метана Формула Название по М. Н. Тривиальное название СН 3 Cl Хлорметан Метилхлорид СН 2 Cl 2 Дихлорметан Хлористый метилен СНCl 3 Трихлорметан Хлороформ СCl 4 Тетрахлорметан Четыреххлористый углерод
 Для осуществления контроля реакции с целью получения одного основного продукта, необходимо «задать» определенные соотношения между ν(Cl 2) и ν(Сn. H 2 n+2) или ν(Cl 2) и ν(СH 4) ν(Cl 2) /ν(Сn. H 2 n+2) = 1/1 или ν(Cl 2) /ν(СH 4) = 1/1 монохлоралкан или монохлорметан ν(Cl 2) /ν(Сn. H 2 n+2) = 2/1 или ν(Cl 2) /ν(СH 4) = 2/1 дихлоралкан или дихлорметан ν(Cl 2) /ν(Сn. H 2 n+2) = 3/1 или ν(Cl 2) /ν(СH 4) = 3/1 трихлоралкан или трихлорметан … ν(Cl 2) /ν(Сn. H 2 n+2) = 2 n+2/1 или ν(Cl 2) /ν(СH 4) = 4/1 полихлоралкан, в молекуле которого все атомы H замещены на атомы Cl; исчерпывающее хлорирование (исчерпывающее галогенирование)
Для осуществления контроля реакции с целью получения одного основного продукта, необходимо «задать» определенные соотношения между ν(Cl 2) и ν(Сn. H 2 n+2) или ν(Cl 2) и ν(СH 4) ν(Cl 2) /ν(Сn. H 2 n+2) = 1/1 или ν(Cl 2) /ν(СH 4) = 1/1 монохлоралкан или монохлорметан ν(Cl 2) /ν(Сn. H 2 n+2) = 2/1 или ν(Cl 2) /ν(СH 4) = 2/1 дихлоралкан или дихлорметан ν(Cl 2) /ν(Сn. H 2 n+2) = 3/1 или ν(Cl 2) /ν(СH 4) = 3/1 трихлоралкан или трихлорметан … ν(Cl 2) /ν(Сn. H 2 n+2) = 2 n+2/1 или ν(Cl 2) /ν(СH 4) = 4/1 полихлоралкан, в молекуле которого все атомы H замещены на атомы Cl; исчерпывающее хлорирование (исчерпывающее галогенирование)
 Хлорирование метана hν СН 4 + Cl 2 → СН 3 Cl + НCl монохлорметан метилхлорид hν СН 4 + 2 Cl 2→ СН 2 Cl 2 + 2 НCl дихлорметан хлористый метилен hν СН 4 + 3 Cl 2→ СНCl 3 + 3 НCl трихлорметан хлороформ hν СН 4 + 4 Cl 2→ СCl 4 + 4 НCl тетрахлорметан четырёххлористый углерод
Хлорирование метана hν СН 4 + Cl 2 → СН 3 Cl + НCl монохлорметан метилхлорид hν СН 4 + 2 Cl 2→ СН 2 Cl 2 + 2 НCl дихлорметан хлористый метилен hν СН 4 + 3 Cl 2→ СНCl 3 + 3 НCl трихлорметан хлороформ hν СН 4 + 4 Cl 2→ СCl 4 + 4 НCl тетрахлорметан четырёххлористый углерод
 1. Галогенирование алканов – процесс взаимодействия алканов с простыми веществами − галогенами (F 2, Cl 2, Br 2, I 2), в результате которого образуются галогеналканы Галогеналканы – галогенпроизводные алканов, полученные в результате замещения одного или нескольких атомов водорода в молекуле алкана на соответствующее количество атомов галогена. Сn. H 2 n+2 → Сn. H 2 n+2 −x Halx , где 1≤ x ≤ 2 n+2 алкан галогеналкан Считаем, что термины «галогенирование» ( «хлорирование» , «бромирование» и т. д. ) означают, что в реакцию вступают 1 моль алкана (Сn. H 2 n+2 ) и 1 моль галогена (Hal 2), в результате образуются моногалогеналканы (Сn. H 2 n+1 Hal), полученные при замещении одного атома водорода (Н) в молекуле алкана на один атом галогена (Hal)
1. Галогенирование алканов – процесс взаимодействия алканов с простыми веществами − галогенами (F 2, Cl 2, Br 2, I 2), в результате которого образуются галогеналканы Галогеналканы – галогенпроизводные алканов, полученные в результате замещения одного или нескольких атомов водорода в молекуле алкана на соответствующее количество атомов галогена. Сn. H 2 n+2 → Сn. H 2 n+2 −x Halx , где 1≤ x ≤ 2 n+2 алкан галогеналкан Считаем, что термины «галогенирование» ( «хлорирование» , «бромирование» и т. д. ) означают, что в реакцию вступают 1 моль алкана (Сn. H 2 n+2 ) и 1 моль галогена (Hal 2), в результате образуются моногалогеналканы (Сn. H 2 n+1 Hal), полученные при замещении одного атома водорода (Н) в молекуле алкана на один атом галогена (Hal)
 а) Фторирование Фтор (F 2) – наиболее реакционноспособный из галогенов Невозможно получить ни монофторалканы, ни полифторалканы при непосредственном взаимодействии алканов с фтором При взаимодействии алканов с фтором происходит практически полная деструкция молекулы алкана; имеет место гомолиз не только всех связей С−Н, но и всех связей С−С 0°C; hν Сn. H 2 n+2 + (3 n +1) F 2 → n CF 4 + (2 n+2) HF 0°C; hν С 3 H 8 + 10 F 2 → 3 CF 4 + 8 HF
а) Фторирование Фтор (F 2) – наиболее реакционноспособный из галогенов Невозможно получить ни монофторалканы, ни полифторалканы при непосредственном взаимодействии алканов с фтором При взаимодействии алканов с фтором происходит практически полная деструкция молекулы алкана; имеет место гомолиз не только всех связей С−Н, но и всех связей С−С 0°C; hν Сn. H 2 n+2 + (3 n +1) F 2 → n CF 4 + (2 n+2) HF 0°C; hν С 3 H 8 + 10 F 2 → 3 CF 4 + 8 HF
 б) Хлорирование Хлор (Cl 2) – менее реакционноспособный по сравнению с фтором, но достаточно активный реагент. При взаимодействии алканов с хлором возможно замещение любого числа атомов водорода на соответствующее число атомов хлора, но при этом не происходит разрушения С—С связей в молекуле алкана. Исчерпывающее галогенирование – процесс замещения всех атомов водорода в молекуле органического субстрата (алкана) на соответствующее количество атомов галогена.
б) Хлорирование Хлор (Cl 2) – менее реакционноспособный по сравнению с фтором, но достаточно активный реагент. При взаимодействии алканов с хлором возможно замещение любого числа атомов водорода на соответствующее число атомов хлора, но при этом не происходит разрушения С—С связей в молекуле алкана. Исчерпывающее галогенирование – процесс замещения всех атомов водорода в молекуле органического субстрата (алкана) на соответствующее количество атомов галогена.
 б) Хлорирование При взаимодействии алканов с хлором (моногалогенирование) Сl 2 действует неизбирательно; неизбирательно реакция протекает неселективно; неселективно замещение атома Н на атом Cl при «любом» атоме С hν СH 4 + Cl 2 → CН 3 Cl + HCl; хлорметан hν СH 3−СH 3 + Cl 2 → СH 3−СH 2−Cl + HCl; хлорэтан hν СH 3−СH 2−СH 3 + Cl 2 → СH 3−СH 2−Cl + + СH 3−СH−СH 3 │ Cl + 1 -хлорпропан 2 -хлорпропан − СH 3 первичный атом углерода, −СH 2− вторичный атом углерода HCl
б) Хлорирование При взаимодействии алканов с хлором (моногалогенирование) Сl 2 действует неизбирательно; неизбирательно реакция протекает неселективно; неселективно замещение атома Н на атом Cl при «любом» атоме С hν СH 4 + Cl 2 → CН 3 Cl + HCl; хлорметан hν СH 3−СH 3 + Cl 2 → СH 3−СH 2−Cl + HCl; хлорэтан hν СH 3−СH 2−СH 3 + Cl 2 → СH 3−СH 2−Cl + + СH 3−СH−СH 3 │ Cl + 1 -хлорпропан 2 -хлорпропан − СH 3 первичный атом углерода, −СH 2− вторичный атом углерода HCl
 Хлорирование 2 -метилбутана hν СН 3−СН−СН 2−СН 3 + Cl 2 → НCl + │ СН 3 + СН 2−СН−СН 2−СН 3 + СН 3−СН−СН−СН 3 + │ │ Cl СН 3 Cl 2 -метил-1 -хлорбутан 3 -метил-2 -хлорбутан Cl │ + СН 3−С−СН 2−СН 3 + СН 3−СН−СН 2 │ │ │ СН 3 Cl 2 -метил-2 -хлорбутан 3 -метил-1 -хлорбутан ─СH 3 первичный атом углерода, ─ СH 2─ вторичный атом углерода ─ СН─ третичный атом углерода │
Хлорирование 2 -метилбутана hν СН 3−СН−СН 2−СН 3 + Cl 2 → НCl + │ СН 3 + СН 2−СН−СН 2−СН 3 + СН 3−СН−СН−СН 3 + │ │ Cl СН 3 Cl 2 -метил-1 -хлорбутан 3 -метил-2 -хлорбутан Cl │ + СН 3−С−СН 2−СН 3 + СН 3−СН−СН 2 │ │ │ СН 3 Cl 2 -метил-2 -хлорбутан 3 -метил-1 -хлорбутан ─СH 3 первичный атом углерода, ─ СH 2─ вторичный атом углерода ─ СН─ третичный атом углерода │
 в) Бромирование Бром (Br 2) – менее реакционноспособный по сравнению с хлором При взаимодействии алканов с бромом Br 2 действует избирательно; избирательно реакция протекает селективно; селективно замещение атома Н на атом Br протекает, в первую очередь, при третичном атоме С, С если нет третичного атома углерода, то при вторичном атоме С, С если нет вторичного атома углерода, то при первичном атоме С Значение энергии (к. Дж/моль) связи C─H для атома углерода первичного вторичного третичного 458 430 339
в) Бромирование Бром (Br 2) – менее реакционноспособный по сравнению с хлором При взаимодействии алканов с бромом Br 2 действует избирательно; избирательно реакция протекает селективно; селективно замещение атома Н на атом Br протекает, в первую очередь, при третичном атоме С, С если нет третичного атома углерода, то при вторичном атоме С, С если нет вторичного атома углерода, то при первичном атоме С Значение энергии (к. Дж/моль) связи C─H для атома углерода первичного вторичного третичного 458 430 339
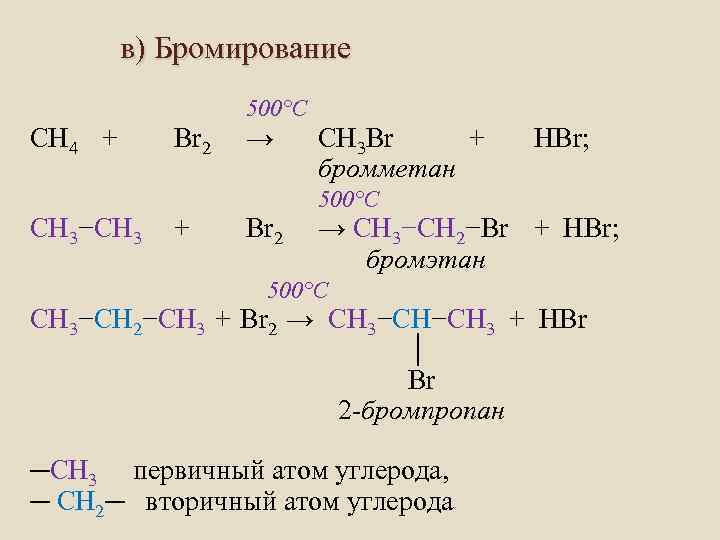 в) Бромирование 500°C СH 4 + Br 2 → CН 3 Br + бромметан HBr; 500°C СH 3−СH 3 + Br 2 → СH 3−СH 2−Br + HBr; бромэтан 500°C СH 3−СH 2−СH 3 + Br 2 → СH 3−СH−СH 3 + HBr │ Br 2 -бромпропан ─СH 3 первичный атом углерода, ─ СH 2─ вторичный атом углерода
в) Бромирование 500°C СH 4 + Br 2 → CН 3 Br + бромметан HBr; 500°C СH 3−СH 3 + Br 2 → СH 3−СH 2−Br + HBr; бромэтан 500°C СH 3−СH 2−СH 3 + Br 2 → СH 3−СH−СH 3 + HBr │ Br 2 -бромпропан ─СH 3 первичный атом углерода, ─ СH 2─ вторичный атом углерода
 Бромирование 2 -метилбутана Br hν │ СН 3−СН−СН 2−СН 3 + Br 2 → НBr + СН 3−С−СН 2−СН 3 │ │ СН 3 2 -бром-2 -метилбутан ─СH 3 первичный атом углерода, ─ СH 2─ вторичный атом углерода ─ СН─ третичный атом углерода │
Бромирование 2 -метилбутана Br hν │ СН 3−СН−СН 2−СН 3 + Br 2 → НBr + СН 3−С−СН 2−СН 3 │ │ СН 3 2 -бром-2 -метилбутан ─СH 3 первичный атом углерода, ─ СH 2─ вторичный атом углерода ─ СН─ третичный атом углерода │
 г) Иодирование Иод (I 2) – наименее реакционноспособный из галогенов Алканы с иодом непосредственно не взаимодействуют Сn. H 2 n+2 + I 2 ≠; равновесие данной реакции практически полностью смещено влево Сn. H 2 n+2 + I 2 → ← Сn. H 2 n+1 I + HI (t°C)
г) Иодирование Иод (I 2) – наименее реакционноспособный из галогенов Алканы с иодом непосредственно не взаимодействуют Сn. H 2 n+2 + I 2 ≠; равновесие данной реакции практически полностью смещено влево Сn. H 2 n+2 + I 2 → ← Сn. H 2 n+1 I + HI (t°C)
 2. Нитрование по Коновалову (1888 год) Нитрование – процесс замещения атома водорода Н на нитро-группу −NO 2 Алканы взаимодействуют с разбавленной азотной кислотой НNO 3 (HO—NO 2) при следующих условиях: ω(НNO 3) = 11% – 14%, t°C=140°C− 150°C, небольшое давление (р), реакция протекает селективно; избирательность реакции нитрования аналогична селективности реакции бромирования: замещение атома Н на группу −NO 2 протекает, в первую очередь, при третичном атоме С, если нет третичного атома углерода, то при вторичном атоме С, если нет вторичного атома углерода, то при первичном атоме С; Схема реакции нитрования R—H + HO—NO 2 → R—NO 2 + Н—ОН
2. Нитрование по Коновалову (1888 год) Нитрование – процесс замещения атома водорода Н на нитро-группу −NO 2 Алканы взаимодействуют с разбавленной азотной кислотой НNO 3 (HO—NO 2) при следующих условиях: ω(НNO 3) = 11% – 14%, t°C=140°C− 150°C, небольшое давление (р), реакция протекает селективно; избирательность реакции нитрования аналогична селективности реакции бромирования: замещение атома Н на группу −NO 2 протекает, в первую очередь, при третичном атоме С, если нет третичного атома углерода, то при вторичном атоме С, если нет вторичного атома углерода, то при первичном атоме С; Схема реакции нитрования R—H + HO—NO 2 → R—NO 2 + Н—ОН
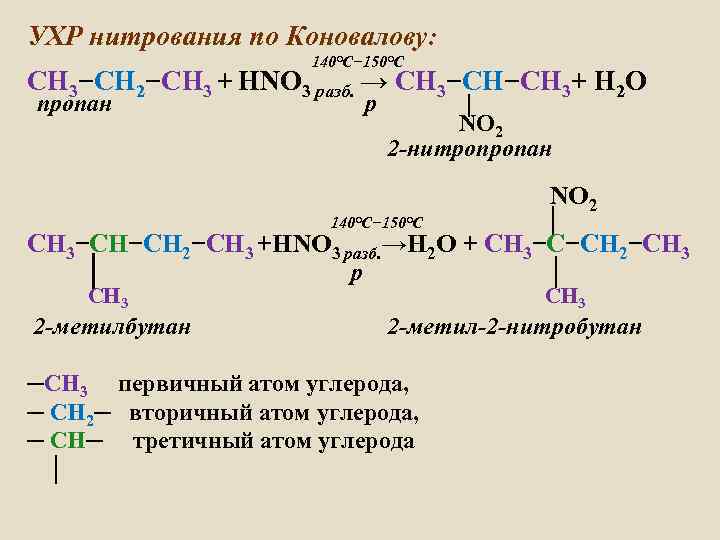 УХР нитрования по Коновалову: 140°C− 150°C СH 3−СH 2−СH 3 + НNO 3 разб. → СH 3−СH−СH 3+ H 2 О пропан р │ NO 2 2 -нитропропан 140°C− 150°C NO 2 │ СН 3−СН−СН 2−СН 3 +НNO 3 разб. →H 2 О + СН 3−С−СН 2−СН 3 │ р │ СН 3 2 -метилбутан СН 3 2 -метил-2 -нитробутан ─СH 3 первичный атом углерода, ─ СH 2─ вторичный атом углерода, ─ СН─ третичный атом углерода │
УХР нитрования по Коновалову: 140°C− 150°C СH 3−СH 2−СH 3 + НNO 3 разб. → СH 3−СH−СH 3+ H 2 О пропан р │ NO 2 2 -нитропропан 140°C− 150°C NO 2 │ СН 3−СН−СН 2−СН 3 +НNO 3 разб. →H 2 О + СН 3−С−СН 2−СН 3 │ р │ СН 3 2 -метилбутан СН 3 2 -метил-2 -нитробутан ─СH 3 первичный атом углерода, ─ СH 2─ вторичный атом углерода, ─ СН─ третичный атом углерода │
 3. Сульфирование – процесс замещения атома водорода Н на сульфо-группу −SO 3 H или −SO 2─ОH Алканы взаимодействуют с концентрированной серной кислотой Н 2 SO 4 (HO—SO 2—OH), насыщенной серным ангидридом SO 3 (олеум), при t°C, реакция протекает селективно; замещение атома Н на группу −SO 3 H протекает только при третичном атоме С; алканы нормального строения не сульфируются; Схема реакции сульфирования R—H + HO—SO 2—OH → R—SO 2—OH + Н—ОН
3. Сульфирование – процесс замещения атома водорода Н на сульфо-группу −SO 3 H или −SO 2─ОH Алканы взаимодействуют с концентрированной серной кислотой Н 2 SO 4 (HO—SO 2—OH), насыщенной серным ангидридом SO 3 (олеум), при t°C, реакция протекает селективно; замещение атома Н на группу −SO 3 H протекает только при третичном атоме С; алканы нормального строения не сульфируются; Схема реакции сульфирования R—H + HO—SO 2—OH → R—SO 2—OH + Н—ОН
 УХР сульфирования t °C СH 3−СH 2−СH 3 +Н 2 SO 4 конц. ≠ пропан SO 3 SO 2−ОH t °C │ СН 3−СН−СН 2−СН 3 + Н 2 SO 4 конц. → H 2 О + СН 3−С−СН 2−СН 3 │ SO 3 │ СН 3 2 -метилбутан-2 -сульфокислота или 2 -метил-2 -сульфобутан −СH 3 первичный атом углерода, −СH 2− вторичный атом углерода −СН− третичный атом углерода │
УХР сульфирования t °C СH 3−СH 2−СH 3 +Н 2 SO 4 конц. ≠ пропан SO 3 SO 2−ОH t °C │ СН 3−СН−СН 2−СН 3 + Н 2 SO 4 конц. → H 2 О + СН 3−С−СН 2−СН 3 │ SO 3 │ СН 3 2 -метилбутан-2 -сульфокислота или 2 -метил-2 -сульфобутан −СH 3 первичный атом углерода, −СH 2− вторичный атом углерода −СН− третичный атом углерода │
 II. Реакции дегидрирования и дегидроциклизации 1. Дегидрирование – процесс отщепления (Е) одной или нескольких молекул водорода (Н 2) от молекулы органического субстрата, в результате которого образуется непредельное соединение, содержащее одну или несколько кратных связей. Особенности процесса дегидрирования алканов: образуется смесь непредельных углеводородов: алкенов, алкадиенов, алкинов; ен диен не рекомендуется использовать данную реакцию в качестве метода получения индивидуальных веществ; дегидрирование алканов – основной промышленный метод получения непредельных углеводородов; как правило, основным продуктом является алкен, в молекуле которого двойная связь образуется у наиболее замещенного атома углерода (между наиболее замещенными атомами углерода); дегидрирование – процесс обратимый
II. Реакции дегидрирования и дегидроциклизации 1. Дегидрирование – процесс отщепления (Е) одной или нескольких молекул водорода (Н 2) от молекулы органического субстрата, в результате которого образуется непредельное соединение, содержащее одну или несколько кратных связей. Особенности процесса дегидрирования алканов: образуется смесь непредельных углеводородов: алкенов, алкадиенов, алкинов; ен диен не рекомендуется использовать данную реакцию в качестве метода получения индивидуальных веществ; дегидрирование алканов – основной промышленный метод получения непредельных углеводородов; как правило, основным продуктом является алкен, в молекуле которого двойная связь образуется у наиболее замещенного атома углерода (между наиболее замещенными атомами углерода); дегидрирование – процесс обратимый
 Непредельные углеводороды АЛКЕНЫ – АЛКИНЫ – АЛКАДИЕНЫ – это ациклические непредельные углеводороды, в молекуле которых имеется одна двойная связь; атомы углерода, которые участвуют в образовании двойной связи в молекуле алкена, находятся в состоянии sp 2 -гибридизации; суффикс названия алкена − ен ен; ен имеется одна тройная связь; атомы углерода, которые участвуют в образовании тройной связи в молекуле алкина, находятся в состоянии sp-гибридизации; суффикс названия алкина − ин ин; ин имеются две двойные связи; атомы углерода, которые участвуют в образовании двойных связей в молекуле алкадиена, как правило, находятся в состоянии sp 2 -гибридизации; суффикс названия алкадиена − диен; ен ен положение кратной связи в молекуле непредельного углеводорода указывают в названии после суффикса по локанту атома углерода с наименьшим номером
Непредельные углеводороды АЛКЕНЫ – АЛКИНЫ – АЛКАДИЕНЫ – это ациклические непредельные углеводороды, в молекуле которых имеется одна двойная связь; атомы углерода, которые участвуют в образовании двойной связи в молекуле алкена, находятся в состоянии sp 2 -гибридизации; суффикс названия алкена − ен ен; ен имеется одна тройная связь; атомы углерода, которые участвуют в образовании тройной связи в молекуле алкина, находятся в состоянии sp-гибридизации; суффикс названия алкина − ин ин; ин имеются две двойные связи; атомы углерода, которые участвуют в образовании двойных связей в молекуле алкадиена, как правило, находятся в состоянии sp 2 -гибридизации; суффикс названия алкадиена − диен; ен ен положение кратной связи в молекуле непредельного углеводорода указывают в названии после суффикса по локанту атома углерода с наименьшим номером
 450°C− 500°C СН 3−СН 3 ⇄ СН 2=СН 2 + СН≡СН + x. H 2 (x=1− 2) этан Cr 2 O 3* этен (этилен) этин (ацетилен) * – другие катализаторы – Ni, Pd, Pt 450°C− 500°C СH 3−СН−СН 3 ⇄ │ Cr 2 O 3 СН 3 2 -метилпропан изобутан СH 2=С−СН 3 + H 2 (☻) │ СН 3 2 -метилпропен изобутен (☻) – метод получения индивидуального вещества 450°C− 500°C СH 3−СН−СН 2−СН 3 ⇄ СH 3−С=СН−СН 2−СН 3+ H 2 │ Cr 2 O 3 │ СН 3 2 -метилпентан 2 -метилпентен-2
450°C− 500°C СН 3−СН 3 ⇄ СН 2=СН 2 + СН≡СН + x. H 2 (x=1− 2) этан Cr 2 O 3* этен (этилен) этин (ацетилен) * – другие катализаторы – Ni, Pd, Pt 450°C− 500°C СH 3−СН−СН 3 ⇄ │ Cr 2 O 3 СН 3 2 -метилпропан изобутан СH 2=С−СН 3 + H 2 (☻) │ СН 3 2 -метилпропен изобутен (☻) – метод получения индивидуального вещества 450°C− 500°C СH 3−СН−СН 2−СН 3 ⇄ СH 3−С=СН−СН 2−СН 3+ H 2 │ Cr 2 O 3 │ СН 3 2 -метилпентан 2 -метилпентен-2
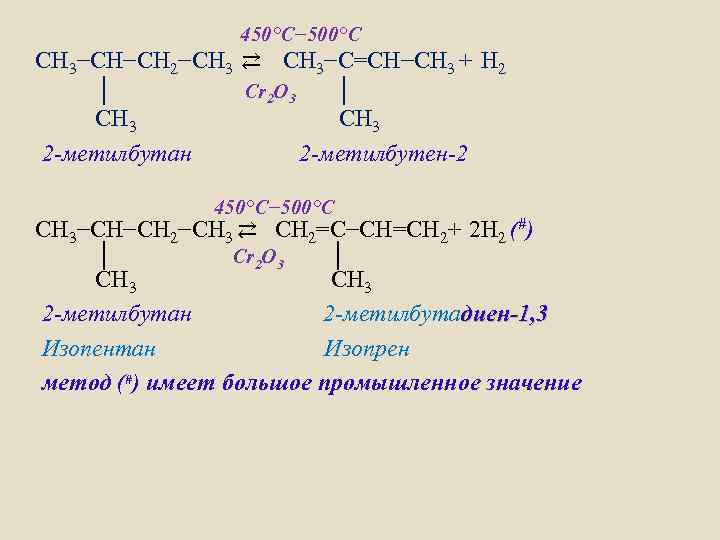 450°C− 500°C СH 3−СН−СН 2−СН 3 ⇄ СH 3−С=СН−СН 3 + H 2 │ Cr 2 O 3 │ СН 3 2 -метилбутан 2 -метилбутен-2 450°C− 500°C СH 3−СН−СН 2−СН 3 ⇄ СH 2=С−СН=СН 2+ 2 H 2 (#) │ Cr 2 O 3 │ СН 3 2 -метилбутан 2 -метилбутадиен-1, 3 Изопентан Изопрен метод (#) имеет большое промышленное значение
450°C− 500°C СH 3−СН−СН 2−СН 3 ⇄ СH 3−С=СН−СН 3 + H 2 │ Cr 2 O 3 │ СН 3 2 -метилбутан 2 -метилбутен-2 450°C− 500°C СH 3−СН−СН 2−СН 3 ⇄ СH 2=С−СН=СН 2+ 2 H 2 (#) │ Cr 2 O 3 │ СН 3 2 -метилбутан 2 -метилбутадиен-1, 3 Изопентан Изопрен метод (#) имеет большое промышленное значение
 2. Дегидроциклизация – дегидрирование с одновременной циклизацией. Дегидроциклизация – процесс отщепления (Е) одной или нескольких молекул водорода от молекулы органического субстрата, в результате которого образуется а) циклопентан и его гомологи – дегидроциклизация по Казанскому и Платэ; б) бензол и его гомологи – ароматизация.
2. Дегидроциклизация – дегидрирование с одновременной циклизацией. Дегидроциклизация – процесс отщепления (Е) одной или нескольких молекул водорода от молекулы органического субстрата, в результате которого образуется а) циклопентан и его гомологи – дегидроциклизация по Казанскому и Платэ; б) бензол и его гомологи – ароматизация.
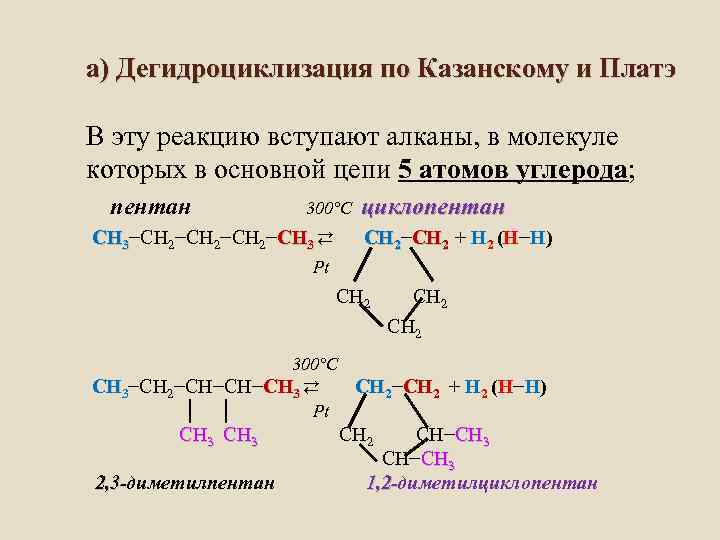 а) Дегидроциклизация по Казанскому и Платэ В эту реакцию вступают алканы, в молекуле которых в основной цепи 5 атомов углерода; пентан 300°C СН 3−СН 2−СН 3 ⇄ циклопентан СН 2−СН 2 + Н 2 (Н−Н) Pt СН 2 CH 2 300°C СН 3−СН 2−СН−СН−СН 3 ⇄ СН 2−СН 2 + Н 2 (Н−Н) │ │ Pt СН 3 СН 2 СН−СН 3 CH−СН 3 2, 3 -диметилпентан 1, 2 -диметилциклопентан 2, 31, 2 -
а) Дегидроциклизация по Казанскому и Платэ В эту реакцию вступают алканы, в молекуле которых в основной цепи 5 атомов углерода; пентан 300°C СН 3−СН 2−СН 3 ⇄ циклопентан СН 2−СН 2 + Н 2 (Н−Н) Pt СН 2 CH 2 300°C СН 3−СН 2−СН−СН−СН 3 ⇄ СН 2−СН 2 + Н 2 (Н−Н) │ │ Pt СН 3 СН 2 СН−СН 3 CH−СН 3 2, 3 -диметилпентан 1, 2 -диметилциклопентан 2, 31, 2 -
 б) Дегидроциклизация − ароматизация Риформинг алканов – процесс переработки алканов, в результате которого образуются бензол и его гомологи (арены) и водород В эту реакцию вступают алканы, в молекуле которых в основной цепи не менее 6 атомов углерода; «условно 1 й» и «условно 6 й» атомы углерода могут быть только первичными (−СН 3) или вторичными (−СН 2−); между указанными атомами углерода не могут находиться четвертичные атомы углерода 300°C, Pt С 6 Н 14 ⇄ С 6 Н 6 + 4 Н 2 н-гексан бензол
б) Дегидроциклизация − ароматизация Риформинг алканов – процесс переработки алканов, в результате которого образуются бензол и его гомологи (арены) и водород В эту реакцию вступают алканы, в молекуле которых в основной цепи не менее 6 атомов углерода; «условно 1 й» и «условно 6 й» атомы углерода могут быть только первичными (−СН 3) или вторичными (−СН 2−); между указанными атомами углерода не могут находиться четвертичные атомы углерода 300°C, Pt С 6 Н 14 ⇄ С 6 Н 6 + 4 Н 2 н-гексан бензол
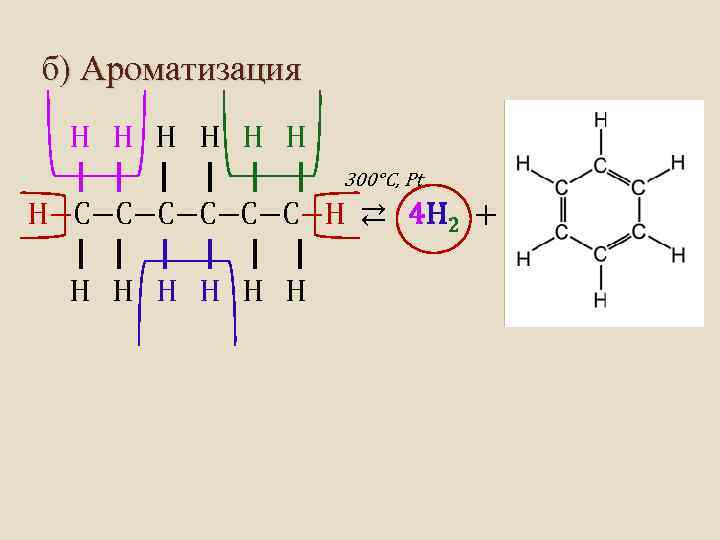 б) Ароматизация Н Н Н | | | 300°C, Pt Н−С−С−С−Н ⇄ 4 H 2 + | | | Н Н Н
б) Ароматизация Н Н Н | | | 300°C, Pt Н−С−С−С−Н ⇄ 4 H 2 + | | | Н Н Н
 III. Изомеризация, пиролиз и крекинг 1. Изомеризация – процесс получения алканов разветвленного строения из алканов нормального строения. Изомеризация возможна для алканов, начиная с С 4 Н 10, изомеризация – одновременно и свойство алканов, и метод получения алканов. 100°C, Al. Cl 3 n−Сn. H 2 n+2 → i−Сn. H 2 n+2 Алкан нормального строения Алкан разветвленного строения СН 3 100°C, Al. Cl 3 │ СН 3−СН 2−СН 3 → СН 3−СН−СН 3 бутан изобутан СН 3−СН 2−СН 3 → СН 3−СН−СН 2−СН 3 + пентан изопентан СН 3 │ + СН 3−С−СН 3 │ СН 3 100°C, Al. Cl 3 │ неопентан
III. Изомеризация, пиролиз и крекинг 1. Изомеризация – процесс получения алканов разветвленного строения из алканов нормального строения. Изомеризация возможна для алканов, начиная с С 4 Н 10, изомеризация – одновременно и свойство алканов, и метод получения алканов. 100°C, Al. Cl 3 n−Сn. H 2 n+2 → i−Сn. H 2 n+2 Алкан нормального строения Алкан разветвленного строения СН 3 100°C, Al. Cl 3 │ СН 3−СН 2−СН 3 → СН 3−СН−СН 3 бутан изобутан СН 3−СН 2−СН 3 → СН 3−СН−СН 2−СН 3 + пентан изопентан СН 3 │ + СН 3−С−СН 3 │ СН 3 100°C, Al. Cl 3 │ неопентан
 2. Пиролиз – процесс расщепления в молекуле органического субстрата практически всех С−С и всех С−Н связей при нагревании без доступа воздуха 700°C, О 2 Сn. H 2 n+2 → n C + (n+1) H 2 700°C, О 2 С 5 H 12 → 5 C + 6 H 2 а) Пиролиз низших алканов 1500°C − 2000°C СH 4 → C + 2 H 2 О 2 1500°C 2 СH 4 → H−С≡С−H + 3 H 2 О 2 ацетилен 1200°C С 2 H 6 → H−С≡С−H + 2 H 2 О 2 1200°C 2 С 3 H 8→ 3 H−С≡С−H + 5 H 2 О 2
2. Пиролиз – процесс расщепления в молекуле органического субстрата практически всех С−С и всех С−Н связей при нагревании без доступа воздуха 700°C, О 2 Сn. H 2 n+2 → n C + (n+1) H 2 700°C, О 2 С 5 H 12 → 5 C + 6 H 2 а) Пиролиз низших алканов 1500°C − 2000°C СH 4 → C + 2 H 2 О 2 1500°C 2 СH 4 → H−С≡С−H + 3 H 2 О 2 ацетилен 1200°C С 2 H 6 → H−С≡С−H + 2 H 2 О 2 1200°C 2 С 3 H 8→ 3 H−С≡С−H + 5 H 2 О 2
 3. Крекинг − процесс расщепления в молекуле алкана некоторых С−С и некоторых С−Н связей при нагревании без доступа воздуха. В результате крекинга образуется смесь алканов и алкенов, в молекуле которых меньшее число атомов углерода, чем в исходном алкане. ü При крекинге алканов, как правило, основными продуктами являются алкан и алкен, в молекулах которых примерно равное число атомов углерода. ü Указанные продукты образуются за счет гомолиза С–С связи, которая расположена в исходном алкане примерно посредине. а) термический ü 500°C − 700°C, О 2 Сn. H 2 n+2 → n−Сx. H 2 x+2 Алкан нормального строения б) каталитический 450°C − 500°C, Al. Cl 3 или Al 2 О 3 Сn. H 2 n+2 → О 2 + i−Сx. H 2 x+2 Сy. H 2 y, где x
3. Крекинг − процесс расщепления в молекуле алкана некоторых С−С и некоторых С−Н связей при нагревании без доступа воздуха. В результате крекинга образуется смесь алканов и алкенов, в молекуле которых меньшее число атомов углерода, чем в исходном алкане. ü При крекинге алканов, как правило, основными продуктами являются алкан и алкен, в молекулах которых примерно равное число атомов углерода. ü Указанные продукты образуются за счет гомолиза С–С связи, которая расположена в исходном алкане примерно посредине. а) термический ü 500°C − 700°C, О 2 Сn. H 2 n+2 → n−Сx. H 2 x+2 Алкан нормального строения б) каталитический 450°C − 500°C, Al. Cl 3 или Al 2 О 3 Сn. H 2 n+2 → О 2 + i−Сx. H 2 x+2 Сy. H 2 y, где x
 а) термический крекинг 500°C − 700°C, О 2 СН 3−(СН 2)3─(СН 2)3−СН 3 → н-октан СН 3−СН 2−СН 3 + б) каталитический крекинг 450°C − 500°C, Al. Cl 3 , О 2 СН 3−(СН 2)3─(СН 2)3−СН 3 → н-октан СН 3−СН 2 −СН 3 + н-бутан (алкан нормального н-бутан строения) СН 3−СН−СН 3 │ СН 3 СН 2=СН−СН 2 −СН 3 бутен-1 (алкен) изобутан (алкан разветвленного строения) + СН 2=СН−СН 2 −СН 3 бутен-1
а) термический крекинг 500°C − 700°C, О 2 СН 3−(СН 2)3─(СН 2)3−СН 3 → н-октан СН 3−СН 2−СН 3 + б) каталитический крекинг 450°C − 500°C, Al. Cl 3 , О 2 СН 3−(СН 2)3─(СН 2)3−СН 3 → н-октан СН 3−СН 2 −СН 3 + н-бутан (алкан нормального н-бутан строения) СН 3−СН−СН 3 │ СН 3 СН 2=СН−СН 2 −СН 3 бутен-1 (алкен) изобутан (алкан разветвленного строения) + СН 2=СН−СН 2 −СН 3 бутен-1
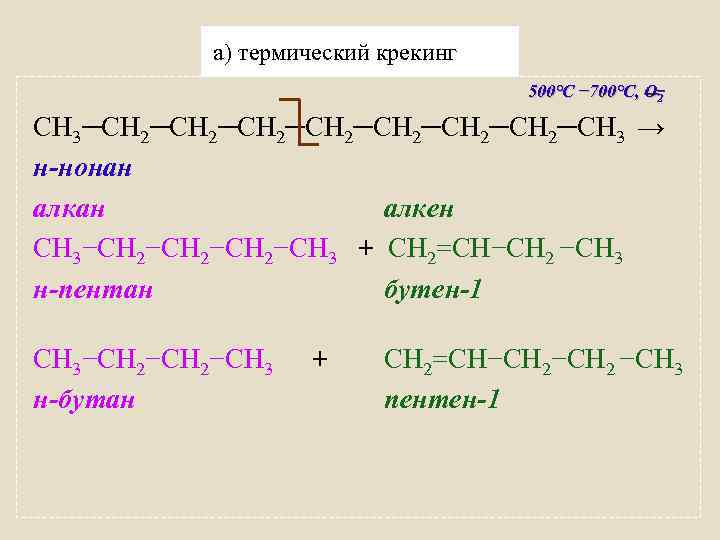 а) термический крекинг 500°C − 700°C, О 2 СН 3─СН 2─СН 2─СН 3 → н-нонан алкен СН 3−СН 2−СН 3 + СН 2=СН−СН 2 −СН 3 н-пентан бутен-1 СН 3−СН 2−СН 3 н-бутан + СН 2=СН−СН 2 −СН 3 пентен-1
а) термический крекинг 500°C − 700°C, О 2 СН 3─СН 2─СН 2─СН 3 → н-нонан алкен СН 3−СН 2−СН 3 + СН 2=СН−СН 2 −СН 3 н-пентан бутен-1 СН 3−СН 2−СН 3 н-бутан + СН 2=СН−СН 2 −СН 3 пентен-1
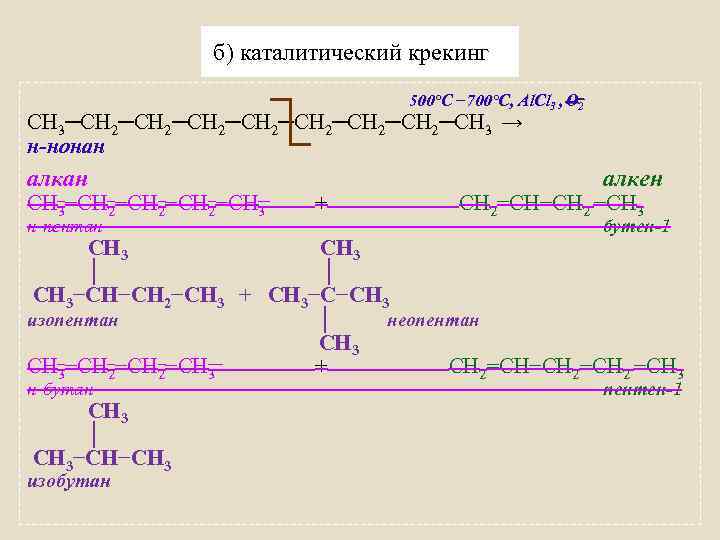 б) каталитический крекинг 500°C − 700°C, Al. Cl 3 , О 2 СН 3─СН 2─СН 2─СН 3 → н-нонан алкан СН 3−СН 2−СН 3 н-пентан + алкен СН 2=СН−СН 2 −СН 3 бутен-1 СН 3 │ │ СН 3−СН−СН 2−СН 3 + СН 3−С−СН 3 изопентан │ неопентан СН 3−СН 2−СН 3 + СН 2=СН−СН 2 −СН 3 н-бутан СН 3 │ СН 3−СН−СН 3 изобутан пентен-1
б) каталитический крекинг 500°C − 700°C, Al. Cl 3 , О 2 СН 3─СН 2─СН 2─СН 3 → н-нонан алкан СН 3−СН 2−СН 3 н-пентан + алкен СН 2=СН−СН 2 −СН 3 бутен-1 СН 3 │ │ СН 3−СН−СН 2−СН 3 + СН 3−С−СН 3 изопентан │ неопентан СН 3−СН 2−СН 3 + СН 2=СН−СН 2 −СН 3 н-бутан СН 3 │ СН 3−СН−СН 3 изобутан пентен-1
 IV. Реакции окисления В органической химии ОВР принято рассматривать с позиции того, что происходит с органическим субстратом: если органическое вещество окислилось, то процесс называют «окислением» , если органическое вещество восстановилось, то процесс называют «восстановлением» . Для ОВР с участием органических соединений применимы все закономерности, характерные для ОВР. Однако, чаще используют следующий подход: 1) органическое вещество окислилось, если в процессе реакции произошла «потеря» атомов Н и/или «приобретение» атомов О; 2) органическое вещество восстановилось, если в процессе реакции произошла «потеря» атомов О и/или «приобретение» атомов Н
IV. Реакции окисления В органической химии ОВР принято рассматривать с позиции того, что происходит с органическим субстратом: если органическое вещество окислилось, то процесс называют «окислением» , если органическое вещество восстановилось, то процесс называют «восстановлением» . Для ОВР с участием органических соединений применимы все закономерности, характерные для ОВР. Однако, чаще используют следующий подход: 1) органическое вещество окислилось, если в процессе реакции произошла «потеря» атомов Н и/или «приобретение» атомов О; 2) органическое вещество восстановилось, если в процессе реакции произошла «потеря» атомов О и/или «приобретение» атомов Н
 IV. Реакции окисления 1. Горение При полном сгорании алканов, как и любых углеводородов, образуется углекислый газ и вода CН 4 + 2 О 2 → CО 2 + 2 Н 2 О + 880 к. Дж Сn. H 2 n+2 + (3 n +1)/2 О 2 → n CО 2 + (n+1) Н 2 О число атомов О n× 2 + (n +1) = 2 n +1 = 3 n + 1 С 5 H 12 + 8 О 2 → 5 CО 2 + 6 Н 2 О, n=5 С 6 H 14 + 19/2 О 2 → 6 CО 2 + 7 Н 2 О или С 6 H 14 + 9, 5 О 2 → 6 CО 2 + 7 Н 2 О или 2 С 6 H 14 + 19 О 2 → 12 CО 2 + 14 Н 2 О число атомов О 6× 2 + 7 = 19
IV. Реакции окисления 1. Горение При полном сгорании алканов, как и любых углеводородов, образуется углекислый газ и вода CН 4 + 2 О 2 → CО 2 + 2 Н 2 О + 880 к. Дж Сn. H 2 n+2 + (3 n +1)/2 О 2 → n CО 2 + (n+1) Н 2 О число атомов О n× 2 + (n +1) = 2 n +1 = 3 n + 1 С 5 H 12 + 8 О 2 → 5 CО 2 + 6 Н 2 О, n=5 С 6 H 14 + 19/2 О 2 → 6 CО 2 + 7 Н 2 О или С 6 H 14 + 9, 5 О 2 → 6 CО 2 + 7 Н 2 О или 2 С 6 H 14 + 19 О 2 → 12 CО 2 + 14 Н 2 О число атомов О 6× 2 + 7 = 19
 2. Каталитическое окисление кислородом воздуха при умеренном нагревании Алканы, будучи наименее активными из углеводородов, являются наиболее устойчивыми к действию окислителей. Алканы окисляются, как правило, в жестких условиях и/или в присутствии катализатора. Каталитическое окисление алканов, кроме СН 4 и СН 3—СН 3, не удается провести по «концевому» атому С (по группе —СН 3); данный процесс сопровождается деструкцией молекулы алкана и приводит к образованию двух примерно равных «осколков» .
2. Каталитическое окисление кислородом воздуха при умеренном нагревании Алканы, будучи наименее активными из углеводородов, являются наиболее устойчивыми к действию окислителей. Алканы окисляются, как правило, в жестких условиях и/или в присутствии катализатора. Каталитическое окисление алканов, кроме СН 4 и СН 3—СН 3, не удается провести по «концевому» атому С (по группе —СН 3); данный процесс сопровождается деструкцией молекулы алкана и приводит к образованию двух примерно равных «осколков» .
 2. Каталитическое окисление кислородом воздуха при умеренном нагревании а) окисление метана 200°C, катализатор 2 CН 4 + О 2 → 2 СН 3 ОН метанол, спирт 500°C, Ag CН 4 + О 2 → H 2 O + Н−С−Н метаналь, альдегид || О 150°C − 200°C, р 2 CН 4 + 3 О 2 → 2 Н−С−ОН + 2 Н 2 О метановая кислота, || карбоновая кислота О
2. Каталитическое окисление кислородом воздуха при умеренном нагревании а) окисление метана 200°C, катализатор 2 CН 4 + О 2 → 2 СН 3 ОН метанол, спирт 500°C, Ag CН 4 + О 2 → H 2 O + Н−С−Н метаналь, альдегид || О 150°C − 200°C, р 2 CН 4 + 3 О 2 → 2 Н−С−ОН + 2 Н 2 О метановая кислота, || карбоновая кислота О
 2. Каталитическое окисление кислородом воздуха при умеренном нагревании б) окислительный крекинг 200°C, NO 2 СН 3−СН 2─СН 2−СН 3 + 5 О 2 → 4 СН 3−СООН + 2 Н 2 О уксусная кислота η (СН 3−СООН) = 90%; ( промышленный метод получения уксусной кислоты 200°C, катализатор 2 С 36 Н 74 + 5 О 2 → 4 С 17 Н 35 СООН + 2 Н 2 О стеариновая или октадекановая кислота 200°C, катализатор 2 С 35 Н 72 + 5 О 2 → 2 С 16 Н 33 СООН + 2 С 17 Н 35 СООН + 2 Н 2 О маргариновая стеариновая кислота или гептадекановая кислота
2. Каталитическое окисление кислородом воздуха при умеренном нагревании б) окислительный крекинг 200°C, NO 2 СН 3−СН 2─СН 2−СН 3 + 5 О 2 → 4 СН 3−СООН + 2 Н 2 О уксусная кислота η (СН 3−СООН) = 90%; ( промышленный метод получения уксусной кислоты 200°C, катализатор 2 С 36 Н 74 + 5 О 2 → 4 С 17 Н 35 СООН + 2 Н 2 О стеариновая или октадекановая кислота 200°C, катализатор 2 С 35 Н 72 + 5 О 2 → 2 С 16 Н 33 СООН + 2 С 17 Н 35 СООН + 2 Н 2 О маргариновая стеариновая кислота или гептадекановая кислота
 3. Окисление сернокислым раствором перманганата калия или бихромата калия KMn. O 4 /H 2 SO 4 Сn. H 2 n+2 ≠ ; K 2 Cr 2 O 7 /H 2 SO 4 Сn. H 2 n+2 ≠ 4. Окисление с помощью оксида меди (II) при нагревании 400°C Сn. H 2 n+2 + (3 n +1) Cu. O → n CО 2 + (n+1) Н 2 О + (3 n +1) Cu 400°C С 5 H 12 + 16 Cu. O → 5 CО 2 + 6 Н 2 О + 16 Cu 5. Конверсия метана водяным паром при нагревании 800°C СH 4 + Н 2 О ⇄ CО + 3 Н 2 Ni
3. Окисление сернокислым раствором перманганата калия или бихромата калия KMn. O 4 /H 2 SO 4 Сn. H 2 n+2 ≠ ; K 2 Cr 2 O 7 /H 2 SO 4 Сn. H 2 n+2 ≠ 4. Окисление с помощью оксида меди (II) при нагревании 400°C Сn. H 2 n+2 + (3 n +1) Cu. O → n CО 2 + (n+1) Н 2 О + (3 n +1) Cu 400°C С 5 H 12 + 16 Cu. O → 5 CО 2 + 6 Н 2 О + 16 Cu 5. Конверсия метана водяным паром при нагревании 800°C СH 4 + Н 2 О ⇄ CО + 3 Н 2 Ni
 Самостоятельная работа Свойства алканов
Самостоятельная работа Свойства алканов
 № 1. Проведите реакции фторирования, бромирования, нитрования по Коновалову и сульфирования для следующих алканов: 1) 2, 3 -диметилбутан; 2) 4 -метилгептан; 3) 2, 5 -диметилгексан; 4) 3, 6 -диметилоктан № 2. Проведите реакции дегидрирования и дегидроциклизации по Казанскому и Платэ для следующих алканов: 1) 2 -метилпентан; 2) 3 -метилпентан; 3) 2, 4 -диметилпентан; 4) 3 -этилпентан
№ 1. Проведите реакции фторирования, бромирования, нитрования по Коновалову и сульфирования для следующих алканов: 1) 2, 3 -диметилбутан; 2) 4 -метилгептан; 3) 2, 5 -диметилгексан; 4) 3, 6 -диметилоктан № 2. Проведите реакции дегидрирования и дегидроциклизации по Казанскому и Платэ для следующих алканов: 1) 2 -метилпентан; 2) 3 -метилпентан; 3) 2, 4 -диметилпентан; 4) 3 -этилпентан
 № 1. Проведите реакции фторирования, бромирования, нитрования по Коновалову и сульфирования для следующих алканов: 1) 2, 2, 3, 3 -тетраметилбутан; 2) 4 -метилгептан; 3) 2, 5 -диметилгексан; 4) 3, 6 -диметилоктан № 2. Проведите реакции хлорирования, пиролиза, дегидроциклизации, горения и термического и каталитического крекинга для следующих алканов: 1) нонан; 2) декан; 3) гептан; 4) пентан Назовите ВСЕ продукты каждой реакции
№ 1. Проведите реакции фторирования, бромирования, нитрования по Коновалову и сульфирования для следующих алканов: 1) 2, 2, 3, 3 -тетраметилбутан; 2) 4 -метилгептан; 3) 2, 5 -диметилгексан; 4) 3, 6 -диметилоктан № 2. Проведите реакции хлорирования, пиролиза, дегидроциклизации, горения и термического и каталитического крекинга для следующих алканов: 1) нонан; 2) декан; 3) гептан; 4) пентан Назовите ВСЕ продукты каждой реакции


