2011 ОХТ Мин ЛК хим реакторы.ppt
- Количество слайдов: 62
 Химические реакторы üПонятие о химическом реакторе. Классификация химических реакторов и режимов их работы. üМатериальный и тепловые балансы реакторов. üМатематические модели процессов в идеальных реакторах. -Реактор идеального смешения периодический ( РИС-П). üРеактор непрерывного действия ( проточные реакторы). - Реактор идеального вытеснения (РИВ). - Реактор идеального смешения непрерывный ( РИС-Н). - Каскад реакторов идеального смешения ( К-РИС). üСравнение эффективности проточных реакторов идеального смешения и идеального вытеснения. üСравнение селективности проточных реакторов. üТемпературные режимы работы реакторов. üСравнение реакторов по температурному режиму.
Химические реакторы üПонятие о химическом реакторе. Классификация химических реакторов и режимов их работы. üМатериальный и тепловые балансы реакторов. üМатематические модели процессов в идеальных реакторах. -Реактор идеального смешения периодический ( РИС-П). üРеактор непрерывного действия ( проточные реакторы). - Реактор идеального вытеснения (РИВ). - Реактор идеального смешения непрерывный ( РИС-Н). - Каскад реакторов идеального смешения ( К-РИС). üСравнение эффективности проточных реакторов идеального смешения и идеального вытеснения. üСравнение селективности проточных реакторов. üТемпературные режимы работы реакторов. üСравнение реакторов по температурному режиму.
 Химическим реактором называется аппарат, в котором осуществляются химические процессы, сочетающие химические реакции с массо и теплопереносом. Основные требования к промышленным реакторам: 1. Максимальная производительность и интенсивность работы 2. Высокий выход продукта и наибольшая селективность процесса. Они обеспечиваются оптимальным режимом работы реактора: температурой, давлением, концентрацией исходных веществ и продуктов реакции. Каталитический реактор должен так же обеспечить эффективное применение катализатора. 3. Минимальные энергетические затраты на перемешивание и транспортировку материалов через реактор, а также наилучшее использование теплоты экзотермических реакций или теплоты, подводимой в реактор для нагрева реагирующих веществ до оп тимальных температур. 4. Легкая управляемость и безопасность работы. Эти условия обеспечиваются рациональной конструкцией реактора и малыми колебаниями параметров технологического режима, позволяющими легко автоматизировать работу реактора. 5. Низкая стоимость изготовления реактора и ремонта его. 6. Устойчивость работы реактора при значительных изменениях основных параметров режима (С, Т, Р, Ак. ω).
Химическим реактором называется аппарат, в котором осуществляются химические процессы, сочетающие химические реакции с массо и теплопереносом. Основные требования к промышленным реакторам: 1. Максимальная производительность и интенсивность работы 2. Высокий выход продукта и наибольшая селективность процесса. Они обеспечиваются оптимальным режимом работы реактора: температурой, давлением, концентрацией исходных веществ и продуктов реакции. Каталитический реактор должен так же обеспечить эффективное применение катализатора. 3. Минимальные энергетические затраты на перемешивание и транспортировку материалов через реактор, а также наилучшее использование теплоты экзотермических реакций или теплоты, подводимой в реактор для нагрева реагирующих веществ до оп тимальных температур. 4. Легкая управляемость и безопасность работы. Эти условия обеспечиваются рациональной конструкцией реактора и малыми колебаниями параметров технологического режима, позволяющими легко автоматизировать работу реактора. 5. Низкая стоимость изготовления реактора и ремонта его. 6. Устойчивость работы реактора при значительных изменениях основных параметров режима (С, Т, Р, Ак. ω).
 Химические реакторы Для выбора конструкции и определения размеров любого реактора необходимо располагать следующими данными: – величинами, характеризующими скорость протекания химических реакций, а также скорость массо и теплопередачи; – внешними ограничениями, накладываемыми технологическим оборудованием, такими как модель реактора, определяющая его гидродинамическую характеристику и скорость процессов переноса вещества и тепла. Главной задачей при изучении процессов, протекающих в реакторах любого типа, является установление функциональной зависимости времени пребывания реагентов в реакторе от различных факторов: = f [х, C, v], где х – заданная степень превращения реагента; С – начальная концентрация реагента; v – скорость химической реакции. Уравнение, связывающее четыре названные величины, называется характеристическим уравнением реактора.
Химические реакторы Для выбора конструкции и определения размеров любого реактора необходимо располагать следующими данными: – величинами, характеризующими скорость протекания химических реакций, а также скорость массо и теплопередачи; – внешними ограничениями, накладываемыми технологическим оборудованием, такими как модель реактора, определяющая его гидродинамическую характеристику и скорость процессов переноса вещества и тепла. Главной задачей при изучении процессов, протекающих в реакторах любого типа, является установление функциональной зависимости времени пребывания реагентов в реакторе от различных факторов: = f [х, C, v], где х – заданная степень превращения реагента; С – начальная концентрация реагента; v – скорость химической реакции. Уравнение, связывающее четыре названные величины, называется характеристическим уравнением реактора.
 Химические реакторы Классификация химических реакторов и режимов их работы Наиболее часто употребляются следующие признаки классификации химических реакторов и режимов их работы: 1) режим движения реакционной среды (гидродинамическая обстановка в реакторе); 2) условия теплообмена в реакторе; 3) фазовый состав реакционной смеси; 4) способ организации процесса; 5) характер изменения параметров процесса во времени; 6) конструктивные характеристики. 1) Классификация реакторов по гидродинамической обстановке. В зависимости от гидродинамической обстановки все реакторы можно разделить на реакторы смешения и вытеснения. Реакторы смешения – это емкостные аппараты с пере мешиванием механической мешалкой или циркуляционным насосом. Реакторы вытеснения – трубчатые аппараты, имеющие вид удлиненного канала.
Химические реакторы Классификация химических реакторов и режимов их работы Наиболее часто употребляются следующие признаки классификации химических реакторов и режимов их работы: 1) режим движения реакционной среды (гидродинамическая обстановка в реакторе); 2) условия теплообмена в реакторе; 3) фазовый состав реакционной смеси; 4) способ организации процесса; 5) характер изменения параметров процесса во времени; 6) конструктивные характеристики. 1) Классификация реакторов по гидродинамической обстановке. В зависимости от гидродинамической обстановки все реакторы можно разделить на реакторы смешения и вытеснения. Реакторы смешения – это емкостные аппараты с пере мешиванием механической мешалкой или циркуляционным насосом. Реакторы вытеснения – трубчатые аппараты, имеющие вид удлиненного канала.
 Химические реакторы 2) Классификация по условиям теплообмена. При отсутствии теплообмена с окружающей средой химический реактор является адиабатическим. В нем вся теплота, выделяющаяся или поглощающаяся в результате химических процессов, расходуется на «внутренний» теплообмен – на нагрев или охлаждение реакционной смеси. Реактор называется изотермическим, если за счет теплообмена с окружающей средой в нем обеспечивается постоянство температуры. В этом случае в любой точке реактора за счет теплообмена полностью компенсируется выделение или поглощение теплоты. В реакторах с промежуточным тепловым режимом тепловой эффект химической реакции частично компенсируется за счет теплообмена с окружающей средой, а частично вызывает изменение температуры реакционной смеси. (политермический реактор)
Химические реакторы 2) Классификация по условиям теплообмена. При отсутствии теплообмена с окружающей средой химический реактор является адиабатическим. В нем вся теплота, выделяющаяся или поглощающаяся в результате химических процессов, расходуется на «внутренний» теплообмен – на нагрев или охлаждение реакционной смеси. Реактор называется изотермическим, если за счет теплообмена с окружающей средой в нем обеспечивается постоянство температуры. В этом случае в любой точке реактора за счет теплообмена полностью компенсируется выделение или поглощение теплоты. В реакторах с промежуточным тепловым режимом тепловой эффект химической реакции частично компенсируется за счет теплообмена с окружающей средой, а частично вызывает изменение температуры реакционной смеси. (политермический реактор)
 Химические реакторы 3) Классификация по фазовому составу реакционной смеси. Для проведения гомогенных процессов применяют реакторы для газофазных и жидкофазных реакций, для проведения гетерогенных процессов – газожидкостные реакторы, реакторы для процессов в системах газ – твердое вещество, жидкость – твердое вещество и др. Особо следует выделить реакторы для проведения гетерогенно каталитических процессов. 4) Классификация по способу организации процесса. По способу организации процесса (способу подвода реагентов и отвода продуктов) реакторы подразделяют на периодические, непрерывно действующие (проточные) и полунепрерывные (полупериодические) 5) Классификация по характеру изменения параметров процесса во времени. В зависимости от характера изменения параметров процесса во времени одни и те же реакторы могут работать в стационарном и нестационарном режимах.
Химические реакторы 3) Классификация по фазовому составу реакционной смеси. Для проведения гомогенных процессов применяют реакторы для газофазных и жидкофазных реакций, для проведения гетерогенных процессов – газожидкостные реакторы, реакторы для процессов в системах газ – твердое вещество, жидкость – твердое вещество и др. Особо следует выделить реакторы для проведения гетерогенно каталитических процессов. 4) Классификация по способу организации процесса. По способу организации процесса (способу подвода реагентов и отвода продуктов) реакторы подразделяют на периодические, непрерывно действующие (проточные) и полунепрерывные (полупериодические) 5) Классификация по характеру изменения параметров процесса во времени. В зависимости от характера изменения параметров процесса во времени одни и те же реакторы могут работать в стационарном и нестационарном режимах.
 Химические реакторы Режим работы реактора называют стационарным, если протекание химической реакции в произвольно выбранной точке характеризуется одинаковыми значениями концентраций реагентов или продуктов, температуры и других параметров процесса в любой момент времени. В стационарном режиме параметры потока на выходе из реактора не зависят от времени. Если в произвольно выбранной точке происходят изменения параметров химического процесса во времени по тому или иному закону, режим работы реактора называют нестационарным. Нестационарный режим является более общим. Стационарный режим возможен для непрерывно действующих проточных реакторов. Но и эти реакторы работают в нестационарном режиме в моменты их пуска и остановки. Нестационарными являются все периодические процессы.
Химические реакторы Режим работы реактора называют стационарным, если протекание химической реакции в произвольно выбранной точке характеризуется одинаковыми значениями концентраций реагентов или продуктов, температуры и других параметров процесса в любой момент времени. В стационарном режиме параметры потока на выходе из реактора не зависят от времени. Если в произвольно выбранной точке происходят изменения параметров химического процесса во времени по тому или иному закону, режим работы реактора называют нестационарным. Нестационарный режим является более общим. Стационарный режим возможен для непрерывно действующих проточных реакторов. Но и эти реакторы работают в нестационарном режиме в моменты их пуска и остановки. Нестационарными являются все периодические процессы.
 Химические реакторы 6) Классификация по конструктивным характеристикам. Химические реакторы отличаются друг от друга и по ряду конструктивных характеристик, оказывающих влияние на их расчет и изготовление. По этому принципу классификации можно выделить следующие типы реакторов: • емкостные реакторы (автоклавы; реакторы камеры; вертикальные и горизонтальные цилиндрические конверторы и т. п. ); • колонные реакторы (реакторы колонны насадочного и тарельчатого типа; каталитические реакторы с неподвижным, движущимся и псевдоожиженным слоем катализатора; полочные реакторы); • реакторы типа теплообменника; • реакторы типа реакционной печи (шахтные, полочные, камерные, вращающиеся печи и т. п. )
Химические реакторы 6) Классификация по конструктивным характеристикам. Химические реакторы отличаются друг от друга и по ряду конструктивных характеристик, оказывающих влияние на их расчет и изготовление. По этому принципу классификации можно выделить следующие типы реакторов: • емкостные реакторы (автоклавы; реакторы камеры; вертикальные и горизонтальные цилиндрические конверторы и т. п. ); • колонные реакторы (реакторы колонны насадочного и тарельчатого типа; каталитические реакторы с неподвижным, движущимся и псевдоожиженным слоем катализатора; полочные реакторы); • реакторы типа теплообменника; • реакторы типа реакционной печи (шахтные, полочные, камерные, вращающиеся печи и т. п. )
 Материальный и тепловой балансы реакторов Составим материальный баланс по исходному веществу А при проведении простой необратимой реакции А → R. В общем виде уравнение материального баланса записывается так где – массовый расход Учитывая, что поступившее в реактор вещество А расходуется в трех направлениях, можно записать где – масса вещества А, вступившего в реакционном объеме в химическую реакцию в единицу времени; – сток вещества А – масса вещества А, выходящего из реакционного объема в единицу времени; – накопление вещества А – масса вещества А, остающегося в реакционном объеме в неизменном виде в единицу времени.
Материальный и тепловой балансы реакторов Составим материальный баланс по исходному веществу А при проведении простой необратимой реакции А → R. В общем виде уравнение материального баланса записывается так где – массовый расход Учитывая, что поступившее в реактор вещество А расходуется в трех направлениях, можно записать где – масса вещества А, вступившего в реакционном объеме в химическую реакцию в единицу времени; – сток вещества А – масса вещества А, выходящего из реакционного объема в единицу времени; – накопление вещества А – масса вещества А, остающегося в реакционном объеме в неизменном виде в единицу времени.
 Материальный и тепловой балансы реакторов Разность между массой вещества А, поступающего в единицу времени в реактор и выходящего из него – это масса вещества А, переносимого конвективным потоком Принимая это во внимание, полученное уравнение можно записать в такой форме В каждом конкретном случае уравнение материального баланса принимает различную форму.
Материальный и тепловой балансы реакторов Разность между массой вещества А, поступающего в единицу времени в реактор и выходящего из него – это масса вещества А, переносимого конвективным потоком Принимая это во внимание, полученное уравнение можно записать в такой форме В каждом конкретном случае уравнение материального баланса принимает различную форму.
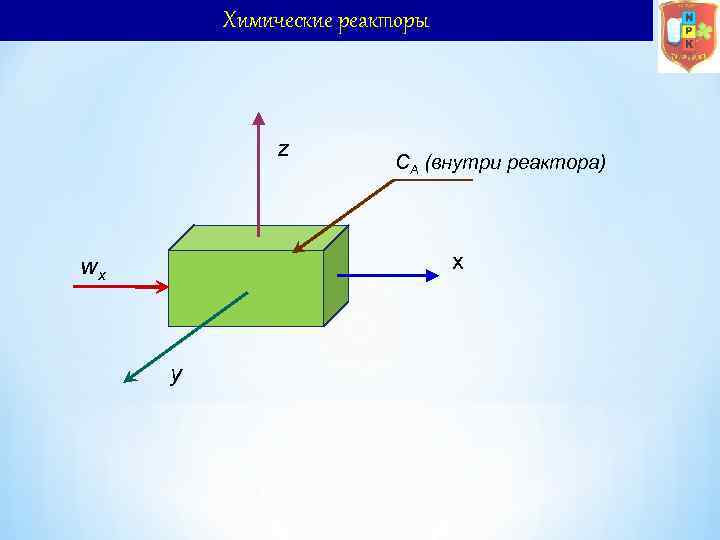
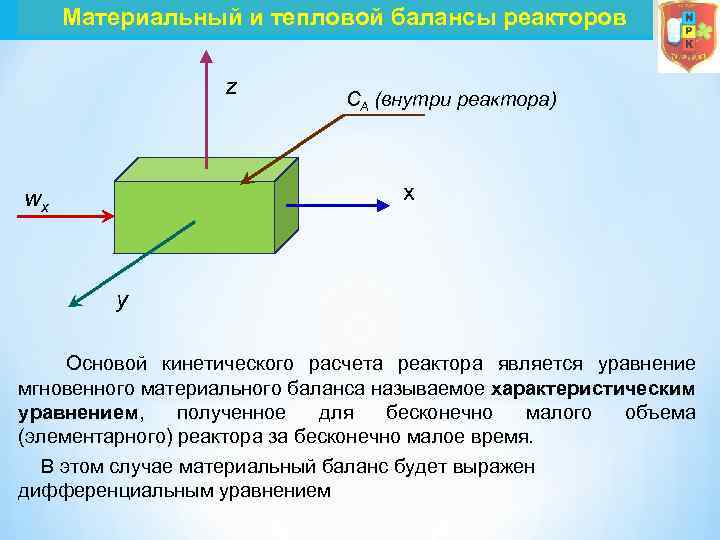 Материальный и тепловой балансы реакторов z CA (внутри реактора) x wx y Основой кинетического расчета реактора является уравнение мгновенного материального баланса называемое характеристическим уравнением, полученное для бесконечно малого объема (элементарного) реактора за бесконечно малое время. В этом случае материальный баланс будет выражен дифференциальным уравнением
Материальный и тепловой балансы реакторов z CA (внутри реактора) x wx y Основой кинетического расчета реактора является уравнение мгновенного материального баланса называемое характеристическим уравнением, полученное для бесконечно малого объема (элементарного) реактора за бесконечно малое время. В этом случае материальный баланс будет выражен дифференциальным уравнением
 Материальный и тепловой балансы реакторов В результате получают уравнение конвективного массообмена, дополненное членом r. А, который учитывает протекание химической реакции. Составленное по исходному реагенту А, оно имеет вид где СА – концентрация вещества А в реакционной смеси; x, y, z – пространственные координаты; D – коэффициент молекулярной и турбулентной диффузии; r. А – скорость химической реакции. Член в левой части уравнения отражает общее изменение концентрации исходного вещества во времени в элементарном объеме, для которого составляется материальный баланс. Это накопление вещества А.
Материальный и тепловой балансы реакторов В результате получают уравнение конвективного массообмена, дополненное членом r. А, который учитывает протекание химической реакции. Составленное по исходному реагенту А, оно имеет вид где СА – концентрация вещества А в реакционной смеси; x, y, z – пространственные координаты; D – коэффициент молекулярной и турбулентной диффузии; r. А – скорость химической реакции. Член в левой части уравнения отражает общее изменение концентрации исходного вещества во времени в элементарном объеме, для которого составляется материальный баланс. Это накопление вещества А.
 Материальный и тепловой балансы реакторов где: скорость накопления концентрации внутри элементарного объема, конвективный поток реагента А в элементарном объеме реактора диффузионный поток реагента А в элементарном объеме реактора. скорость химического превращения внутри элементарного объема
Материальный и тепловой балансы реакторов где: скорость накопления концентрации внутри элементарного объема, конвективный поток реагента А в элементарном объеме реактора диффузионный поток реагента А в элементарном объеме реактора. скорость химического превращения внутри элементарного объема
 Материальный и тепловой балансы реакторов Тепловой баланс в общем виде можно представить уравнением Qприх = Qрасх, где Qприх – количество теплоты, поступающей в реактор в единицу времени; Qрасх – количество теплоты, расходуемое в единицу времени. Рассмотрим случай, когда простая необратимая реакция А → R протекает с выделением теплоты: А → R + Q, тогда приход теплоты можно записать в виде Qприх = Qх. р + Qреаг, где Qх. р – количество теплоты, выделяющееся в результате химического превращения вещества А в единицу времени; Qреаг – количество теплоты, вносимое исходными реагентами, поступающими в реактор в единицу времени. Расход теплоты может быть представлен уравнением Qрасх = Qпрод + Qнак + Qт, где Qпрод – количество теплоты, уносимое из реактора продуктами реакции в единицу времени; Qнак – количество теплоты, накапливающееся в реакторе в единицу времени; Qт – количество теплоты, расходуемое в единицу времени в результате теплообмена с окружающей средой.
Материальный и тепловой балансы реакторов Тепловой баланс в общем виде можно представить уравнением Qприх = Qрасх, где Qприх – количество теплоты, поступающей в реактор в единицу времени; Qрасх – количество теплоты, расходуемое в единицу времени. Рассмотрим случай, когда простая необратимая реакция А → R протекает с выделением теплоты: А → R + Q, тогда приход теплоты можно записать в виде Qприх = Qх. р + Qреаг, где Qх. р – количество теплоты, выделяющееся в результате химического превращения вещества А в единицу времени; Qреаг – количество теплоты, вносимое исходными реагентами, поступающими в реактор в единицу времени. Расход теплоты может быть представлен уравнением Qрасх = Qпрод + Qнак + Qт, где Qпрод – количество теплоты, уносимое из реактора продуктами реакции в единицу времени; Qнак – количество теплоты, накапливающееся в реакторе в единицу времени; Qт – количество теплоты, расходуемое в единицу времени в результате теплообмена с окружающей средой.
 Материальный и тепловой балансы реакторов Qх. р + Qреаг = Qпрод + Qнак + Qт В общем случае имеет место изменение параметров процесса (температуры, концентрации и т. п. ) по объему реактора или во времени, в связи с чем тепловой баланс так же, как и материальный, составляют в дифференциальной форме. Для этой цели используют дифференциальное уравнение конвективного теплообмена, в которое вводят дополнительные члены, учитывающие отвод теплоты в результате теплообмена и теплоту реакции. где ρ – плотность реакционной смеси; Ср – удельная теплоемкость реакционной смеси; х, y, z – пространственные координаты; Wx, Wy, Wz – составляющие скорости движения потока в направлении осей Х, Y, Z; λ – коэффициент молекулярной и турбулентной теплопроводности реакционной смеси; Fуд – удельная поверхность теплообмена; K – коэффициент теплопередачи; ΔТ = Т – Тт , где Т – температура реакционной смеси; Тт – температура в теплообменнике; r – скорость химической реакции; ΔН – изменение энтальпии реакции
Материальный и тепловой балансы реакторов Qх. р + Qреаг = Qпрод + Qнак + Qт В общем случае имеет место изменение параметров процесса (температуры, концентрации и т. п. ) по объему реактора или во времени, в связи с чем тепловой баланс так же, как и материальный, составляют в дифференциальной форме. Для этой цели используют дифференциальное уравнение конвективного теплообмена, в которое вводят дополнительные члены, учитывающие отвод теплоты в результате теплообмена и теплоту реакции. где ρ – плотность реакционной смеси; Ср – удельная теплоемкость реакционной смеси; х, y, z – пространственные координаты; Wx, Wy, Wz – составляющие скорости движения потока в направлении осей Х, Y, Z; λ – коэффициент молекулярной и турбулентной теплопроводности реакционной смеси; Fуд – удельная поверхность теплообмена; K – коэффициент теплопередачи; ΔТ = Т – Тт , где Т – температура реакционной смеси; Тт – температура в теплообменнике; r – скорость химической реакции; ΔН – изменение энтальпии реакции
 Математические модели процессов в идеальных реакторах Рассмотрим реакторы, работающие в изотермическом режиме. Так как в таких реакторах внутри их объема отсутствует движущая сила теплообмена (∆Т = 0), то из математической модели реактора первоначально можно исключить уравнение теплового баланса. В таком случае математическая модель сводится к уравнению материального баланса, учитывающему химическую реакцию и массообмен. Реакторы периодические характеризуются одновременной загрузкой реагентов. При этом процесс складывается из трех стадий: загрузки сырья, его обработки (химического превращения) и выгрузки продукта. После проведения этих операций они повторяются вновь, т. е. работа реактора осуществляется циклически. Время одного цикла, проводимого в периодическом реакторе, определяется уравнением = + Где – полное время цикла; – рабочее время, затрачиваемое на проведение химической реакции; – вспомогательное время, затрачиваемое на загрузку реагентов и выгрузку продукта.
Математические модели процессов в идеальных реакторах Рассмотрим реакторы, работающие в изотермическом режиме. Так как в таких реакторах внутри их объема отсутствует движущая сила теплообмена (∆Т = 0), то из математической модели реактора первоначально можно исключить уравнение теплового баланса. В таком случае математическая модель сводится к уравнению материального баланса, учитывающему химическую реакцию и массообмен. Реакторы периодические характеризуются одновременной загрузкой реагентов. При этом процесс складывается из трех стадий: загрузки сырья, его обработки (химического превращения) и выгрузки продукта. После проведения этих операций они повторяются вновь, т. е. работа реактора осуществляется циклически. Время одного цикла, проводимого в периодическом реакторе, определяется уравнением = + Где – полное время цикла; – рабочее время, затрачиваемое на проведение химической реакции; – вспомогательное время, затрачиваемое на загрузку реагентов и выгрузку продукта.
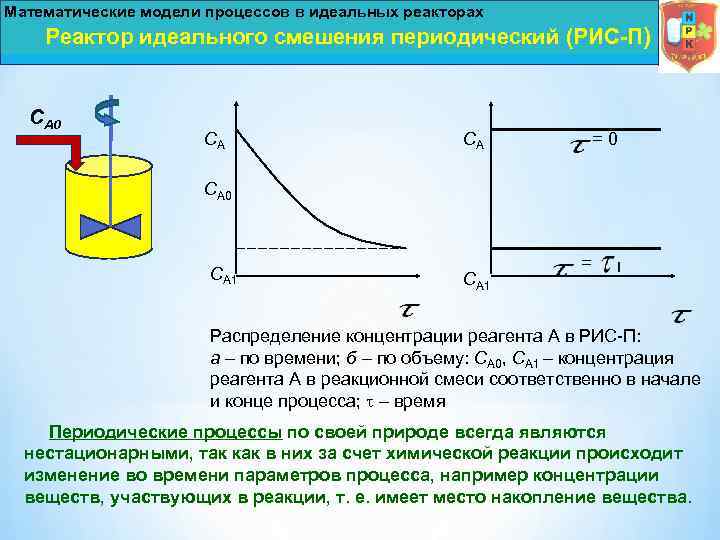 Математические модели процессов в идеальных реакторах Реактор идеального смешения периодический (РИС-П) СА 0 СА СА = 0 СА 1 = Распределение концентрации реагента А в РИС П: а – по времени; б – по объему: СА 0, СА 1 – концентрация реагента А в реакционной смеси соответственно в начале и конце процесса; – время Периодические процессы по своей природе всегда являются нестационарными, так как в них за счет химической реакции происходит изменение во времени параметров процесса, например концентрации веществ, участвующих в реакции, т. е. имеет место накопление вещества.
Математические модели процессов в идеальных реакторах Реактор идеального смешения периодический (РИС-П) СА 0 СА СА = 0 СА 1 = Распределение концентрации реагента А в РИС П: а – по времени; б – по объему: СА 0, СА 1 – концентрация реагента А в реакционной смеси соответственно в начале и конце процесса; – время Периодические процессы по своей природе всегда являются нестационарными, так как в них за счет химической реакции происходит изменение во времени параметров процесса, например концентрации веществ, участвующих в реакции, т. е. имеет место накопление вещества.
 Реактор идеального смешения периодический (РИС-П) (7 1) С учетом полученных значений уравнение (7 1) упрощается и может быть записано не в частных производных, а в виде обыкновенного дифференциального уравнения: (7 2)
Реактор идеального смешения периодический (РИС-П) (7 1) С учетом полученных значений уравнение (7 1) упрощается и может быть записано не в частных производных, а в виде обыкновенного дифференциального уравнения: (7 2)
 Реактор идеального смешения периодический (РИС-П) Все реакции протекают либо без изменения, либо с изменением объема реакционной смеси. Для реакций первого типа (V = const) текущая концентрация реагента А составляет где NА – начальное химическое количество исходного вещества А в реакционной смеси; V – объем реакционной смеси. Подставив полученное выражение для СА в уравнение (7 2), находим или (7 3)
Реактор идеального смешения периодический (РИС-П) Все реакции протекают либо без изменения, либо с изменением объема реакционной смеси. Для реакций первого типа (V = const) текущая концентрация реагента А составляет где NА – начальное химическое количество исходного вещества А в реакционной смеси; V – объем реакционной смеси. Подставив полученное выражение для СА в уравнение (7 2), находим или (7 3)
 Реактор идеального смешения периодический (РИС-П) Интегрируя уравнение (7 3) в пределах изменения времени от 0 до и степени превращения от 0 до х. А, получаем характеристическое уравнение РИС-П для условий, когда объем реакционной смеси не изменяется в течение процесса: (7 4) Рассмотрим некоторые частные случаи этого уравнения Для необратимой реакции нулевого порядка Для необратимой реакции первого порядка
Реактор идеального смешения периодический (РИС-П) Интегрируя уравнение (7 3) в пределах изменения времени от 0 до и степени превращения от 0 до х. А, получаем характеристическое уравнение РИС-П для условий, когда объем реакционной смеси не изменяется в течение процесса: (7 4) Рассмотрим некоторые частные случаи этого уравнения Для необратимой реакции нулевого порядка Для необратимой реакции первого порядка
 Реактор идеального смешения периодический (РИС-П) Для необратимой реакции n-го порядка В тех случаях, когда интегрирование уравнения (7 4) связано с трудностями, определение времени производят методом графического интегрирования. Для этого строят графическую зависимость 1/(– r. А) от х. А и вычисляют площадь под кривой между начальным х. А 0 и конечным х. А значениями степени превращения. Для х. А 0 = 0 искомая площадь выражается уравнением Подставив полученное значение для S в уравнение (7 4), находим
Реактор идеального смешения периодический (РИС-П) Для необратимой реакции n-го порядка В тех случаях, когда интегрирование уравнения (7 4) связано с трудностями, определение времени производят методом графического интегрирования. Для этого строят графическую зависимость 1/(– r. А) от х. А и вычисляют площадь под кривой между начальным х. А 0 и конечным х. А значениями степени превращения. Для х. А 0 = 0 искомая площадь выражается уравнением Подставив полученное значение для S в уравнение (7 4), находим
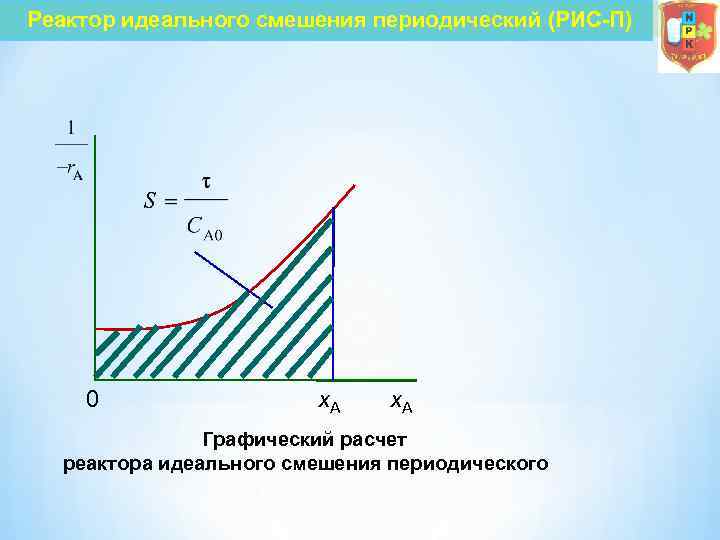 Реактор идеального смешения периодический (РИС-П) 0 х. А Графический расчет реактора идеального смешения периодического
Реактор идеального смешения периодический (РИС-П) 0 х. А Графический расчет реактора идеального смешения периодического
 Реакторы непрерывного действия (проточные реакторы) Реактор идеального вытеснения (РИВ) Для непрерывных реакторов удобней пользоваться понятием условного времени пребывания реагентов в системе (времени контакта), которое определяется уравнением = где – время пребывания; Vр – объем реактора; V 0 – объем реакционной смеси, поступающей в реактор в единицу времени (объемный расход реагентов), измеренный при определенных условиях. Проточные реакторы отличаются различным характером перемещения в них вещества (гидродинамической обстановкой). По этому признаку непрерывные реакторы разделяют на: ü реакторы идеального вытеснения (РИВ) ü реакторы идеального смешения (РИС).
Реакторы непрерывного действия (проточные реакторы) Реактор идеального вытеснения (РИВ) Для непрерывных реакторов удобней пользоваться понятием условного времени пребывания реагентов в системе (времени контакта), которое определяется уравнением = где – время пребывания; Vр – объем реактора; V 0 – объем реакционной смеси, поступающей в реактор в единицу времени (объемный расход реагентов), измеренный при определенных условиях. Проточные реакторы отличаются различным характером перемещения в них вещества (гидродинамической обстановкой). По этому признаку непрерывные реакторы разделяют на: ü реакторы идеального вытеснения (РИВ) ü реакторы идеального смешения (РИС).
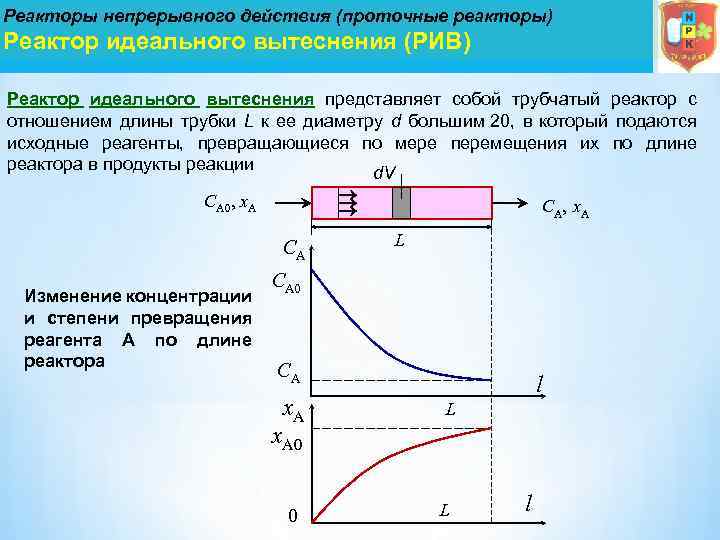 Реакторы непрерывного действия (проточные реакторы) Реактор идеального вытеснения (РИВ) Реактор идеального вытеснения представляет собой трубчатый реактор с отношением длины трубки L к ее диаметру d большим 20, в который подаются исходные реагенты, превращающиеся по мере перемещения их по длине реактора в продукты реакции d. V СА 0, х. А СА Изменение концентрации и степени превращения реагента А по длине реактора L СА 0 СА х. А l L х. А 0 0 L l
Реакторы непрерывного действия (проточные реакторы) Реактор идеального вытеснения (РИВ) Реактор идеального вытеснения представляет собой трубчатый реактор с отношением длины трубки L к ее диаметру d большим 20, в который подаются исходные реагенты, превращающиеся по мере перемещения их по длине реактора в продукты реакции d. V СА 0, х. А СА Изменение концентрации и степени превращения реагента А по длине реактора L СА 0 СА х. А l L х. А 0 0 L l
 Реакторы непрерывного действия (проточные реакторы) Реактор идеального вытеснения (РИВ) Поскольку в РИВ реакционная смесь двигается только в одном направлении (по длине l), то для первой группы членов правой части уравнения (7 1) можно записать (выбрав за направление оси Х направление движения потока реагентов в реакторе): где W – линейная скорость движения реакционной смеси в реакторе; l – длина пути, пройденного элементом объема реакционной смеси в реакторе. Так каждый элемент объема реакционной смеси в реакторе не смешивается ни с предыдущим, ни с последующим объемами, а также отсутствует радиальное перемешивание (т. е. нет ни продольной, ни радиальной диффузии), то
Реакторы непрерывного действия (проточные реакторы) Реактор идеального вытеснения (РИВ) Поскольку в РИВ реакционная смесь двигается только в одном направлении (по длине l), то для первой группы членов правой части уравнения (7 1) можно записать (выбрав за направление оси Х направление движения потока реагентов в реакторе): где W – линейная скорость движения реакционной смеси в реакторе; l – длина пути, пройденного элементом объема реакционной смеси в реакторе. Так каждый элемент объема реакционной смеси в реакторе не смешивается ни с предыдущим, ни с последующим объемами, а также отсутствует радиальное перемешивание (т. е. нет ни продольной, ни радиальной диффузии), то
 Реакторы непрерывного действия (проточные реакторы) Реактор идеального вытеснения (РИВ) С учетом вышесказанного уравнение (7 1) для реакторов идеального вытеснения принимает вид (7 5) Это уравнение материального баланса является математическим описанием потоков реагентов в РИВ при нестационарном режиме (таком, когда параметры процесса меняются не только по длине реактора, но и непостоянны во времени) Стационарный режим характеризуется тем, что параметры в данной точке реакционного объема не меняются во времени, т. е. Тогда уравнение (7 5) примет вид (7 6)
Реакторы непрерывного действия (проточные реакторы) Реактор идеального вытеснения (РИВ) С учетом вышесказанного уравнение (7 1) для реакторов идеального вытеснения принимает вид (7 5) Это уравнение материального баланса является математическим описанием потоков реагентов в РИВ при нестационарном режиме (таком, когда параметры процесса меняются не только по длине реактора, но и непостоянны во времени) Стационарный режим характеризуется тем, что параметры в данной точке реакционного объема не меняются во времени, т. е. Тогда уравнение (7 5) примет вид (7 6)
 Если объем реакционной смеси не изменяется в процессе, то справедливо уравнение после дифференцирования которого получим Длину пути l можно выразить как произведение (W ), откуда при постоянной линейной скорости потока dl = W d (7 7) После интегрирования уравнения (7 7) в пределах изменения степени превращения от 0 до х. А получаем характеристическое уравнение РИВ: (7 8)
Если объем реакционной смеси не изменяется в процессе, то справедливо уравнение после дифференцирования которого получим Длину пути l можно выразить как произведение (W ), откуда при постоянной линейной скорости потока dl = W d (7 7) После интегрирования уравнения (7 7) в пределах изменения степени превращения от 0 до х. А получаем характеристическое уравнение РИВ: (7 8)
 Реакторы непрерывного действия (проточные реакторы) Реактор идеального вытеснения (РИВ) Уравнение (7 8) для РИВ аналогично уравнению (7 4), полученному для РИС П. В уравнении (7 4) время есть время проведения реакции в периодическом реакторе (от загрузки сырья до выгрузки продуктов), а в уравнении (7 8) – время, в течение которого реакционная смесь проходит через РИВ от входа в реактор до выхода из него (при условии, что реакция идет без изменения объема). Уравнение (7 8) для необратимой реакции n-го порядка примет вид: или Для реакции нулевого порядка формула имеет вид Для необратимой реакции первого порядка
Реакторы непрерывного действия (проточные реакторы) Реактор идеального вытеснения (РИВ) Уравнение (7 8) для РИВ аналогично уравнению (7 4), полученному для РИС П. В уравнении (7 4) время есть время проведения реакции в периодическом реакторе (от загрузки сырья до выгрузки продуктов), а в уравнении (7 8) – время, в течение которого реакционная смесь проходит через РИВ от входа в реактор до выхода из него (при условии, что реакция идет без изменения объема). Уравнение (7 8) для необратимой реакции n-го порядка примет вид: или Для реакции нулевого порядка формула имеет вид Для необратимой реакции первого порядка
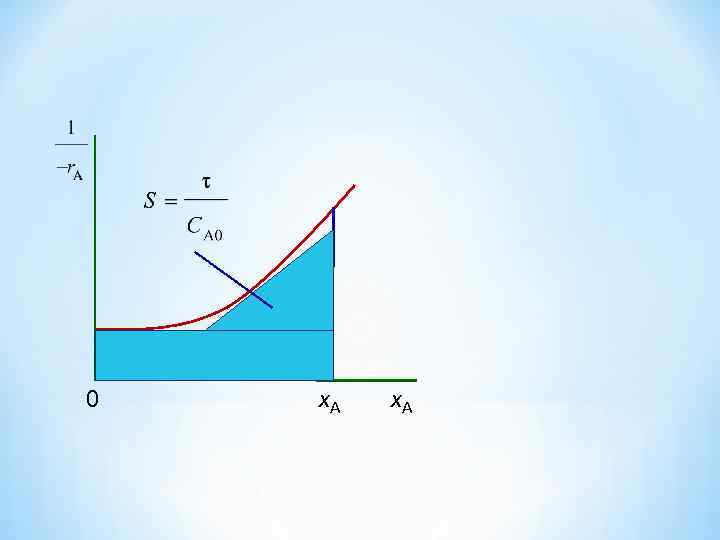
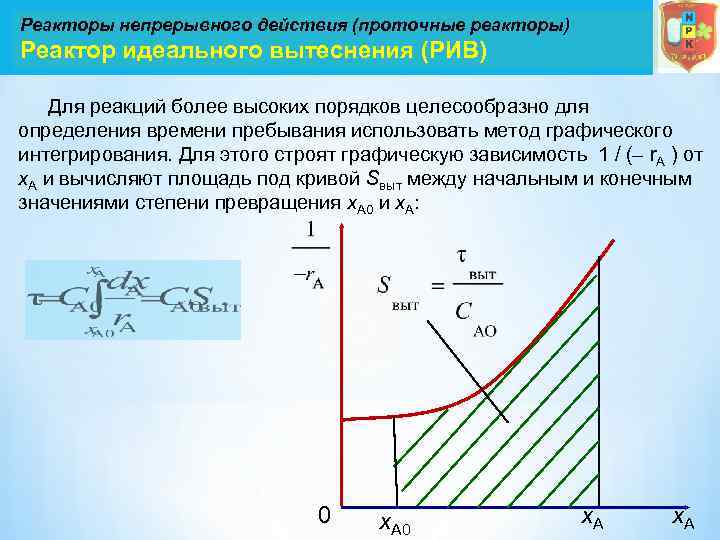 Реакторы непрерывного действия (проточные реакторы) Реактор идеального вытеснения (РИВ) Для реакций более высоких порядков целесообразно для определения времени пребывания использовать метод графического интегрирования. Для этого строят графическую зависимость 1 / (– r. А ) от х. А и вычисляют площадь под кривой Sвыт между начальным и конечным значениями степени превращения х. А 0 и х. А: 0 х. А
Реакторы непрерывного действия (проточные реакторы) Реактор идеального вытеснения (РИВ) Для реакций более высоких порядков целесообразно для определения времени пребывания использовать метод графического интегрирования. Для этого строят графическую зависимость 1 / (– r. А ) от х. А и вычисляют площадь под кривой Sвыт между начальным и конечным значениями степени превращения х. А 0 и х. А: 0 х. А
 Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) СА 0 СА Непрерывный реактор идеального смешения (РИС-Н) – это реактор с мешалкой, в который непрерывно подают реагенты и выводят из него продукты реакции. Благодаря интенсивному перемешиванию потоков мгновенно устанавливается одинаковая по всему объему реактора концентрация реагента А, равная его концентрации на выходе из реактора. Резкое изменение концентрации при входе реагентов в реактор происходит за счет мгновенного смешения поступающих реагентов с реакционной массой, уже находящейся в реакторе, где концентрация компонента А значительно ниже, чем в подаваемой реакционной смеси.
Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) СА 0 СА Непрерывный реактор идеального смешения (РИС-Н) – это реактор с мешалкой, в который непрерывно подают реагенты и выводят из него продукты реакции. Благодаря интенсивному перемешиванию потоков мгновенно устанавливается одинаковая по всему объему реактора концентрация реагента А, равная его концентрации на выходе из реактора. Резкое изменение концентрации при входе реагентов в реактор происходит за счет мгновенного смешения поступающих реагентов с реакционной массой, уже находящейся в реакторе, где концентрация компонента А значительно ниже, чем в подаваемой реакционной смеси.
 Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) СА 0 СА Величина перепада между начальной СА 0 и конечной СА концентрациями исходного реагента зависит при прочих равных условиях от величины скорости химической реакции. Чем она выше, тем меньше концентрация реагента А в реакторе и больше перепад (СА 0 – СА). С другой стороны, при одной и той же скорости реакции величина перепада зависит от времени пребывания ( ) реагентов в реакторе. Чем выше, тем полнее проходит реакция и тем ниже концентрация реагента СА в реакционной смеси. СА 0 СА 1 СА 2 СА Концентрация реагента А в РИС Н при различном времени пребывания реагентов в реакторе ( 1 < 2 < 3): V – координата объема; V 0 – координата, характеризующая вход реагентов в реактор СА 3 V 0 V
Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) СА 0 СА Величина перепада между начальной СА 0 и конечной СА концентрациями исходного реагента зависит при прочих равных условиях от величины скорости химической реакции. Чем она выше, тем меньше концентрация реагента А в реакторе и больше перепад (СА 0 – СА). С другой стороны, при одной и той же скорости реакции величина перепада зависит от времени пребывания ( ) реагентов в реакторе. Чем выше, тем полнее проходит реакция и тем ниже концентрация реагента СА в реакционной смеси. СА 0 СА 1 СА 2 СА Концентрация реагента А в РИС Н при различном времени пребывания реагентов в реакторе ( 1 < 2 < 3): V – координата объема; V 0 – координата, характеризующая вход реагентов в реактор СА 3 V 0 V
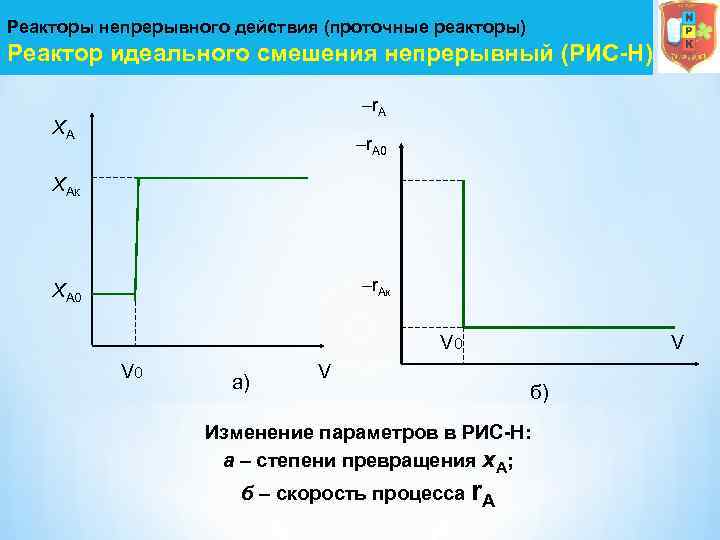 Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) –r. A XА –r. A 0 XАк –r. Aк XА 0 V 0 а) V V б) Изменение параметров в РИС-Н: а – степени превращения х. А; б – скорость процесса r. A
Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) –r. A XА –r. A 0 XАк –r. Aк XА 0 V 0 а) V V б) Изменение параметров в РИС-Н: а – степени превращения х. А; б – скорость процесса r. A
 Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) Исходя из уравнения материального баланса: СА 0 СА где Vр – объем реактора; V – объемный расход реагентов
Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) Исходя из уравнения материального баланса: СА 0 СА где Vр – объем реактора; V – объемный расход реагентов
 Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) Условием стационарности процесса в РИС Н является равенство скорости конвективного переноса вещества А и скорости его химического превращения СА 0 СА где Vр – объем реактора; V – объемный расход реагентов Отношение Vp / V – это условное время пребывания . Тогда (7 9) Это характеристическое уравнение реактора идеального смешения. Для более общего случая, когда начальная степень превращения х. А 0 не равна нулю, оно записывается
Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) Условием стационарности процесса в РИС Н является равенство скорости конвективного переноса вещества А и скорости его химического превращения СА 0 СА где Vр – объем реактора; V – объемный расход реагентов Отношение Vp / V – это условное время пребывания . Тогда (7 9) Это характеристическое уравнение реактора идеального смешения. Для более общего случая, когда начальная степень превращения х. А 0 не равна нулю, оно записывается
 Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) Для простой необратимой реакции n-го порядка уравнение (7 9) примет вид СА 0 СА Для реакции нулевого порядка Для реакции первого порядка
Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) Для простой необратимой реакции n-го порядка уравнение (7 9) примет вид СА 0 СА Для реакции нулевого порядка Для реакции первого порядка
 Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) Каскад представляет собой несколько последовательно соединенных проточных реакторов (секций) идеального смешения. Реакционная смесь последовательно проходит через все секции. СА 0 В последнем реакторе каскада концентрации, а следовательно, и скорость реакции те же, что и в единичном реакторе, но в каждом из предыдущих аппаратов каскада концентрации реагирующих веществ выше поэтому скорости реакции будут выше, чем в последующем аппарате. В результате средняя скорость реакции в каскаде превысит среднюю скорость реакции в одиночном реакторе СА 1 СА 2 СА 3
Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) Каскад представляет собой несколько последовательно соединенных проточных реакторов (секций) идеального смешения. Реакционная смесь последовательно проходит через все секции. СА 0 В последнем реакторе каскада концентрации, а следовательно, и скорость реакции те же, что и в единичном реакторе, но в каждом из предыдущих аппаратов каскада концентрации реагирующих веществ выше поэтому скорости реакции будут выше, чем в последующем аппарате. В результате средняя скорость реакции в каскаде превысит среднюю скорость реакции в одиночном реакторе СА 1 СА 2 СА 3
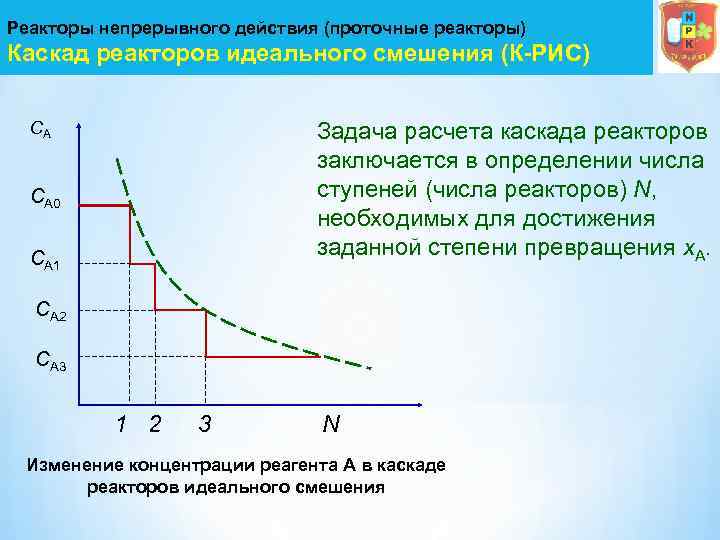 Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) СА Задача расчета каскада реакторов заключается в определении числа ступеней (числа реакторов) N, необходимых для достижения заданной степени превращения х. А. СА 0 СА 1 СА 2 СА 3 1 2 3 N Изменение концентрации реагента А в каскаде реакторов идеального смешения
Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) СА Задача расчета каскада реакторов заключается в определении числа ступеней (числа реакторов) N, необходимых для достижения заданной степени превращения х. А. СА 0 СА 1 СА 2 СА 3 1 2 3 N Изменение концентрации реагента А в каскаде реакторов идеального смешения
 Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) Существует аналитический и графический методы расчета каскада реакторов Для расчета каскада реакторов необходимо иметь сведения о кинетике процесса [r. А = f(СА)], знать концентрацию исходного реагента А на входе в первый реактор СА 0 и на выходе из последнего реактора САN (т. е. общую степень превращения х. А), необходимо также задать объем единичного реактора (т. е. время пребывания в единичном реакторе смешения τсм), при этом предполагается, что объемы единичных реакторов в каскаде равны. Для единичного N-го реактора идеального смешения (7 10) где , − концентрации компонента А соответственно на входе в N й реактор и на выходе из него. Для расчета скорость процесса в реакторе уравнение 7 10 представим в следующем виде: (7 11)
Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) Существует аналитический и графический методы расчета каскада реакторов Для расчета каскада реакторов необходимо иметь сведения о кинетике процесса [r. А = f(СА)], знать концентрацию исходного реагента А на входе в первый реактор СА 0 и на выходе из последнего реактора САN (т. е. общую степень превращения х. А), необходимо также задать объем единичного реактора (т. е. время пребывания в единичном реакторе смешения τсм), при этом предполагается, что объемы единичных реакторов в каскаде равны. Для единичного N-го реактора идеального смешения (7 10) где , − концентрации компонента А соответственно на входе в N й реактор и на выходе из него. Для расчета скорость процесса в реакторе уравнение 7 10 представим в следующем виде: (7 11)
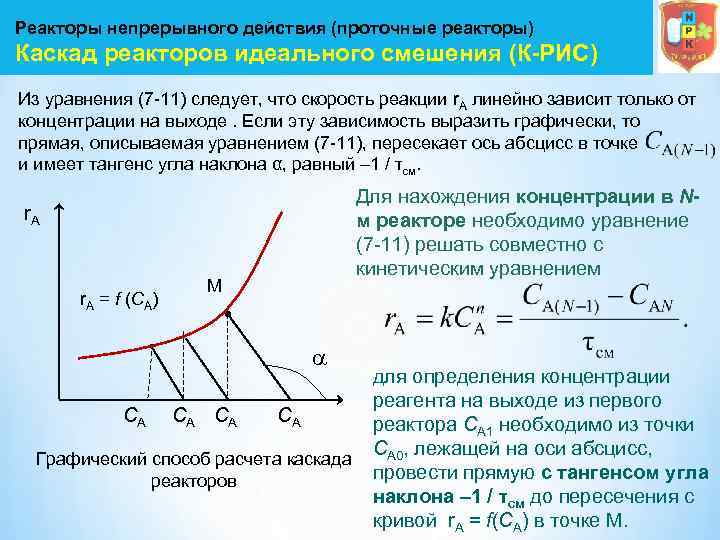 Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) Из уравнения (7 11) следует, что скорость реакции r. А линейно зависит только от концентрации на выходе. Если эту зависимость выразить графически, то прямая, описываемая уравнением (7 11), пересекает ось абсцисс в точке и имеет тангенс угла наклона α, равный – 1 / τсм. Для нахождения концентрации в Nм реакторе необходимо уравнение (7 11) решать совместно с кинетическим уравнением r. A = f (CA) М для определения концентрации реагента на выходе из первого CА CА реактора СА 1 необходимо из точки СА 0, лежащей на оси абсцисс, Графический способ расчета каскада провести прямую с тангенсом угла реакторов наклона – 1 / τсм до пересечения с кривой r. A = f(CA) в точке М.
Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) Из уравнения (7 11) следует, что скорость реакции r. А линейно зависит только от концентрации на выходе. Если эту зависимость выразить графически, то прямая, описываемая уравнением (7 11), пересекает ось абсцисс в точке и имеет тангенс угла наклона α, равный – 1 / τсм. Для нахождения концентрации в Nм реакторе необходимо уравнение (7 11) решать совместно с кинетическим уравнением r. A = f (CA) М для определения концентрации реагента на выходе из первого CА CА реактора СА 1 необходимо из точки СА 0, лежащей на оси абсцисс, Графический способ расчета каскада провести прямую с тангенсом угла реакторов наклона – 1 / τсм до пересечения с кривой r. A = f(CA) в точке М.
 Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) В аналитическом расчете каскада для каждой ступени используется уравнение материального баланса одиночного реактора смешения непрерывного действия. Используя характеристическое уравнение для РИС Н в виде последовательно для расчета отдельных ступеней каскада, получаем: … где – среднее время пребывания реагентов в отдельных ступенях каскада …
Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) В аналитическом расчете каскада для каждой ступени используется уравнение материального баланса одиночного реактора смешения непрерывного действия. Используя характеристическое уравнение для РИС Н в виде последовательно для расчета отдельных ступеней каскада, получаем: … где – среднее время пребывания реагентов в отдельных ступенях каскада …
 Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) Для реакции первого порядка (n=1) Vp=const; V=const Среднее время пребывания реагентов в каскаде равно сумме времени пребывания в отдельных ступенях, которое одинаково во всех реакторах
Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) Для реакции первого порядка (n=1) Vp=const; V=const Среднее время пребывания реагентов в каскаде равно сумме времени пребывания в отдельных ступенях, которое одинаково во всех реакторах
 Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) Число реакторов в каскаде рассчитывается по уравнению
Реакторы непрерывного действия (проточные реакторы) Каскад реакторов идеального смешения (К-РИС) Число реакторов в каскаде рассчитывается по уравнению
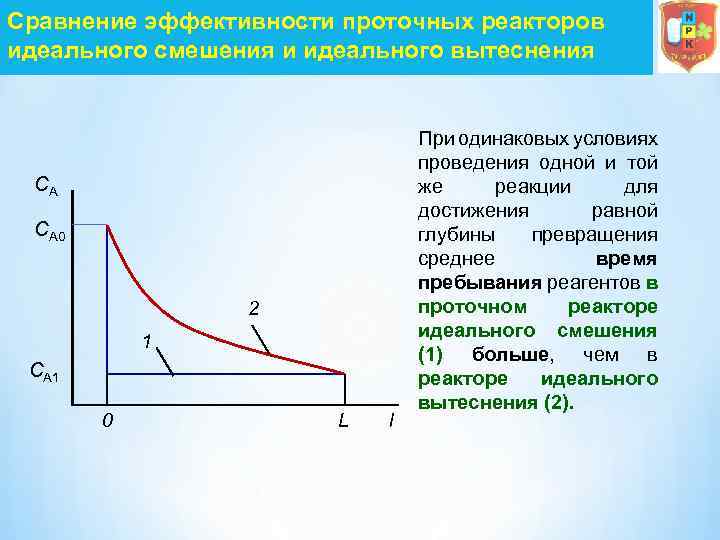 Сравнение эффективности проточных реакторов идеального смешения и идеального вытеснения CА CА 0 2 1 CА 1 0 L l При одинаковых условиях проведения одной и той же реакции для достижения равной глубины превращения среднее время пребывания реагентов в проточном реакторе идеального смешения (1) больше, чем в реакторе идеального вытеснения (2).
Сравнение эффективности проточных реакторов идеального смешения и идеального вытеснения CА CА 0 2 1 CА 1 0 L l При одинаковых условиях проведения одной и той же реакции для достижения равной глубины превращения среднее время пребывания реагентов в проточном реакторе идеального смешения (1) больше, чем в реакторе идеального вытеснения (2).
 Сравнение эффективности проточных реакторов идеального смешения и идеального вытеснения Так как текущая концентрация в РИВ выше, то следовательно: выше скорость превращения, поэтому времени необходимо меньше CА CА 0 1 2 CА 1 0 L l Исходя из этого размер реактора меньше, следовательно, у РИВ выше интенсивность чем у РИС-Н. Для реакции первого порядка n=1: Х=10% а = 1, 06 Х=58% а = 1, 44 Х=90% а = 3, 9 Следовательно объём реактора РИС-Н должен быть в 4 раза больше РИВ
Сравнение эффективности проточных реакторов идеального смешения и идеального вытеснения Так как текущая концентрация в РИВ выше, то следовательно: выше скорость превращения, поэтому времени необходимо меньше CА CА 0 1 2 CА 1 0 L l Исходя из этого размер реактора меньше, следовательно, у РИВ выше интенсивность чем у РИС-Н. Для реакции первого порядка n=1: Х=10% а = 1, 06 Х=58% а = 1, 44 Х=90% а = 3, 9 Следовательно объём реактора РИС-Н должен быть в 4 раза больше РИВ
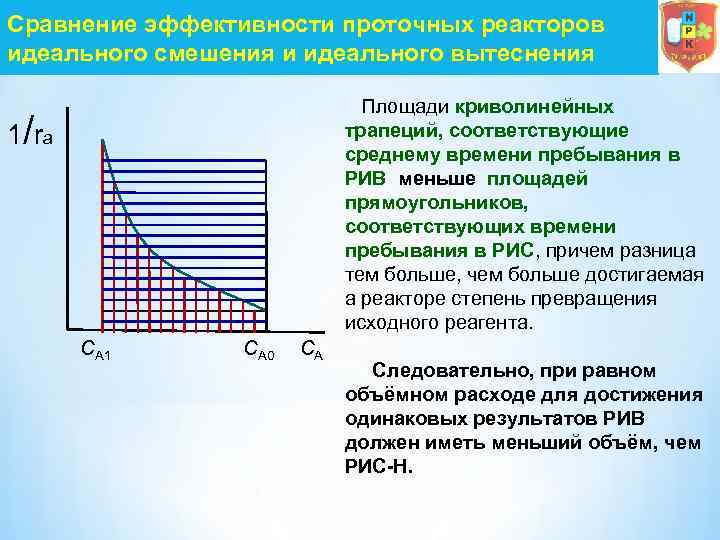 Сравнение эффективности проточных реакторов идеального смешения и идеального вытеснения 1 / ra CА 1 CА 0 CА Площади криволинейных трапеций, соответствующие среднему времени пребывания в РИВ меньше площадей прямоугольников, соответствующих времени пребывания в РИС, причем разница тем больше, чем больше достигаемая а реакторе степень превращения исходного реагента. Следовательно, при равном объёмном расходе для достижения одинаковых результатов РИВ должен иметь меньший объём, чем РИС-Н.
Сравнение эффективности проточных реакторов идеального смешения и идеального вытеснения 1 / ra CА 1 CА 0 CА Площади криволинейных трапеций, соответствующие среднему времени пребывания в РИВ меньше площадей прямоугольников, соответствующих времени пребывания в РИС, причем разница тем больше, чем больше достигаемая а реакторе степень превращения исходного реагента. Следовательно, при равном объёмном расходе для достижения одинаковых результатов РИВ должен иметь меньший объём, чем РИС-Н.
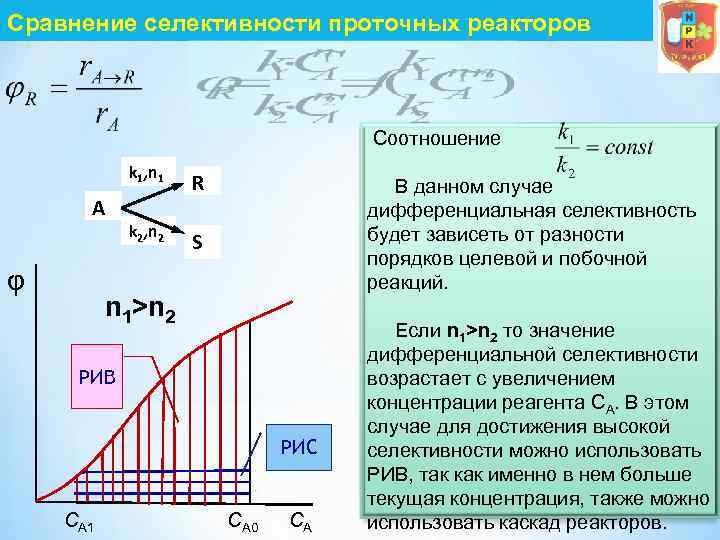 Сравнение селективности проточных реакторов Соотношение k 1, n 1 A φ R k 2, n 2 S В данном случае дифференциальная селективность будет зависеть от разности порядков целевой и побочной реакций. n 1>n 2 РИВ РИС CА 1 CА 0 CА Если n 1>n 2 то значение дифференциальной селективности возрастает с увеличением концентрации реагента СА. В этом случае для достижения высокой селективности можно использовать РИВ, так как именно в нем больше текущая концентрация, также можно использовать каскад реакторов.
Сравнение селективности проточных реакторов Соотношение k 1, n 1 A φ R k 2, n 2 S В данном случае дифференциальная селективность будет зависеть от разности порядков целевой и побочной реакций. n 1>n 2 РИВ РИС CА 1 CА 0 CА Если n 1>n 2 то значение дифференциальной селективности возрастает с увеличением концентрации реагента СА. В этом случае для достижения высокой селективности можно использовать РИВ, так как именно в нем больше текущая концентрация, также можно использовать каскад реакторов.
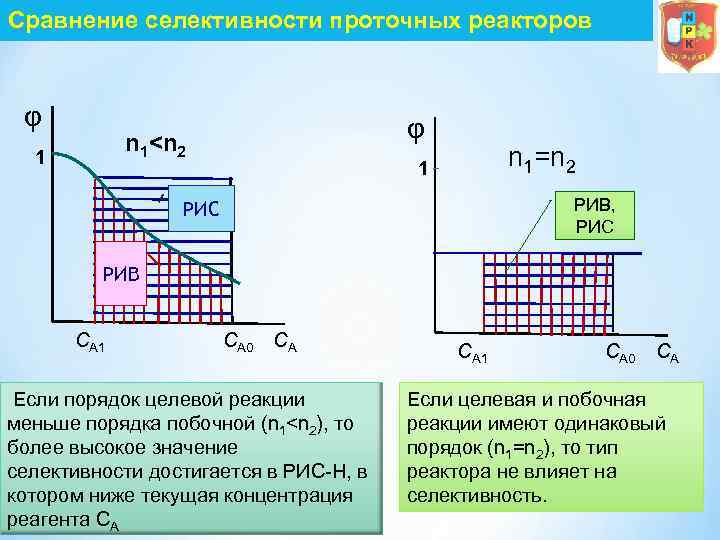 Сравнение селективности проточных реакторов φ φ n 1
Сравнение селективности проточных реакторов φ φ n 1
 Температурные режимы работы реакторов В зависимости от теплового режима реакторы разделяют на три группы: адиабатические, изотермические и политермические Адиабатический и изотермический реакторы представляют предельные случаи, которых на практике не бывает, но режим работы многих промышленных реакторов приближается к этим крайним моделям, поэтому с достаточной для практических целей точностью реакторы могут рассчитываться по уравнениям, полученным для адиабатических и изотермических режимов. Исходным уравнением для расчета реакторов с учетом переноса тепла является уравнение теплового баланса, которое обычно составляют по одному из компонентов реакционной смеси. Форма уравнения теплового баланса определяется также тепловым режимом в реакторе Qх. р + Qреаг = Qпрод + Qнак + Qт
Температурные режимы работы реакторов В зависимости от теплового режима реакторы разделяют на три группы: адиабатические, изотермические и политермические Адиабатический и изотермический реакторы представляют предельные случаи, которых на практике не бывает, но режим работы многих промышленных реакторов приближается к этим крайним моделям, поэтому с достаточной для практических целей точностью реакторы могут рассчитываться по уравнениям, полученным для адиабатических и изотермических режимов. Исходным уравнением для расчета реакторов с учетом переноса тепла является уравнение теплового баланса, которое обычно составляют по одному из компонентов реакционной смеси. Форма уравнения теплового баланса определяется также тепловым режимом в реакторе Qх. р + Qреаг = Qпрод + Qнак + Qт
 Температурные режимы работы реакторов Адиабатический режим В адиабатических реакторах отсутствует теплообмен с окружающей средой (Qт = 0), для стационарных условий не происходит также накопление теплоты (Qнак = 0), поэтому уравнение теплового баланса принимает вид Qх. р + Qреаг = Qпрод Gисх. Cp. Tн ± Gисх. CAx. Aq = Gпрод. Cp. Tк
Температурные режимы работы реакторов Адиабатический режим В адиабатических реакторах отсутствует теплообмен с окружающей средой (Qт = 0), для стационарных условий не происходит также накопление теплоты (Qнак = 0), поэтому уравнение теплового баланса принимает вид Qх. р + Qреаг = Qпрод Gисх. Cp. Tн ± Gисх. CAx. Aq = Gпрод. Cp. Tк
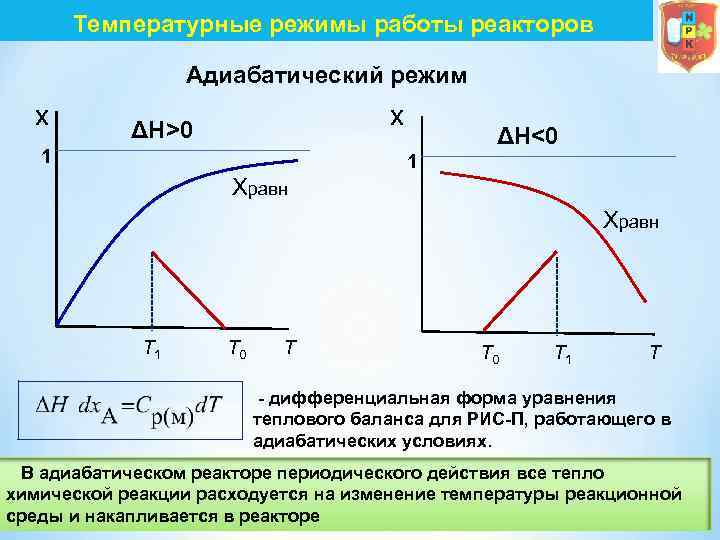 Температурные режимы работы реакторов Адиабатический режим x x ΔH>0 1 ΔH<0 1 Xравн T 1 T 0 T 1 T - дифференциальная форма уравнения теплового баланса для РИС-П, работающего в адиабатических условиях. В адиабатическом реакторе периодического действия все тепло химической реакции расходуется на изменение температуры реакционной среды и накапливается в реакторе
Температурные режимы работы реакторов Адиабатический режим x x ΔH>0 1 ΔH<0 1 Xравн T 1 T 0 T 1 T - дифференциальная форма уравнения теплового баланса для РИС-П, работающего в адиабатических условиях. В адиабатическом реакторе периодического действия все тепло химической реакции расходуется на изменение температуры реакционной среды и накапливается в реакторе
 Температурные режимы работы реакторов Адиабатический режим При стационарном режиме скорость тепловыделения в результате химического превращения ( ) и скорость уноса теплоты с конвективным потоком равны между собой, что обеспечивает неизменность температуры во времени для любой точки реактора. Изменение температуры имеет место только по длине реактора l. Для получения полных тепловых потоков дифференциальные уравнения интегрируют либо по времени (для РИС П), либо по объему или длине (для РИВ). Реакторы идеального смешения непрерывного действия (РИС Н) в стационарном режиме характеризуются отсутствием градиента параметров как во времени, так и по объему, в связи с чем уравнение теплового баланса (так же, как и материального) составляют сразу для всего реактора в целом, пользуясь конечными значениями параметров на входе в реактор и на выходе из него.
Температурные режимы работы реакторов Адиабатический режим При стационарном режиме скорость тепловыделения в результате химического превращения ( ) и скорость уноса теплоты с конвективным потоком равны между собой, что обеспечивает неизменность температуры во времени для любой точки реактора. Изменение температуры имеет место только по длине реактора l. Для получения полных тепловых потоков дифференциальные уравнения интегрируют либо по времени (для РИС П), либо по объему или длине (для РИВ). Реакторы идеального смешения непрерывного действия (РИС Н) в стационарном режиме характеризуются отсутствием градиента параметров как во времени, так и по объему, в связи с чем уравнение теплового баланса (так же, как и материального) составляют сразу для всего реактора в целом, пользуясь конечными значениями параметров на входе в реактор и на выходе из него.
 Температурные режимы работы реакторов Адиабатический режим в РИС Н благодаря интенсивному перемешиванию все параметры процесса, имеющие на входе в реактор значения CА 0, х. А 0, Т 0, мгновенно изменяются до CА, х. А, Т, имеющих одинаковые значения по всему объему реактора и отличающихся от выходных параметров (7 12) Уравнение теплового баланса (7 12) показывает, что в адиабатическом реакторе идеального смешения непрерывного действия вся теплота химической реакции расходуется на нагревание реагентов от температуры Т 0 до Т и уносится из реактора конвективным потоком. Для любой степени превращения х. А вещества А температура в реакторе может быть рассчитана по формуле
Температурные режимы работы реакторов Адиабатический режим в РИС Н благодаря интенсивному перемешиванию все параметры процесса, имеющие на входе в реактор значения CА 0, х. А 0, Т 0, мгновенно изменяются до CА, х. А, Т, имеющих одинаковые значения по всему объему реактора и отличающихся от выходных параметров (7 12) Уравнение теплового баланса (7 12) показывает, что в адиабатическом реакторе идеального смешения непрерывного действия вся теплота химической реакции расходуется на нагревание реагентов от температуры Т 0 до Т и уносится из реактора конвективным потоком. Для любой степени превращения х. А вещества А температура в реакторе может быть рассчитана по формуле
 Температурные режимы работы реакторов Изотермический режим В изотермическом реакторе идеального смешения непрерывном отвод (или подвод) теплоты осуществляется через стенку, которая охлаждается каким либо хладагентом или с помощью теплообменных элементов, расположенных внутри реактора. Так как в изотермических условиях температура реакционной среды не изменяется (Т = const) Qх. р + Qреаг = Qпрод ± Q Gисх. Cp. Tн ± Gисх. CA 0 x. Aq = Gпрод. Cp. Tк ±KFΔT
Температурные режимы работы реакторов Изотермический режим В изотермическом реакторе идеального смешения непрерывном отвод (или подвод) теплоты осуществляется через стенку, которая охлаждается каким либо хладагентом или с помощью теплообменных элементов, расположенных внутри реактора. Так как в изотермических условиях температура реакционной среды не изменяется (Т = const) Qх. р + Qреаг = Qпрод ± Q Gисх. Cp. Tн ± Gисх. CA 0 x. Aq = Gпрод. Cp. Tк ±KFΔT
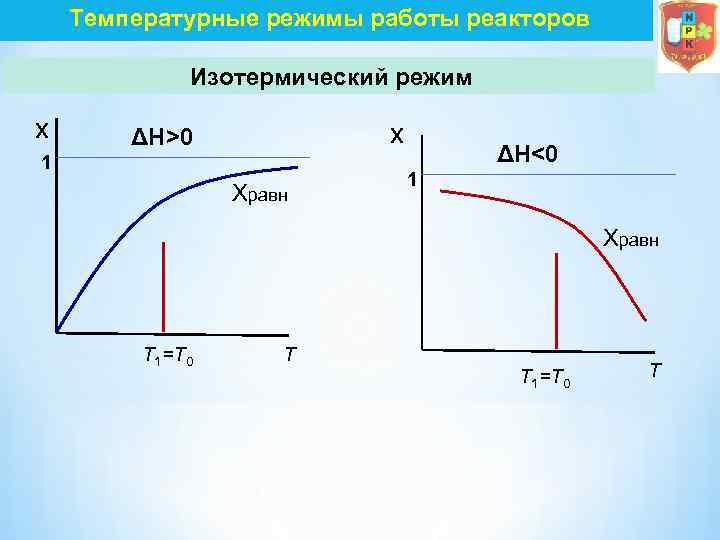 Температурные режимы работы реакторов Изотермический режим x x ΔH>0 1 Xравн ΔH<0 1 Xравн T 1=T 0 T
Температурные режимы работы реакторов Изотермический режим x x ΔH>0 1 Xравн ΔH<0 1 Xравн T 1=T 0 T
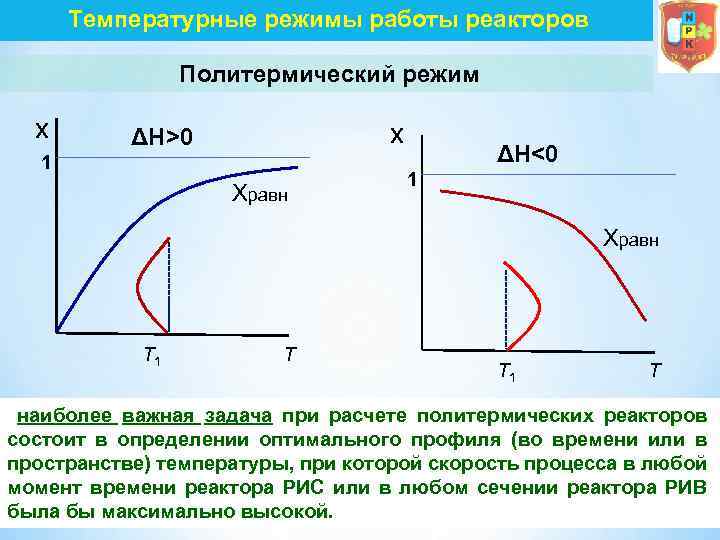 Температурные режимы работы реакторов Политермический режим x x ΔH>0 1 Xравн ΔH<0 1 Xравн T 1 T наиболее важная задача при расчете политермических реакторов состоит в определении оптимального профиля (во времени или в пространстве) температуры, при которой скорость процесса в любой момент времени реактора РИС или в любом сечении реактора РИВ была бы максимально высокой.
Температурные режимы работы реакторов Политермический режим x x ΔH>0 1 Xравн ΔH<0 1 Xравн T 1 T наиболее важная задача при расчете политермических реакторов состоит в определении оптимального профиля (во времени или в пространстве) температуры, при которой скорость процесса в любой момент времени реактора РИС или в любом сечении реактора РИВ была бы максимально высокой.
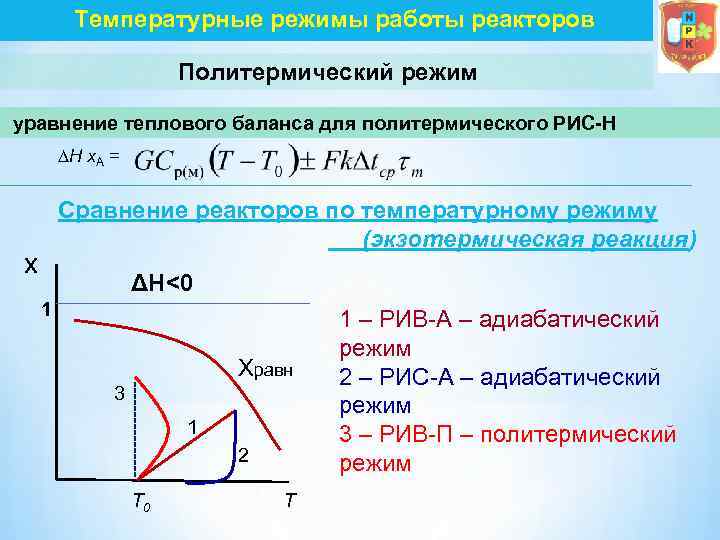 Температурные режимы работы реакторов Политермический режим уравнение теплового баланса для политермического РИС-Н Н х. А = Сравнение реакторов по температурному режиму (экзотермическая реакция) x ΔH<0 1 Xравн 3 1 2 T 0 T 1 – РИВ А – адиабатический режим 2 – РИС А – адиабатический режим 3 – РИВ П – политермический режим
Температурные режимы работы реакторов Политермический режим уравнение теплового баланса для политермического РИС-Н Н х. А = Сравнение реакторов по температурному режиму (экзотермическая реакция) x ΔH<0 1 Xравн 3 1 2 T 0 T 1 – РИВ А – адиабатический режим 2 – РИС А – адиабатический режим 3 – РИВ П – политермический режим
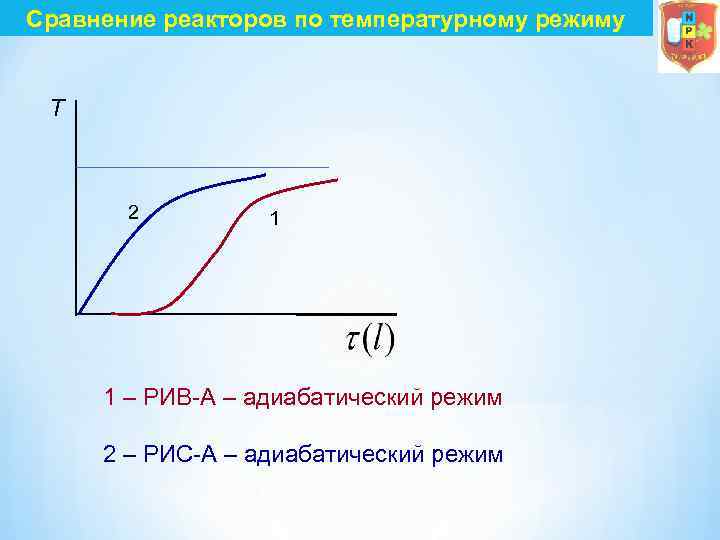 Сравнение реакторов по температурному режиму T 2 1 1 – РИВ А – адиабатический режим 2 – РИС А – адиабатический режим
Сравнение реакторов по температурному режиму T 2 1 1 – РИВ А – адиабатический режим 2 – РИС А – адиабатический режим

 Химические реакторы Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) С А 0 С А СА 0 СА 1 СА 2 СА СА 3 Y 0 Y
Химические реакторы Реакторы непрерывного действия (проточные реакторы) Реактор идеального смешения непрерывный (РИС-Н) С А 0 С А СА 0 СА 1 СА 2 СА СА 3 Y 0 Y
 0 х. А
0 х. А
 Химические реакторы z CA (внутри реактора) x wx y
Химические реакторы z CA (внутри реактора) x wx y
 Химические реакторы СА 0
Химические реакторы СА 0


