Копия 2011 ОХТ Мин ЛК Гетерогенные процессы.ppt
- Количество слайдов: 41
 Химические реакторы ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ
Химические реакторы ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ
 В гетерогенном химическом процессе исходные вещества и продукты находятся в разных фазах. По виду участвующих в процессе фаз различают следующие гетерогенные системы: а) «газ-твердое» (Г-Т) (адсорбция и десорбция газов, обжиг руд, окисление металлов, восстановление твердых оксидов, горение твердых топлив); 2 Fе. S (тв. ) + ЗО 2 (г. ) = 2 Fe. О (тв. ) + 2 SО 2 (г. ) 4 Fе. S 2, (тв. ) + 11 O 2 (г. ) = 8 SО 2 (г. ) + 2 Fе 2 О 3 (тв. ) С (тв. ) + Н 20 (г. ) = СО (г. )+ Н 2 (г. ) б) «жидкость—твердое» (Ж-Т) (адсорбция, растворение, выщелачивание, экстракция, кристаллизация); в) «газ-жидкость» (Г-Ж) (абсорбция, конденсация, перегонка жидких смесей, дистилляция и ректификация); г) несмешивающаяся система «жидкость—жидкость» (Ж-Ж) (жидкостная экстракция); д) система «твердое—твердое» (Т-Т) (спекание, процессы получения цемента и керамики, высокотемпературный синтез неорганических материалов); е) многофазные системы — «газ—жидкость—твердое» , «жидкость-жидкость (несмешивающиеся) – газ»
В гетерогенном химическом процессе исходные вещества и продукты находятся в разных фазах. По виду участвующих в процессе фаз различают следующие гетерогенные системы: а) «газ-твердое» (Г-Т) (адсорбция и десорбция газов, обжиг руд, окисление металлов, восстановление твердых оксидов, горение твердых топлив); 2 Fе. S (тв. ) + ЗО 2 (г. ) = 2 Fe. О (тв. ) + 2 SО 2 (г. ) 4 Fе. S 2, (тв. ) + 11 O 2 (г. ) = 8 SО 2 (г. ) + 2 Fе 2 О 3 (тв. ) С (тв. ) + Н 20 (г. ) = СО (г. )+ Н 2 (г. ) б) «жидкость—твердое» (Ж-Т) (адсорбция, растворение, выщелачивание, экстракция, кристаллизация); в) «газ-жидкость» (Г-Ж) (абсорбция, конденсация, перегонка жидких смесей, дистилляция и ректификация); г) несмешивающаяся система «жидкость—жидкость» (Ж-Ж) (жидкостная экстракция); д) система «твердое—твердое» (Т-Т) (спекание, процессы получения цемента и керамики, высокотемпературный синтез неорганических материалов); е) многофазные системы — «газ—жидкость—твердое» , «жидкость-жидкость (несмешивающиеся) – газ»
 Гетерогенные процессы Механизм гетерогенных процессов сложнее гомогенных, так как взаимопредшествует их доставка к поверхности раздела фаз и массообмен между фазами. Поэтому скорость гетерогенных некаталитических процессов, как правило, меньше скорости гомогенных процессов. Многие гетерогенные процессы не связаны с химическими реакциями и основаны только на физико химических явлениях. Химические гетерогенные процессы включают в качестве этапа химические реакции, которые идут в одной из фаз после перемещения туда реагентов или на поверхности раздела фаз. На гетерогенные равновесия влияют температура, давление, концентрации реагентов и продуктов реакции. Равновесие гетерогенных процессов определяется константой равновесия химических реакций, законом распределения компонентов между фазами и правилом фаз. Равновесные концентрации компонентов в соприкасающихся фазах определяются законом распределения вещества, который устанавливает постоянное соотношение между равновесными концентрациями вещества в двух фазах системы при определенной температуре.
Гетерогенные процессы Механизм гетерогенных процессов сложнее гомогенных, так как взаимопредшествует их доставка к поверхности раздела фаз и массообмен между фазами. Поэтому скорость гетерогенных некаталитических процессов, как правило, меньше скорости гомогенных процессов. Многие гетерогенные процессы не связаны с химическими реакциями и основаны только на физико химических явлениях. Химические гетерогенные процессы включают в качестве этапа химические реакции, которые идут в одной из фаз после перемещения туда реагентов или на поверхности раздела фаз. На гетерогенные равновесия влияют температура, давление, концентрации реагентов и продуктов реакции. Равновесие гетерогенных процессов определяется константой равновесия химических реакций, законом распределения компонентов между фазами и правилом фаз. Равновесные концентрации компонентов в соприкасающихся фазах определяются законом распределения вещества, который устанавливает постоянное соотношение между равновесными концентрациями вещества в двух фазах системы при определенной температуре.
 Постоянство соотношений не нарушается при изменении начальной концентрации компонента или общего давления в системе. На законе распределения основаны такие промышленные процессы, как абсорбция газов жидкостями, десорбция газов, экстрагирование. Частные случаи закона распределения для равновесий в системе Ж Г известны под названием законов Генри и Рауля. Равновесие фаз определяется правилом фаз. На основании правила фаз производят расчеты фазовых равновесий в различных гетерогенных системах и определяют количественный эффект изменения температуры, давления, концентрации реагентов. Правило фаз позволяет вычислить степени свободы, то есть число факторов, которое можно изменять независимо друг от друга без изменения числа фаз в двух и многофазных системах: С = К + П – Ф где С – число степеней свободы или вариантность системы; К – число независимых химических компонентов в системе; П – чмсло внешних параметров, влияющих на равновесие фаз; Ф – число фаз.
Постоянство соотношений не нарушается при изменении начальной концентрации компонента или общего давления в системе. На законе распределения основаны такие промышленные процессы, как абсорбция газов жидкостями, десорбция газов, экстрагирование. Частные случаи закона распределения для равновесий в системе Ж Г известны под названием законов Генри и Рауля. Равновесие фаз определяется правилом фаз. На основании правила фаз производят расчеты фазовых равновесий в различных гетерогенных системах и определяют количественный эффект изменения температуры, давления, концентрации реагентов. Правило фаз позволяет вычислить степени свободы, то есть число факторов, которое можно изменять независимо друг от друга без изменения числа фаз в двух и многофазных системах: С = К + П – Ф где С – число степеней свободы или вариантность системы; К – число независимых химических компонентов в системе; П – чмсло внешних параметров, влияющих на равновесие фаз; Ф – число фаз.
 Гетерогенные процессы Механизм гетерогенных процессов сложнее гомогенных, так как взаимодействию реагентов, находящихся в разных фазах, предшествует их доставка к поверхности раздела фаз и массообмен между фазами. Поэтому скорость гетерогенных некаталитических процессов, как правило, меньше скорости гомогенных процессов. Массообмен между фазами осуществляется с помощью диффузии и характеризуется коэффициентом массообмена β = D/δ где D — коэффициент диффузии, δ толщина пограничного слоя. Для расчета β, который служит описательной характеристикой и для более сложных механизмов переноса, используют критериальные уравнения.
Гетерогенные процессы Механизм гетерогенных процессов сложнее гомогенных, так как взаимодействию реагентов, находящихся в разных фазах, предшествует их доставка к поверхности раздела фаз и массообмен между фазами. Поэтому скорость гетерогенных некаталитических процессов, как правило, меньше скорости гомогенных процессов. Массообмен между фазами осуществляется с помощью диффузии и характеризуется коэффициентом массообмена β = D/δ где D — коэффициент диффузии, δ толщина пограничного слоя. Для расчета β, который служит описательной характеристикой и для более сложных механизмов переноса, используют критериальные уравнения.
 Перенос массы в направлении поверхности соприкосновения фаз может происходить в результате молекулярной диффузии и конвекции, вызванной гидростатическими силами, течением потока или использованием перемешивающих устройств. Отдельный случай представляет собой движение турбулентного потока, в котором можно различить две зоны: ламинарную (слой около поверхности соприкосновения фаз – пограничный слой ) и турбулентную (в глубине фазы – ядро потока). Считая, что в турбулентой зоне концентрация практически выравнивается, перенос массы в такой системе можно представить как молекулярную диффузию через пограничный ламинарный слой с эффективной (приведенной) толщиной. Перенос вещества до границ разделе фаз называется массоотдачей.
Перенос массы в направлении поверхности соприкосновения фаз может происходить в результате молекулярной диффузии и конвекции, вызванной гидростатическими силами, течением потока или использованием перемешивающих устройств. Отдельный случай представляет собой движение турбулентного потока, в котором можно различить две зоны: ламинарную (слой около поверхности соприкосновения фаз – пограничный слой ) и турбулентную (в глубине фазы – ядро потока). Считая, что в турбулентой зоне концентрация практически выравнивается, перенос массы в такой системе можно представить как молекулярную диффузию через пограничный ламинарный слой с эффективной (приведенной) толщиной. Перенос вещества до границ разделе фаз называется массоотдачей.
 Диффузия. количество вещества А, перенесенного за счет диффузии в единицу времени через поверхность F, перпендикулярную направлению переноса, пропорционально градиенту концентраций этого вещества в данный момент времени τ: Коэффициент пропорциональности D называется коэффициентом молекулярной диффузии; его размерность (длина)2/ время
Диффузия. количество вещества А, перенесенного за счет диффузии в единицу времени через поверхность F, перпендикулярную направлению переноса, пропорционально градиенту концентраций этого вещества в данный момент времени τ: Коэффициент пропорциональности D называется коэффициентом молекулярной диффузии; его размерность (длина)2/ время
 Диффузия В общем случае концентрация меняется как в пространстве, так и во времени. Изменение концентрации вещества А во времени в результате молекулярной диффузии описывается вторым законом Фика: Коэффициент молекулярной диффузии D является функцией молекулярных свойств (плотность, вязкость) того вещества, которое диффундирует, и того вещества, в котором происходит диффузия. Из кинетической теории газов следует, что значение коэффициента диффузии обратно пропорционально давлению, и пропорционально температуре в степени 3/2: Коэффициент диффузии в газах при атмосферном давлении составляют 0, 1 1 см 2/с, а для жидкости их значения в 104 105 раз меньше.
Диффузия В общем случае концентрация меняется как в пространстве, так и во времени. Изменение концентрации вещества А во времени в результате молекулярной диффузии описывается вторым законом Фика: Коэффициент молекулярной диффузии D является функцией молекулярных свойств (плотность, вязкость) того вещества, которое диффундирует, и того вещества, в котором происходит диффузия. Из кинетической теории газов следует, что значение коэффициента диффузии обратно пропорционально давлению, и пропорционально температуре в степени 3/2: Коэффициент диффузии в газах при атмосферном давлении составляют 0, 1 1 см 2/с, а для жидкости их значения в 104 105 раз меньше.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ Зависимость коэффициента диффузии в жидкостях от температуры выражается эмпирическим уравнением: В твердых телах диффузия еще более медленна, а коэффициент диффузии составляет 1 см 2/год. если при граничных значениях ΔС (градиент концентрации) и Δz = δ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Скорость гетерогенных процессов характеризуется величиной фактического выхода продукта или коэффициентом скорости процесса в кинетическом уравнении. Химическим факторами являются константы скоростей химических реакций. К физическим и гидродинамическим относятся величина межфазной поверхности, коэффициент диффузии и другие физические свойства реагентов и продуктов реакции, геометрические параметры аппаратов, факторы, влияющие на турбулентность системы.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ Зависимость коэффициента диффузии в жидкостях от температуры выражается эмпирическим уравнением: В твердых телах диффузия еще более медленна, а коэффициент диффузии составляет 1 см 2/год. если при граничных значениях ΔС (градиент концентрации) и Δz = δ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Скорость гетерогенных процессов характеризуется величиной фактического выхода продукта или коэффициентом скорости процесса в кинетическом уравнении. Химическим факторами являются константы скоростей химических реакций. К физическим и гидродинамическим относятся величина межфазной поверхности, коэффициент диффузии и другие физические свойства реагентов и продуктов реакции, геометрические параметры аппаратов, факторы, влияющие на турбулентность системы.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Гетерогенные процессы, сопровождаемые химической реакцией могут быть трех типов: 1) когда химическая реакция протекает на поверхности раздела фаз, этот тип характерен для процессов с участием твердой фазы: Т Ж, Т Г, Г Ж Т и др. ; 2) когда химические реакции протекают в объеме одной из фаз после переноса в нее вещества из другой, такие процессы наиболее распространены и могут идти с участием любых фаз в системах Г Ж, Ж Ж (несмешивающихся), Т Ж, Г Ж Т и др. ; 3) когда реакция происходит на поверхности вновь образующейся фазы, этот тип возможен для процессов взаимодействия твердых фаз. При проведении гетерогенных ХТП химическая реакция протекает на поверхности контакта фаз, к которой предварительно должны быть подведены реагенты. Таким образом, в отличие от гомогенных процессов на скорость гетерогенных процессов влияет не только скорость химической реакции, но и скорость подвода реагентов к поверхности контакта фаз и скорость отвода продуктов реакции от нее. Условная поверхность контакта фаз находится внутри одной из фаз, и она в общем случае не совпадает с поверхностью раздела фаз.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Гетерогенные процессы, сопровождаемые химической реакцией могут быть трех типов: 1) когда химическая реакция протекает на поверхности раздела фаз, этот тип характерен для процессов с участием твердой фазы: Т Ж, Т Г, Г Ж Т и др. ; 2) когда химические реакции протекают в объеме одной из фаз после переноса в нее вещества из другой, такие процессы наиболее распространены и могут идти с участием любых фаз в системах Г Ж, Ж Ж (несмешивающихся), Т Ж, Г Ж Т и др. ; 3) когда реакция происходит на поверхности вновь образующейся фазы, этот тип возможен для процессов взаимодействия твердых фаз. При проведении гетерогенных ХТП химическая реакция протекает на поверхности контакта фаз, к которой предварительно должны быть подведены реагенты. Таким образом, в отличие от гомогенных процессов на скорость гетерогенных процессов влияет не только скорость химической реакции, но и скорость подвода реагентов к поверхности контакта фаз и скорость отвода продуктов реакции от нее. Условная поверхность контакта фаз находится внутри одной из фаз, и она в общем случае не совпадает с поверхностью раздела фаз.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Глубина проникновения реагентов внутрь одной из фаз к поверхности контакта зависит от соотношения скоростей диффузии и реакции. При очень низкой скорости реакции процесс может протекать во всем объеме одной из фаз. Влияние физических процессов переноса вещества (массопередачи между фазами) тем больше, чем выше скорость химической реакции. Стадию, скорость которой существенно меньше возможных скоростей других стадий, называют лимитирующей. При наличии лимитирующей стадии наиболее эффективны те воздействия на процесс, которые изменяют скорость именно лимитирующей стадии. В свою очередь, массопередача сама может протекать в несколько последовательных стадий. Так, для гетерогенного процесса с участием пористого твердого вещества и газа можно выделить несколько элементарных стадий: 1) подведение путем диффузии реагирующих веществ из потока к внешней поверхности твердого тела (внешняя диффузия); 2) диффузия газообразных реагентов в порах зерна твердого тела к его внутренней поверхности (внутренняя диффузия); 3) собственно химическая реакция (кинетическая стадия);
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Глубина проникновения реагентов внутрь одной из фаз к поверхности контакта зависит от соотношения скоростей диффузии и реакции. При очень низкой скорости реакции процесс может протекать во всем объеме одной из фаз. Влияние физических процессов переноса вещества (массопередачи между фазами) тем больше, чем выше скорость химической реакции. Стадию, скорость которой существенно меньше возможных скоростей других стадий, называют лимитирующей. При наличии лимитирующей стадии наиболее эффективны те воздействия на процесс, которые изменяют скорость именно лимитирующей стадии. В свою очередь, массопередача сама может протекать в несколько последовательных стадий. Так, для гетерогенного процесса с участием пористого твердого вещества и газа можно выделить несколько элементарных стадий: 1) подведение путем диффузии реагирующих веществ из потока к внешней поверхности твердого тела (внешняя диффузия); 2) диффузия газообразных реагентов в порах зерна твердого тела к его внутренней поверхности (внутренняя диффузия); 3) собственно химическая реакция (кинетическая стадия);
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ 4) диффузия продуктов реакции из внутренних областей твердого вещества к внешней поверхности (внутренняя диффузия); 5) диффузия продуктов реакции с внешней поверхности в поток(внешняя диффузия). Под скоростью гетерогенного химического процесса понимают количество одного из реагентов или продуктов реакции, которое прореагирует или образуется в единицу времени на единице поверхности раздела фаз. Лимитирующая стадия этап многостадийного процесса, характеризующийся максимальной движущей силой и минимальной интенсивностью (константой скорости). Лимитирующая стадия определяет режим или область протекания процесса. Лимитирующая стадия является определяющей стадией, т. к. закономерности лимитирующей стадии определяют (совпадают) закономерности процесса в целом.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ 4) диффузия продуктов реакции из внутренних областей твердого вещества к внешней поверхности (внутренняя диффузия); 5) диффузия продуктов реакции с внешней поверхности в поток(внешняя диффузия). Под скоростью гетерогенного химического процесса понимают количество одного из реагентов или продуктов реакции, которое прореагирует или образуется в единицу времени на единице поверхности раздела фаз. Лимитирующая стадия этап многостадийного процесса, характеризующийся максимальной движущей силой и минимальной интенсивностью (константой скорости). Лимитирующая стадия определяет режим или область протекания процесса. Лимитирующая стадия является определяющей стадией, т. к. закономерности лимитирующей стадии определяют (совпадают) закономерности процесса в целом.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Скорость процесса в целом и закономерности его протекания определяются скоростью лимитирующей стадии. Если лимитирующей является стадия 1 или 5, то говорят, что процесс протекает во внешнедиффузионной области, т. е. общая скорость ХТП определяется скоростью диффузии реагентов или продуктов через пограничный слой газа или жидкости к внешней поверхности твердого вещества. Если скорость ХТП лимитирует 2 или 4 я стадии — процесс протекает во внутридиффузионной области, когда лимитирующей стадией является химическая реакция, — в кинетической области. При несущественном различии скоростей смежных стадий процесс протекает в соответствующих переходных областях.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Скорость процесса в целом и закономерности его протекания определяются скоростью лимитирующей стадии. Если лимитирующей является стадия 1 или 5, то говорят, что процесс протекает во внешнедиффузионной области, т. е. общая скорость ХТП определяется скоростью диффузии реагентов или продуктов через пограничный слой газа или жидкости к внешней поверхности твердого вещества. Если скорость ХТП лимитирует 2 или 4 я стадии — процесс протекает во внутридиффузионной области, когда лимитирующей стадией является химическая реакция, — в кинетической области. При несущественном различии скоростей смежных стадий процесс протекает в соответствующих переходных областях.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ Система «газ (жидкость) - твердое» В данной системе твердый реагент омывается потоком (текучей фазы) с другим газообразным или жидким реагентом. Продукты реакции переходят в газообразную фазу, твердая частица уменьшается. Процесс можно представить уравнением: Аг + Вт = Rг Обтекающий твердую частицу Вт поток хорошо перемешан в объеме, так что концентрация газообразного компонента А; . в нем постоянна и равна С(). У поверхности частицы образуется пограничный слой Пс. Через него компонент Аг проникает к поверхности частицы, где и происходит реакция, газообразные продукты которой удаляются в поток обратным путем.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ Система «газ (жидкость) - твердое» В данной системе твердый реагент омывается потоком (текучей фазы) с другим газообразным или жидким реагентом. Продукты реакции переходят в газообразную фазу, твердая частица уменьшается. Процесс можно представить уравнением: Аг + Вт = Rг Обтекающий твердую частицу Вт поток хорошо перемешан в объеме, так что концентрация газообразного компонента А; . в нем постоянна и равна С(). У поверхности частицы образуется пограничный слой Пс. Через него компонент Аг проникает к поверхности частицы, где и происходит реакция, газообразные продукты которой удаляются в поток обратным путем.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Скорость отдельной стадии процесса определяется ее параметрами (константой cкорости или коэфф. массопередачи) и движущей силой. Предположим, что процесс протекает в стационарном режиме. При установившемся режиме количество исходного вещества, которое должно прореагировать в единицу времени на единице межфазной поверхности, равно количеству вещества, перенесенного в зону реакции в результате диффузии. r = rх. р. = rдифф Тогда скорость реакции 1 порядка: rх. р. = k. CA для массопереноса через ламинарный пограничный слой толщиной δ rдифф = β(СА 0 – СА) в установившемся режиме k. CA = β(СА 0 – СА)
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Скорость отдельной стадии процесса определяется ее параметрами (константой cкорости или коэфф. массопередачи) и движущей силой. Предположим, что процесс протекает в стационарном режиме. При установившемся режиме количество исходного вещества, которое должно прореагировать в единицу времени на единице межфазной поверхности, равно количеству вещества, перенесенного в зону реакции в результате диффузии. r = rх. р. = rдифф Тогда скорость реакции 1 порядка: rх. р. = k. CA для массопереноса через ламинарный пограничный слой толщиной δ rдифф = β(СА 0 – СА) в установившемся режиме k. CA = β(СА 0 – СА)
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ следовательно, константа скорости гетерогенного процесса К Если величины, обратные константам скорости, принять в качестве сопротивления превращению на соответствующих этапах, то уравнение показывает, что сопротивление превращению равно сумме кинетического 1/ k и диффузионного сопротивлений 1/β.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ следовательно, константа скорости гетерогенного процесса К Если величины, обратные константам скорости, принять в качестве сопротивления превращению на соответствующих этапах, то уравнение показывает, что сопротивление превращению равно сумме кинетического 1/ k и диффузионного сопротивлений 1/β.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Если k « β реакция малоинтенсивна, Сп = Со, т. е. реакция будет протекать при максимально возможной в данных условиях концентрации (с максимальной движущей силой). Наблюдаемая скорость процесса будет равна скорости реакции: rх. р. = k. CA и не зависит от параметра β, т. к. диффузия не оказывает влияния на скорость превращения. Это кинетическая область протекания процесса, для которой реакция является лимитирующей стадией. В случае, когда k » β интенсивность массообмена мала, и из уравнения получим Сп « Со и скорость процесса будет равна: r = rдифф. = β CA 0 Массоперенос осуществляется при максимальной движущей силе, сопротивление диффузии определяет скорость превращения (скорость превращения не зависит от параметра реакции), и процесс протекает в диффузионной области, массоперенос лимитирующая стадия.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Если k « β реакция малоинтенсивна, Сп = Со, т. е. реакция будет протекать при максимально возможной в данных условиях концентрации (с максимальной движущей силой). Наблюдаемая скорость процесса будет равна скорости реакции: rх. р. = k. CA и не зависит от параметра β, т. к. диффузия не оказывает влияния на скорость превращения. Это кинетическая область протекания процесса, для которой реакция является лимитирующей стадией. В случае, когда k » β интенсивность массообмена мала, и из уравнения получим Сп « Со и скорость процесса будет равна: r = rдифф. = β CA 0 Массоперенос осуществляется при максимальной движущей силе, сопротивление диффузии определяет скорость превращения (скорость превращения не зависит от параметра реакции), и процесс протекает в диффузионной области, массоперенос лимитирующая стадия.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ СПОСОБЫ ОПРЕДЕЛЕНИЯ ЛИМИТИРУЮЩЕЙ СТАДИИ. Определение лимитирующей стадии гетерогенного процесса необходимо для определения способов управления такими процессами, определения зависимости между временем пребывания и степенью превращения реагентов (твердых), подбора и расчета реакторов. Все методы определения лимитирующей стадии можно разделить на 3 группы: 1) Теоретические методы; 2) Методы, основанные на изучении влияния изменения параметров гетерогенного процесса на его скорость; 3) Методы, основанные на сравнении экспериментальных и теоретических зависимостей. Теоретические методы. Если известны коэффициенты массоотдачи β 1 β 2 и константа скорости k, то, сравнивая их числовые значения, можно решить вопрос о том, есть ли в данных условиях проведения гетерогенного процесса лимитирующая стадия, и если она есть, то какая именно, лимитирующая стадия, как указывалось выше обладает максимальным сопротивлением.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ СПОСОБЫ ОПРЕДЕЛЕНИЯ ЛИМИТИРУЮЩЕЙ СТАДИИ. Определение лимитирующей стадии гетерогенного процесса необходимо для определения способов управления такими процессами, определения зависимости между временем пребывания и степенью превращения реагентов (твердых), подбора и расчета реакторов. Все методы определения лимитирующей стадии можно разделить на 3 группы: 1) Теоретические методы; 2) Методы, основанные на изучении влияния изменения параметров гетерогенного процесса на его скорость; 3) Методы, основанные на сравнении экспериментальных и теоретических зависимостей. Теоретические методы. Если известны коэффициенты массоотдачи β 1 β 2 и константа скорости k, то, сравнивая их числовые значения, можно решить вопрос о том, есть ли в данных условиях проведения гетерогенного процесса лимитирующая стадия, и если она есть, то какая именно, лимитирующая стадия, как указывалось выше обладает максимальным сопротивлением.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ СПОСОБЫ ОПРЕДЕЛЕНИЯ ЛИМИТИРУЮЩЕЙ СТАДИИ. Методы, основанные на изучении влияния изменения параметров гетерогенного процесса на его скорость. Лимитирующую стадию можно экспериментально определить, изучая изменение скорости гетерогенного процесса в зависимости от температуры Т, линейной скорости (газового или жидкостного) потока w и степени измельчения 1/R. Если гетерогенный процесс в некотором диапазоне изменения параметров его проведения (Т, w, R) лимитируется химической реакцией, то скорость его определяется в основном константой скорости химического взаимодействия. Константа скорости k экспоненциально увеличивается с ростом температуры, в то время как коэффициенты массоотдачи на диффузионных стадиях β 1 β 2 зависят от температуры очень слабо (~ Т 1/2).
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ СПОСОБЫ ОПРЕДЕЛЕНИЯ ЛИМИТИРУЮЩЕЙ СТАДИИ. Методы, основанные на изучении влияния изменения параметров гетерогенного процесса на его скорость. Лимитирующую стадию можно экспериментально определить, изучая изменение скорости гетерогенного процесса в зависимости от температуры Т, линейной скорости (газового или жидкостного) потока w и степени измельчения 1/R. Если гетерогенный процесс в некотором диапазоне изменения параметров его проведения (Т, w, R) лимитируется химической реакцией, то скорость его определяется в основном константой скорости химического взаимодействия. Константа скорости k экспоненциально увеличивается с ростом температуры, в то время как коэффициенты массоотдачи на диффузионных стадиях β 1 β 2 зависят от температуры очень слабо (~ Т 1/2).
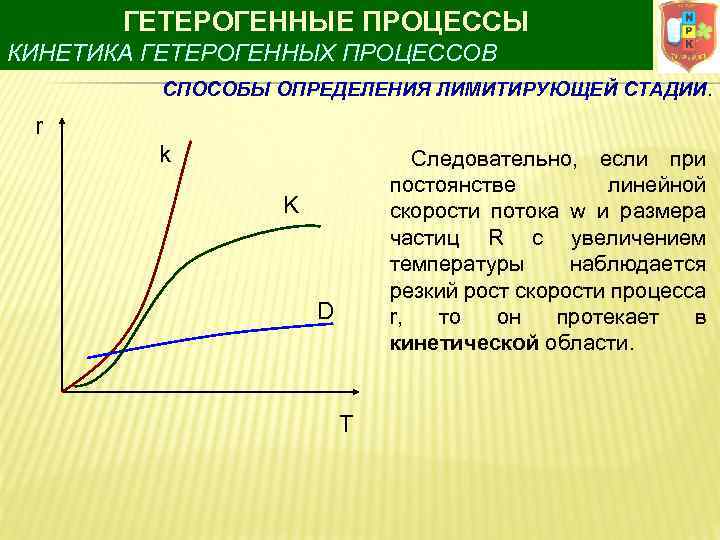 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ СПОСОБЫ ОПРЕДЕЛЕНИЯ ЛИМИТИРУЮЩЕЙ СТАДИИ. r k Следовательно, если при постоянстве линейной скорости потока w и размера частиц R с увеличением температуры наблюдается резкий рост скорости процесса r, то он протекает в кинетической области. K D T
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ СПОСОБЫ ОПРЕДЕЛЕНИЯ ЛИМИТИРУЮЩЕЙ СТАДИИ. r k Следовательно, если при постоянстве линейной скорости потока w и размера частиц R с увеличением температуры наблюдается резкий рост скорости процесса r, то он протекает в кинетической области. K D T
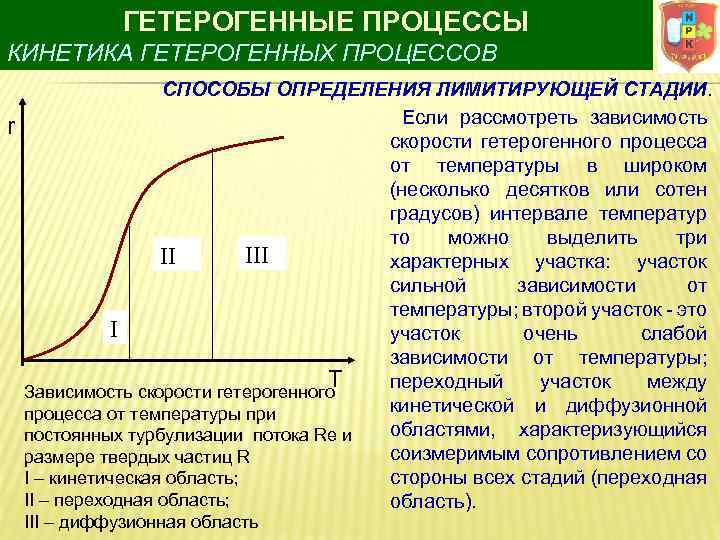 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ r СПОСОБЫ ОПРЕДЕЛЕНИЯ ЛИМИТИРУЮЩЕЙ СТАДИИ. Если рассмотреть зависимость скорости гетерогенного процесса от температуры в широком (несколько десятков или сотен градусов) интервале температур то можно выделить три III II характерных участка: участок сильной зависимости от температуры; второй участок это I участок очень слабой зависимости от температуры; T переходный участок между Зависимость скорости гетерогенного кинетической и диффузионной процесса от температуры при областями, характеризующийся постоянных турбулизации потока Re и соизмеримым сопротивлением со размере твердых частиц R стороны всех стадий (переходная I – кинетическая область; II – переходная область; область). III – диффузионная область
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ r СПОСОБЫ ОПРЕДЕЛЕНИЯ ЛИМИТИРУЮЩЕЙ СТАДИИ. Если рассмотреть зависимость скорости гетерогенного процесса от температуры в широком (несколько десятков или сотен градусов) интервале температур то можно выделить три III II характерных участка: участок сильной зависимости от температуры; второй участок это I участок очень слабой зависимости от температуры; T переходный участок между Зависимость скорости гетерогенного кинетической и диффузионной процесса от температуры при областями, характеризующийся постоянных турбулизации потока Re и соизмеримым сопротивлением со размере твердых частиц R стороны всех стадий (переходная I – кинетическая область; II – переходная область; область). III – диффузионная область
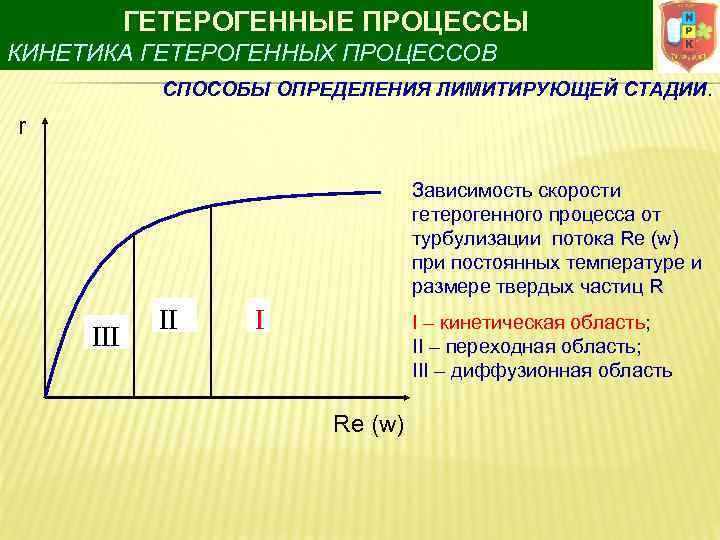 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ СПОСОБЫ ОПРЕДЕЛЕНИЯ ЛИМИТИРУЮЩЕЙ СТАДИИ. r Зависимость скорости гетерогенного процесса от турбулизации потока Re (w) при постоянных температуре и размере твердых частиц R III II I I – кинетическая область; II – переходная область; III – диффузионная область Re (w)
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ СПОСОБЫ ОПРЕДЕЛЕНИЯ ЛИМИТИРУЮЩЕЙ СТАДИИ. r Зависимость скорости гетерогенного процесса от турбулизации потока Re (w) при постоянных температуре и размере твердых частиц R III II I I – кинетическая область; II – переходная область; III – диффузионная область Re (w)
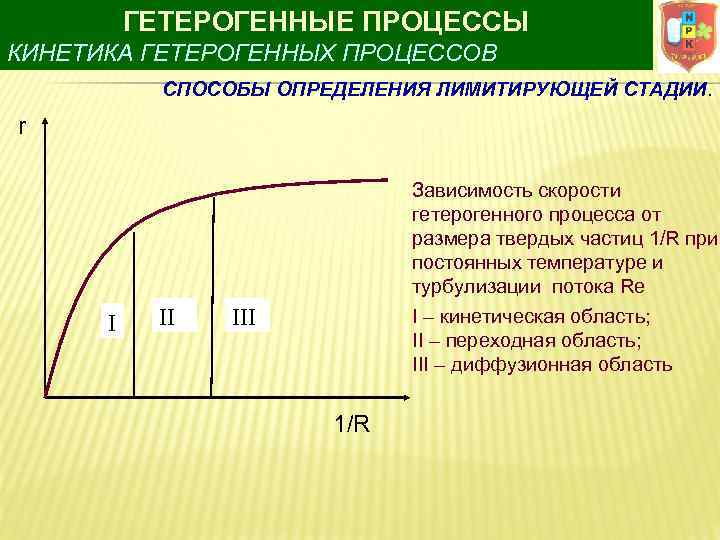 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ СПОСОБЫ ОПРЕДЕЛЕНИЯ ЛИМИТИРУЮЩЕЙ СТАДИИ. r I II Зависимость скорости гетерогенного процесса от размера твердых частиц 1/R при постоянных температуре и турбулизации потока Re I – кинетическая область; II – переходная область; III – диффузионная область III 1/R
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ СПОСОБЫ ОПРЕДЕЛЕНИЯ ЛИМИТИРУЮЩЕЙ СТАДИИ. r I II Зависимость скорости гетерогенного процесса от размера твердых частиц 1/R при постоянных температуре и турбулизации потока Re I – кинетическая область; II – переходная область; III – диффузионная область III 1/R
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ ВНЕШНЕДИФФУЗИОННАЯ ОБЛАСТЬ ПРОТЕКАНИЯ ПРОЦЕССОВ Основные признаки протекания процесса во внешнедиффузионной области: а) сильное влияние линейной скорости потока или интенсивности перемешивания на наблюдаемую скорость процесса при постоянстве времени контакта фаз; б) слабая зависимость влияния температуры на скорость процесса, обусловленная низким значением энергии активации; в) наблюдаемый порядок реакции не превышает 1, независимо от истинного порядка реакции; г) наличие градиента температур между потоком и внешней поверхностью твердого вещества при проведении реакций с тепловым эффектом. При этом для газофазных экзо и эндотермических процессов с большим тепловым эффектом эта разность может достигать десятков градусов.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ ВНЕШНЕДИФФУЗИОННАЯ ОБЛАСТЬ ПРОТЕКАНИЯ ПРОЦЕССОВ Основные признаки протекания процесса во внешнедиффузионной области: а) сильное влияние линейной скорости потока или интенсивности перемешивания на наблюдаемую скорость процесса при постоянстве времени контакта фаз; б) слабая зависимость влияния температуры на скорость процесса, обусловленная низким значением энергии активации; в) наблюдаемый порядок реакции не превышает 1, независимо от истинного порядка реакции; г) наличие градиента температур между потоком и внешней поверхностью твердого вещества при проведении реакций с тепловым эффектом. При этом для газофазных экзо и эндотермических процессов с большим тепловым эффектом эта разность может достигать десятков градусов.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ ВНУТРИДИФФУЗИОННАЯ ОБЛАСТЬ ПРОТЕКАНИЯ ПРОЦЕССОВ Протекание процессов во внутридиффузионной области наиболее часто наблюдается в системе Г—Т или Ж—Т, если твердое вещество является пористым. Лимитирующей стадией в этом случае будет диффузия реагентов или продуктов реакции в порах. Характерные признаки протекания процессов во внутридиффузионной области: а) сильная зависимость скорости процесса от размера частиц dч твердого материала, связанная с ослаблением внутридиффузиоиных торможений с уменьшением dч и соответственно средней длины пор; б) незначительное влияние температуры на скорость процесса, особенно при мелкопористой структуре твердого вещества, диффузия в котором протекает по механизму Кнудсена; в) изменение порядка реакции и энергии активации при изменении условий протекания процесса (Т, Р, С. . . ); г) наличие градиента температур внутри пористого твердого материала. Разность температур между внутренней и внешней поверхностью может превышать 100 градусов при высоком тепловом эффекте и низкой теплопроводности материала пористого тела.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ ВНУТРИДИФФУЗИОННАЯ ОБЛАСТЬ ПРОТЕКАНИЯ ПРОЦЕССОВ Протекание процессов во внутридиффузионной области наиболее часто наблюдается в системе Г—Т или Ж—Т, если твердое вещество является пористым. Лимитирующей стадией в этом случае будет диффузия реагентов или продуктов реакции в порах. Характерные признаки протекания процессов во внутридиффузионной области: а) сильная зависимость скорости процесса от размера частиц dч твердого материала, связанная с ослаблением внутридиффузиоиных торможений с уменьшением dч и соответственно средней длины пор; б) незначительное влияние температуры на скорость процесса, особенно при мелкопористой структуре твердого вещества, диффузия в котором протекает по механизму Кнудсена; в) изменение порядка реакции и энергии активации при изменении условий протекания процесса (Т, Р, С. . . ); г) наличие градиента температур внутри пористого твердого материала. Разность температур между внутренней и внешней поверхностью может превышать 100 градусов при высоком тепловом эффекте и низкой теплопроводности материала пористого тела.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ КИНЕТИЧЕСКАЯ ОБЛАСТЬ ПРОТЕКАНИЯ ПРОЦЕССОВ При протекании процессов в кинетической области стадия химической реакции является лимитирующей, и ее скорость определяет скорость процесса в целом. Диффузионные торможения в этом случае отсутствуют, и скорость процесса рассчитывают, используя методы истинной или формальной кинетики, по кинетическим уравнениям, рассмотренным ранее. Основные признаки протекания процессов в кинетической области: а) сильная зависимость скорости процесса от температуры, описываемая уравнением Аррениуса. При этом энергия активации, как правило, велика и при уменьшении температуры в большинстве случаев практически не изменяется; б) независимость скорости процесса от линейной скорости газа или жидкости (при сохранении неизменным времени контакта) и интенсивности перемешивания (при проведении процесса в замкнутом объеме), а для высокопористых материалов — и от размера частиц.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ КИНЕТИЧЕСКАЯ ОБЛАСТЬ ПРОТЕКАНИЯ ПРОЦЕССОВ При протекании процессов в кинетической области стадия химической реакции является лимитирующей, и ее скорость определяет скорость процесса в целом. Диффузионные торможения в этом случае отсутствуют, и скорость процесса рассчитывают, используя методы истинной или формальной кинетики, по кинетическим уравнениям, рассмотренным ранее. Основные признаки протекания процессов в кинетической области: а) сильная зависимость скорости процесса от температуры, описываемая уравнением Аррениуса. При этом энергия активации, как правило, велика и при уменьшении температуры в большинстве случаев практически не изменяется; б) независимость скорости процесса от линейной скорости газа или жидкости (при сохранении неизменным времени контакта) и интенсивности перемешивания (при проведении процесса в замкнутом объеме), а для высокопористых материалов — и от размера частиц.
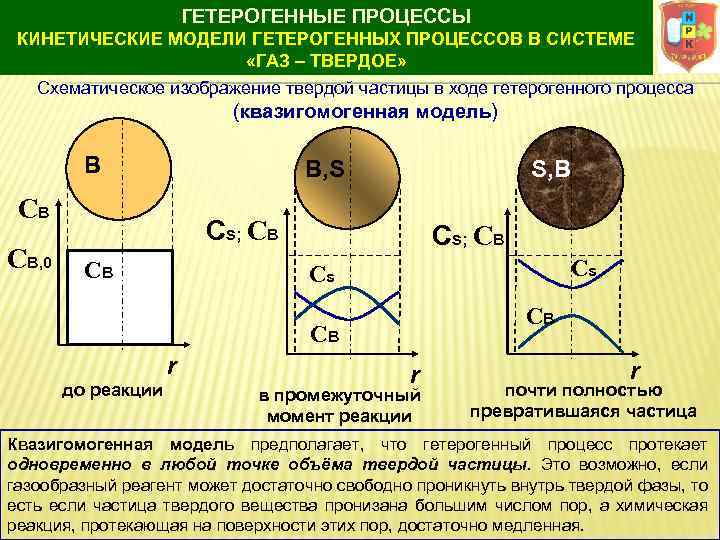 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ТВЕРДОЕ» Схематическое изображение твердой частицы в ходе гетерогенного процесса (квазигомогенная модель) B B, S CB CB, 0 S, B Cs; CB Cs Cs CB CB r до реакции r в промежуточный момент реакции r почти полностью превратившаяся частица Квазигомогенная модель предполагает, что гетерогенный процесс протекает одновременно в любой точке объёма твердой частицы. Это возможно, если газообразный реагент может достаточно свободно проникнуть внутрь твердой фазы, то есть если частица твердого вещества пронизана большим числом пор, а химическая реакция, протекающая на поверхности этих пор, достаточно медленная.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ТВЕРДОЕ» Схематическое изображение твердой частицы в ходе гетерогенного процесса (квазигомогенная модель) B B, S CB CB, 0 S, B Cs; CB Cs Cs CB CB r до реакции r в промежуточный момент реакции r почти полностью превратившаяся частица Квазигомогенная модель предполагает, что гетерогенный процесс протекает одновременно в любой точке объёма твердой частицы. Это возможно, если газообразный реагент может достаточно свободно проникнуть внутрь твердой фазы, то есть если частица твердого вещества пронизана большим числом пор, а химическая реакция, протекающая на поверхности этих пор, достаточно медленная.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ТВЕРДОЕ» «сжимающееся ядро» Отличительной особенностью данной модели является образование помимо газообразного, твердого продукта Аг + Вт = Rг + Sт который компенсирует расход твердого реагента Вт, то есть в ходе процесса размер твердой частицы не меняется. Реакция протекает на границе раздела твердых фаз исходного реагента и продукта. Реакция начинается на поверхности твердого компонента и фронталь но продвигается вглубь. В какой то момент процесса частица будет состоять из ядра радиусом rя, содержащего не прореагировавшее вещество Вт, и наружного слоя продукта или/и не реагирующих, инертных для протекающей реакции компонентов. Реакция протекает на поверхности ядра, в результате чего оно уменьшается, но размер частицы (R 0) сохраняется
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ТВЕРДОЕ» «сжимающееся ядро» Отличительной особенностью данной модели является образование помимо газообразного, твердого продукта Аг + Вт = Rг + Sт который компенсирует расход твердого реагента Вт, то есть в ходе процесса размер твердой частицы не меняется. Реакция протекает на границе раздела твердых фаз исходного реагента и продукта. Реакция начинается на поверхности твердого компонента и фронталь но продвигается вглубь. В какой то момент процесса частица будет состоять из ядра радиусом rя, содержащего не прореагировавшее вещество Вт, и наружного слоя продукта или/и не реагирующих, инертных для протекающей реакции компонентов. Реакция протекает на поверхности ядра, в результате чего оно уменьшается, но размер частицы (R 0) сохраняется
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ТВЕРДОЕ» «сжимающееся ядро» Структура процесса включает следующие стадии (этапы). Для газообразных компонентов: 1. Перенос компонента А из потока к поверхности частицы (этап I). 2. Перенос реагента через слой инертного вещества к поверхности ядра (этап II); как правило, инертное вещество представляет собой пористый материал, и перенос компонента осуществляется диффузией по порам. 3. Реакция Аг с Вт на поверхности ядра (этап III). Газообразные продукты отводятся в обратном порядке. Предполагается, что они не влияют на скорость превращения. Для твердого компонента: 1. Реакция Вт с Аг на поверхности ядра (этап III). 2. Изменение размера ядра Вт.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ТВЕРДОЕ» «сжимающееся ядро» Структура процесса включает следующие стадии (этапы). Для газообразных компонентов: 1. Перенос компонента А из потока к поверхности частицы (этап I). 2. Перенос реагента через слой инертного вещества к поверхности ядра (этап II); как правило, инертное вещество представляет собой пористый материал, и перенос компонента осуществляется диффузией по порам. 3. Реакция Аг с Вт на поверхности ядра (этап III). Газообразные продукты отводятся в обратном порядке. Предполагается, что они не влияют на скорость превращения. Для твердого компонента: 1. Реакция Вт с Аг на поверхности ядра (этап III). 2. Изменение размера ядра Вт.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ТВЕРДОЕ» модель «СЖИМАЮЩАЯСЯ СФЕРА» В данной системе твердый реагент омывается потоком (текучей фазы) с другим газообразным или жидким реагентом. Продукты реакции переходят в газообразную фазу, твердая частица уменьшается. Процесс можно представить уравнением: Аг + Вт = Rг Индексы «г» и «т» указывают, в какой фазе находится компонент. Объемное содержание вещества в конденсированной фазе (в твердой частице) в сотни раз больше, чем в газе, и уменьшение размера частицы происходит намного медленнее установления распределения концентраций в пограничном слое, поэтому процессы, протекающие в газовой фазе, можно считать стационарными относительно процесса в твердой фазе.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ТВЕРДОЕ» модель «СЖИМАЮЩАЯСЯ СФЕРА» В данной системе твердый реагент омывается потоком (текучей фазы) с другим газообразным или жидким реагентом. Продукты реакции переходят в газообразную фазу, твердая частица уменьшается. Процесс можно представить уравнением: Аг + Вт = Rг Индексы «г» и «т» указывают, в какой фазе находится компонент. Объемное содержание вещества в конденсированной фазе (в твердой частице) в сотни раз больше, чем в газе, и уменьшение размера частицы происходит намного медленнее установления распределения концентраций в пограничном слое, поэтому процессы, протекающие в газовой фазе, можно считать стационарными относительно процесса в твердой фазе.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ТВЕРДОЕ» модель «СЖИМАЮЩАЯСЯ СФЕРА» Структура процесса представлена следующими стадиями (этапами). В газовой фазе: 1. Перенос реагента А из потока к поверхности частицы (этап I). Для этого концентрация А у поверхности Сп должна быть меньше, чем в потоке. Распределение концентрации показано в нижней части рисунка. 2. Реакция А с твердым В на наружной поверхности частицы (этап II). Газообразные продукты реакции К отводятся от поверхности обратно в поток. Полагаем, что скорость реакции не зависит от концентрации К и их отвод от поверхности не влияет на процесс. В твердой фазе: 1. Реакция В с газообразным компонентом А на поверхности (этап II). 2. Изменение (уменьшение) размера частицы r (этап III). Первоначально частица имеет радиус R().
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ТВЕРДОЕ» модель «СЖИМАЮЩАЯСЯ СФЕРА» Структура процесса представлена следующими стадиями (этапами). В газовой фазе: 1. Перенос реагента А из потока к поверхности частицы (этап I). Для этого концентрация А у поверхности Сп должна быть меньше, чем в потоке. Распределение концентрации показано в нижней части рисунка. 2. Реакция А с твердым В на наружной поверхности частицы (этап II). Газообразные продукты реакции К отводятся от поверхности обратно в поток. Полагаем, что скорость реакции не зависит от концентрации К и их отвод от поверхности не влияет на процесс. В твердой фазе: 1. Реакция В с газообразным компонентом А на поверхности (этап II). 2. Изменение (уменьшение) размера частицы r (этап III). Первоначально частица имеет радиус R().
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ЖИДКОСТЬ» Наиболее распространенной кинетической моделью процессов в системе Г Ж является пленочная модель, согласно которой: а) по обе стороны межфазной поверхности существуют ламинарные пограничные пленки газа и жидкости; б) за пределами пограничных пленок концентрации реагирующих компонентов постоянны; в) на поверхности раздела фаз между концентрациями поглощаемого компонента в жидкой и газовой фазе устанавливается динамическое равновесие, подчиняющееся закону Генри
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ЖИДКОСТЬ» Наиболее распространенной кинетической моделью процессов в системе Г Ж является пленочная модель, согласно которой: а) по обе стороны межфазной поверхности существуют ламинарные пограничные пленки газа и жидкости; б) за пределами пограничных пленок концентрации реагирующих компонентов постоянны; в) на поверхности раздела фаз между концентрациями поглощаемого компонента в жидкой и газовой фазе устанавливается динамическое равновесие, подчиняющееся закону Генри
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ЖИДКОСТЬ» Исходные компоненты А и В содержатся в газе и в жидкости соответственно. Выразим их концентрации аналогично их агрегатному состоянию: парциальное давление А в газе p. A и концентрация В в жидкости Св. Реакция протекает в жидкой фазе и продукты остаются в жидкости или могут перейти в газ, т. е. запишем уравнение следующим образом: Аг + Вж = Rж + (Sг) Скорость реакции описывается кинетическим уравнением r=k. САСВ, где СA — концентрация А в жидкой фазе. Основные этапы (стадии) процесса 1. Перенос компонента А из объема газа через пограничный слой к поверхности раздела фаз (этап I). 2. Перенос А через поверхность раздела из газа в жидкость (этап II). 3. Перенос А от поверхности раздела через пограничный слой жидкости в ее объем (этап III). 4. Реакция между А и В в жидкости (этап IV).
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ КИНЕТИЧЕСКИЕ МОДЕЛИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ В СИСТЕМЕ «ГАЗ – ЖИДКОСТЬ» Исходные компоненты А и В содержатся в газе и в жидкости соответственно. Выразим их концентрации аналогично их агрегатному состоянию: парциальное давление А в газе p. A и концентрация В в жидкости Св. Реакция протекает в жидкой фазе и продукты остаются в жидкости или могут перейти в газ, т. е. запишем уравнение следующим образом: Аг + Вж = Rж + (Sг) Скорость реакции описывается кинетическим уравнением r=k. САСВ, где СA — концентрация А в жидкой фазе. Основные этапы (стадии) процесса 1. Перенос компонента А из объема газа через пограничный слой к поверхности раздела фаз (этап I). 2. Перенос А через поверхность раздела из газа в жидкость (этап II). 3. Перенос А от поверхности раздела через пограничный слой жидкости в ее объем (этап III). 4. Реакция между А и В в жидкости (этап IV).
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ СИСТЕМА «ГАЗ – ЖИДКОСТЬ» Математическая модель указанной последовательности этапов основана на равенстве потоков WI, WII и WIII на стадиях переноса и превращения WIV компонента А: WI = WIII = WIV Поток компонента А через газовый пограничный слой WI = βг. S(p. А p*А), где βг — коэффициент массообмена между объемом газа и поверхностью раздела фаз; р*А — парциальное давление А у поверхности раздела фаз; S площадь поверхности раздела фаз. Перенос через поверхность раздела фаз — явление, протекающее в масштабе молекул, и можно полагать, что приповерхностные парциальное давление в газе р*А и концентрация в жидкости С*А находятся в равновесии, т. е. С*А = Кя p*А, где Кя - константа абсорбции. Поток компонента через жидкостной пограничный слой WIII = βж. S(СА С*А). где (βж — коэффициент массообмена между поверхностью раздела фаз и объемом жидкости. Реакция протекает в жидкости, и скорость превращения А в ее объеме Vж WIV = k. СAСВVж.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ СИСТЕМА «ГАЗ – ЖИДКОСТЬ» Математическая модель указанной последовательности этапов основана на равенстве потоков WI, WII и WIII на стадиях переноса и превращения WIV компонента А: WI = WIII = WIV Поток компонента А через газовый пограничный слой WI = βг. S(p. А p*А), где βг — коэффициент массообмена между объемом газа и поверхностью раздела фаз; р*А — парциальное давление А у поверхности раздела фаз; S площадь поверхности раздела фаз. Перенос через поверхность раздела фаз — явление, протекающее в масштабе молекул, и можно полагать, что приповерхностные парциальное давление в газе р*А и концентрация в жидкости С*А находятся в равновесии, т. е. С*А = Кя p*А, где Кя - константа абсорбции. Поток компонента через жидкостной пограничный слой WIII = βж. S(СА С*А). где (βж — коэффициент массообмена между поверхностью раздела фаз и объемом жидкости. Реакция протекает в жидкости, и скорость превращения А в ее объеме Vж WIV = k. СAСВVж.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ СИСТЕМА «ГАЗ – ЖИДКОСТЬ» При небольших температурах (правая часть графика) константа скорости реакции мала k « βоб. Св и в системе устанавливается кинетический режим. Однако, с возрастанием температуры зависимость Wн будет все больше отлична от увеличения константы скорости реакции k, так как на скорости реакции начинает сказываться константа абсорбции Кл (во многих случаях растворимость газа в жидкости уменьшается). Зависимость наблюдаемой скорости превращения Wн в гетерогенном процессе «газ —жидкость» и константы скорости реакции k от температуры Т; режимы процесса: / — кинетический; 2 — переходный; 3 — диффузионный
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ СИСТЕМА «ГАЗ – ЖИДКОСТЬ» При небольших температурах (правая часть графика) константа скорости реакции мала k « βоб. Св и в системе устанавливается кинетический режим. Однако, с возрастанием температуры зависимость Wн будет все больше отлична от увеличения константы скорости реакции k, так как на скорости реакции начинает сказываться константа абсорбции Кл (во многих случаях растворимость газа в жидкости уменьшается). Зависимость наблюдаемой скорости превращения Wн в гетерогенном процессе «газ —жидкость» и константы скорости реакции k от температуры Т; режимы процесса: / — кинетический; 2 — переходный; 3 — диффузионный
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ Процессы взаимодействия между твердыми фазами и в мноrофазных системах Взаимодействие только между твердыми фазами наиболее характерно для процессов спекания. С п е к а н и е это процесс получения агрегатов частиц из мелкозернистых, порошкообразных или пылевидных материалов при высоких температурах. Реакции между твердыми материалами часто проходят с участием газовой или жидкой фаз, образующихся во время реакции. При выборе модели, пригодной для описания таких процессов, учитывают появление этих фаз, последующие стадии их диффузии и химическую реакцию. Установлено, что появление газовой и жидкой фаз способствует ускорению взаимодействия между твердыми материалами. Поэтому такие процессы относят к многофазным, и скорость их определяется скоростью одной из перечисленных элементарных стадий.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ Процессы взаимодействия между твердыми фазами и в мноrофазных системах Взаимодействие только между твердыми фазами наиболее характерно для процессов спекания. С п е к а н и е это процесс получения агрегатов частиц из мелкозернистых, порошкообразных или пылевидных материалов при высоких температурах. Реакции между твердыми материалами часто проходят с участием газовой или жидкой фаз, образующихся во время реакции. При выборе модели, пригодной для описания таких процессов, учитывают появление этих фаз, последующие стадии их диффузии и химическую реакцию. Установлено, что появление газовой и жидкой фаз способствует ускорению взаимодействия между твердыми материалами. Поэтому такие процессы относят к многофазным, и скорость их определяется скоростью одной из перечисленных элементарных стадий.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ МЕТОДЫ ИНТЕНСИФИКАЦИИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Основным фактором интенсификации процесса, проходящего во внешнедиффузионной области, является повышение турбулизации в зоне раздела фаз. Это достигается или повышением интенсивности перемешивания или увеличением линейной скорости движения жидкой или газовой фаз. Менее существенно повышение температуры, которая сказывается лишь на молекулярной составляющей диффузии. Следует учитывать, что с ростом температуры процесс еще более углубляется во внешнедиффузионную область, так как скорость химической реакции возрастает быстрее скорости молекулярной диффузии. Таким образом, несмотря на некоторое увеличение наблюдаемой скорости процесса с повышением Т, внешнедиффузионные торможения растут, и этот способ интенсификации не является рациональным. В системах Г — Ж с увеличением поверхности одновременно растет и коэффициент массопередачи и этот прием интенсификации является наиболее рациональным. При протекании процесса во внешнедиффузионной области движущей силой в уравнении скорости процесса является разность концентраций реагентов в потоке Сi 0 и на внешней поверхности Сi. F. При этом увеличение Сi 0 способствует увеличению наблюдаемой скорости процесса.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ МЕТОДЫ ИНТЕНСИФИКАЦИИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Основным фактором интенсификации процесса, проходящего во внешнедиффузионной области, является повышение турбулизации в зоне раздела фаз. Это достигается или повышением интенсивности перемешивания или увеличением линейной скорости движения жидкой или газовой фаз. Менее существенно повышение температуры, которая сказывается лишь на молекулярной составляющей диффузии. Следует учитывать, что с ростом температуры процесс еще более углубляется во внешнедиффузионную область, так как скорость химической реакции возрастает быстрее скорости молекулярной диффузии. Таким образом, несмотря на некоторое увеличение наблюдаемой скорости процесса с повышением Т, внешнедиффузионные торможения растут, и этот способ интенсификации не является рациональным. В системах Г — Ж с увеличением поверхности одновременно растет и коэффициент массопередачи и этот прием интенсификации является наиболее рациональным. При протекании процесса во внешнедиффузионной области движущей силой в уравнении скорости процесса является разность концентраций реагентов в потоке Сi 0 и на внешней поверхности Сi. F. При этом увеличение Сi 0 способствует увеличению наблюдаемой скорости процесса.
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ МЕТОДЫ ИНТЕНСИФИКАЦИИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Фактор снижения диффузионных торможений с уменьшением размера частиц твердой фазы является основным при интенсификации процессов, протекающих во внутридиффузионной области. Другой прием интенсификации — повышение давления Р. С ростом Р увеличивается движущая сила процесса диффузии. Приемы увеличения поверхности для систем Г — Ж, Г (Ж) — Т (непористое) при кинетической области протекания процесса принципиально не отличаются от описанных выше способов для внешнедиффузионной области. Повышение температуры — наиболее эффективный способ ускорения процесса в кинетической области – от этого зависит константа скорости реакции k. Для пористых твердых материалов для системы Г (Ж) — Т основным фактором развития внутренней поверхности является уменьшение диаметра пор при увеличении их числа. В отличии от диффузионных областей скорость процессов, протекающих в кинетической области, всегда прямо пропорциональна удельной поверхности материала. Отклонение от прямолинейной зависимости указывает на переход процесса во внутридиффузионную область
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ МЕТОДЫ ИНТЕНСИФИКАЦИИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ Фактор снижения диффузионных торможений с уменьшением размера частиц твердой фазы является основным при интенсификации процессов, протекающих во внутридиффузионной области. Другой прием интенсификации — повышение давления Р. С ростом Р увеличивается движущая сила процесса диффузии. Приемы увеличения поверхности для систем Г — Ж, Г (Ж) — Т (непористое) при кинетической области протекания процесса принципиально не отличаются от описанных выше способов для внешнедиффузионной области. Повышение температуры — наиболее эффективный способ ускорения процесса в кинетической области – от этого зависит константа скорости реакции k. Для пористых твердых материалов для системы Г (Ж) — Т основным фактором развития внутренней поверхности является уменьшение диаметра пор при увеличении их числа. В отличии от диффузионных областей скорость процессов, протекающих в кинетической области, всегда прямо пропорциональна удельной поверхности материала. Отклонение от прямолинейной зависимости указывает на переход процесса во внутридиффузионную область
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ Реакторы для процессов в системе Г - Т
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ Реакторы для процессов в системе Г - Т
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ Реакторы для процессов в системе Г - Ж
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ Реакторы для процессов в системе Г - Ж
 ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ


