05. Химические реакции. Скорость химической реакции.pptx
- Количество слайдов: 53
 Химические реакции. Скорость химической реакции
Химические реакции. Скорость химической реакции
 Одни Что такое химические связи химическая разрушаются, а образуются реакция? новые
Одни Что такое химические связи химическая разрушаются, а образуются реакция? новые
 Химические реакции внутри нас Химические реакции вокруг нас
Химические реакции внутри нас Химические реакции вокруг нас
 Признаки классификации химических реакций?
Признаки классификации химических реакций?
 Реакции соединения, По числу и составу разложения, замещения и исходных веществ и продуктов реакции обмена
Реакции соединения, По числу и составу разложения, замещения и исходных веществ и продуктов реакции обмена
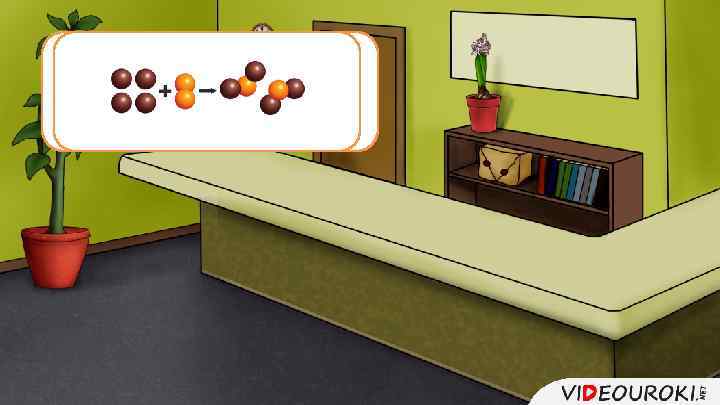 Это реакция Са. О + Н 2 O 2 = Са(ОН)2 2 Mg + О = 2 Mg. O горения
Это реакция Са. О + Н 2 O 2 = Са(ОН)2 2 Mg + О = 2 Mg. O горения
 2 Hg. O = 2 Hg O 2 Н 2 О = 2 Н 2 ++О 22
2 Hg. O = 2 Hg O 2 Н 2 О = 2 Н 2 ++О 22
 Cu Zn + H 2 SO= = Zn. SO)42 + H 2↑ + 2 Ag. NO 3 4 Cu(NO 3 + 2 Ag↓
Cu Zn + H 2 SO= = Zn. SO)42 + H 2↑ + 2 Ag. NO 3 4 Cu(NO 3 + 2 Ag↓
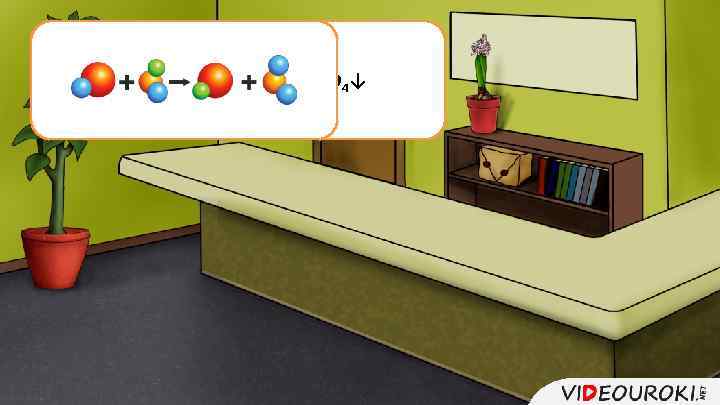 Na 2 SO 4 + Ba. Cl 2 = 2 Na. Cl + Ba. SO 4↓
Na 2 SO 4 + Ba. Cl 2 = 2 Na. Cl + Ba. SO 4↓
 Экзотермическая реакция Экзотермические и Эндотермическая реакция эндотермические+ O 2+–Q 2 Mg + O= = 2 Mg. O Q 2 Hg. O 2 2 Hg реакции
Экзотермическая реакция Экзотермические и Эндотермическая реакция эндотермические+ O 2+–Q 2 Mg + O= = 2 Mg. O Q 2 Hg. O 2 2 Hg реакции
 Необратимая Обратимая реакция Обратимые и реакция Образуется газ, осадок, Обратимые реакции необратимые слабый электролит 2 HCl. N реакции 2 NH 2↑ + H 2 O + K+CO 3 = ↔ + CO 2 KCl 2 2 3 H 2 3
Необратимая Обратимая реакция Обратимые и реакция Образуется газ, осадок, Обратимые реакции необратимые слабый электролит 2 HCl. N реакции 2 NH 2↑ + H 2 O + K+CO 3 = ↔ + CO 2 KCl 2 2 3 H 2 3
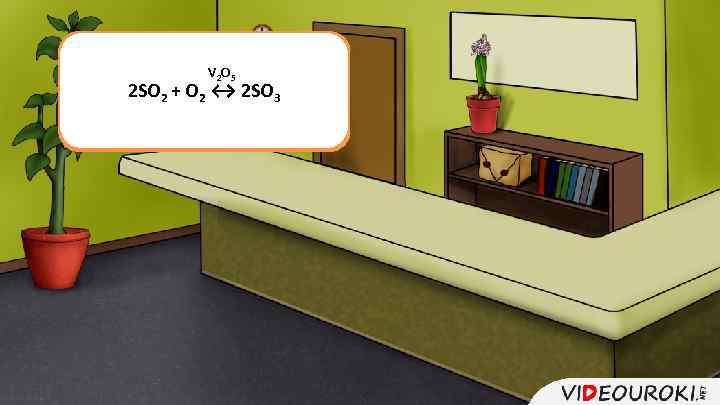 Каталитические и V 2 O 5 В каталитических реакциях 2 SO 2 + O 2 ↔ 2 SO 3 некаталитические участвует катализатор реакции
Каталитические и V 2 O 5 В каталитических реакциях 2 SO 2 + O 2 ↔ 2 SO 3 некаталитические участвует катализатор реакции
 Окислительно. Реакции без изменения восстановительные степени окисления
Окислительно. Реакции без изменения восстановительные степени окисления
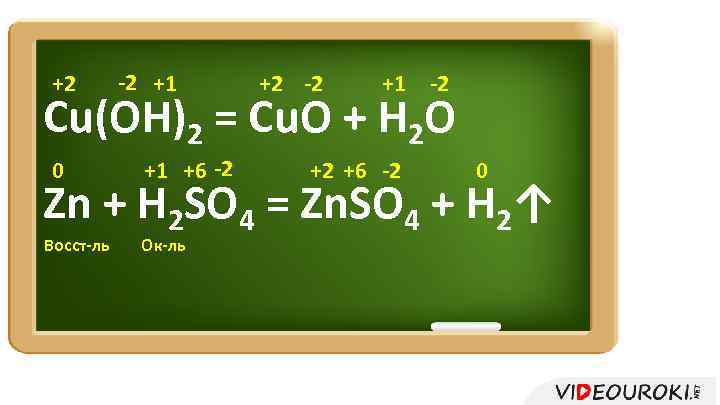 +2 -2 +1 -2 Cu(OH)2 = Cu. O + H 2 O 0 +1 +6 -2 +2 +6 -2 0 Zn + H 2 SO 4 = Zn. SO 4 + H 2↑ Восст-ль Ок-ль
+2 -2 +1 -2 Cu(OH)2 = Cu. O + H 2 O 0 +1 +6 -2 +2 +6 -2 0 Zn + H 2 SO 4 = Zn. SO 4 + H 2↑ Восст-ль Ок-ль
 Гомогенная реакция Гомогенные и гетерогенные HCl(р-р) + Na. OH(р-р) = Na. Cl(р-р) + H 2 O реакции Гетерогенная реакция S(тв. ) + O 2(г. ) = SO 2(г. )
Гомогенная реакция Гомогенные и гетерогенные HCl(р-р) + Na. OH(р-р) = Na. Cl(р-р) + H 2 O реакции Гетерогенная реакция S(тв. ) + O 2(г. ) = SO 2(г. )
 Cu. SO 4 + Fe = Fe. SO 4 + Cu↓
Cu. SO 4 + Fe = Fe. SO 4 + Cu↓
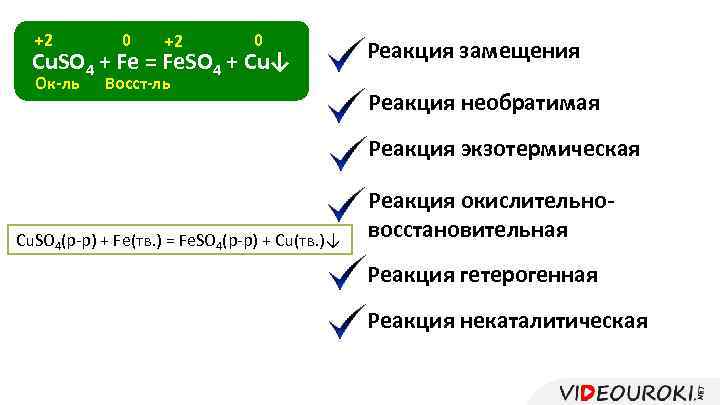 +2 0 Cu. SO 4 + Fe = Fe. SO 4 + Cu↓ Ок-ль Восст-ль Реакция замещения Реакция необратимая Реакция экзотермическая Cu. SO 4(р-р) + Fe(тв. ) = Fe. SO 4(р-р) + Cu(тв. )↓ Реакция окислительновосстановительная Реакция гетерогенная Реакция некаталитическая
+2 0 Cu. SO 4 + Fe = Fe. SO 4 + Cu↓ Ок-ль Восст-ль Реакция замещения Реакция необратимая Реакция экзотермическая Cu. SO 4(р-р) + Fe(тв. ) = Fe. SO 4(р-р) + Cu(тв. )↓ Реакция окислительновосстановительная Реакция гетерогенная Реакция некаталитическая
 Частицы должны столкнуться быть активными А+Б
Частицы должны столкнуться быть активными А+Б
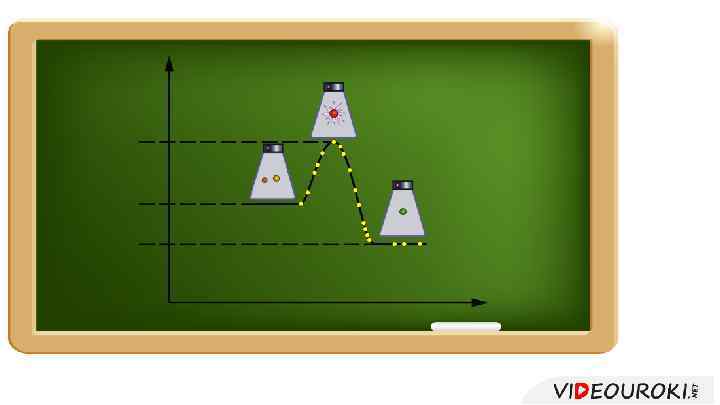
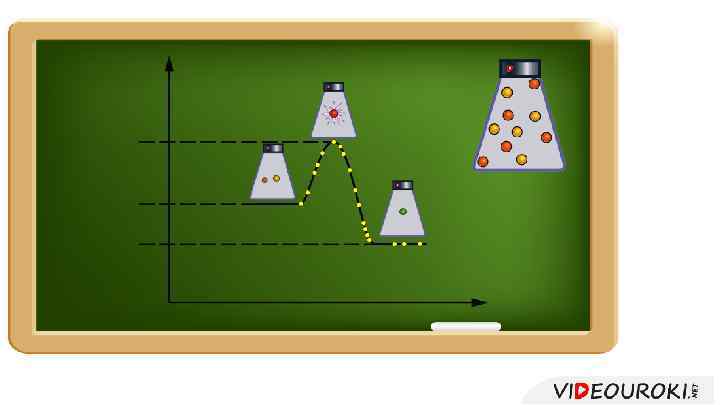
 Если энергия активации мала, то скорость реакции велика, то реакция будет большая протекать медленно
Если энергия активации мала, то скорость реакции велика, то реакция будет большая протекать медленно
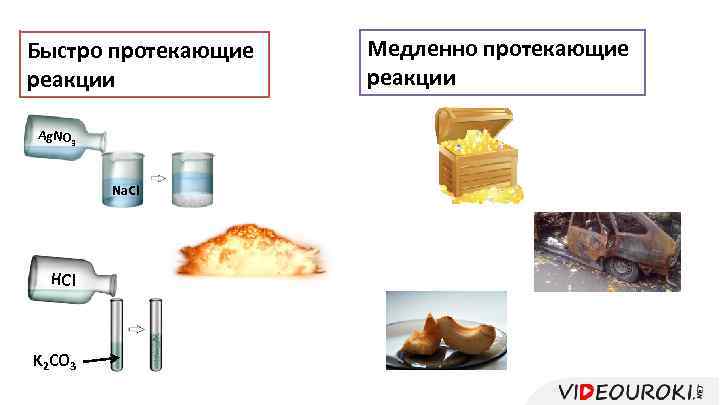 Быстро протекающие реакции Ag. NO 3 Na. Cl HCl K 2 CO 3 Медленно протекающие реакции
Быстро протекающие реакции Ag. NO 3 Na. Cl HCl K 2 CO 3 Медленно протекающие реакции


 Что такое скорость Скорость химической У каждой реакции своя реакции? реакции изучает кинетика скорость протекания
Что такое скорость Скорость химической У каждой реакции своя реакции? реакции изучает кинетика скорость протекания
 Прочитывал 200 страниц за полчаса
Прочитывал 200 страниц за полчаса
 Читал со скоростью две тысячи слов в минуту
Читал со скоростью две тысячи слов в минуту
 Выучивал иностранный язык за 6 -8 недель
Выучивал иностранный язык за 6 -8 недель
 Скорость 125 миль в час
Скорость 125 миль в час
 Скорость химической реакции: υ — скорость химической реакции (моль/ (л· с)) Δс – это изменение концентрации вещества; изменяется концентрация вещества.
Скорость химической реакции: υ — скорость химической реакции (моль/ (л· с)) Δс – это изменение концентрации вещества; изменяется концентрация вещества.
 От чего зависит скорость реакции? От природы реагирующих веществ
От чего зависит скорость реакции? От природы реагирующих веществ
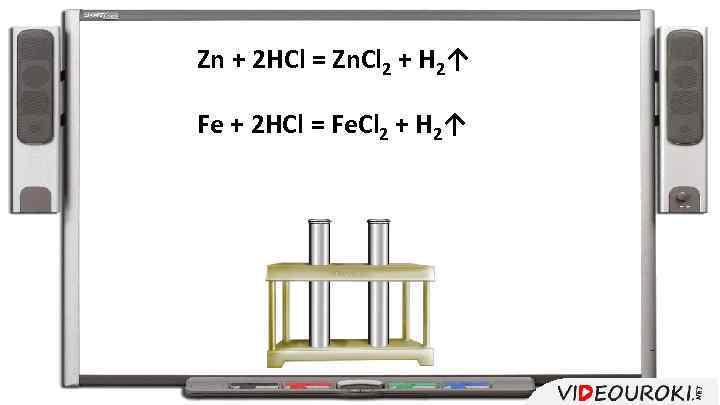 Zn + 2 HCl = Zn. Cl 2 + H 2↑ Fe + 2 HCl = Fe. Cl 2 + H 2↑
Zn + 2 HCl = Zn. Cl 2 + H 2↑ Fe + 2 HCl = Fe. Cl 2 + H 2↑
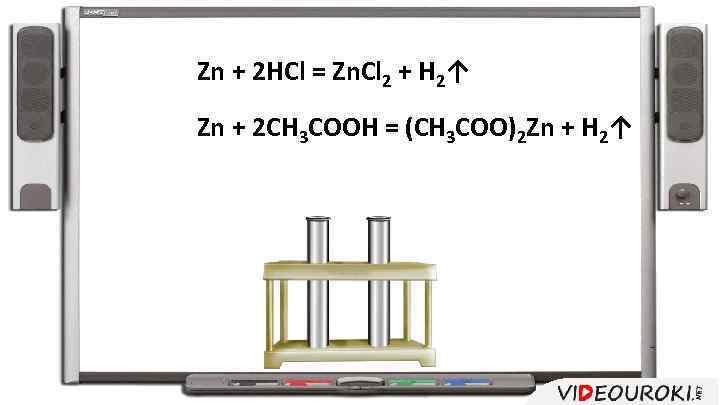 Zn + 2 HCl = Zn. Cl 2 + H 2↑ Zn + 2 CH 3 COOH = (CH 3 COO)2 Zn + H 2↑
Zn + 2 HCl = Zn. Cl 2 + H 2↑ Zn + 2 CH 3 COOH = (CH 3 COO)2 Zn + H 2↑
 От концентрации реагирующих веществ
От концентрации реагирующих веществ

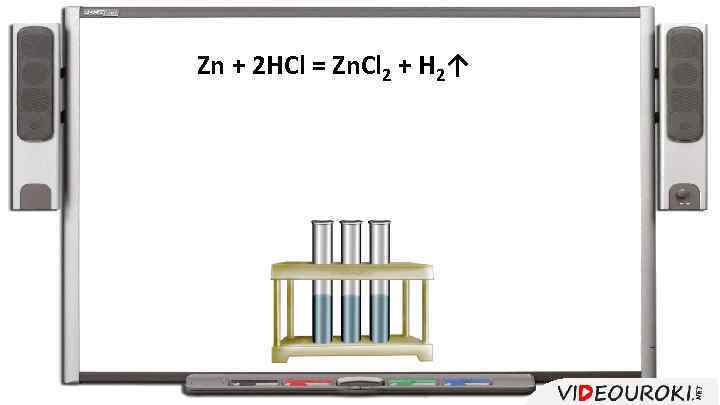 Zn + 2 HCl = Zn. Cl 2 + H 2↑
Zn + 2 HCl = Zn. Cl 2 + H 2↑
 Чем выше концентрация веществ, тем и больше скорость взаимодействия между ними
Чем выше концентрация веществ, тем и больше скорость взаимодействия между ними
 Скорость реакции зависит от площади соприкосновения реагирующих веществ
Скорость реакции зависит от площади соприкосновения реагирующих веществ
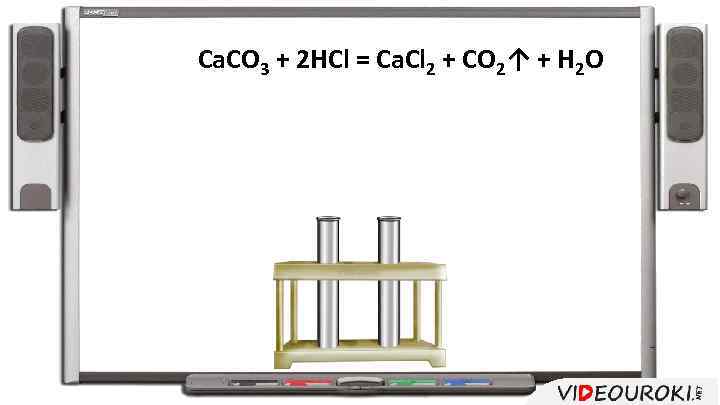 Ca. CO 3 + 2 HCl = Ca. Cl 2 + CO 2↑ + H 2 O
Ca. CO 3 + 2 HCl = Ca. Cl 2 + CO 2↑ + H 2 O
 Чем больше площадь соприкосновения реагирующих веществ, тем выше скорость реакции
Чем больше площадь соприкосновения реагирующих веществ, тем выше скорость реакции
 1 кг стружек 1 кг цельной древесины
1 кг стружек 1 кг цельной древесины

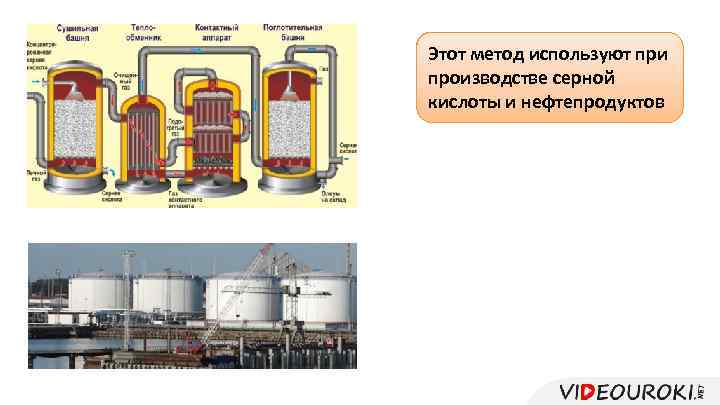 Измельчают твёрдое Этот Через него снизу при метод используют На производстве вещество до состояния пропускают второе производстве серной слой используют кипящий пыли кислотывещество и нефтепродуктов
Измельчают твёрдое Этот Через него снизу при метод используют На производстве вещество до состояния пропускают второе производстве серной слой используют кипящий пыли кислотывещество и нефтепродуктов
 Модель «кипящего слоя»
Модель «кипящего слоя»

 При. Скорость реакции повышении температуры В химическое взаимодействие Чем выше температура, тем количествотолько активные вступают активных частиц зависит от больше скорость реакции увеличивается частицы температуры
При. Скорость реакции повышении температуры В химическое взаимодействие Чем выше температура, тем количествотолько активные вступают активных частиц зависит от больше скорость реакции увеличивается частицы температуры
 Правило Вант-Гоффа: При повышении температуры на каждые 10 0 С скорость химической реакции возрастает в 2 -4 раза Эта величина называется температурным коэффициентом (ϒ).
Правило Вант-Гоффа: При повышении температуры на каждые 10 0 С скорость химической реакции возрастает в 2 -4 раза Эта величина называется температурным коэффициентом (ϒ).
 Высокотемпературные химические процессы
Высокотемпературные химические процессы
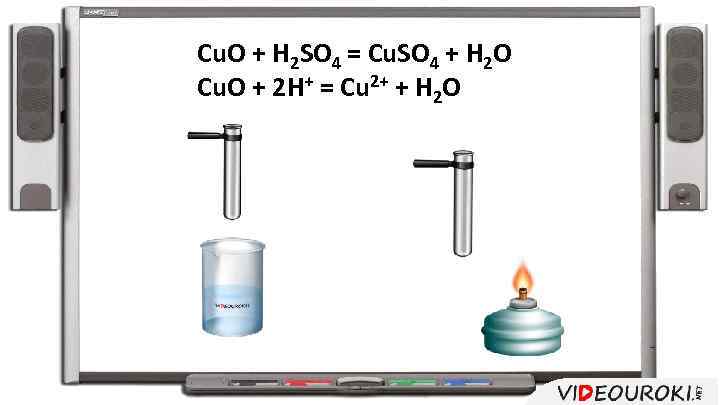 Cu. O + H 2 SO 4 = Cu. SO 4 + H 2 O Cu. O + 2 H+ = Cu 2+ + H 2 O
Cu. O + H 2 SO 4 = Cu. SO 4 + H 2 O Cu. O + 2 H+ = Cu 2+ + H 2 O
 Чем выше температура, тем больше скорость реакции
Чем выше температура, тем больше скорость реакции
 Скорость реакции зависит от наличия катализаторов
Скорость реакции зависит от наличия катализаторов
 Скорость реакции Чем выше давление, тем зависит от давления больше скорость реакции (для газов)
Скорость реакции Чем выше давление, тем зависит от давления больше скорость реакции (для газов)
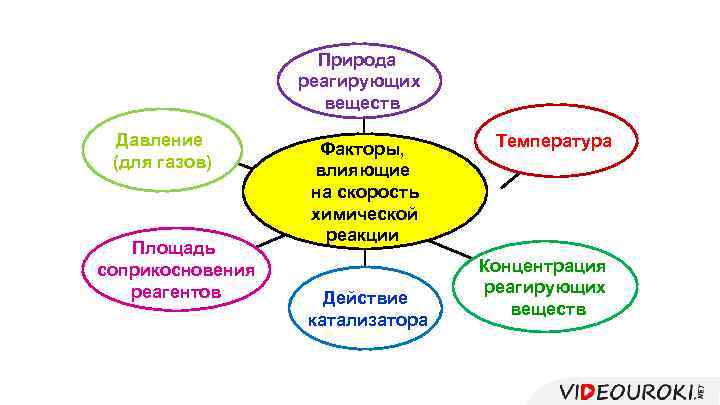 Природа реагирующих веществ Давление (для газов) Площадь соприкосновения реагентов Факторы, влияющие на скорость химической реакции Действие катализатора Температура Концентрация реагирующих веществ
Природа реагирующих веществ Давление (для газов) Площадь соприкосновения реагентов Факторы, влияющие на скорость химической реакции Действие катализатора Температура Концентрация реагирующих веществ


