2012-12Химические методы очистки сточных вод.ppt
- Количество слайдов: 17
 Химические методы очистки сточных вод К химическим методам очистки сточных вод относят • нейтрализацию, • окисление и восстановление • реагентные методы выделения загрязняющих веществ в виде малорастворимых и нерастворимых соединений.
Химические методы очистки сточных вод К химическим методам очистки сточных вод относят • нейтрализацию, • окисление и восстановление • реагентные методы выделения загрязняющих веществ в виде малорастворимых и нерастворимых соединений.
 Нейтрализация сточных вод Используют различные способы нейтрализации сточных вод: • взаимная нейтрализация смешением кислых и щелочных сточных вод, • реагентная нейтрализация • фильтрование кислых вод через нейтрализующие материалы, • абсорбцией кислых газов щелочными водами или абсорбцией аммиака кислыми водами. В процессе нейтрализации могут образовываться осадки, которые отфильтровываются.
Нейтрализация сточных вод Используют различные способы нейтрализации сточных вод: • взаимная нейтрализация смешением кислых и щелочных сточных вод, • реагентная нейтрализация • фильтрование кислых вод через нейтрализующие материалы, • абсорбцией кислых газов щелочными водами или абсорбцией аммиака кислыми водами. В процессе нейтрализации могут образовываться осадки, которые отфильтровываются.
 Нейтрализация смешением Взаимную нейтрализацию кислых и щелочных вод осуществляют путем их смешения в соответствующем соотношении, которое производят в устройстве, называемом нейтрализатор смешения. В нем происходит смешивание, чему способствует наличие мешалки или устройство барботирования воздуха.
Нейтрализация смешением Взаимную нейтрализацию кислых и щелочных вод осуществляют путем их смешения в соответствующем соотношении, которое производят в устройстве, называемом нейтрализатор смешения. В нем происходит смешивание, чему способствует наличие мешалки или устройство барботирования воздуха.
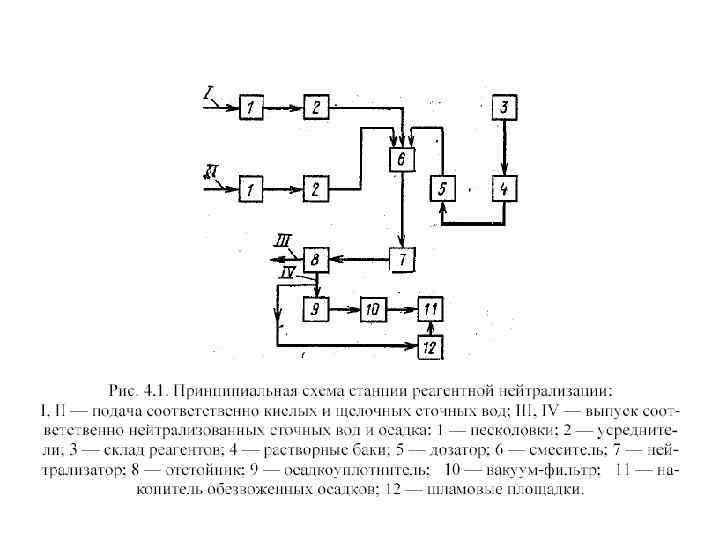
 Реагентная нейтрализация При реагентной нейтрализации для нейтрализации кислых вод могут быть использованы: Na. OH (каустическая сода), KOH, Ca(OH)2 (гашеная известь) , Na 2 CO 3 (кальцинированная сода), NH 4 OH (аммиачная вода), Ca. CO 3, Mg. CO 3, доломит (Ca. CO 3 Mg. CO 3), цемент. Наиболее доступным реагентом является гидроксид кальция (известковое молоко) с содержанием 5… 10% активной извести Ca(OH)2. Иногда для нейтрализации применяют отходы производства: шлаки металлургических производств. H 2 SO 4 + Ca(OH)2 →Ca. SO 4↓ + 2 H 2 O
Реагентная нейтрализация При реагентной нейтрализации для нейтрализации кислых вод могут быть использованы: Na. OH (каустическая сода), KOH, Ca(OH)2 (гашеная известь) , Na 2 CO 3 (кальцинированная сода), NH 4 OH (аммиачная вода), Ca. CO 3, Mg. CO 3, доломит (Ca. CO 3 Mg. CO 3), цемент. Наиболее доступным реагентом является гидроксид кальция (известковое молоко) с содержанием 5… 10% активной извести Ca(OH)2. Иногда для нейтрализации применяют отходы производства: шлаки металлургических производств. H 2 SO 4 + Ca(OH)2 →Ca. SO 4↓ + 2 H 2 O
 Нейтрализация щелочных сточных вод кислыми газами Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы, например, отходящие газы, содержащие CO 2, SO 2, N 2 O 3 и др. Применение кислых газов позволяет не только нейтрализовать сточные воды, но и одновременно производить очистку самих газов от вредных компонентов, что соответствует ресурсосберегающей технологии. Преимуществом этой схемы является также исключение использования жидких кислот, а также возможность создания бессточной схемы водопотребления. Процесс нейтрализации проводится в реакторах с мешалкой, в распылительных, пленочных и тарельчатых колоннах.
Нейтрализация щелочных сточных вод кислыми газами Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы, например, отходящие газы, содержащие CO 2, SO 2, N 2 O 3 и др. Применение кислых газов позволяет не только нейтрализовать сточные воды, но и одновременно производить очистку самих газов от вредных компонентов, что соответствует ресурсосберегающей технологии. Преимуществом этой схемы является также исключение использования жидких кислот, а также возможность создания бессточной схемы водопотребления. Процесс нейтрализации проводится в реакторах с мешалкой, в распылительных, пленочных и тарельчатых колоннах.
 Нейтрализация кислых сточных вод путем их фильтрования через нейтрализующие материалы Нейтрализация соляно- и азотнокислых, а также сернокислых сточных вод при концентрации серной кислоты не более 1, 5 г/л происходит на непрерывно действующих фильтрах. Нейтрализующие материалы: доломит, известняк, магнезит, мел, мрамор и др. Крупность фракций материала загрузки 3… 8 см; расчетная скорость фильтрования зависит от вида загрузочного материала, но не более 5 м/ч; продолжительность контакта не менее 10 мин. Высоту загрузки Н для сточных вод, содержащих HCI и HNO 3 принимают равной 1… 1, 5 м, а содержащих H 2 SO 4 — равной 1, 5… 2 м. Вода фильтруется сверху вниз или снизу вверх.
Нейтрализация кислых сточных вод путем их фильтрования через нейтрализующие материалы Нейтрализация соляно- и азотнокислых, а также сернокислых сточных вод при концентрации серной кислоты не более 1, 5 г/л происходит на непрерывно действующих фильтрах. Нейтрализующие материалы: доломит, известняк, магнезит, мел, мрамор и др. Крупность фракций материала загрузки 3… 8 см; расчетная скорость фильтрования зависит от вида загрузочного материала, но не более 5 м/ч; продолжительность контакта не менее 10 мин. Высоту загрузки Н для сточных вод, содержащих HCI и HNO 3 принимают равной 1… 1, 5 м, а содержащих H 2 SO 4 — равной 1, 5… 2 м. Вода фильтруется сверху вниз или снизу вверх.

 Очистка сточных вод окислением загрязнителей Для очистки сточных вод от цианидов, сероводорода, сульфидов и др. веществ используют следующие окислители; • газообразный и сжиженный хлор, • диоксид хлора, • хлорат кальция, • гипохлориты кальция и натрия, • перманганат калия, бихромат калия, • пероксид водорода, • кислород воздуха, озон и др.
Очистка сточных вод окислением загрязнителей Для очистки сточных вод от цианидов, сероводорода, сульфидов и др. веществ используют следующие окислители; • газообразный и сжиженный хлор, • диоксид хлора, • хлорат кальция, • гипохлориты кальция и натрия, • перманганат калия, бихромат калия, • пероксид водорода, • кислород воздуха, озон и др.
 В процессе окисления токсичные загрязнения, содержащиеся в сточных водах, в результате химических реакций переходят в менее токсичные, которые удаляют из воды. Активность вещества как окислителя определяется величиной окислительного потенциала. Первое место среди окислителей занимает фтор, который из-за высокой агрессивности не может быть использован на практике. Для других веществ величина окислительного потенциала равна: для озона – 2, 07; для хлора – 0, 94; для пероксида водорода - 0, 68; для перманганата калия – 0, 59.
В процессе окисления токсичные загрязнения, содержащиеся в сточных водах, в результате химических реакций переходят в менее токсичные, которые удаляют из воды. Активность вещества как окислителя определяется величиной окислительного потенциала. Первое место среди окислителей занимает фтор, который из-за высокой агрессивности не может быть использован на практике. Для других веществ величина окислительного потенциала равна: для озона – 2, 07; для хлора – 0, 94; для пероксида водорода - 0, 68; для перманганата калия – 0, 59.
 Окисление пероксидом водорода Пероксид водорода используется для окисления нитритов, альдегидов, фенолов, цианидов, серосодержащих отходов, активных красителей. Пероксид водорода в кислой и щелочной средах разлагается по следующим схемам: CN- + H 2 O 2 → CNO- +H 2 O Na. CN + 2 H 2 O →Na. CNO- + H 2 O В разбавленных растворах процесс окисления органических веществ протекает медленно, поэтому используют катализаторы – ионы металлов переменной валентности (Fe 2+ , Cr 2+ , Mn 2+, Co 2+, Cr 2+, Ag 2+). Окисление кислородом воздуха Кислород воздуха используют при очистке воды от железа. Реакция окисления в водном растворе протекает по схеме: 4 Fe 2+ + O 2 +10 H 2 O → 4 Fe(OH)3↓ + 8 H+ Пиролюзит является природным материалом, состоящим в основном из диоксида марганца. Его используют для окисления трехвалентного мышьяка в пятивалентный: H 3 As. O 3 + Mn. O 2 + H 2 SO 4 = H 3 As. O 4 + Mn. SO 4 + H 2 O
Окисление пероксидом водорода Пероксид водорода используется для окисления нитритов, альдегидов, фенолов, цианидов, серосодержащих отходов, активных красителей. Пероксид водорода в кислой и щелочной средах разлагается по следующим схемам: CN- + H 2 O 2 → CNO- +H 2 O Na. CN + 2 H 2 O →Na. CNO- + H 2 O В разбавленных растворах процесс окисления органических веществ протекает медленно, поэтому используют катализаторы – ионы металлов переменной валентности (Fe 2+ , Cr 2+ , Mn 2+, Co 2+, Cr 2+, Ag 2+). Окисление кислородом воздуха Кислород воздуха используют при очистке воды от железа. Реакция окисления в водном растворе протекает по схеме: 4 Fe 2+ + O 2 +10 H 2 O → 4 Fe(OH)3↓ + 8 H+ Пиролюзит является природным материалом, состоящим в основном из диоксида марганца. Его используют для окисления трехвалентного мышьяка в пятивалентный: H 3 As. O 3 + Mn. O 2 + H 2 SO 4 = H 3 As. O 4 + Mn. SO 4 + H 2 O
 Очистка сточных вод восстановлением Методы восстановительной очистки сточных вод применяют для удаления из сточных вод соединений ртути, хрома, мышьяка. В процессе очистки неорганические соединения ртути восстанавливают до металлической ртути, которую отделяют от воды отстаиванием, фильтрованием или флотацией. Для восстановления ртути и ее соединений применяют сульфид железа, боргидрид натрия, гидросульфит натрия, гидразин, железный порошок, сероводород, алюминиевую пудру. Наиболее распространенным способом удаления мышьяка из сточных вод является осаждение его в виде труднорастворимых соединений диоксидом серы.
Очистка сточных вод восстановлением Методы восстановительной очистки сточных вод применяют для удаления из сточных вод соединений ртути, хрома, мышьяка. В процессе очистки неорганические соединения ртути восстанавливают до металлической ртути, которую отделяют от воды отстаиванием, фильтрованием или флотацией. Для восстановления ртути и ее соединений применяют сульфид железа, боргидрид натрия, гидросульфит натрия, гидразин, железный порошок, сероводород, алюминиевую пудру. Наиболее распространенным способом удаления мышьяка из сточных вод является осаждение его в виде труднорастворимых соединений диоксидом серы.
 Метод очистки сточных вод от веществ, содержащих шестивалентный хром, основан на восстановлении его до трехвалентного с последующим осаждением в виде гидроксида в щелочной среде. В качестве восстановителей используют активированный уголь, сульфат железа, бисульфат натрия, гидросульфита натрия водород, диоксид серы, отходы органических веществ, пиритный огарок.
Метод очистки сточных вод от веществ, содержащих шестивалентный хром, основан на восстановлении его до трехвалентного с последующим осаждением в виде гидроксида в щелочной среде. В качестве восстановителей используют активированный уголь, сульфат железа, бисульфат натрия, гидросульфита натрия водород, диоксид серы, отходы органических веществ, пиритный огарок.
 Реагентные методы выделения загрязняющих веществ в виде нерастворимых или труднорастворимых примесей- химическое осаждение Очистка сточных вод от ионов тяжелых металлов Для удаления из сточных вод соединений ртути, хрома, кадмия, цинка, свинца, меди, никеля, мышьяка и других веществ наиболее распространены реагентные методы очистки, сущность которых заключается в переводе растворимых в воде веществ в нерастворимые и малорастворимые соединения при добавлении различных реагентов с последующим отделением их от воды в виде осадков.
Реагентные методы выделения загрязняющих веществ в виде нерастворимых или труднорастворимых примесей- химическое осаждение Очистка сточных вод от ионов тяжелых металлов Для удаления из сточных вод соединений ртути, хрома, кадмия, цинка, свинца, меди, никеля, мышьяка и других веществ наиболее распространены реагентные методы очистки, сущность которых заключается в переводе растворимых в воде веществ в нерастворимые и малорастворимые соединения при добавлении различных реагентов с последующим отделением их от воды в виде осадков.
 В качестве реагентов для удаления из сточных вод ионов тяжелых металлов используют гидроксиды кальция и натрия, карбонат натрия, сульфиды натрия, различные отходы. Наиболее широко используется гидроксид кальция. Осаждение металлов происходит в виде гидроксидов. При обработке кислых вод оксидом кальция и гидроксидом натрия ионы цинка, меди, никеля, свинца, кадмия, кобальта, содержащиеся в стоках, связываются в труднорастворимые соединения.
В качестве реагентов для удаления из сточных вод ионов тяжелых металлов используют гидроксиды кальция и натрия, карбонат натрия, сульфиды натрия, различные отходы. Наиболее широко используется гидроксид кальция. Осаждение металлов происходит в виде гидроксидов. При обработке кислых вод оксидом кальция и гидроксидом натрия ионы цинка, меди, никеля, свинца, кадмия, кобальта, содержащиеся в стоках, связываются в труднорастворимые соединения.
 ПРИМЕРЫ: Образование гидроксидов: Ме 2+ + 2 ОН- →Ме(ОН)2↓ Ме 3+ + 3 ОН- →Ме(ОН)3↓ Образование карбонатов: Ni 2+ + CO 32 - →Ni. Co 3↓ Pb 2+ + CO 32 - →Pb. Co 3↓ Образование гидроксид-карбонатов: 2 Cu 2+ + 2 OH- + CO 32 - → (Cu. OH)2 Co 3↓ 2 Ni 2+ + 2 OH- + CO 32 - → (Ni. OH)2 Co 3↓ 2 Pb 2+ + + 2 OH + CO 32 - → (Pb. OH)2 Co 3↓ Образование сульфидов: Ме 2+ + S 2 - →Ме. S 2↓ (Mn. S, Fe. S, Co. S, Ni. S, Sn. S)
ПРИМЕРЫ: Образование гидроксидов: Ме 2+ + 2 ОН- →Ме(ОН)2↓ Ме 3+ + 3 ОН- →Ме(ОН)3↓ Образование карбонатов: Ni 2+ + CO 32 - →Ni. Co 3↓ Pb 2+ + CO 32 - →Pb. Co 3↓ Образование гидроксид-карбонатов: 2 Cu 2+ + 2 OH- + CO 32 - → (Cu. OH)2 Co 3↓ 2 Ni 2+ + 2 OH- + CO 32 - → (Ni. OH)2 Co 3↓ 2 Pb 2+ + + 2 OH + CO 32 - → (Pb. OH)2 Co 3↓ Образование сульфидов: Ме 2+ + S 2 - →Ме. S 2↓ (Mn. S, Fe. S, Co. S, Ni. S, Sn. S)



