Свойства минералов.ppt
- Количество слайдов: 48
 Химические и физические свойства минералов
Химические и физические свойства минералов
 Свойства минералов Химические свойства Образование химических связей n Изоморфизм n Физические свойства Оптические (цвет, цвет черты, блеск) n Механические (спайность, твердость, плотность) n
Свойства минералов Химические свойства Образование химических связей n Изоморфизм n Физические свойства Оптические (цвет, цвет черты, блеск) n Механические (спайность, твердость, плотность) n
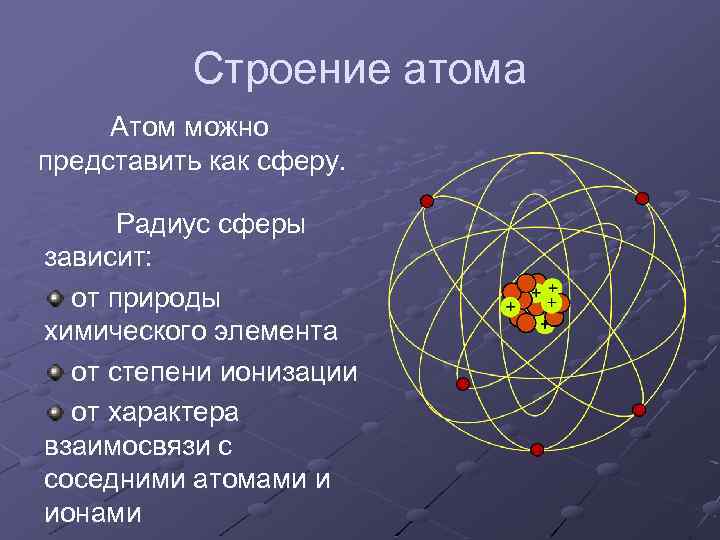 Строение атома Атом можно представить как сферу. Радиус сферы зависит: от природы химического элемента от степени ионизации от характера взаимосвязи с соседними атомами и ионами
Строение атома Атом можно представить как сферу. Радиус сферы зависит: от природы химического элемента от степени ионизации от характера взаимосвязи с соседними атомами и ионами
 Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения. Типы химических связей Металлическая связь Ковалентная связь Ионная связь Ван-дер-Ваальсова связь
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения. Типы химических связей Металлическая связь Ковалентная связь Ионная связь Ван-дер-Ваальсова связь
 Металлическая связь Металлическая структура кристалла рассматривается как упаковка положительно заряженных атомов, а отделившиеся от них электроны, рассеяны в пространстве между атомами и подвижны. Свойства: высокая электропроводность, теплопроводность Примеры: самородные металлы, некоторые сульфиды и арсениды
Металлическая связь Металлическая структура кристалла рассматривается как упаковка положительно заряженных атомов, а отделившиеся от них электроны, рассеяны в пространстве между атомами и подвижны. Свойства: высокая электропроводность, теплопроводность Примеры: самородные металлы, некоторые сульфиды и арсениды
 Ковалентная связь Обобществление двумя атомами двух или более электронов своих внешних оболочек Свойства: неэлектропроводны; нерастворимы в воде Примеры: алмаз, инертные газы
Ковалентная связь Обобществление двумя атомами двух или более электронов своих внешних оболочек Свойства: неэлектропроводны; нерастворимы в воде Примеры: алмаз, инертные газы
 Ионная связь Является следствием электростатического притяжения между противоположно заряженными ионами. Сила связи зависит от изменения межатомных расстояний Свойства: неэлектропроводны Примеры: большинство неорганических соединений
Ионная связь Является следствием электростатического притяжения между противоположно заряженными ионами. Сила связи зависит от изменения межатомных расстояний Свойства: неэлектропроводны Примеры: большинство неорганических соединений
 Ван-дер-Ваальсовы связи Возникают в результате электрического дисбаланса, связанного со смещением положительного заряда ядра из центра отрицательного поля окружающей это ядро электронной оболочки. Свойства: низкая твердость малая прочность легкоплавкость Примеры: самородная сера
Ван-дер-Ваальсовы связи Возникают в результате электрического дисбаланса, связанного со смещением положительного заряда ядра из центра отрицательного поля окружающей это ядро электронной оболочки. Свойства: низкая твердость малая прочность легкоплавкость Примеры: самородная сера
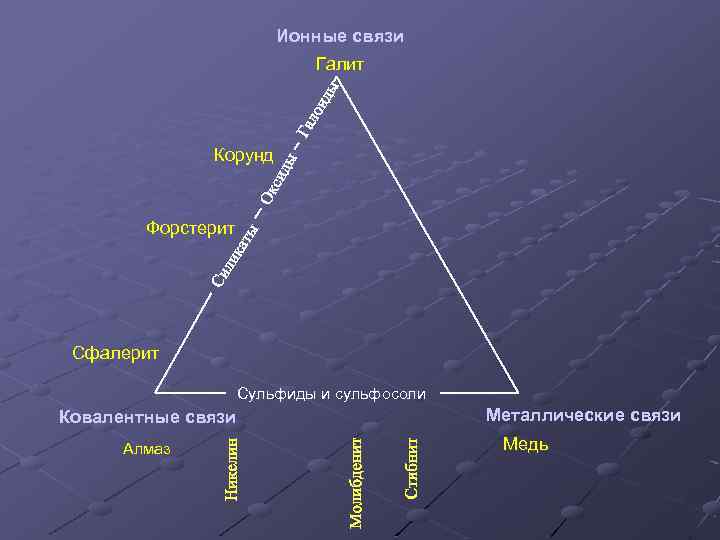 Ионные связи Галит Корунд Форстерит Сфалерит Сульфиды и сульфосоли Ковалентные связи Алмаз Металлические связи Медь
Ионные связи Галит Корунд Форстерит Сфалерит Сульфиды и сульфосоли Ковалентные связи Алмаз Металлические связи Медь
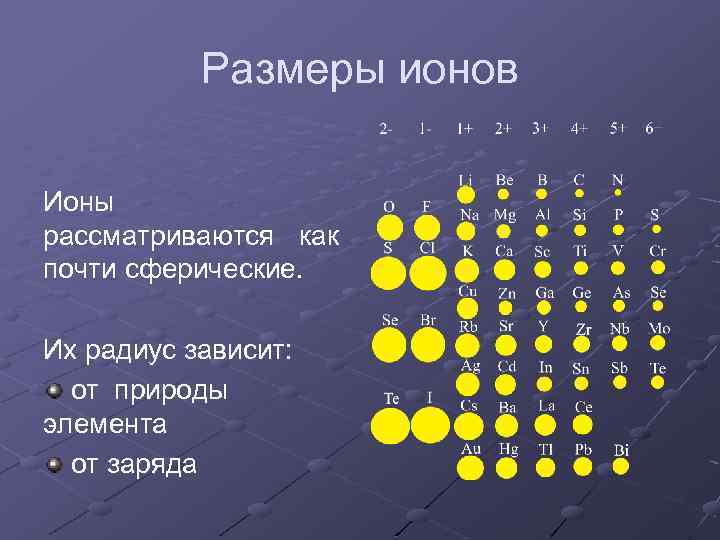 Размеры ионов Ионы рассматриваются как почти сферические. Их радиус зависит: от природы элемента от заряда
Размеры ионов Ионы рассматриваются как почти сферические. Их радиус зависит: от природы элемента от заряда
 Принцип плотнейшей упаковки Кубическая плотнейшая упаковка
Принцип плотнейшей упаковки Кубическая плотнейшая упаковка
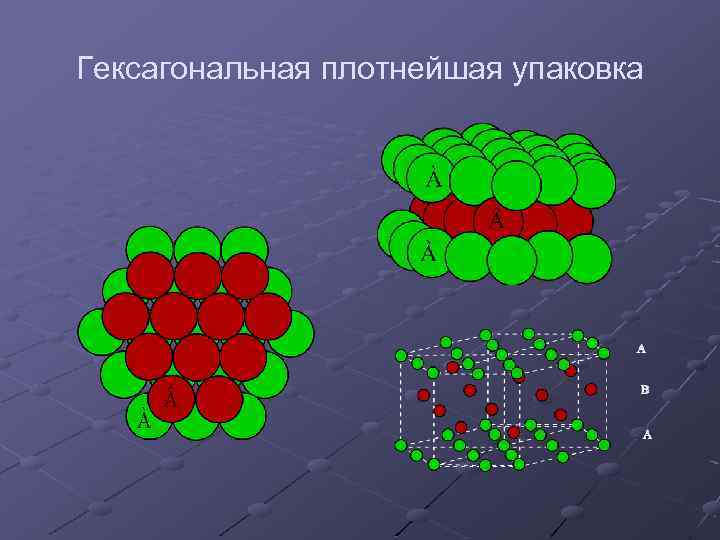 Гексагональная плотнейшая упаковка
Гексагональная плотнейшая упаковка
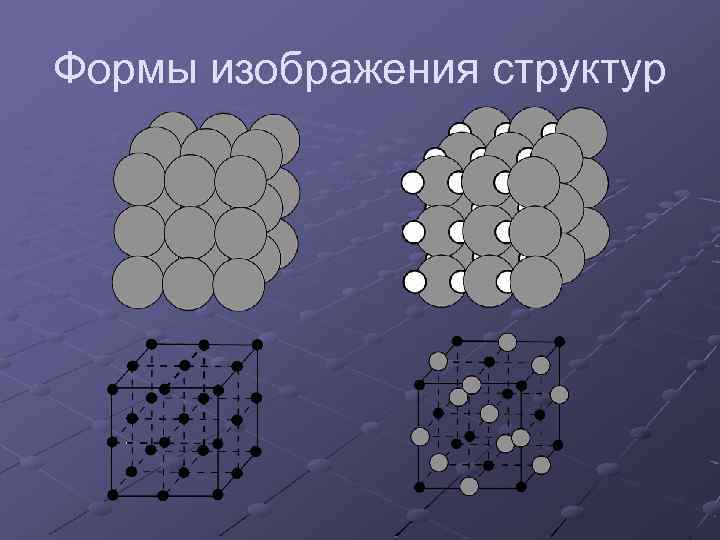 Формы изображения структур
Формы изображения структур
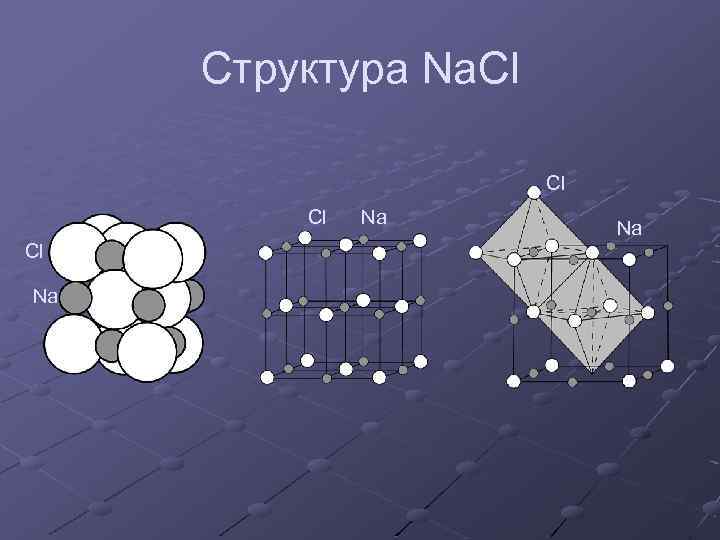 Структура Na. Cl Cl Na Na Na
Структура Na. Cl Cl Na Na Na
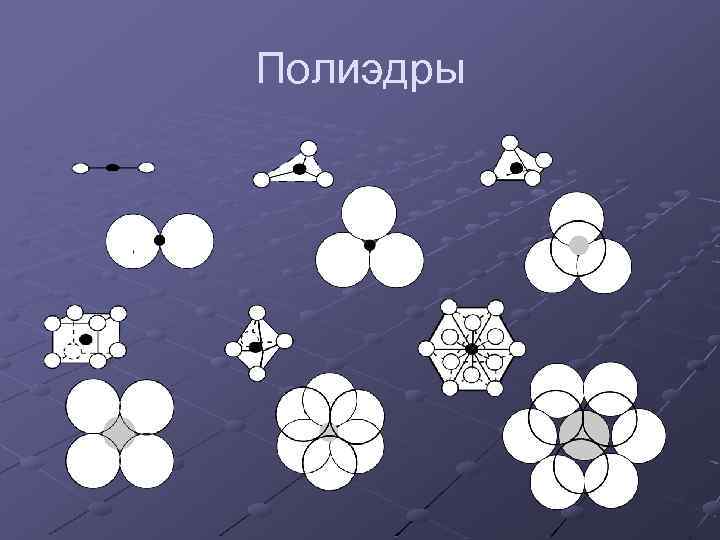 Полиэдры
Полиэдры
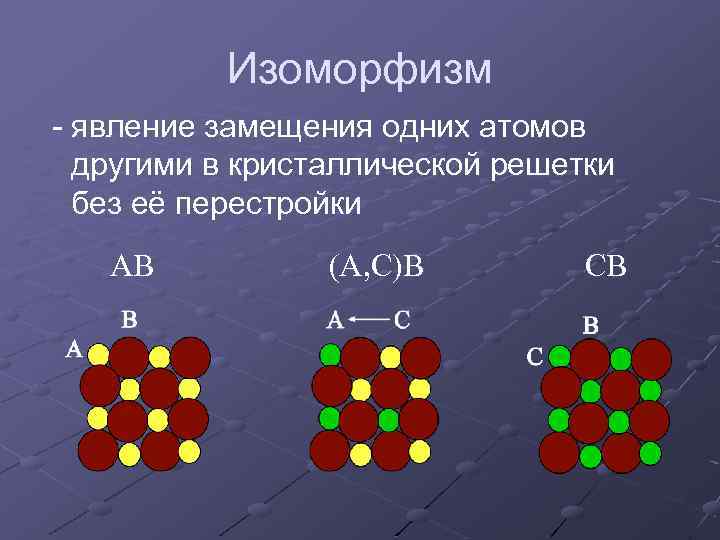 Изоморфизм - явление замещения одних атомов другими в кристаллической решетки без её перестройки АВ (А, С)В СВ
Изоморфизм - явление замещения одних атомов другими в кристаллической решетки без её перестройки АВ (А, С)В СВ
 Условия изоморфизма Сохранение электронейтральности кристаллической решетки Близость радиусов ионов, участвующих в замещении (разница не более 15 %) Сходство в строении электронных оболочек ионов, участвующих в замещении
Условия изоморфизма Сохранение электронейтральности кристаллической решетки Близость радиусов ионов, участвующих в замещении (разница не более 15 %) Сходство в строении электронных оболочек ионов, участвующих в замещении
 Типы изоморфизма по числу атомов, участвующих в замещении по способам компенсации валентности по положению изоморфных примесей в структуре по полноте замещения одного атома другим
Типы изоморфизма по числу атомов, участвующих в замещении по способам компенсации валентности по положению изоморфных примесей в структуре по полноте замещения одного атома другим
 По числу участвующих атомов Двуатомный Оливин (Mg, Fe)2 Si. O 4 Форстерит Mg 2 Si. O 4 Фаялит Fe 2 Si. O 4 Mg 2+ Fe 2+ Многоатомный Диопсид (Ca, Mg)Si 2 O 6 – Эгирин (Na, Fe)Si 2 O 6 Ca 2+ + Mg 2+ Na+ + Fe 3+
По числу участвующих атомов Двуатомный Оливин (Mg, Fe)2 Si. O 4 Форстерит Mg 2 Si. O 4 Фаялит Fe 2 Si. O 4 Mg 2+ Fe 2+ Многоатомный Диопсид (Ca, Mg)Si 2 O 6 – Эгирин (Na, Fe)Si 2 O 6 Ca 2+ + Mg 2+ Na+ + Fe 3+
 По способу компенсации валентности Изовалентный Сфалерит Zn. S Zn 2+ Fe 2+ Корунд Al 2 O 3 Al 3+ Cr 3+ Гетеровалентный 1) с сохранением числа атомов 2) с уменьшением числа атомов Пирротин Fe. S 3 Fe 2+ 2 Fe 3+ + 3) с увеличением числа атомов Кварц Si. O 2 Si 4+ Fe 3+ + Na+ аметист
По способу компенсации валентности Изовалентный Сфалерит Zn. S Zn 2+ Fe 2+ Корунд Al 2 O 3 Al 3+ Cr 3+ Гетеровалентный 1) с сохранением числа атомов 2) с уменьшением числа атомов Пирротин Fe. S 3 Fe 2+ 2 Fe 3+ + 3) с увеличением числа атомов Кварц Si. O 2 Si 4+ Fe 3+ + Na+ аметист
 По положению изоморфных примесей Твердые растворы замещения Оливин; Сфалерит Твердые растворы вычитания Пирротин Твердые растворы внедрения Кварц (аметист)
По положению изоморфных примесей Твердые растворы замещения Оливин; Сфалерит Твердые растворы вычитания Пирротин Твердые растворы внедрения Кварц (аметист)
 По полноте возможных замещений Неограниченный (совершенный) Оливин, диопсид-эгирин Ограниченный (несовершенный) Сфалерит Весьма ограниченный Корунд
По полноте возможных замещений Неограниченный (совершенный) Оливин, диопсид-эгирин Ограниченный (несовершенный) Сфалерит Весьма ограниченный Корунд
 Оптические свойства Цвет Черта Блеск
Оптические свойства Цвет Черта Блеск
 Цвет минерала Собственная окраска Чужеродная окраска Ложная окраска
Цвет минерала Собственная окраска Чужеродная окраска Ложная окраска
 Собственная окраска возникает под действием фотонов света, проходящего через кристалл Причины возникновения идиохроматической окраски 1. 2. 3. Окраска переноса заряда Наличие элементов-хромофоров Наличие электронно-дырочных центров
Собственная окраска возникает под действием фотонов света, проходящего через кристалл Причины возникновения идиохроматической окраски 1. 2. 3. Окраска переноса заряда Наличие элементов-хромофоров Наличие электронно-дырочных центров
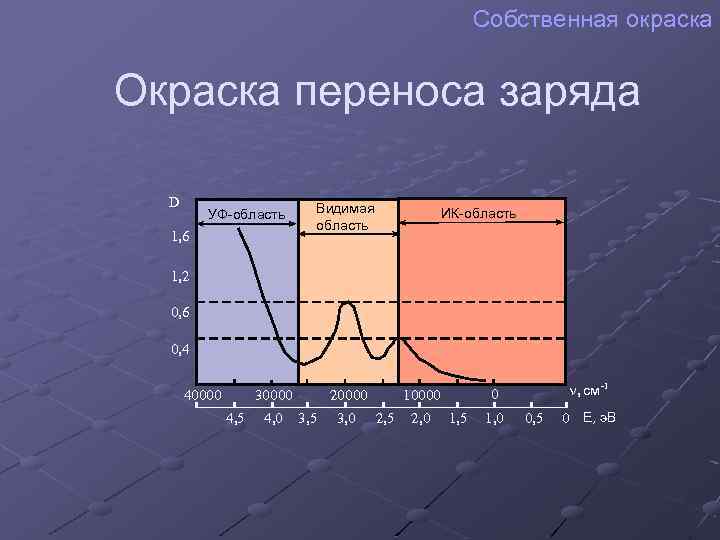 Собственная окраска Окраска переноса заряда D УФ-область 1, 6 Видимая область ИК-область 1, 2 0, 6 0, 4 40000 30000 4, 5 4, 0 20000 3, 5 3, 0 2, 5 2, 0 n, см -1 0 10000 1, 5 1, 0 0, 5 0 Е, э. В
Собственная окраска Окраска переноса заряда D УФ-область 1, 6 Видимая область ИК-область 1, 2 0, 6 0, 4 40000 30000 4, 5 4, 0 20000 3, 5 3, 0 2, 5 2, 0 n, см -1 0 10000 1, 5 1, 0 0, 5 0 Е, э. В
 Собственная окраска Окраска переноса заряда Eперех у/ф и/к l у/ф и/к Eперех у/ф и/к l l
Собственная окраска Окраска переноса заряда Eперех у/ф и/к l у/ф и/к Eперех у/ф и/к l l
 Собственная окраска D Стибнит Реальгар Окраска переноса заряда Аурипигмент Флогопит Рубин Стибнит Изумруд Азурит Аурипигмент Малахит 333 400 500 666 30 000 25 000 20 000 15 000 10 000 Видимая область Кальцит
Собственная окраска D Стибнит Реальгар Окраска переноса заряда Аурипигмент Флогопит Рубин Стибнит Изумруд Азурит Аурипигмент Малахит 333 400 500 666 30 000 25 000 20 000 15 000 10 000 Видимая область Кальцит
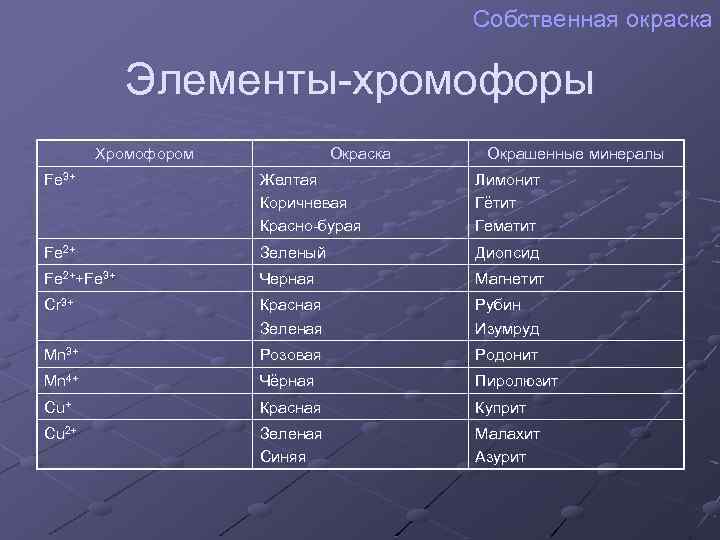 Собственная окраска Элементы-хромофоры Хромофором Окраска Окрашенные минералы Fe 3+ Желтая Коричневая Красно-бурая Лимонит Гётит Гематит Fe 2+ Зеленый Диопсид Fe 2++Fe 3+ Черная Магнетит Cr 3+ Красная Зеленая Рубин Изумруд Mn 3+ Розовая Родонит Mn 4+ Чёрная Пиролюзит Cu+ Красная Куприт Cu 2+ Зеленая Синяя Малахит Азурит
Собственная окраска Элементы-хромофоры Хромофором Окраска Окрашенные минералы Fe 3+ Желтая Коричневая Красно-бурая Лимонит Гётит Гематит Fe 2+ Зеленый Диопсид Fe 2++Fe 3+ Черная Магнетит Cr 3+ Красная Зеленая Рубин Изумруд Mn 3+ Розовая Родонит Mn 4+ Чёрная Пиролюзит Cu+ Красная Куприт Cu 2+ Зеленая Синяя Малахит Азурит
 Собственная окраска Элементы-хромофоры Железо Лимонит Диопсид Fe 3+ Fe 2++Fe 3+ Магнетит Гётит
Собственная окраска Элементы-хромофоры Железо Лимонит Диопсид Fe 3+ Fe 2++Fe 3+ Магнетит Гётит
 Собственная окраска Элементы-хромофоры Хром Cr 3+ Берилл Be 3 Al 2(Si 6 O 18) (не более 3 %) Al 3+ Cr 3+ Корунд Al 2 O 3 (не более 3 %) Al 3+ Изумруд Cr 3+ Рубин
Собственная окраска Элементы-хромофоры Хром Cr 3+ Берилл Be 3 Al 2(Si 6 O 18) (не более 3 %) Al 3+ Cr 3+ Корунд Al 2 O 3 (не более 3 %) Al 3+ Изумруд Cr 3+ Рубин
 Собственная окраска Элементы-хромофоры Cu 2+ Cu+ Малахит Cu 2(CO 3)(OH)2 Куприт Cu 2 O Азурит Cu 3(CO 3)2(OH)2
Собственная окраска Элементы-хромофоры Cu 2+ Cu+ Малахит Cu 2(CO 3)(OH)2 Куприт Cu 2 O Азурит Cu 3(CO 3)2(OH)2
 Собственная окраска Электронно-дырочные центры Межузельные «лишние» ионы в структуре минерала Кварц Si. O 2 Si 4+ Al 3++Na+ Морион Аметист – фиолетовый кварц Si 4+ Fe 3++Na+ Аметист Морион - черный кварц
Собственная окраска Электронно-дырочные центры Межузельные «лишние» ионы в структуре минерала Кварц Si. O 2 Si 4+ Al 3++Na+ Морион Аметист – фиолетовый кварц Si 4+ Fe 3++Na+ Аметист Морион - черный кварц
 Собственная окраска Электронно-дырочные центры Наличие вакансий в структуре минерала Сидерит Fe. CO 3 3 Fe 2+ Сидерит 2 Fe 3++
Собственная окраска Электронно-дырочные центры Наличие вакансий в структуре минерала Сидерит Fe. CO 3 3 Fe 2+ Сидерит 2 Fe 3++
 Собственная окраска Энергохроматическая окраска Возникает при перезарядке ионов в атомы Na+ + Cl- Na 0 + Cl 0 Голубая окраска галита (Na. Cl) Галит
Собственная окраска Энергохроматическая окраска Возникает при перезарядке ионов в атомы Na+ + Cl- Na 0 + Cl 0 Голубая окраска галита (Na. Cl) Галит
 Чужеродная окраска Вызвана механическими примесями в минерале (включения другого минерала, органических частиц, пузырьки газов) Микроклин, окрашенный примесью гематита
Чужеродная окраска Вызвана механическими примесями в минерале (включения другого минерала, органических частиц, пузырьки газов) Микроклин, окрашенный примесью гематита
 Ложная окраска Обусловлена оптическими явлениями – интерференцией и дифракцией света. Побежалость Иризация Опалесценция
Ложная окраска Обусловлена оптическими явлениями – интерференцией и дифракцией света. Побежалость Иризация Опалесценция
 Псевдохроматическая окраска Побежалость Обусловлена появлением на поверхности непрозрачных минералов тончайшей пленки вторичных минералов. При отражении света от верхней и нижней границы плёнки возникает интерференция, проявляющейся в радужной окраске минерала. Плёнка Cu. Fe. S 2 Халькопирит
Псевдохроматическая окраска Побежалость Обусловлена появлением на поверхности непрозрачных минералов тончайшей пленки вторичных минералов. При отражении света от верхней и нижней границы плёнки возникает интерференция, проявляющейся в радужной окраске минерала. Плёнка Cu. Fe. S 2 Халькопирит
 Псевдохроматическая окраска Иризация - радужная окраска просвечивающих минералов. Связана с наличием в минералах тонкочешуйчатых пластинок, различных по составу и оптическим свойствам. Плагиоклазы Твердый раствор альбита (Ab) и анортита (An) Na(Al. Si 3 O 8) Ca(Al 2 Si 2 O 8)
Псевдохроматическая окраска Иризация - радужная окраска просвечивающих минералов. Связана с наличием в минералах тонкочешуйчатых пластинок, различных по составу и оптическим свойствам. Плагиоклазы Твердый раствор альбита (Ab) и анортита (An) Na(Al. Si 3 O 8) Ca(Al 2 Si 2 O 8)
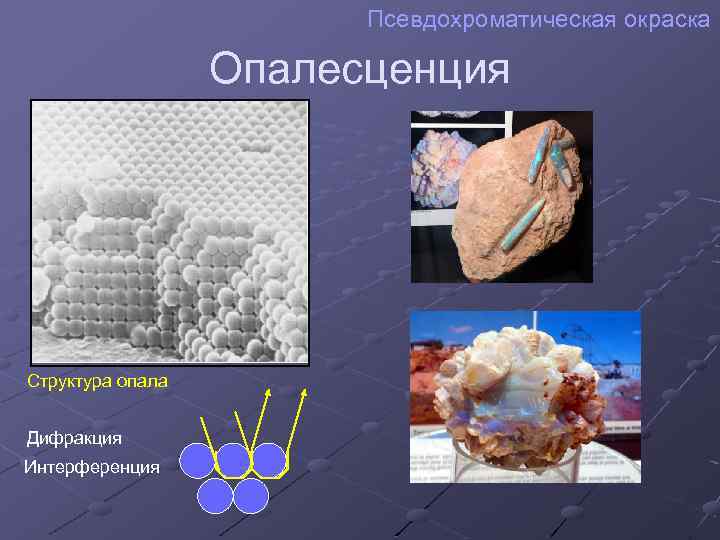 Псевдохроматическая окраска Опалесценция Структура опала Дифракция Интерференция
Псевдохроматическая окраска Опалесценция Структура опала Дифракция Интерференция
 Цвет черты - цвет минерала в порошке. Является более устойчивой характеристикой окраски минерала
Цвет черты - цвет минерала в порошке. Является более устойчивой характеристикой окраски минерала
 Блеск Металлический (самородные металлы; сульфиды) Стеклянный (кварц, кальцит) Алмазный (алмаз; сфалерит)
Блеск Металлический (самородные металлы; сульфиды) Стеклянный (кварц, кальцит) Алмазный (алмаз; сфалерит)
 Псевдоблеск Зависит от типа минерального агрегата Жирный (нефелин) Шелковистый (гипс; хризотил) Матовый (каолин)
Псевдоблеск Зависит от типа минерального агрегата Жирный (нефелин) Шелковистый (гипс; хризотил) Матовый (каолин)
 Спайность - способность минерала раскалываться параллельно определенным кристаллографическим направлениям По степени совершенства выделяют: 1. 2. 3. 4. 5. Весьма совершенная (слюды) Совершенная (кальцит, галенит) Средняя (диопсид, полевой шпат) Несовершенная (кварц) Весьма несовершенная (пирит)
Спайность - способность минерала раскалываться параллельно определенным кристаллографическим направлениям По степени совершенства выделяют: 1. 2. 3. 4. 5. Весьма совершенная (слюды) Совершенная (кальцит, галенит) Средняя (диопсид, полевой шпат) Несовершенная (кварц) Весьма несовершенная (пирит)
 Спайность Число направлений спайности зависит от кристаллографической формы, параллельно граням которой проходят плоскости спайности
Спайность Число направлений спайности зависит от кристаллографической формы, параллельно граням которой проходят плоскости спайности
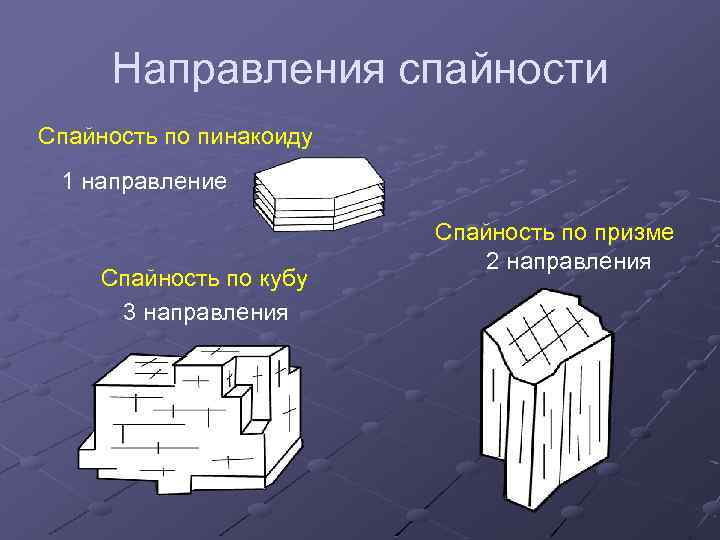 Направления спайности Спайность по пинакоиду 1 направление Спайность по кубу 3 направления Спайность по призме 2 направления
Направления спайности Спайность по пинакоиду 1 направление Спайность по кубу 3 направления Спайность по призме 2 направления
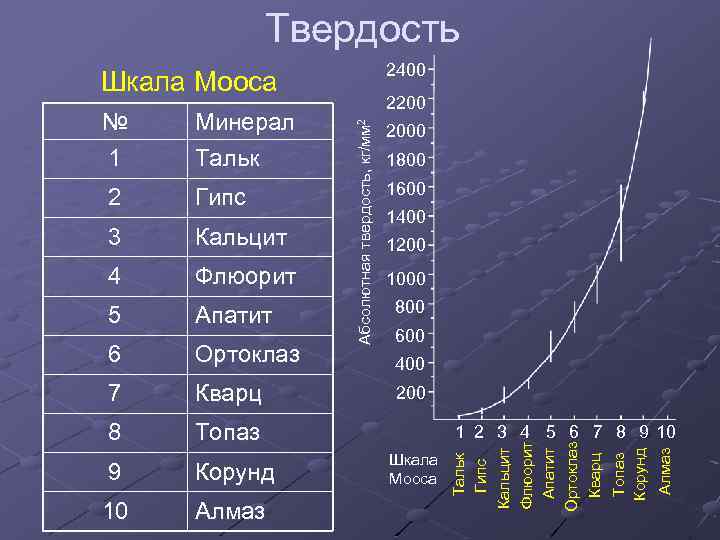 Твердость 2400 Шкала Мооса 3 Кальцит 4 Флюорит 5 Апатит 6 Ортоклаз 7 Кварц 8 Топаз 9 Корунд 10 Алмаз 1600 1400 1200 1000 800 600 400 200 1 2 3 4 5 6 7 8 9 10 Шкала Мооса Алмаз Гипс 1800 Топаз Корунд 2 2000 Тальк Гипс Кальцит Флюорит Апатит Ортоклаз Кварц Минерал Тальк Абсолютная твердость, кг/мм 2 № 1 2200
Твердость 2400 Шкала Мооса 3 Кальцит 4 Флюорит 5 Апатит 6 Ортоклаз 7 Кварц 8 Топаз 9 Корунд 10 Алмаз 1600 1400 1200 1000 800 600 400 200 1 2 3 4 5 6 7 8 9 10 Шкала Мооса Алмаз Гипс 1800 Топаз Корунд 2 2000 Тальк Гипс Кальцит Флюорит Апатит Ортоклаз Кварц Минерал Тальк Абсолютная твердость, кг/мм 2 № 1 2200
 Плотность минералов Низкая Нерудные минералы < 2 г/см 3 сильвин Средняя 2 – 4 г/см 3 кварц, кальцит Высокая 4 – 6 г/см 3 барит Очень высокая > 6 г/см 3 пироморфит Рудные минералы < 4 г/см 3 марматит 4 – 6 г/см 3 молибденит 6 – 10 г/см 3 медь > 10 г/см 3 платина
Плотность минералов Низкая Нерудные минералы < 2 г/см 3 сильвин Средняя 2 – 4 г/см 3 кварц, кальцит Высокая 4 – 6 г/см 3 барит Очень высокая > 6 г/см 3 пироморфит Рудные минералы < 4 г/см 3 марматит 4 – 6 г/см 3 молибденит 6 – 10 г/см 3 медь > 10 г/см 3 платина


