Введение. Сульфирование.pptx
- Количество слайдов: 66

Химическая технология органических веществ

Литература: Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза. М. : Химия, 1988. 589 с Лисицын В. Н. Химия и технология промежуточных продуктов. Учебник для вузов. М. : Химия, 1987. 368 с. Горелик М. В. , Эфрос Л. С. Основы химии и технологии ароматических соединений. М. : Химия, 1992. 640 с. Теддер Дж. , Нехватал А. , Джуб А. Промышленная органическая химия. М: Мир, 1977. Тимофеев В. С. , Серафимов Л. А. Принципы технологии основного органического и нефтехимического синтеза. М. : Высшая школа, 2003, 536 с. Чекалин М. А. . Пассет Б. В. , Иоффе Б. А. Технология органических красителей и промежуточных продуктов. Л. : Химия, 1980. 472 с. Пассет Б. В. , Воробьева В. Я. Технология химико-фармацевтических препаратов и антибиотиков. М. : Медицина, 1977. 430 с. Мокрушин В. С. , Вавилов Г. А. Основы химии и технологии биоорганических и синтетических лекарственных веществ. Учебное пособие. СПб. : Проспект Науки, 2009. 496 с. 2

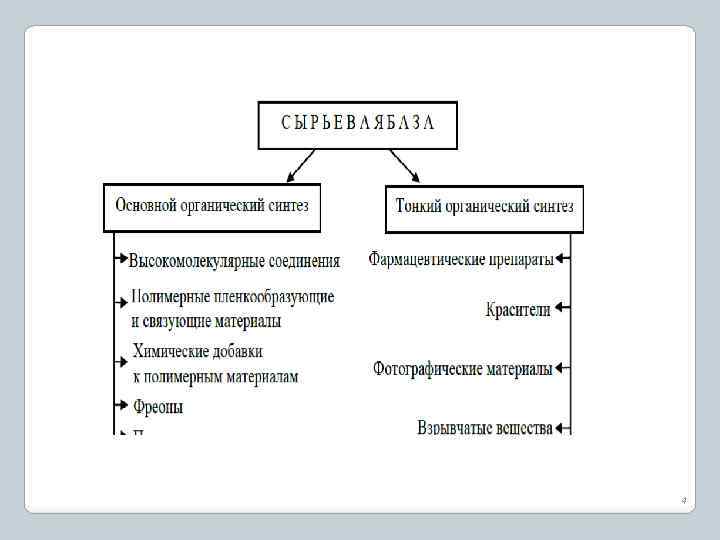
v Основной органический синтез – совокупность производств органических веществ относительно простого строения, вырабатываемых в очень больших количествах и используемых как в качестве целевых продуктов, так и полупродуктов в других отраслях органического синтеза. В качестве полупродуктов используются простейшие представители гомологических рядов углеводородов, спиртов, альдегидов, кетонов, органических кислот и т. д. v Тонкий органический синтез – совокупность производств органических веществ сложного строения, вырабатываемых в относительно небольших количествах и используемых преимущественно в качестве целевых конечных продуктов. К ним относятся лекарственные вещества, красители, фото- и кинореактивы, взрывчатые вещества, косметические препараты, душистые вещества и т. п. 3
4

Сырьевая база производств органического синтеза • Структура сырьевой базы: нефть и продукты ее переработки, продукты коксо химического производства, природный и попутный газ, лесохимическое и сельскохозяйственное сырье. • Методы переработки сырья и извлечения исходных ароматических соединений. [Лебедев, Лисицын, Мокрушин]

Уголь • Кокс (75 -80%) • Коксовый газ (15 -20%) • Жидкие продукты (4 -5%) Нефть • Парафины • Олефины • Ароматические углеводороды Газ Сырьевая база органического • Низшие парафины синтеза • Олефины

ПРОДУКТЫ КОКСОХИМИЧЕСКОГО ПРОИЗВОДСТВА Сырой бензол (легкое масло, Ткип< 200 ОС): бензол, толуол, ксилолы, сольвент (этилбензол, этилтолуолы, мезитилен, инден, кумарон, стирол и др. ), фенол, крезолы, пиридин, 2 , 3 , 4 метилпиридины (пиколины), диметилпиридины (лутидины) 7

Продукты переработки нефти (нефтеоргсинтез) В нефти различают углеводородную часть углеводороды: парафиновые, парафино-нафтеновые, парафино-нафтено-ароматические, ароматические неуглеводородную часть кислородные соединения: фенолы, нафтеновые кислоты, гетероциклы; азотистые: производные пиридина и хинолина, амины; сернистые: тиофен, тиоспирты и тиоэфиры 8
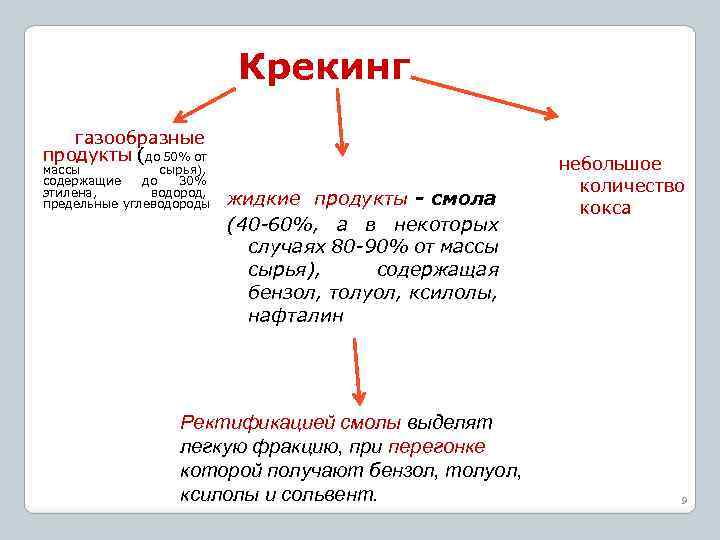
Крекинг газообразные продукты (до 50% от массы сырья), содержащие до 30% этилена, водород, предельные углеводороды жидкие продукты - смола (40 -60%, а в некоторых случаях 80 -90% от массы сырья), содержащая бензол, толуол, ксилолы, нафталин Ректификацией смолы выделят легкую фракцию, при перегонке которой получают бензол, толуол, ксилолы и сольвент. небольшое количество кокса 9
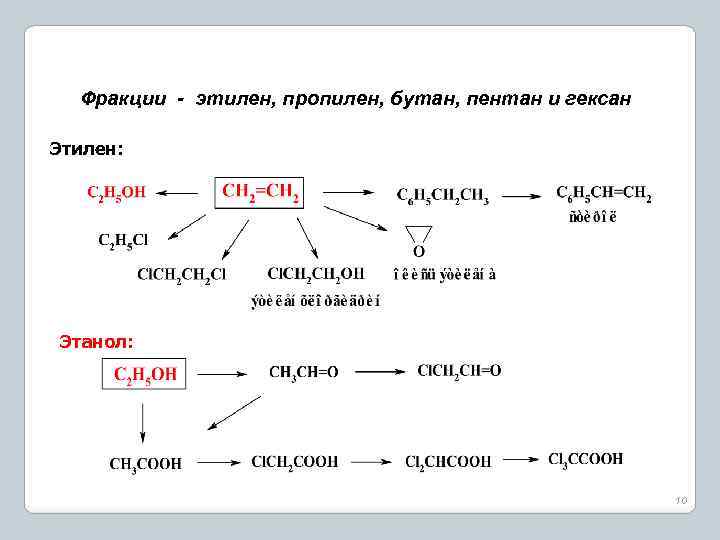
Фракции - этилен, пропилен, бутан, пентан и гексан Этилен: Этанол: 10
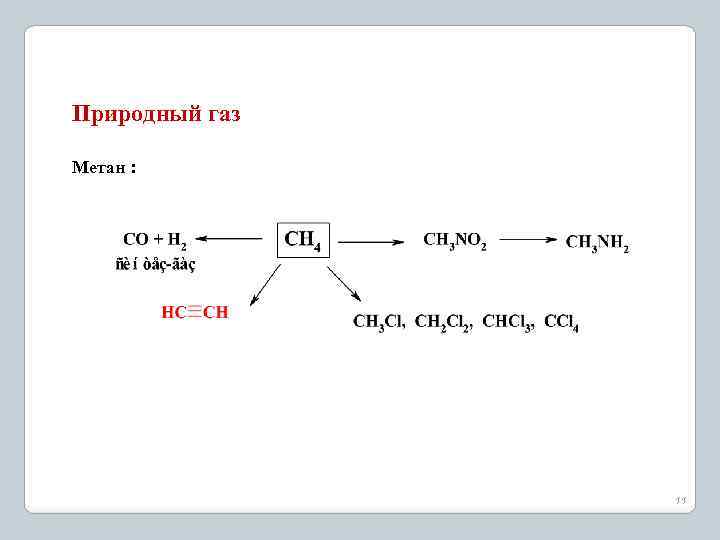
Природный газ Метан : 11

Синтез-газ Каталитическая конверсия метана Окислительная конверсия метана
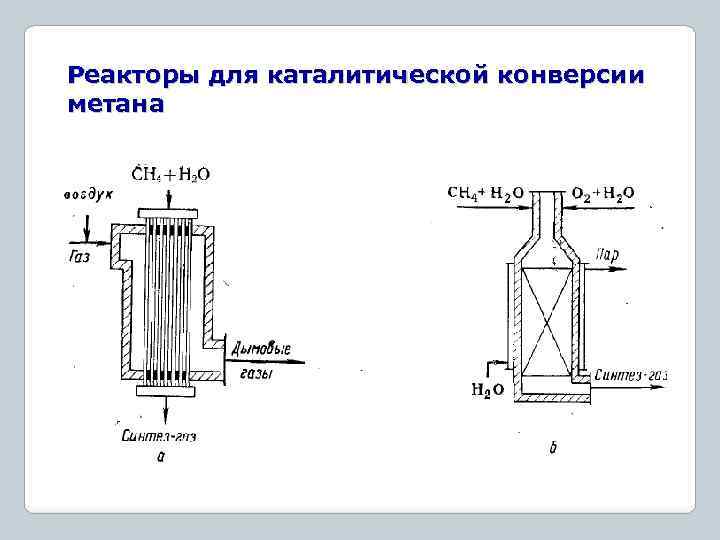
Реакторы для каталитической конверсии метана
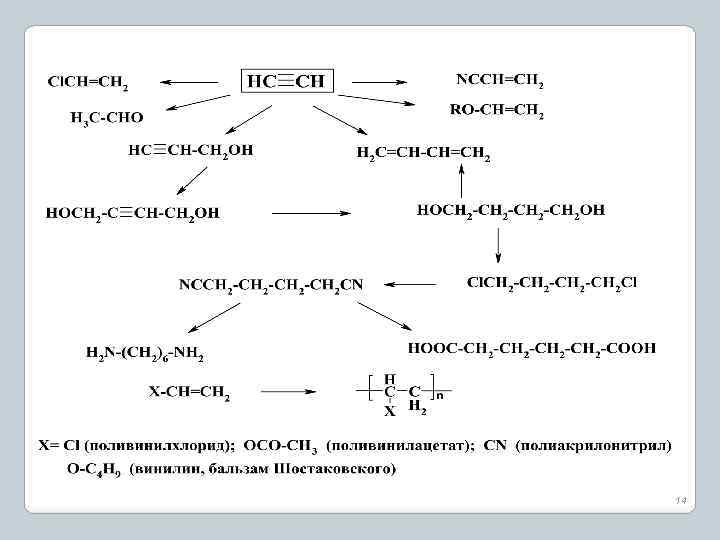
14

ХИМИЧЕСКАЯ ПЕРЕРАБОТКА ДРЕВЕСИНЫ Сухая перегонка Производство целлюлозы Выделение природных продуктов сахаристые вещества (пентозы, гексозы, ванилин), смолы, терпены, скипидар, канифоль, талловое масло, дубильные вещества, эфирные масла 15
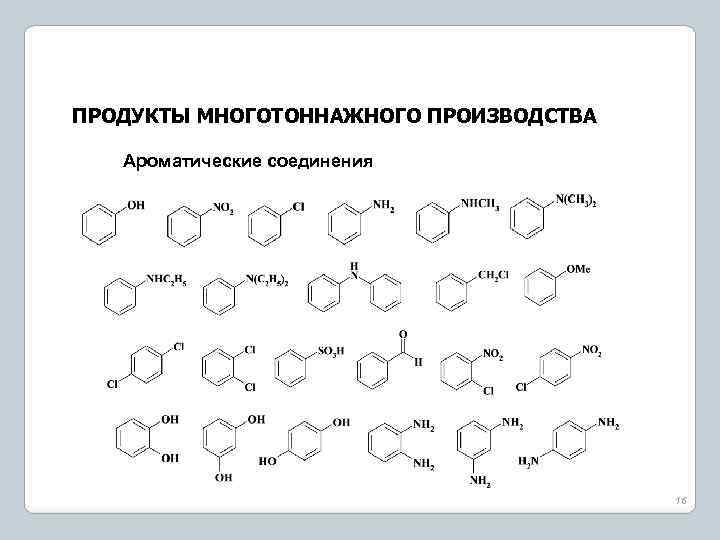
ПРОДУКТЫ МНОГОТОННАЖНОГО ПРОИЗВОДСТВА Ароматические соединения 16
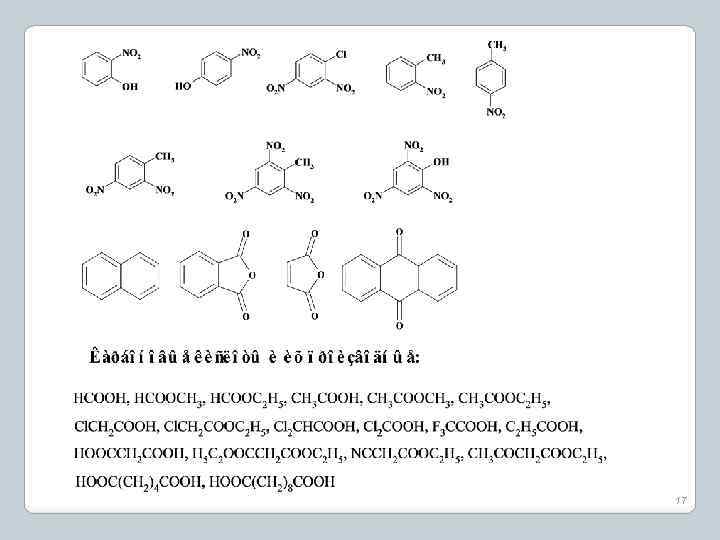
17
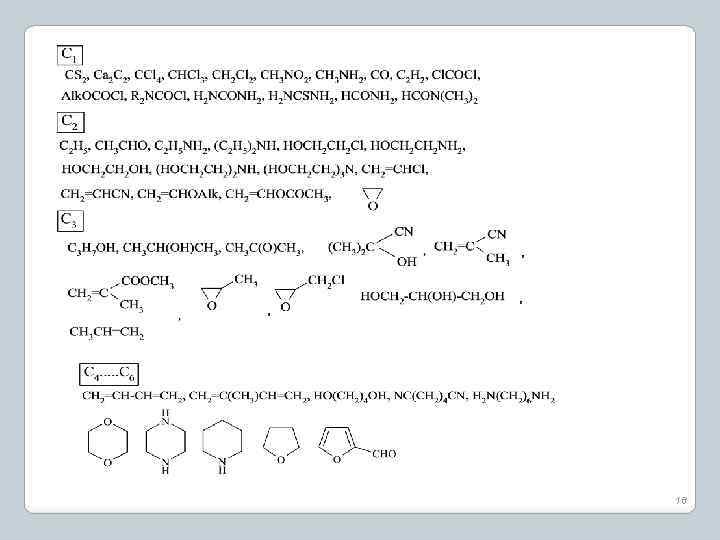
18

Классификация химических реакций, механизмы и кинетика, применение в промышленном органическом синтезе

Наиболее важными реакциями в промышленном синтезе органических полупродуктов являются следующие: 1)сульфирование и сульфохлорирование; 2)нитрование и нитрозирование; 3)галогенирование; 4)восстановление и окисление; 5) оксилирование и аминирование; 6) диазотирование (и превращение диазосоединений) ; 7) алкилирование и ацилирование аминов, спиртов и фенолов; 8)алкилирование, алкоксилирование и ацилирование атома углерода, в частности, в ядре; 9) реакции конденсации (циклоконденсация, гетероциклизация). 20

Реакции замещения в ароматическом ряду. Протеканию химической реакции замещения предшествует образование электрофильной или нуклеофильной атакующей частицы: 21

Электрофильное замещение (SE ) 22
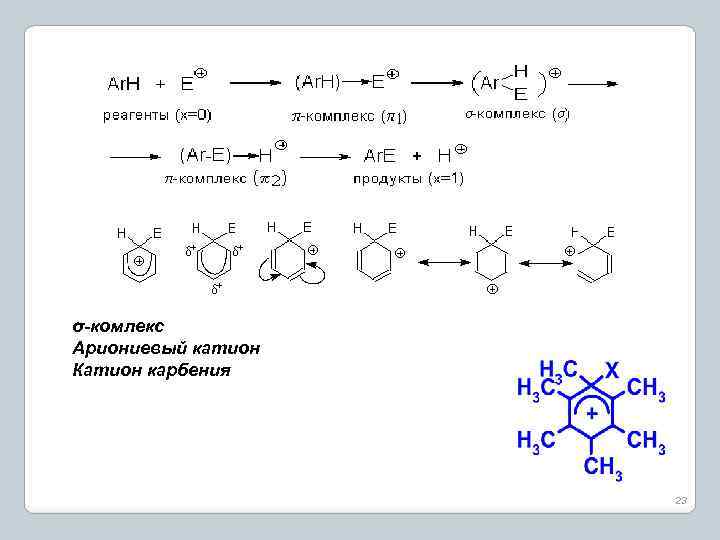
σ-комлекс Ариониевый катион Катион карбения 23
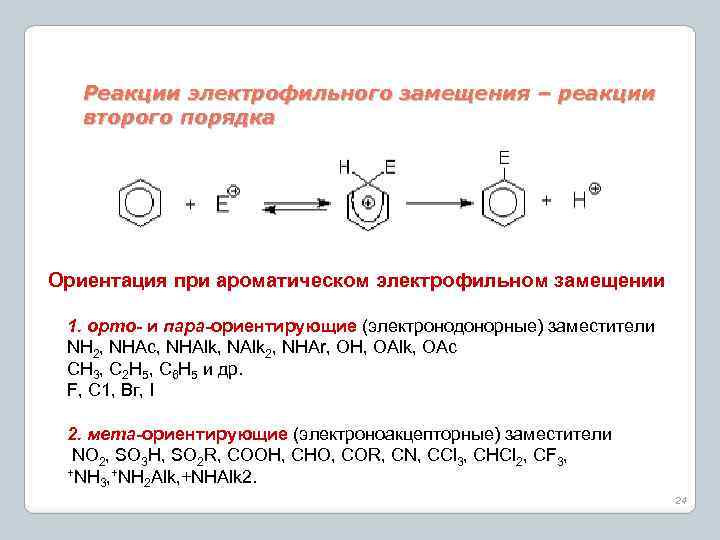
Реакции электрофильного замещения – реакции второго порядка Ориентация при ароматическом электрофильном замещении 1. орто- и пара-ориентирующие (электронодонорные) заместители NH 2, NHAc, NHAlk, NAlk 2, NHAr, OH, OAlk, OAc СН 3, С 2 Н 5, С 6 Н 5 и др. F, C 1, Вг, I 2. мета-ориентирующие (электроноакцепторные) заместители NO 2, SO 3 H, SO 2 R, COOH, CHO, COR, CN, CCl 3, CHCl 2, CF 3, +NH Alk, +NHAlk 2. 3 2 24

Индукционный и мезомерный эффекты заместителей Введение какого-либо заместителя в ароматическое кольцо приводит к перераспределению электронной плотности в результате индуктивного (I-эффекта) и мезомерного эффекта (эффекта сопряжения, M-эффекта). +I -эффект проявляют группы СН 3, C 2 H 5, СН(СНз)2, С(СН 3)з, О–I -эффект — OR, +OR 2, =O, NR 2, +NR 3, =NR, F, Cl, Br, I, C 6 H 5. 25

+М -эффект уменьшается при увеличении электроотрицательности атома, несущего неподеленную пару электронов, вследствие снижения его тенденции отдавать эту пару электро нов, например: С > N > О > F, а также при увеличении объема такого атома, например: F > С 1 > Вг >I. -М -эффект проявляют такие группы, как СО, NO 2, SO 2 и т. п. , которые могут расширить или перегруппировать свою октетную электронную оболочку. Это возможно для тех атомов и групп, которые содер жаткратные связи и у которых формально один π электрон может из связанного состояния перейти в свободное р состояние. При этом –М эффект возрастает с увеличением электроотрицательности 26 атома – акцептора

27

Нуклеофильное замещение (SN ) 28

В зависимости от заместителей, которые находятся у атома углерода, связанного с нуклеофугной группой, а также и от растворителя, реакции могут идти по механизму - асинхронного (SN 1) синхронного замещения (SN 2). Асинхронный механизм реакций (SN 1) процесс диссоциации 29

Синхронный (бимолекулярный) механизм реакций. (SN 2) Механизм «присоединения — отщепления» , широко принятый для реакций ароматического нуклеофильного замещения, экспериментально подтверждается образованием промежуточ ных комплексов — продуктов присоединения нуклеофильного агента, так называемых комплексов Майзенхаймера, проявлением основного катализа, эффекта заместителя в молекуле субстрата, природы реагента. В соответствии с рассмотренным механизмом взаимодействие 2, 4, 6 тринитрофенетола с метоксид анионом протекает с промежуточным образованием σ комплекса: 30

Радикальное замещение (SR) 31

4. Сульфирование ароматических соединений

Сульфирующие агенты. Факторы, определяющие расход сульфореагента 1. Концентрированная серная кислота - 92 -94% H 2 SO 4 (купоросное масло) 2. Моногидрат - 98 -100% H 2 SO 4 3. Жидкий олеум : 6 -25% свободного SO 3 (H 2 S 2 O 7), 60 -65% свободного SO 3 (H 2 S 2 O 7); 4. Хлорсульфоновая кислота – HOSO 2 Cl; 5. Бисульфиты и сульфиты. 33
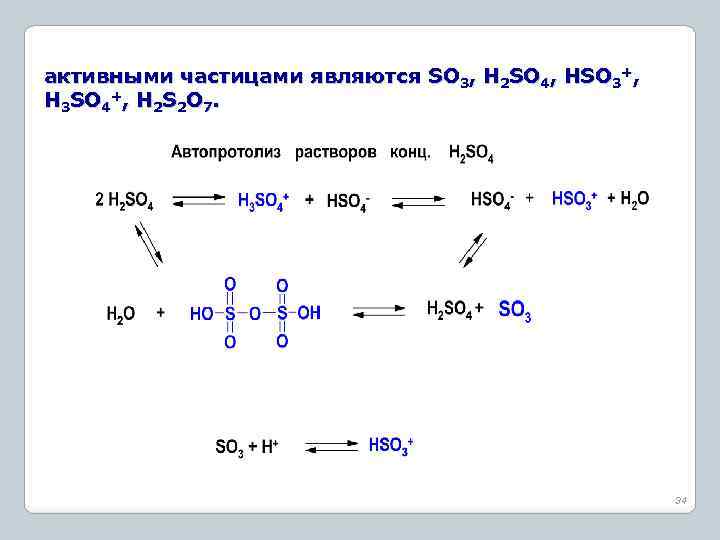
активными частицами являются SO 3, H 2 SO 4, HSO 3+, H 3 SO 4+, H 2 S 2 O 7. 34
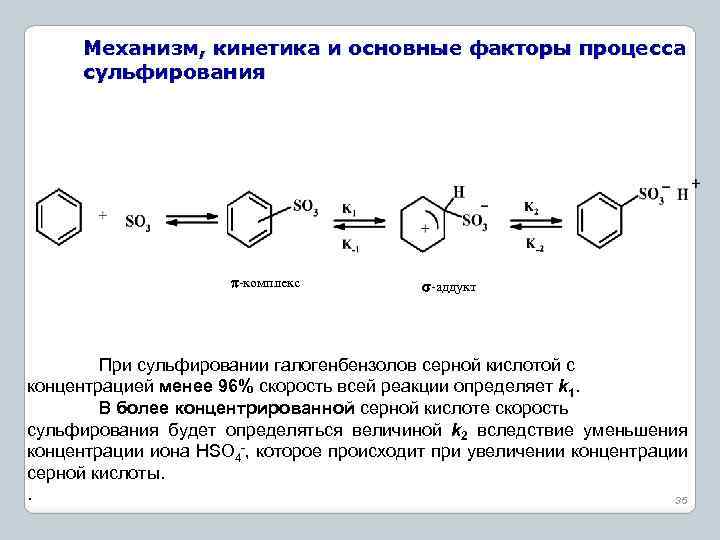
Механизм, кинетика и основные факторы процесса сульфирования -комплекс -аддукт При сульфировании галогенбензолов серной кислотой с концентрацией менее 96% скорость всей реакции определяет k 1. В более концентрированной серной кислоте скорость сульфирования будет определяться величиной k 2 вследствие уменьшения концентрации иона HSO 4 , которое происходит при увеличении концентрации серной кислоты. . 35
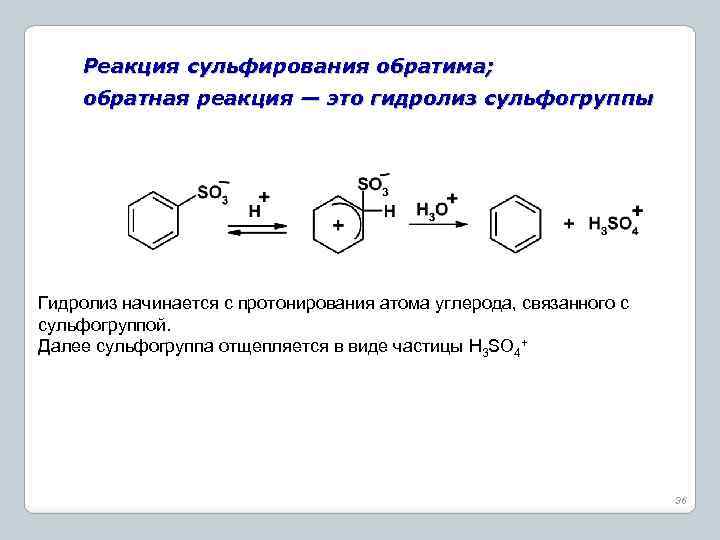
Реакция сульфирования обратима; обратная реакция — это гидролиз сульфогруппы Гидролиз начинается с протонирования атома углерода, связанного с сульфогруппой. Далее сульфогруппа отщепляется в виде частицы H 3 SO 4+ 36

Влияние концентрации серной кислоты Концентрацию сульфирующего агента (выраженную в процентах SO 3), при которой сульфирование практически уже не идет, называют величиной π-сульфирования. -Сульфирование – это концентрация отработанной серной кислоты после завершения процесса сульфирования, выраженная в процентах SO 3, при которой наблюдается максимальный выход сульфокислоты Зависит от природы исходного соединения, числа вводимых сульфогрупп и температуры сульфирования. 37

Количество серной кислоты, необходимой для сульфирова ния 1 кмоль ароматического соединения, рассчитывают из уравнения баланса по SO 3: G*s/100 - Gc*x*80/Mc = G*π/100 - Gc*x*80/Mc*π/100 где G - количество серной кислоты в кг, необходимое для сульфирования; s - концентрация исходной серной кислоты в % (считая на SO 3); Gc количество сульфируемого вещества в кг, х количество вводимых сульфогрупп, 80 – мольная масса SO 3, Мс – мольная масса сульфируемого вещества, в кг. Отсюда следует, что: G = (Gc*x*80/Mc) * (100 – π)/(s – π) Из полученного выражения видно, что чем больше значе ниеs, т. е. чем выше концентрация исходной серной кислоты, тем меньше G, т. е. тем меньше необходимое количество кислоты. Если разность (s π) невелика, то количества используемой, а следовательно, и отработанной кислоты будут значтельными. 38

Используя приведенное выше выражение, можно рассчитать необходимые количества купоросного масла, моногидрата и олеума и количество образующейся отработанной серной кисло ты при сульфировании, например, бензола (π = 66%). Для сульфирования 1 кмоль бензола моногидратом с учетом его величины π – сульфирования необходимо около 2 кмоль серной кислоты. На практике часто используют менее концентрированную серную кислоту, чтобы исключить побочные реакции, протекающие применении очень концентрированной серной кислоты: 1. образование полисульфокислот, 2. сульфонов Ar. SO 2 Ar, 3. окислительные процессы. Следует иметь в виду, что серная кислота, триоксид серы и особенно олеум являются сильными окислителями. 39

Следует учитывать место вхождения сульфогруппы в молекулу ароматического соединения введения сульфогруппы в положение 1 необходима более концентрированная кислота, чем при введении сульфогруппы в положение 2. Чем выше концентрация серной кислоты, тем ниже скорость гидролиза сульфогруппы, которому подвержена в первую очередь сульфогруппа в положении 1. 40

Влияние температуры Повышение температуры реакции приводит к увеличению скорости реакции вообще и скорости сульфирования в частности. При проведении сульфирования при более высокой температуре необходим меньший избыток серной кислоты, так как при этом уменьшается значение π сульфирования. В каждом случае существует допустимый предел температуры, при превышении которого воз можны нежелательные побочные реакции: üвступление большего числа сульфогрупп, üобразование сульфонов, üокисление молекулы органического вещества. 41
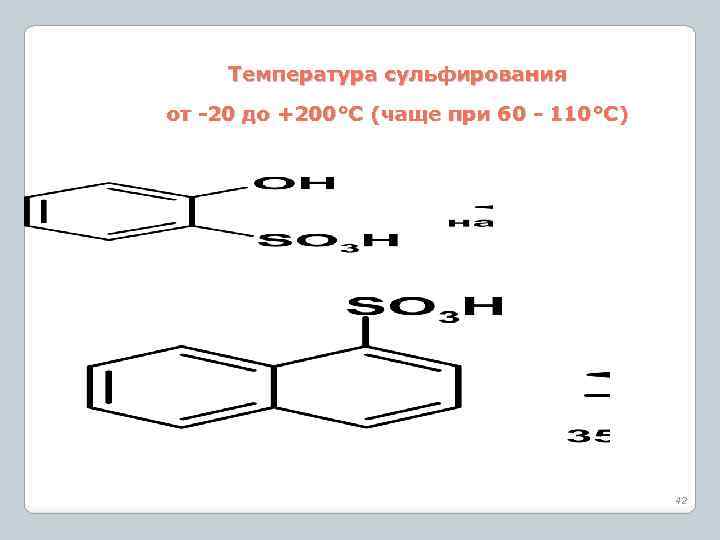
Температура сульфирования от -20 до +200°С (чаще при 60 - 110°С) 42

Технология процесса сульфирования Сульфуратор ‒ чугунный (стальной) аппарат, снабженный мешалкой (якорной, турбинной) q При сульфировании при повышенной температуре серную кислоту добавляют к жидкому (расплавленному) исходному соединению. q Если твердые вещества вводятся в реакционную массу в нерасплавленном виде (например, нафталин при сульфировании при 60 °С), то они должны быть хорошо измельчены. q Нагревание паром через рубашку q 43

Технология процесса сульфирования При сульфировании в ароматическое ядро обычно вводят одну или две сульфогруппы, соответственно моно- и дисульфокислоты т. е. получают Полисульфокислоты чаще всего получают ступенчатым сульфированием; сульфирующий агент прибавляют в несколько приемов, меняя его концентрацию и температуру сульфирования, т. е. создают наиболее благоприятные условия для протекания второго и третьего сульфирования. q Контроль за ходом сульфирования осуществляют отбором проб из реакционной массы и определением их растворимости в воде или в растворе карбоната натрия. Введение даже одной сульфогруппы приводит к растворимости пробы. q Иногда определяют количество свободной серной кислоты в реакционной массе. q 44

Выделение сульфокислоты из реакционной массы q Разбавление реакционной массы холодной водой или выливание ее на лед (например, нафталин-1, 5 дисульфокислота) q Выделяют в виде солей, преимущественно натриевых Нейтрализация сульфомассы содой экономически менее выгодна, а потому используется реже, нежели нейтрализация сульфитом. Особенно в тех производ ствах, где получаемые соли сульфокислот затем используют в процессах щелочного плавления (получение фенола и 2 нафтола). 45

Выделение сульфокислоты из реакционной массы q Нейтрализация сульфомассы (наиболее дешевое сырье) мелом или известью При нейтрализации сульфомассы известью не образуется углекислый газ, что существенно облегчает ведение процесса на этой стадии. С другой стороны, мел является более дешевым сырьем и при нейтрализации мелом сульфат кальция образуется в более легко фильтрующейся форме. Вследствие этого мел используют в качестве нейтрализующего агента чаще, чем известь. 46

Выделение сульфокислоты из реакционной массы Нейтрализацию обычно проводят в аппарате, который представляет собой стальной котел, футерованный кислотоупорной плиткой или гомогенно освинцованный. Для отвода тепла внутри котла размещен свинцовый змеевик. Реакционная масса перемешивается рамной или лопастной мешалкой. В верхней части аппарата помещается перфорированная труба, через которую подается пар для пеногашения. Сульфомассу постепенно, при работающей мешалке, загружают на предварительно нагретый до 90— 95°С раствор сульфита. При несоблюдении режима загрузки может произойти вы брос реакционной массы из нейтрализатора. После загрузки рассчитанного количества сульфомассы содержимое нейтрализатора кипятят для полного удаления сернистого газа. 47

Выделение сульфокислоты из реакционной массы Полученные соли сульфокислот можно выделить из раствора упариванием последнего. Однако такой метод требует больших энергетических затрат и, кроме того, может пройти частичное десульфирование образовавшейся сульфокислоты. Поэтому часто для выделения натриевых и кальциевых солей сульфокислот пользуются методом высаливания. Высаливанию можно подвергать как разбавленные водой сульфомассы, так и полученные в результате нейтрализации сульфомасс растворы солей сульфокислот. В качестве высаливающих агентов используют чаще всего поваренную соль или сульфат натрия. Высаливание ведут в стальных футерованных котлах с мешалками. Наличие в растворе большой концентрации одноименных ионов приводит к уменьшению растворимости соли сульфокислоты и выпадению ее в осадок. 48
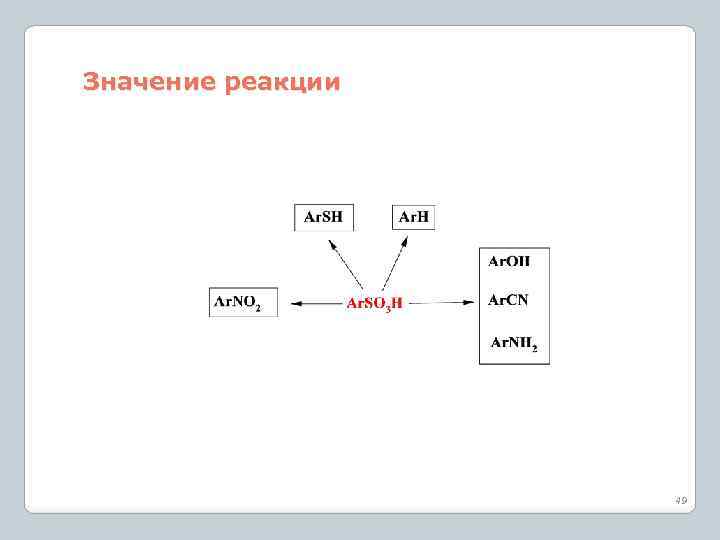
Значение реакции 49
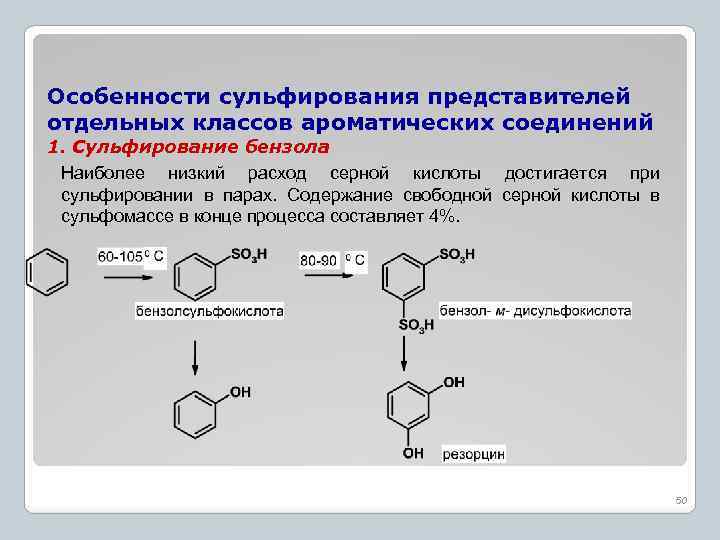
Особенности сульфирования представителей отдельных классов ароматических соединений 1. Сульфирование бензола Наиболее низкий расход серной кислоты достигается при сульфировании в парах. Содержание свободной серной кислоты в сульфомассе в конце процесса составляет 4%. 50
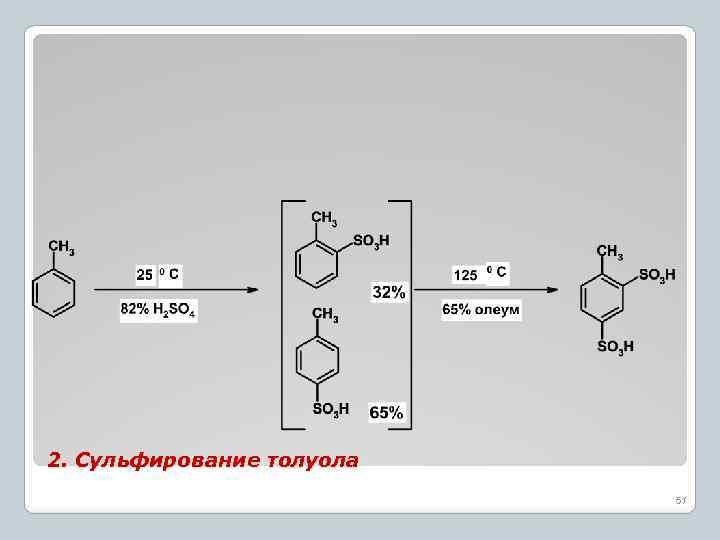
2. Сульфирование толуола 51
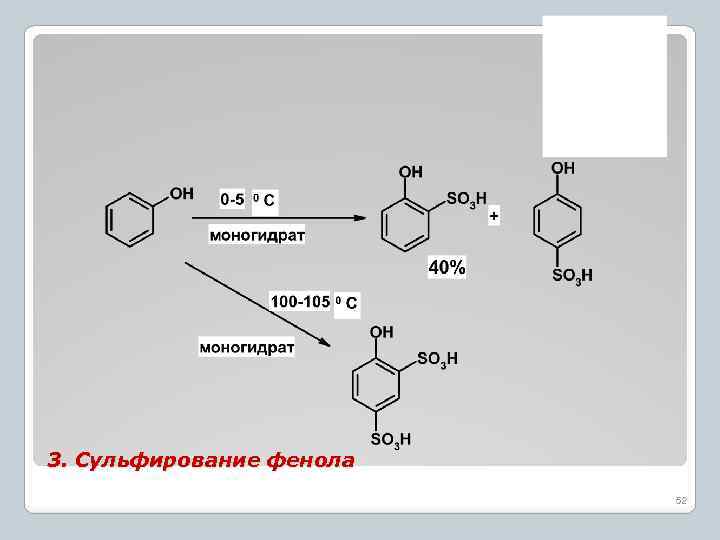
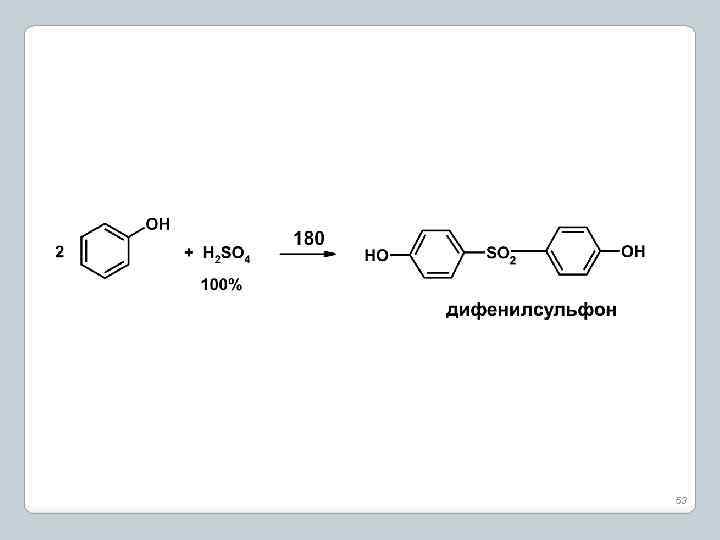
3. Сульфирование фенола 52
53
4. Сульфирование хлорбензола 54
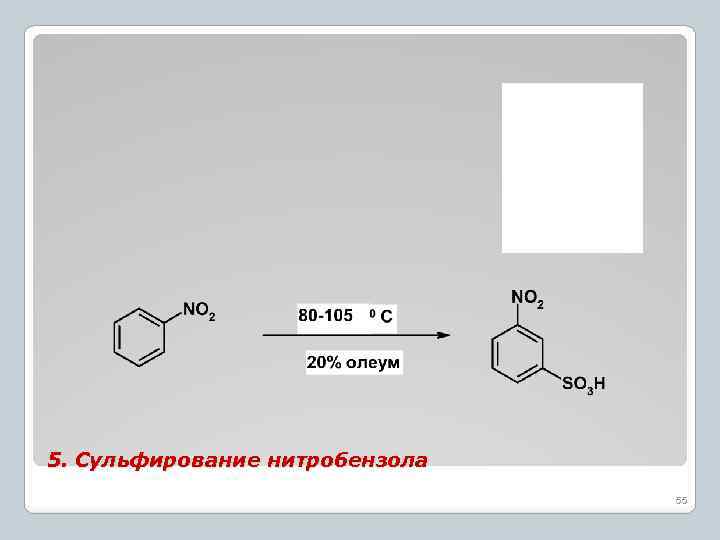
5. Сульфирование нитробензола 55
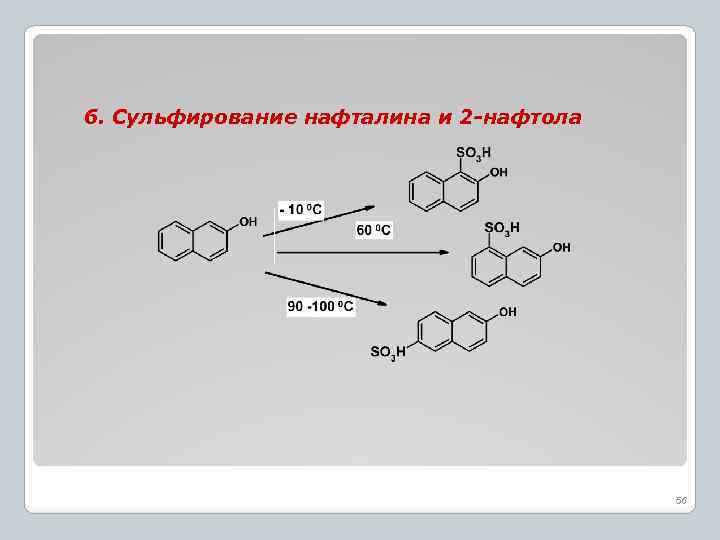
6. Сульфирование нафталина и 2 -нафтола 56
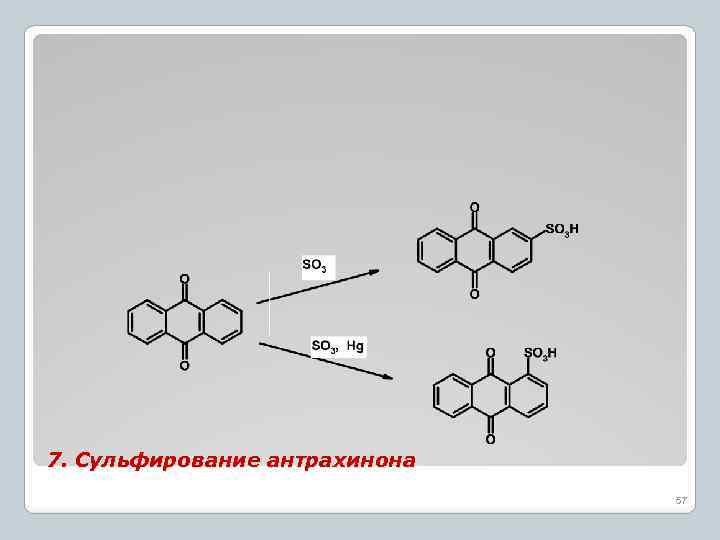
7. Сульфирование антрахинона 57
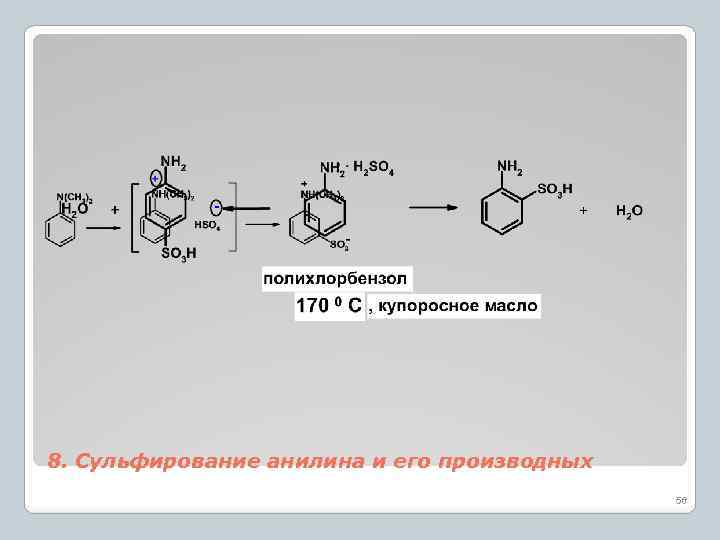
8. Сульфирование анилина и его производных 58
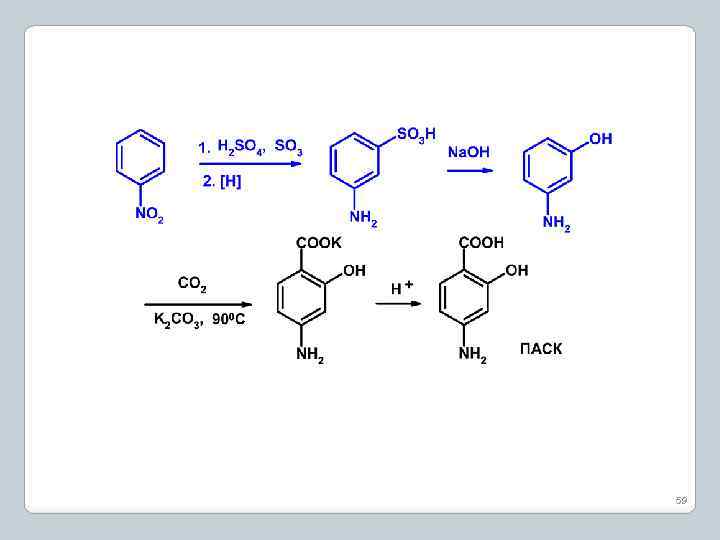
59
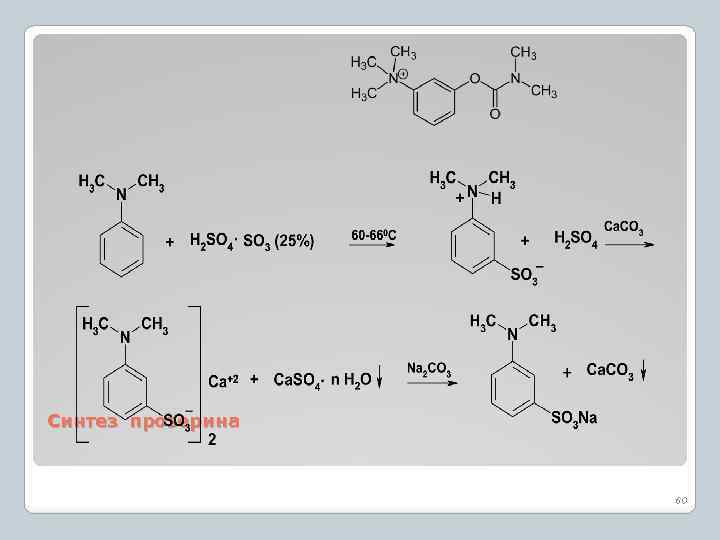
Синтез прозерина 60
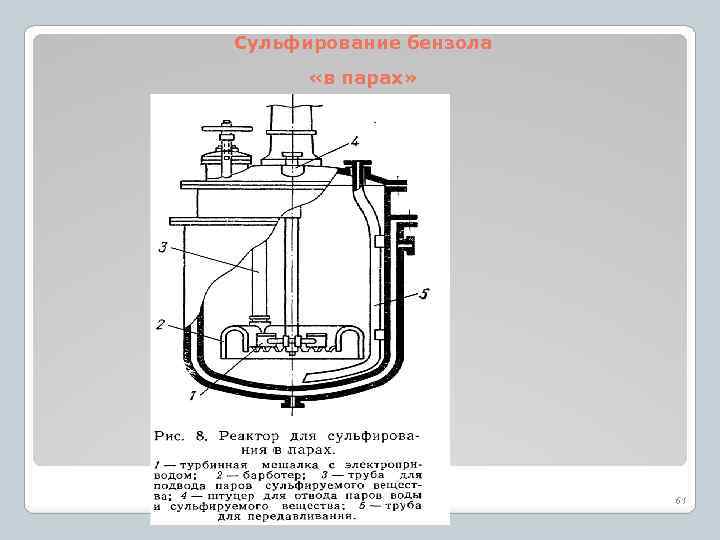
Сульфирование бензола «в парах» 61
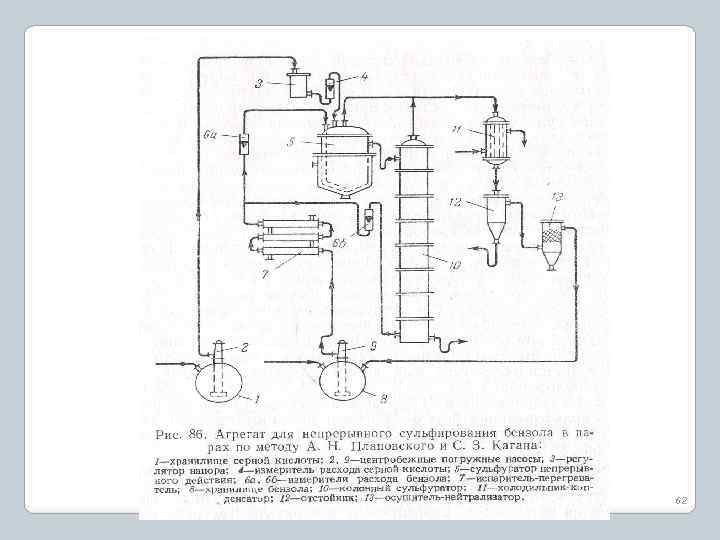
62

Хлорсульфирование ароматических соединений 63

5. Реакция сульфохлорирования
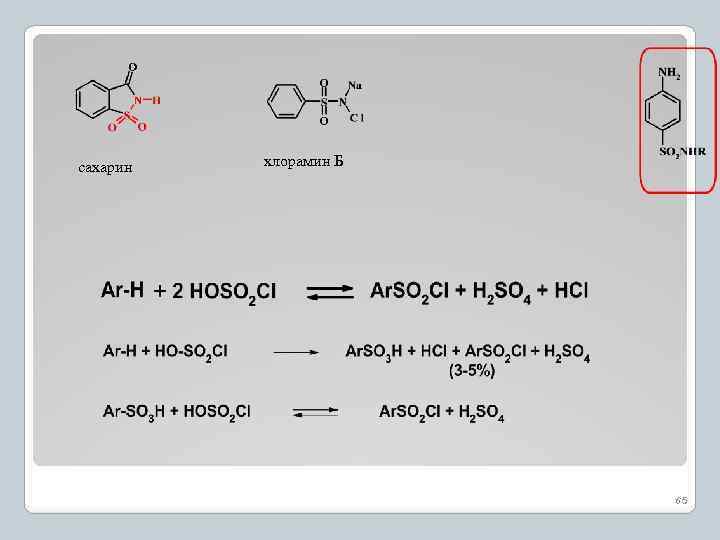
сахарин хлорамин Б 65
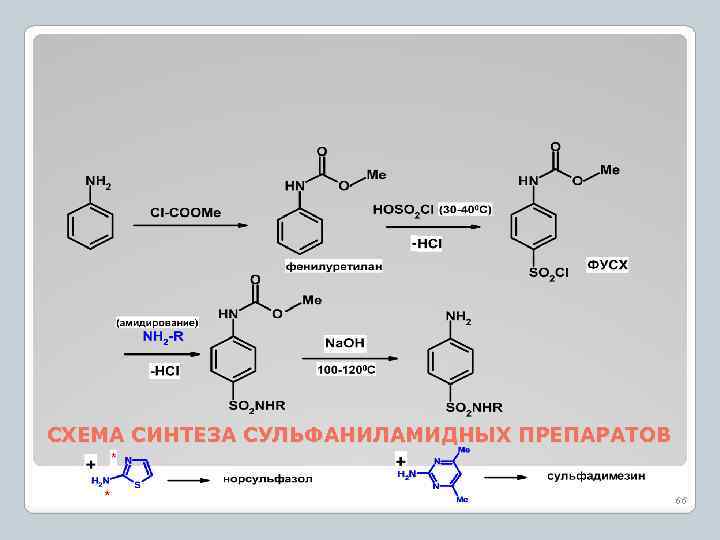
СХЕМА СИНТЕЗА СУЛЬФАНИЛАМИДНЫХ ПРЕПАРАТОВ 66
Введение. Сульфирование.pptx