Химическая термодинамика.pptx
- Количество слайдов: 53

Химическая термодинамика ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА рассматривает взаимосвязи между работой и энергией применительно к химическим превращениям. Химические реакции обычно сопровождаются высвобождением или поглощением определенного количества теплоты, тепловыми эффектами, и условия их протекания подчиняется фундаментальным принципам (началам) термодинамики.

Основные понятия и определения Термодинамика исторически возникла как эмпирическая наука об основных способах преобразования внутренней энергии тел для совершения механической работы. Однако в процессе своего развития термодинамика проникла во все разделы физики, где возможно ввести понятие «температура» и позволила теоретически предсказать многие явления задолго до появления строгой теории этих явлений. Что и зачем изучает термодинамика (ХТД)? Химическая термодинамика – это раздел химии, которая изучает: превращения различных видов энергии при химических реакциях, процессах растворения, кристаллизации; энергетические эффекты, сопровождающие химические и физические процессы; возможности и границы самопроизвольного протекания процессов, и условия равновесия.

Термодинамическая система, ее виды Объектом изучения в термодинамике является термодинамическая система, под которой понимают мысленно или реально выделенную из пространства совокупность тел (атомов, молекул, частиц), находящихся в определенном фазовом состоянии. В ХТД все системы условно разделяют на три типа: открытые, закрытые и изолированные. Системы, которые могут обмениваться с окружающей средой и энергией и веществом называются открытыми. Системы, которые обмениваются только энергией, называются закрытыми. Если между средой и системой отсутствует и тепло- и массообмен – это изолированная система. В реальных условиях таких систем не существует, а понятие изолированной системы вводится для упрощения модели описания различных процессов в ТДС. По фазовому составу системы различают на гомогенные, состоящие из одной фазы и гетерогенные, состоящие из нескольких фаз. Процессы, которые протекают на границе раздела фаз – гетерогенные. По количеству веществ, входящих в ТДС их разделяют на однокомпонентные и многокомпонентные, так все растворы являются гомогенными и многокомпонентными системами.

Состояния и процессы в ТДС Любая система может существовать в различных термодинамических состояниях и в определенных условиях переходить из одного в другое. Состояние системы называется равновесным, если оно во времени не изменяется. Переход системы из одного состояния во другое называется процессом. Все системы стремятся к состоянию равновесия, однако далеко не всегда его достигают. Состояние системы можно описать набором значений различных параметров и функций. Одна и та же система может находиться в различных состояниях. Каждое состояние характеризуется определённым набором значений различных физических характеристик, которые получили название термодинамических параметров и функций состояния системы.

Параметры и функции состояния Термодинамические параметры и функции делятся на интенсивные и экстенсивные. Интенсивные не зависят от количества вещества системы, экстенсивные, наоборот, зависят. Изменение одного из параметров приводит к изменению состояния в целом. К интенсивным параметрам относятся: • давление (р); • температура (Т); • концентрация (с); • плотность (ρ) и ряд других. Экстенсивные параметры – масса (m), объем (V), теплоемкость (cр) и т. д. Состояние системы и происходящие в ней изменения определяются также и функциями состояния. Функция состояния – это такая функция независимых параметров, значение которой, однозначно определяет равновесное состояние системы. К основным ТД функциям относятся: • внутренняя энергия (U); • энтальпия (Н); • энтропия (S); • изобарно-изотермический потенциал (G); • изохорно-изотермический потенциал (F).

Параметры и функции состояния Любое изменение параметров системы есть не что иное, как термодинамический процесс. При осуществлении большинства процессов, встречающихся в природе и промышленности, один или несколько параметров остаются неизменными. Поэтому выделяют четыре основных термодинамических процесса: изобарный, p = const; например нагревание песка, воды или камней под действием солнечных лучей; изохорный, V = const, например, скисание молока в стеклянной бутылке; изотермический, T = const, например, надувание воздушного шарика; адиабатический, когда не происходит ни выделения, ни поглощения тепла, т. е. ΔQ = 0, например нагревание и остывание воздушных масс.
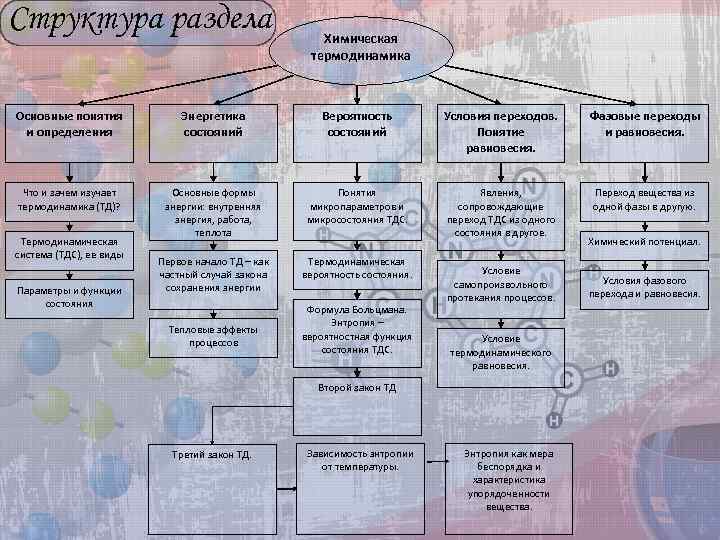
Структура раздела Химическая термодинамика Основные понятия и определения Энергетика состояний Вероятность состояний Условия переходов. Понятие равновесия. Фазовые переходы и равновесия. Что и зачем изучает термодинамика (ТД)? Основные формы энергии: внутренняя энергия, работа, теплота Понятия микропараметров и микросостояния ТДС. Явления, сопровождающие переход ТДС из одного состояния в другое. Переход вещества из одной фазы в другую. Первое начало ТД – как частный случай закона сохранения энергии Термодинамическая вероятность состояния. Термодинамическая система (ТДС), ее виды Параметры и функции состояния Тепловые эффекты процессов Формула Больцмана. Энтропия – вероятностная функция состояния ТДС. Условие самопроизвольного протекания процессов. Условие термодинамического равновесия. Второй закон ТД Третий закон ТД. Зависимость энтропии от температуры. Энтропия как мера беспорядка и характеристика упорядоченности вещества. Химический потенциал. Условия фазового перехода и равновесия.

Энергетика состояний В ХТД важнейшую роль играют энергетические характеристики системы, поскольку из основного закона природы – закона сохранения энергии следует стремление любой системы занимать состояние с наименьшей энергией.

Внутренняя энергия системы Основной функцией состояния системы является её внутренняя энергия, которая включает в себя кинетическую энергию поступательного, колебательного и вращательного движения всех частиц системы и потенциальную энергию, обусловленную взаимодействием частиц между собой. Экспериментально точное значение внутренней энергии U определить нельзя, можно определить лишь её изменение : В первую очередь, внутренняя энергия является функцией температуры и рассчитывается по формуле: ΔU = сv m(T 2 -T 1), где с - удельная теплоемкость, m -масса, Т - температура. Однако это выражение имеет приближенный характер, не учитывающий зависимость теплоемкости от температуры, более точно изменение внутренней энергии можно получить из дифференциального уравнения: d. U = сv. md. T.

Другие формы энергии: работа, теплота Система обменивается с внешней средой тепловой энергией Q и механической энергией (работой) А. Теплота является мерой энергии переданной от одного тела другому за счет разности температур этих тел. Работа является мерой энергии переданной системе за счет перемещения масс под действием каких-либо сил. В ХТД считают положительной теплоту, подводимую к системе и работу которую система совершает против внешних сил. Эти физические величины не являются функциями состояния, а характеризуются изменениями определенных функций.

Первое начало ТД –частный случай закона сохранения энергии В большинстве случаев различные макросостояния (состояния с разными значениями параметров) системы имеют разные энергии. При переходе системы из одного состояния в другое, в соответствии с законом сохранения энергии, обязана выделится или поглотиться энергия в той или иной форме. Первый закон (начало) ТД определяет: как и в каких формах, эта энергия меняется. Согласно 1 -му началу термодинамики – если система переходит из 1 -го состояния во 2 -ое, то количество энергии, которое выделяется или поглощается системой в виде теплоты Q и работы А, равно изменению внутренней энергии системы ΔU, тогда выражение 1 -го закона можно записать так: Q = ΔU + А т. е. теплота, подводимая к системе расходуется на увеличение ее внутренней энергии и совершение системой работы против внешних сил. В дифференциальной форме (для бесконечно малого количества теплоты) 1 -й закон ТД будет выглядеть так: δQ = d. U + Σpidqi где произведение соответствующих интенсивного pi и малого изменения экстенсивного dqi параметров равно определенному виду работы (например, работа расширения равна рd. V, где р- давление, а V -объем).

Энтальпия – энергия расширенной системы Рассмотрим 1 -й закон ТД для случая, когда совершается только работа расширения при постоянном давлении. Работа расширения будет равна: А = рΔV = p(V 2 – V 1)-, следовательно Q = ΔU + p(V 2 – V 1) или: Выражение в скобках (U + p. V) обозначается как H и называется энтальпией. Энтальпия – есть функция состояния системы, имеет размерность энергии. Выражая первое начало ТД, через энтальпию получим: Теплота, подводимая к системе, идет на увеличение энтальпии. Из определения энтальпии следует, что энергетическая функция, которая также как и внутренняя энергия должна зависеть от температуры, однако кроме внутренней энергии она включает в себя еще и работу которую система может совершить при расширении: ΔН = ΔU + pΔV, поэтому ее еще иногда называют энергией расширенной системы.

Изменение энтальпии – мера устойчивости вещества Точное значение энтальпии какого-либо состояния определить нельзя, поскольку оно зависит от очень большого числа параметров, поэтому рассчитывают изменение энтальпии ΔН (также как и ΔU) при переходе системы из одного состояния в другое. При этом становится понятным физический смысл этих функций: ΔН =- Qр, ΔU =- Qv Здесь Qр , Qv – теплота которая выделяется или поглощается в результате протекания процессов внутри системы при постоянном давлении или объеме. Эти теплоты получили названия тепловых эффектов химических реакций. Сущность химических реакций сводится к разрыву связей в исходных веществах и образованию связей в продуктах реакции. Т. к. образование связей протекает с выделением энергии, а разрыв с поглощением энергии, то химические реакции сопровождаются энергетическими эффектами. Отсюда следует, что чем больше энергии выделяется при протекании реакции, тем более устойчивым получаются ее продукты, то есть значения ΔН и ΔU в определенных условиях однозначно характеризуют устойчивость вещества. Раздел термодинамики, который изучает тепловые эффекты химических реакций, называется термохимией.

Тепловые эффекты процессов Тепловой эффект химической реакции, (изменение энтальпии или внутренней энергии системы), вследствие протекания химической реакции - отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов. Тепловой эффект обозначается символами Qр (Qр = –ΔH) при постоянстве давления или Qv (Qv = –ΔU) при постоянстве объема. Его величина соответствует разности между энергиями исходного и конечного состояний реакции: ΔH = Hкон. – Hисх. = Eкон. – Eисх. Отсюда следует, что если энергия конечного состояния меньше исходного, то теплота выделяется, а ΔH<0, и наоборот. Реакции, протекающие с выделением теплоты, проявляют положительный тепловой эффект (Qр>0, ΔH<0) и называются экзотермическими. Рис. 5. 1. Реакции, которые идут с поглощением теплоты из окружающей среды (Qр<0, ΔH>0), т. е. с отрицательным тепловым эффектом, являются эндотермическими.

Тепловые эффекты процессов Изменение энергии в различных реакциях показано на рис. 5. 1. Величины ΔH и ΔU сильно различаются только для веществ в газообразном состоянии. Для систем, в которых вещества находятся в конденсированном состоянии изменение объёма в ходе реакции мало, т. е. , тогда ; .

Энтальпии (теплоты) образования веществ При образовании любого химического соединения выделяется или поглощается определенное количество теплоты, поэтому тепловой эффект образования определяет его устойчивость. Поскольку изменение энтальпии зависит от количества образующегося вещества, ее приводят к 1 -му молю и определяют в стандартных условиях: Т=298 К, Р=101, 3 к. ПА, обозначая ΔH 0. Этот тепловой эффект получил название стандартной теплоты или энтальпии образования. Стандартная энтальпия (теплота) образования – это количество теплоты, которое выделяется или поглощается в результате образования в стандартных условиях 1 моля химического соединения из простых веществ, взятых и полученного в термодинамически устойчивых фазах и модификациях. Для любого соединения получается строго определенное значение ΔH 0. По величинам и знакам энтальпии образования можно судить об устойчивости соединения относительно его распада на простые вещества. Стандартные энтальпии образования простых веществ в термодинамически устойчивых модификациях приняты за 0. Например, энтальпия образования углерода в модификации «графит» равна 0, а в модификации «алмаз» ΔHалмаз 0 = 1, 90 к. Дж/моль, что означает: для углерода более устойчивой является модификация графита, поэтому именно для этого состояния на ΔH 0 принято за 0. Для сложных веществ энтальпии образования ΔH 0 и внутренние энергии образования (ΔU 0) сведены в таблицы термодинамических величин.

Энтальпия – энергия расширенной системы Табл. 5. 1. Стандартные энтальпии образования ΔHoобр. . некоторых веществ при 298, 15 К Вещество и состояние Ag (к) Ag. Br (к) Ag. Cl (к) Ag. F (к) Ag. I (к) Al. Cl 3 (к) Al 2 O 3 (аморф) Al 2 S 3 (к) Au 2 O 3 (к) BF 3 (г) BH 3 (г) Ba. O (к) Br 2 (г) Br 2 (ж) C (к, алмаз) C (к, графит) CCl 4 (г) CH 3 OH (ж) CH 4 (г) CO (г) DHoобр. , 298, 15 к. Дж/моль 0 -100, 7 -127, 1 -205, 9 -61, 9 0 -704, 2 -1675, 7 -1602 -724 -13, 0 0 -1136, 9 92 -548 30, 91 0 1, 83 0 -102, 9 -239, 45 -74, 81 -110, 52 Вещество и состояние C 6 H 6 (ж) HCN (г) Ca. Cl 2 (к) Ca. CO 3 (к) Ca. F 2 (к) Ca(OH)2 (к) Ca. O (к) Ca. S (к) Cl 2 (г) HCl (г) H 2 (г) I 2 (к) HI (г) N 2 (г) NH 3 (г) NO 2 (г) N 2 O 4 (ж) N 2 O 5 (к) Na. OH (к) O 2 (г) DHoобр. , 298, 15 к. Дж/моль 49, 03 134, 7 -795, 9 -1206, 8 -1220, 9 -985, 1 -635, 1 -476, 98 0 -92, 31 0 0 26, 57 0 -46, 2 90, 2 33, 5 82, 01 9, 6 -19, 0 -42, 7 -495, 93 0

Энтальпии (теплоты) образования веществ Из таблицы 5. 1. следует, что соединение менее устойчиво, чем простые вещества, из которых оно образовано, если. DHoобр. ˃0, и чем меньше значение DHoобр. тем более устойчиво вещество. Наиболее устойчивыми соединениями являются соли и оксиды, при этом, чем больше связей с кислородом, тем устойчивость выше. Так, из оксидов азота наиболее термически неустойчивым оказывается NO, а устойчивым N 2 O 5. Для соединений бора оказывается, что чем полярнее связь, тем выше устойчивость соединений: BF 3 намного стабильнее BH 3. Среди галогенидов серебра устойчивость уменьшается в ряду: Ag. F – Ag. Cl – Ag. Br – Ag. I, что также объясняется уменьшением полярности связи.

Закон Гесса Химическая термодинамика позволяет, не проводя экспериментального исследования процессов, рассчитывать их тепловые эффекты. Это стало возможным благодаря одному из основных законов термохимии – закону Г. И. Гесса (1840 г. ). Этот закон является частным случаем 1 -го начала термодинамики и был сформулирован так: тепловой эффект химической реакции не зависит от пути ее протекания, а зависит лишь от природы и физического состояния исходных веществ и продуктов реакции. Поскольку тепловой эффект равен изменению термодинамической функции состояния (-ΔH или ΔU), то в более общем виде, закон Гесса можно выразить следующим образом: изменение любой термодинамической функции не зависит от пути перехода системы из одного состояния в другое, а определяется только видом и состоянием исходных и конечных веществ. Герман Иванович Гесс (фр. Germain Henri Hess, 1802, Женева — 1850, Санкт-Петербург) — российский химик, академик Петербургской Академии наук (1834)

Закон Гесса Стехиометрическое уравнение реакции в котором указан тепловой эффект называется термохимическим уравнением. Сграфит + О 2 газ = СО 2 газ; ? H = - 393, 51 к. Дж/моль (5. 1) СОгаз + ? O 2 raз = СО 2 газ; ? H = - 282, 98 к. Дж/моль (5. 2) С термохимическими уравнениями можно проводить любые математические действия, тем самым определять тепловые эффекты различных реакций. Пример: определим ? H образования СО. Для этого вычтем из уравнения (5. 1. ) уравнение (5. 2. ) и получим: Сграфит + 1/2 О 2 гaз = СОгаз; ? H - 110, 53 к. Дж/моль (5. 3)

Зависимость тепловых эффектов от температуры. Закон Кирхгофа Тепловой эффект является слабо возрастающей функцией температуры в соответствии с законом Кирхгофа: где ΔС – разность сумм теплоёмкостей продуктов и исходных веществ реакции. Теплоёмкость (С) это количество теплоты, которое необходимо для нагревания определённого количества вещества на 1 К, если относится к 1 молю – молярная, к 1 кг – удельная. при при

Расчеты тепловых эффектов Закон Гесса позволяет, используя значения стандартных теплот образования исходных веществ и продуктов, определять тепловой эффект реакции. Для этого применяется важное следствие: тепловой эффект химической реакции равен сумме стандартных энтальпий образования продуктов реакций за вычетом суммы стандартных энтальпий образования реагентов с учётом стехиометрических коэффициентов. Для реакции тепловой эффект определяем так: где n, m, p и q – стехиометрические коэффициенты, ΔH 0 f – теплоты образования веществ A, B, C и D. В качестве примера, определим тепловой эффект и энергетику реакции взаимодействия метана с оксидом углерода(IV), если стандартные энтальпии образования метана, оксида углерода(IV) и оксида углерода(II) при 298 К соответственно равны: -75; -393 и -111 к. Дж/моль.

Расчеты тепловых эффектов Решение: Записываем стехиометрическое уравнение реакции: СН 4 газ + СО 2 газ =2 СОгаз +2 Н 2 газ Используя следствие из закона Гесса, рассчитываем тепловой эффект: ΔH 0 хр = (2ΔH 0 СО +2ΔH 0 Н 2) - (ΔH 0 СН 4 + ΔH 0 СО 2) ΔH 0 хр= (2(-111) +2(0)) - (-75 - 393) = - 242 к. Дж. Данная реакция является экзотермической

Расчеты тепловых эффектов Применяя следствие из закона Гесса, можно решать и другую задачу – по известным теплотам сгорания находить теплоту образования вещества. Пример 2. Определим стандартную энтальпию образования C 2 H 5 OH(ж), если стандартные энтальпии сгорания углерода, водорода и этанола при 298 К соответственно равны: -393; -286 и -1366 к. Дж/моль. Решение: Записываем стехиометрические уравнения сгорания веществ: Сгаз + О 2 газ =СО 2 газ; ΔH = -393 к. Дж/моль (5. 4) Н 2 газ + О 2 газ = ½ Н 2 Ож; ΔH = -286 к. Дж/моль (5. 5) C 2 H 5 OH(ж) + 3 О 2 газ = 2 СО 2 газ + 3 Н 2 Ож; ΔH = -1366 к. Дж/моль (5. 6) Умножаем уравнение (5. 4. ) на 2, уравнение (5. 5. ) на 3 и вычитаем их сумму из уравнения (5. 6. ) получаем уравнение образования C 2 H 5 OH(ж) Используя следствие из закона Гесса, рассчитываем теплоту образования C 2 H 5 OH(ж), учитывая, что энтальпии сгорания С и Н 2 равны энтальпиям образования СО 2 и Н 2 О: ΔH 0 (C 2 H 5 OH(ж))= ΔH 0 сгор - 3ΔH 0 СО 2 - 2ΔH 0 Н 2 О ΔH 0(C 2 H 5 OH(ж)) = - 1366 – 2(- 393) – 3(-286) = - 8 к. Дж.

Вероятность состояний Первый закон термодинамики утверждает, что теплота может превращаться в работу, а работа в теплоту и не устанавливает условий, при которых возможны эти превращения. Превращение работы в теплоту происходит всегда полностью и безусловно. Обратный процесс превращения теплоты в работу при непрерывном её переходе возможен только при определенных условиях и не полностью. Теплота сама собой может переходить от более нагретых тел к холодным. Переход теплоты от холодных тел к нагретым сам собой не происходит. Для этого нужно затратить дополнительную энергию. Таким образом, для полного анализа состояний и процессов в ТДС необходимо учитывать кроме первого закона термодинамики еще дополнительные условия. Эти условия определяет второй закон термодинамики. Он устанавливает, возможен или невозможен тот или иной процесс, в каком направлении протекает процесс, когда достигается термодинамическое равновесие и при каких условиях можно получить максимальную работу, учитывая вероятность возможных состояний системы.

Микропараметры и микросостояния ТДС Для определения обычного состояния системы необходимо задать определенный набор значений макропараметров (давление, температуру, объем, концентрацию и т. д. ), при этом неважно, где и в какой момент находятся все частицы этой системы. Если макропараметры не меняются, а молекулы, атомы меняют свое положение, мы все равно считаем, что система находится в состоянии равновесия. Однако, если энергия системы постоянна (изолированная система), то в определенных условиях в ней возможны процессы, которые не объяснимы только с позиций 1 -го начала ТД. Например, взаимная диффузия двух различных газов, находящихся в одной ТДС, или переход теплоты от более нагретого тела к более холодному. Поэтому необходимо ввести еще одну характеристическую функцию, которая определяла бы условия протекания процессов, как в изолированных, так и в закрытых и открытых системах. Для этого введем понятия микропараметров и микросостояний. При описании состояния любой ТДС на микроуровне (молекулы, атомы) необходимо указать для каждой частицы ее положение в пространстве и энергию, первое достигается указанием 3 -х декартовых координат, второе определяется значениями трех импульсов (вектора по направлениям) всего 6 параметров для одной микрочастицы. Если система состоит из N частиц, то для определения одного микросостояния потребуется 6 N параметров. Очевидно, что для одного равновесного макросостояния можно указать очень большое число соответствующих ему микросостояний.

Микропараметры и микросостояния ТДС Рассмотрим простую систему всего из двух неотличимых частиц, находящихся в некотором объеме. Мысленно разделим этот объем на две части, и, пронумеровав частицы, найдем число способов, которым можно разместить их в этих двух частях (Рис. 5. 2). Как видно из рисунка, всего таких способов будет четыре, но два нижних неотличимы, так как частицы 1 и 2 совершенно одинаковы, и соответствуют одному и тому же макроскопическому состоянию системы. Таким образом, мы имеем три различных микроскопических состояния системы, номера которых обозначены слева на рисунке. Два верхних микросостояния реализуются только одним способом, а третье, нижнее двумя. Число способов Рисунок 5. 2 Распределение 2 -х частиц в пространстве и является термодинамической вероятностью W, величина которой приведена справа от рисунков. Все четыре способа равновероятны, поэтому большую часть времени система будет находиться в третьем состоянии

Микропараметры и микросостояния ТДС Вероятность p (на рисунке ее значения приведены справа от W) - конкретного микроскопического состояния определяется отношением числа способов, которым можно реализовать это состояние W к общему числу возможных способов размещения молекул. Первые два микросостояния более упорядоченные - в них мы можем выделить две области, в одной есть частицы, в другой - нет. Третье микросостояние менее упорядоченное, так как мы не можем выделить таких областей. Это означает, что вероятность нахождения системы в менее упорядоченном макроскопическом состоянии больше, чем в упорядоченном. Мы рассмотрели только 2 частицы. Число способов размещения N молекул в двух частях объема равно 2 N, а число способов размещения всех молекул в одной половине объема равно 1. Из этого следует, что вероятность нахождения всех молекул в одной половине объема p = 1/2 N. При большом числе молекул (в одном моле газа N = 6· 1023) вероятность упорядоченного состояния, когда все частицы соберутся в одной половине становится практически равной нулю. Таким образом, чем большим числом способов может быть реализовано определенное макроскопическое состояние системы (или, что одно и то же, чем больше термодинамическая вероятность W этого состояния), тем менее оно упорядоченное и наиболее вероятное.

Термодинамическая вероятность состояния (ТДВ) Термодинамическая вероятность – число способов, которыми может быть определено макросостояние системы. Термодинамическая вероятность в ХТД обозначается W (в физике называется статистический вес – ω) равна числу микросостояний, реализующих данное макросостояние. Максимально большое число микросостояний для системы из N частиц соответствует числу их перестановок N!, из чего следует, что Wmах = N!. В системе, в которой все частицы не различимы и не меняют своего положения и энергии возможно только одно микросостояние и Wmin = 1. Если в системе имеется N 1 частиц одного вида, N 2 частиц второго вида и так далее, то число перестановок будет меньше N!, и из теории групп, следует, что: В случае, если все частицы разные N 1 = N 2 = N 1 = 1 в системе наблюдается максимальный беспорядок и реализуется 1 -й случай, если, наоборот, одинаковые, то N 1 = N и возникает полный порядок (случай 2). Термодинамическая вероятность не является вероятностью в математическом смысле. Она может принимать очень большие значения. В системе состоящей всего из 5 частиц Wmах = 5! =120, из 10 частиц, она имеет порядок 105.

Формула Больцмана. Энтропия – вероятностная функция состояния ТДС Термодинамическая вероятность связана с одной из основных макроскопических характеристик системы энтропией S соотношением Больцмана: S = kln. W, где k — постоянная Больцмана, k= R/Nа R – универсальная газовая постоянная. Вероятностное толкование понятия энтропии было дано в статистической физике Людвигом Больцманом. Энтропия — (от греч. etropía поворот, превращение) понятие, впервые введенное в термодинамике для определения меры необратимого рассеяния энергии. В статистической термодинамике энтропия не только функция состояния системы и физическая величина, характеризующая направленность процессов в природе, но и мера беспорядка и хаоса. В изолированных системах изменение энтропии служит критерием определяющим направление процесса.

Второй закон ТД. Различные формулировки Существуют несколько эквивалентных формулировок второго начала термодинамики: Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» (такой процесс называется процессом Клаузиуса). Постулат Томсона: «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона). Формулировка Оствальда: «Вечный двигатель 2 -го рода невозможен» . Для существования теплового двигателя необходимы 2 источника – горячий источник и холодный источник (окружающая среда). Если тепловой двигатель работает только от одного источника, то он называется вечным двигателем 2 -го рода. Формулировка Карно: «Там где есть разница температур, возможно совершение работы» .

Второй закон ТД. Различные формулировки Из приведенных формулировок 2 -го закона термодинамики, однозначно не следует, почему такие процессы не возможны, поэтому и была ведена функция – энтропия, характеризующая вероятность перехода системы от одного состояния к другому. Рассмотрим систему из двух контактирующих тел с разными температурами. Тепло будет переходить от тела с большей температурой к телу с меньшей, до тех пор, пока температуры обоих тел не выровняются. При этом от одного тела к другому будет передано определенное количество тепла δQ. Но энтропия при этом у первого тела уменьшится на меньшую величину, чем она увеличится у второго тела, которое принимает теплоту, так как, по определению, d. S=δQ/T (температура в знаменателе!). То есть, в результате этого самопроизвольного процесса энтропия системы из двух тел станет больше суммы энтропий этих тел до начала процесса. Иначе говоря, самопроизвольный процесс передачи тепла от тела с высокой температурой к телу с более низкой температурой привел к тому, что энтропия системы из этих двух тел увеличилась!

Второй закон ТД для изолированной системы Рассматривая систему из двух тел, мы подразумевали, что внешнего теплопритока в нее или теплооттока из нее нет - то есть, считали ее изолированной. Отсюда еще одна формулировка второго закона термодинамики: «в изолированной системе самопроизвольный процесс возможен в сторону состояния с наибольшим значением термодинамической вероятности или энтропии при этом в системе устанавливается равновесие» . Или: «Энтропия изолированной системы стремится к максимуму» . Наиболее короткое выражение для второго закона для изолированной системы можно представить так: ΔS > 0; самопроизвольный процесс; ΔS = 0, S=Smax – равновесие.

Второй закон ТД для закрытой системы. Если в систему поступает тепло, то ее энтропия будет увеличиваться еще больше, так как при получении телом тепла энтропия его увеличивается: d. S=δQ/T, здесь d. S – приращение энтропии, δQ малое количество теплоты, поступающей в систему, T – постоянная температура при которой эта теплота поступает. Это выражение справедливо только для равновесных процессов, и может определять 2 й закон ТД так: «теплота, подводимая к системе при постоянной температуре, приводит к увеличению энтропии на величину ΔS=Q/T» (интегральная форма). Отсюда энтропия получила еще одно название – приведенная теплота. Размерность энтропии Дж/К.

Третий закон ТД Третье начало термодинамики или тепловая теорема Нернста рассматривает изменения в ТДС при стремлении температуры к абсолютному 0 К. В 1911 году Макс Планк сформулировал третье начало термодинамики как условие обращения в нуль энтропии всех тел при стремлении температуры к абсолютному нулю: . S → 0. Отсюда S 0 = 0, что даёт возможность определять абсолютное значения энтропии и других термодинамических потенциалов. Из статистического рассмотрения системы следует, что число возможных микросостояний при понижении температуры должно также уменьшаться и в итоге стать единственным. Это означает что энтропия будет стремится к нулю. Поэтому одну из формулировок второго закона ТД можно представить так: Энтропия идеального кристалла при стремлении температуры к абсолютному нулю также стремится к нулю. Из этого постулата следует, что энтропия является возрастающей функцией температуры.
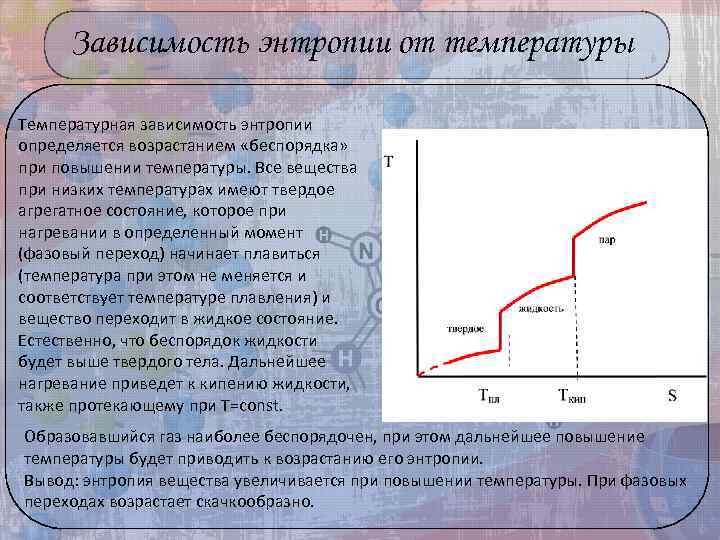
Зависимость энтропии от температуры Температурная зависимость энтропии определяется возрастанием «беспорядка» при повышении температуры. Все вещества при низких температурах имеют твердое агрегатное состояние, которое при нагревании в определенный момент (фазовый переход) начинает плавиться (температура при этом не меняется и соответствует температуре плавления) и вещество переходит в жидкое состояние. Естественно, что беспорядок жидкости будет выше твердого тела. Дальнейшее нагревание приведет к кипению жидкости, также протекающему при Т=const. Образовавшийся газ наиболее беспорядочен, при этом дальнейшее повышение температуры будет приводить к возрастанию его энтропии. Вывод: энтропия вещества увеличивается при повышении температуры. При фазовых переходах возрастает скачкообразно.

Энтропия – характеристика упорядоченности вещества В отличие от энтальпии и внутренней энергии для различных веществ можно определить абсолютное значение энтропии. Поскольку энтропия является экстенсивной возрастающей функцией температуры, ее задают для стандартных условий и обозначают So. Значения стандартных энтропий для некоторых соединений приведены в таблице 5. 2. Вещество и состояние Ag (к) Ag. Br (к) Ag. Cl (к) Ag. F (к) Ag. I (к) Al. Cl 3 (к) Al 2 O 3 (к) C (к, алмаз) C (к, графит) CH 4 (г) CO 2 (г) So, 298, 15 Дж/(моль К) 42, 55 107, 1 96, 1 84 115, 5 28, 34 109, 3 50, 9 2, 37 5, 74 186, 31 197, 54 213, 67 Вещество и состояние Cl 2 (г) HCl (г) H 2 (г) I 2 (к) HI (г) N 2 (г) NH 3 (г) NO 2 (г) N 2 O 4 (г) O 2 (г) Si. O 2 (к, a -кварц) So, 298, 15 Дж/(моль К) 222, 98 186, 79 130, 52 116, 1 206, 48 191, 5 192, 6 210, 6 240, 2 219, 86 303, 8 205, 04 41, 84

Энтропия – характеристика упорядоченности вещества Из представленных данных следует, что энтропия характеризует фазовое состояние веществ. Наибольшее значение она имеет для газов, наименьшее для кристаллов с высокой симметрией и упорядоченностью (алмаз, графит). – для простых веществ, чем «проще» соединение, тем ниже его энтропия (N 2, NO, N 2 O, N 2 O 4). В ряду галогенидов серебра, энтропия увеличивается от Ag. F к Ag. I. Вывод: чем более сложное вещество и выше его беспорядочность (газы) тем выше его энтропия. Для энтропии (также как и для всех функций состояния) справедливо следствие из закона Гесса, которое позволяет рассчитывать изменение энтропии в различных реакциях: a 1 А 1+ a 2 А 2 + a 3 А 3+…= b 1 В 1 + b 2 В 2 + b 3 В 3 или (Σ ai. Аi = Σ bi. Bi ), тогда изменение энтропии можно определить по уравнению: ΔS = Σ bi. So. Bi – Σai. So. Аi Если в ходе реакции объём возрастает, то . возрастает , т. е. усложняется состав

Энтропия – характеристика упорядоченности вещества Изменение энтропии ΔS в ходе реакции образования соединений из простых веществ называют энтропией образования ΔSобр, при этом энтропия образования отличается от стандартной энтропии этого вещества. В изолированных системах все реальные процессы (например, расширение газа, диффузия, теплопередача) протекают в сторону увеличения энтропии. В результате этих процессов система приходит в состояние термодинамического равновесия, и ее макроскопические параметры (V, P, T) перестают меняться. В этом состоянии энтропия системы достигает максимального значения. Поэтому состояние термодинамического равновесия изолированной системы можно определить, как состояние с максимальным значением энтропии, или с максимальной величиной хаоса.

Условия переходов. Понятие равновесия Только для изолированной системы, у которой нет обмена энергией с окружающей средой, энтропия является единственным фактором, определяющим возможность протекания процессов. На практике, обычно системы закрытые, в которых изменяется внутренняя энергия и может совершаться работа против внешних сил. Для таких систем критерием направления протекания процесса является не только стремление системы перейти в состояние с наибольшей термодинамической вероятностью, но и стремление системы перейти в состояние с наименьшей энергией, т. е. выделить теплоту в окружающую среду. Стремление среды к увеличению энтропии называется энтропийным фактором. Стремление системы к уменьшению энергии называется энтальпийным фактором.

Самопроизвольный и вынужденный процессы Главный вопрос, на который отвечает химическая термодинамика – это возможность перехода ТДС из одного состояния в другое. Точнее определение условий, когда такой процесс реализуется. Поскольку состояние системы характеризуется постоянством макропарметров, любое превращение в системе обязательно приведет к изменению какой-либо функции состояния. Например, плавление льда сопровождается увеличением внутренней энергии и, наоборот, замерзание воды ее уменьшением. При этом, либо тот, либо другой процесс протекают в определенных условиях без нашего вмешательства. Эти условия легко определяются: при стандартном и неизменном давлении все решает температура, при Т>273 К будет плавление, при Т< 273 К – замерзание. Отсюда вывод – ТДС в одних условиях может перейти к данному состоянию, и такой процесс мы будем называть самопроизвольным, обратный процесс самостоятельно невозможен – назовем его вынужденным. Изменяя внешние условия, можно вернуть систему в исходное состояние, за счет обратимости большинства процессов, при этом вынужденный процесс уже будет самопроизвольным.

Работа – критерий самопроизвольности Из рассмотренного примера, очевидно, что одного изменения энергии системы не достаточно, для определения самопроизвольного процесса, необходимо учитывать только определенную форму энергии – работу. Герман Людвиг Фердинанд фон Гельмгольц (1821, — 1894, ) — немецкий физик, физиолог и психолог Определим самопроизвольный процесс – как процесс, в результате протекания, которого можно получить полезную работу, и будем считать, что она при этом положительна А>0, тогда обратный – вынужденный процесс можно совершить только затратив работу, и А<0. Однако работа не является функцией состояния и для определения условия самопроизвольности, введем дополнительные функции – изохорно-изотермический и изобарно-изотремический потенциалы.

Энергия Гельмгольца – мера самопроизвольного протекания процессов при V, Т=const. Для определения условия самопроизвольности в изохорноизотермических условиях (V, Т=const) рассмотрим закрытую ТДС. Из первого начала ТД: Q = ΔU + А, из второго ΔS = T/Q, решаем эту систему относительно работы получаем: А = - (ΔU- TΔS). Выражение в скобках обозначим ΔF и определим новую функцию состояния как: F = U – TS Эта функция получила название – изохорно-изотермический потенциал или свободная энергия Гельмгольца. Физический смысл ее: ΔF = -АV, T, то есть, изменение энергии Гельмгольца – это максимальная полезная работа, совершаемая в изохорноизотермическом процессе с обратным знаком, что означает убыль этой энергии в самопроизвольном процессе. Герман Людвиг Фердинанд фон Гельмгольц (1821, — 1894, ) — немецкий физик, физиолог и психолог

Энергия Гиббса мера самопроизвольного протекания процессов при Р, Т=const. В случае изобарно-изотермического процесса, вместо ΔU необходимо рассматривать ΔН, уже учитывающую величину работы расширения, тогда сумма всех остальных видов работ будет являться максимальной полезной работой АР, T и: АР, Т = - (ΔН- TΔS), или ΔG = ΔН- TΔS Здесь G - изобарно-изотермический потенциал или свободная энергия Гиббса, изменение которой есть работа с обратным знаком ΔG=-АР, Т, совершаемая в изобарноизотермическом процессе. ΔG и ΔF являются функциями состояния системы. Вывод: в самопроизвольных процессах G и F должны убывать, а их изменения – ΔG и ΔF <0. Джозайя Уиллард Гиббс (англ. Josiah Willard Gibbs; 1839— 1903) — американский математик, физик и физикохимик, один из создателей векторного анализа, статистической физики, математической теории термодинамики

Соотношения между термодинамическими функциями состояния Почти все рассмотренные ТДФ состояния являются энергиями (кроме энтропии – отношение энергии к температуре). Поэтому между ними легко установить следующие соотношения, представленные на рис. 5. 4. Функцией, из которой получаются остальные, является внутренняя энергия: Рис. 5. 4. Связь между термодинамическими функциями Рис. 5. 4. Связь между состояния. термодинамическими Из этих выражений следует, что самой большой, функциями состояния. учитывающей работу расширения будет энтальпия – энергосодержание системы, самой маленькой – энергия Гельмгольца. Изменения энтальпии и внутренней энергии определяют тепловые эффекты процессов, энергии Гиббса и Гельмгольца – их полезную работу. Из этого следует, что вся теплота не может перейти в полезную работу, так как есть потерянная или связанная энергия (ТΔS), расходующаяся на увеличение энтропии. Изменения энергий Гиббса и Гельмгольца: отличаются на величину работы расширения, поэтому для процессов в онденсированных средах в ходе реакции , тогда .

Условие равновесия и его положение в обратимых химических реакциях Система, находящаяся бесконечно долго в определенном состоянии с постоянными значениями макропараметров является равновесной, а такое состояние – состоянием термодинамического равновесия. При этом все термодинамические функции состояния будут иметь постоянные значения, то есть энергии Гиббса (G) или Гельмгольца (F) не изменяются и являются минимальными, работа против внешних сил не совершается. Следовательно, условием равновесия будет: ΔG=0, при Р, Т = const. ΔF=0, при V, Т = const. образования 1 -го моль соединения из простых веществ при стандартных условиях, называется стандартной энергией Гиббса и обозначается ΔGообр. Изменение энергии Гиббса хр в ходе химической реакции можно рассчитать, используя следствие из закона Гесса, ΔGхр равно сумме энергий Гиббса продуктов реакции за вычетом суммы энергий Гиббса реагентов с учётом стехиометрических коэффициентов и для реакции: Σ ai. Аi = Σ bi. Bi ΔG = Σ biΔGo. Bi - ΣaiΔGo. Аi ΔGообр = 0 – для простых веществ рис. 5. 5 б) ΔG>0 самопроизвольно будет протекать обратная реакция (рис. 5. 5 в).

Р и с. 5. 5 И з м е н и е э н е р г и и Г и б б с а в р е Условие равновесия и его положение в обратимых химических реакциях Величина и знак ΔG или ΔF определяют возможность самопроизвольного протекания процесса и положение равновесия. При протекании химической реакции свободные энергии должны убывать и достигать минимального значения при установлении равновесия. Рассмотрим реакцию между веществами А и В (рис. 5. 5). ΔG=0 между исходными веществами и продуктами реакции установится равновесие посередине: это означает–вещества прореагировали наполовину (рис. 5. 5 а). ΔG<0 процесс идет слева направо или в прямом направлении (продуктов много,

Р и с. 5. 5 И з м е н и е Условие равновесия и его положение в обратимых химических реакциях Определим условия, при которых различные реакции могут протекать самопроизвольно (в прямом направлении) или вынуждено (в обратном). Таблица 5. 5. Изменение ТДФС как характеристика направления процесса. Вывод э н е р г и и − + − Протекает самопроизвольно при любой T − − − + Протекает при низких T + + + − Протекает при высоких T Г и б б с а + − + Не протекает (протекает в обратном направлении) в р е Из данных таблицы 5. 5 следует, что эндотермические реакции возможны только при высоких температурах и увеличении энтропии в ходе процесса.

Фазовые переходы и равновесия В гетерогенных системах существует несколько фаз. Фаза – это часть системы реально отделенная от других частей границей раздела и характеризующаяся другими значениями макропараметров (например, плотность, концентрация, теплоемкость и т. п. ). Если в системе число и состав фаз не меняется, то система находится в состоянии фазового равновесия. Это означает, что между фазами отсутствует тепловое, механическое и химическое взаимодействие. Изменение количества одного и того же компонента в разных фазах возможно только при фазовом переходе. Фазовый переход (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую, даже без изменения внешних условий (например, плавление льда при стандартных давлении и температуре). Фазовый переход происходит, когда вещество пересекает поверхность, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда существует термодинамический параметр или функция состояния, которая скачкообразно меняется при фазовом переходе (например, энтропия).

Классификация фазовых переходов При фазовом переходе первого рода скачкообразно изменяются основные экстенсивные параметры и функции: объём, внутренняя энергия, энтропия и т. п. Наиболее распространённые примеры фазовых переходов первого рода связаны с изменением агрегатного состояния вещества: плавление и кристаллизация; кипение и конденсация; сублимация и десублимация. При фазовом переходе второго рода плотность и внутренняя энергия могут сохраняться, резко меняются их производные по температуре и давлению: теплоёмкость, коэффициент теплового расширения, различные восприимчивости и т. д. Фазовые переходы второго рода происходят в тех случаях, когда меняется симметрия строения вещества (симметрия может полностью исчезнуть или понизиться). Наиболее распространённые примеры фазовых переходов второго рода: переход парамагнетик-ферромагнетик или парамагнетик-антиферромагнетик (параметр порядка — намагниченность); переход металлов и сплавов в состояние сверхпроводимости (параметр порядка — плотность сверхпроводящего конденсата); переход аморфных материалов в стеклообразное состояние.

Химический потенциал В открытых системах изменение внутренней энергии происходит не только в результате получения или отдачи теплоты и совершения работы, но и за счёт изменения масс, входящих в систему компонентов. Все свойства открытых систем и ΔG будут зависеть от количества каждого компонента: ΔG=μ dn, где ΔG - энергия Гиббса, μ – химический потенциал, dn – изменённое количество вещества системы выраженное в молях. Химический потенциал – интенсивный параметр состояния. В условиях, и сохранения количеств всех других компонентов, μ равен частной производной энергии Гиббса по количеству компонента: μi = (∂G/∂ni)P, T, i ≠j Если в системе – компонентов, то. Химический потенциал зависит от парциального давления компонента (для газов) или от его концентрации в растворе: μi = μio+ RTlnpi; μi = μio+ RTlnci, здесь μio стандартное значение химического потенциала, полученное при стандартных условиях и единичных концентрациях или давлениях.

Условия фазового перехода и равновесия Рассмотрим химически однородную гетерогенную систему (состоящую из одного компонента). Пусть в этой системе имеется граница раздела между фазами 1 и 2 (рис. 5. 6). Если из фазы 1 в фазу 2 переходит вещества, то изменение энергии Гиббса в фазе 1 будет равно: ΔG 1 = -μ 1Δn, а в фазе 2: ΔG 2 = μ 2Δn (знак минус указывает на убыль энергии, + на ее увеличение). Общее изменение энергии системы будет равно их сумме: ΔG = -μ 1Δn + μ 2Δn Для того чтобы фазовый переход произошел ΔG < 0, что возможно при условии: -μ 1Δn + μ 2Δn< 0, или μ 1 > μ 2 Отсюда следует вывод – фазовый переход компонента осуществляется из фазы с большим химическим потенциалом в фазу с меньшим. Равновесие между фазами возможно только в том Рис. 5. 6. Переход вещества из случае, когда химические потенциалы фазы 1 в фазу 2. компонента в этих фазах равны:

Условия фазового перехода и равновесия Данный вывод можно распространить для общего случая перехода вещества из какой-либо системы в окружающую среду (открытые системы) и записать его так: независимо от числа компонентов открытой системы возможен переход любого из них в другую фазу окружающей среды и, наоборот, при условии выравнивания химических потенциалов этого компонента в фазах системы и среды. При равенстве химических потенциалов наступает равновесие между фазами – сколько вещества уходит из системы, столько же и возвращается.
Химическая термодинамика.pptx