термодинамика.pptx
- Количество слайдов: 25
 Химическая термодинамика
Химическая термодинамика
 Термодинамические функции состояния vвнутренняя энергия U, к. Дж/моль или к. Дж; (∆U) v энтальпия Н, к. Дж/моль или к. Дж; (∆H) vэнтропия S, к. Дж/моль*K; (∆S) v энергия Гиббса G, к. Дж/моль или к. Дж; (∆G)
Термодинамические функции состояния vвнутренняя энергия U, к. Дж/моль или к. Дж; (∆U) v энтальпия Н, к. Дж/моль или к. Дж; (∆H) vэнтропия S, к. Дж/моль*K; (∆S) v энергия Гиббса G, к. Дж/моль или к. Дж; (∆G)
 Внутренняя энергия химической системы включает в себя все виды энергии: энергию движения молекул, атомов, ядер, электронов и т. д. , энергию взаимодействия этих частиц друг с другом , т. е. энергию, заключенную в межмолекулярных и химических связях, внутриядерную и другие виды энергий, кроме кинетической энергии системы в целом и потенциальной энергии ее положения
Внутренняя энергия химической системы включает в себя все виды энергии: энергию движения молекул, атомов, ядер, электронов и т. д. , энергию взаимодействия этих частиц друг с другом , т. е. энергию, заключенную в межмолекулярных и химических связях, внутриядерную и другие виды энергий, кроме кинетической энергии системы в целом и потенциальной энергии ее положения
 Стандартная энтальпия образования химического соединения есть тепловой эффект реакции образования одного моля этого соединения из простых веществ в их наиболее устойчивом состоянии при стандартных условиях. Пример: Так, например, можно рассчитать ∆H⁰ реакции, если теплоты образования Al 2 O 3, SO 3, Al 2(SO 4)3 соответственно равны -1675, 7; - 395, 8; -3441, 8 к. Дж/моль, и определите, какая это реакция (экзотермическая или эндотермическая): Al 2 O 3(тв) + 3 SO 3(г) = Al 2(SO 4)3(тв) Решение: ∆H⁰ = ∆H⁰обр(Al 2(SO 4)3) - ∆H⁰обр(Al 2 O 3) - 3∆H⁰обр(SO 3) =-578, 7 (к. Дж) Т. к. ∆H⁰ < 0 , то реакция - экзотермическая
Стандартная энтальпия образования химического соединения есть тепловой эффект реакции образования одного моля этого соединения из простых веществ в их наиболее устойчивом состоянии при стандартных условиях. Пример: Так, например, можно рассчитать ∆H⁰ реакции, если теплоты образования Al 2 O 3, SO 3, Al 2(SO 4)3 соответственно равны -1675, 7; - 395, 8; -3441, 8 к. Дж/моль, и определите, какая это реакция (экзотермическая или эндотермическая): Al 2 O 3(тв) + 3 SO 3(г) = Al 2(SO 4)3(тв) Решение: ∆H⁰ = ∆H⁰обр(Al 2(SO 4)3) - ∆H⁰обр(Al 2 O 3) - 3∆H⁰обр(SO 3) =-578, 7 (к. Дж) Т. к. ∆H⁰ < 0 , то реакция - экзотермическая
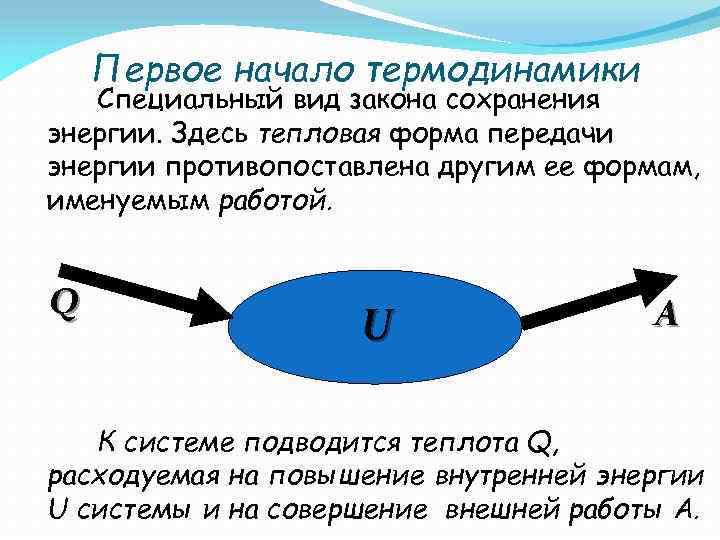 Первое начало термодинамики Специальный вид закона сохранения энергии. Здесь тепловая форма передачи энергии противопоставлена другим ее формам, именуемым работой. Q U A К системе подводится теплота Q, расходуемая на повышение внутренней энергии U системы и на совершение внешней работы A.
Первое начало термодинамики Специальный вид закона сохранения энергии. Здесь тепловая форма передачи энергии противопоставлена другим ее формам, именуемым работой. Q U A К системе подводится теплота Q, расходуемая на повышение внутренней энергии U системы и на совершение внешней работы A.
 Законы термохимии Закон Гесса. тепловой эффект химической реакции не зависит от пути ее протекания, а зависит лишь от начального и конечного состояний системы(при р, T=const или V, Т=const). Закон Лавуазье, Лапласа. тепловой эффект образования химического соединения равен по величине, но обратен по знаку тепловому эффекту его разложения, т. е. ΔHобр. =ΔHразл. .
Законы термохимии Закон Гесса. тепловой эффект химической реакции не зависит от пути ее протекания, а зависит лишь от начального и конечного состояний системы(при р, T=const или V, Т=const). Закон Лавуазье, Лапласа. тепловой эффект образования химического соединения равен по величине, но обратен по знаку тепловому эффекту его разложения, т. е. ΔHобр. =ΔHразл. .
 Условия стандартного состояния веществ Состояние вещества Простое твердое вещество Стандартное состояние вещества Кристаллическое твердое вещество Простое жидкое вещество Чистая жидкость Газообразное состояние Парциальное давление 100 к. Па или относительное давление 1 Растворенное вещество Концентрация 1 моль/л
Условия стандартного состояния веществ Состояние вещества Простое твердое вещество Стандартное состояние вещества Кристаллическое твердое вещество Простое жидкое вещество Чистая жидкость Газообразное состояние Парциальное давление 100 к. Па или относительное давление 1 Растворенное вещество Концентрация 1 моль/л
 Следствия из законов С целью нахождения тепловых эффектов процессов с термохимическими уравнениями можно обращаться как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям. Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов. ΔH = ΣΔHобр. конечн – ΣΔHобр. нач
Следствия из законов С целью нахождения тепловых эффектов процессов с термохимическими уравнениями можно обращаться как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям. Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов. ΔH = ΣΔHобр. конечн – ΣΔHобр. нач
 Стандартная энтальпия образования химического соединения есть тепловой эффект реакции образования одного моля этого соединения из простых веществ в их наиболее устойчивом состоянии при стандартных условиях. Пример: Так, например, можно рассчитать ∆H⁰ реакции, если теплоты образования Al 2 O 3, SO 3, Al 2(SO 4)3 соответственно равны -1675, 7; - 395, 8; -3441, 8 к. Дж/моль, и определите, какая это реакция (экзотермическая или эндотермическая): Al 2 O 3(тв) + 3 SO 3(г) = Al 2(SO 4)3(тв) Решение: ∆H⁰ = ∆H⁰обр(Al 2(SO 4)3) - ∆H⁰обр(Al 2 O 3) - 3∆H⁰обр(SO 3) =-578, 7 (к. Дж) Т. к. ∆H⁰ < 0 , то реакция - экзотермическая
Стандартная энтальпия образования химического соединения есть тепловой эффект реакции образования одного моля этого соединения из простых веществ в их наиболее устойчивом состоянии при стандартных условиях. Пример: Так, например, можно рассчитать ∆H⁰ реакции, если теплоты образования Al 2 O 3, SO 3, Al 2(SO 4)3 соответственно равны -1675, 7; - 395, 8; -3441, 8 к. Дж/моль, и определите, какая это реакция (экзотермическая или эндотермическая): Al 2 O 3(тв) + 3 SO 3(г) = Al 2(SO 4)3(тв) Решение: ∆H⁰ = ∆H⁰обр(Al 2(SO 4)3) - ∆H⁰обр(Al 2 O 3) - 3∆H⁰обр(SO 3) =-578, 7 (к. Дж) Т. к. ∆H⁰ < 0 , то реакция - экзотермическая
 Энтальпия - это сумма внутренней энергии системы и работы расширения или сжатия системы (p∆V). Qp =∆U + p∆V =∆H т. е. изобарный тепловой эффект реакции Qp равен изменению энтальпии. Энтальпия первого пути равна сумме энтальпий отдельных стадий второго пути
Энтальпия - это сумма внутренней энергии системы и работы расширения или сжатия системы (p∆V). Qp =∆U + p∆V =∆H т. е. изобарный тепловой эффект реакции Qp равен изменению энтальпии. Энтальпия первого пути равна сумме энтальпий отдельных стадий второго пути
 Энергия химической связи Eх. с – энергия, которую нужно затратить, чтобы превратить один моль газообразных молекул в отдельные газообразные атомы (при н. у. )(энергия атомизации). Средние стандартные энтальпии связи могут быть определены путем усреднения значений, найденных для целых классов соединений: < Eх. с. >=∆H° атомизации/∑х. с.
Энергия химической связи Eх. с – энергия, которую нужно затратить, чтобы превратить один моль газообразных молекул в отдельные газообразные атомы (при н. у. )(энергия атомизации). Средние стандартные энтальпии связи могут быть определены путем усреднения значений, найденных для целых классов соединений: < Eх. с. >=∆H° атомизации/∑х. с.
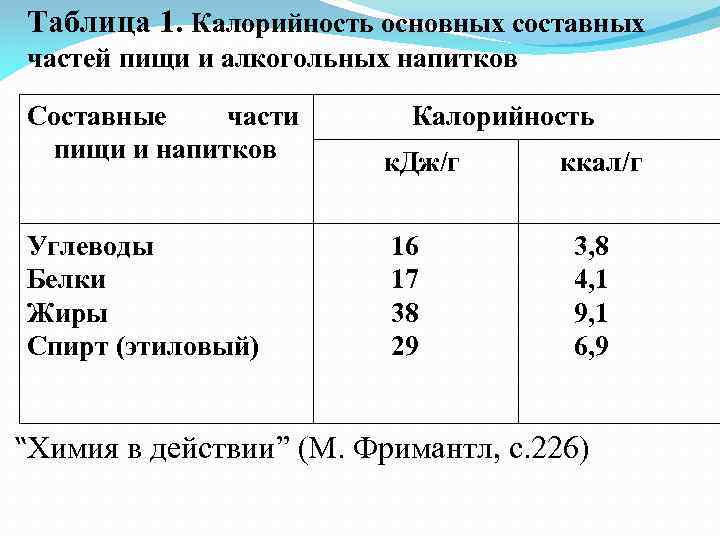 Таблица 1. Калорийность основных составных частей пищи и алкогольных напитков Составные части пищи и напитков Калорийность к. Дж/г Углеводы Белки Жиры Спирт (этиловый) 16 17 38 29 ккал/г 3, 8 4, 1 9, 1 6, 9 “Химия в действии” (М. Фримантл, с. 226)
Таблица 1. Калорийность основных составных частей пищи и алкогольных напитков Составные части пищи и напитков Калорийность к. Дж/г Углеводы Белки Жиры Спирт (этиловый) 16 17 38 29 ккал/г 3, 8 4, 1 9, 1 6, 9 “Химия в действии” (М. Фримантл, с. 226)
 Табл. 2 Продукты Калорийность к. Дж/г ккал/г Сливочное масло 30, 41 7, 40 Орехи 23, 64 5, 70 Сыр 16, 82 4, 06 Сахар 16, 80 3, 94 Рис 15, 36 3, 61 Мясо 11, 07 2, 66 Белый хлеб 9, 91 2, 33 Мороженое 6, 98 1, 66 Картофель 3, 69 0, 86 Апельсины 1, 50 0, 35 Пиво 1, 29 0, 31
Табл. 2 Продукты Калорийность к. Дж/г ккал/г Сливочное масло 30, 41 7, 40 Орехи 23, 64 5, 70 Сыр 16, 82 4, 06 Сахар 16, 80 3, 94 Рис 15, 36 3, 61 Мясо 11, 07 2, 66 Белый хлеб 9, 91 2, 33 Мороженое 6, 98 1, 66 Картофель 3, 69 0, 86 Апельсины 1, 50 0, 35 Пиво 1, 29 0, 31
 Энтропия (S) - функция состояния, характеризующая степень беспорядка системы. Энтропия системы зависит от: числа частиц в системе от природы вещества агрегатного состояния вещества от строения молекулы от температуры
Энтропия (S) - функция состояния, характеризующая степень беспорядка системы. Энтропия системы зависит от: числа частиц в системе от природы вещества агрегатного состояния вещества от строения молекулы от температуры
 Связь энтропии с числом частиц 0 вещество S , Дж/моль*град UCl 2 19, 0 UCl 3 38 UCl 4 47, 4 UCl 6 62, 0 При данном агрегатном состоянии значение энтропии тем больше, чем больше атомов содержится в молекуле.
Связь энтропии с числом частиц 0 вещество S , Дж/моль*град UCl 2 19, 0 UCl 3 38 UCl 4 47, 4 UCl 6 62, 0 При данном агрегатном состоянии значение энтропии тем больше, чем больше атомов содержится в молекуле.
 Зависимость Энтропии от температуры
Зависимость Энтропии от температуры
 ЭНТРОПИЯ Горячее тело Тепловая изоляция Q 1 теплота 2 d. S≥ 0 T 1>T 2 Холодное тело Закон возрастания энтропии или второе начало термодинамики: Энтропия изолированной термодинамической системы может только возрастать либо по достижении максимального значения оставаться постоянной.
ЭНТРОПИЯ Горячее тело Тепловая изоляция Q 1 теплота 2 d. S≥ 0 T 1>T 2 Холодное тело Закон возрастания энтропии или второе начало термодинамики: Энтропия изолированной термодинамической системы может только возрастать либо по достижении максимального значения оставаться постоянной.
 Свободная Энергия Гиббса G − термодинамическая функция состояния системы (к. Дж/моль). Изменение энергии Гиббса в системе при протекании химической реакции ∆G называют энергией Гиббса химической реакции. ∆G= ∆H-T∆S G A С B путь процесса Изменение энергии Гиббса при протекании процессов: AB-самопроизвольного BC-несамопроизвольного B-состояние равновесия
Свободная Энергия Гиббса G − термодинамическая функция состояния системы (к. Дж/моль). Изменение энергии Гиббса в системе при протекании химической реакции ∆G называют энергией Гиббса химической реакции. ∆G= ∆H-T∆S G A С B путь процесса Изменение энергии Гиббса при протекании процессов: AB-самопроизвольного BC-несамопроизвольного B-состояние равновесия
 Стандартная Энергия Гиббса образования Стандартная энергия Гиббса образования (∆G° 298) – изменение ∆G реакции образования одного моля вещества из простых веществ в их устойчивом состоянии при стандартных условиях. Пример: Так, например, можно рассчитать стандартную энергию Гиббса реакции и определить возможность самопроизвольного ее протекания при любых условиях: NO (г) + 0. 5 O 2(г) =NO 2(г) Решение: NO (г) + 0. 5 O 2(г) = NO 2(г) ∆G° 298 126, 8 0 51, 8 (к. Дж/моль) ∆G°реакц = ∆G°обр(NO 2) - ∆G°обр(NO) = 51, 8 -126, 8 = -75 (к. Дж) Т. к. ∆G°реакц < -40 к. Дж, то протекание реакции возможно при любых условиях.
Стандартная Энергия Гиббса образования Стандартная энергия Гиббса образования (∆G° 298) – изменение ∆G реакции образования одного моля вещества из простых веществ в их устойчивом состоянии при стандартных условиях. Пример: Так, например, можно рассчитать стандартную энергию Гиббса реакции и определить возможность самопроизвольного ее протекания при любых условиях: NO (г) + 0. 5 O 2(г) =NO 2(г) Решение: NO (г) + 0. 5 O 2(г) = NO 2(г) ∆G° 298 126, 8 0 51, 8 (к. Дж/моль) ∆G°реакц = ∆G°обр(NO 2) - ∆G°обр(NO) = 51, 8 -126, 8 = -75 (к. Дж) Т. к. ∆G°реакц < -40 к. Дж, то протекание реакции возможно при любых условиях.
 Зависимость возможности самопроизвольного протекания реакции от функций состояния системы ΔH < 0 ΔS > 0 ΔG < 0 ΔH > 0 ΔS < 0 ΔG > 0 ΔH < 0 ΔS < 0 ΔG > 0, ΔG < 0 ΔH > 0 ΔS > 0 ΔG > 0, ΔG < 0 C 2 H 5–O–C 2 H 5 + 6 O 2 = 4 CO 2 + 5 H 2 O (реакция возможна при любой температуре) N 2(г) + 2 H 2 O(ж) = NH 4 NO 2(тв) (реакция невозможна) N 2 + 3 H 2 = 2 NH 3 (возможна при низкой температуре) N 2 O 4(г) = 2 NO 2(г) (возможна при высокой температуре).
Зависимость возможности самопроизвольного протекания реакции от функций состояния системы ΔH < 0 ΔS > 0 ΔG < 0 ΔH > 0 ΔS < 0 ΔG > 0 ΔH < 0 ΔS < 0 ΔG > 0, ΔG < 0 ΔH > 0 ΔS > 0 ΔG > 0, ΔG < 0 C 2 H 5–O–C 2 H 5 + 6 O 2 = 4 CO 2 + 5 H 2 O (реакция возможна при любой температуре) N 2(г) + 2 H 2 O(ж) = NH 4 NO 2(тв) (реакция невозможна) N 2 + 3 H 2 = 2 NH 3 (возможна при низкой температуре) N 2 O 4(г) = 2 NO 2(г) (возможна при высокой температуре).
 Использование значений ∆G на практике при нестандартных условиях На практике условия чаще всего нестандартные. Однако и в этом случае можно судить о направлении самопроизвольного протекания реакции по значению ∆G: ∆G°реакц < -40 к. Дж – реакция протекает в прямом направлении; ∆G°реакц > +40 к. Дж – реакция протекает в обратном направлении; -40< ∆G°реакц < +40 к. Дж – реакция может протекать как в прямом, так и в обратном направлении.
Использование значений ∆G на практике при нестандартных условиях На практике условия чаще всего нестандартные. Однако и в этом случае можно судить о направлении самопроизвольного протекания реакции по значению ∆G: ∆G°реакц < -40 к. Дж – реакция протекает в прямом направлении; ∆G°реакц > +40 к. Дж – реакция протекает в обратном направлении; -40< ∆G°реакц < +40 к. Дж – реакция может протекать как в прямом, так и в обратном направлении.
 Оценка устойчивости вещество ΔG 0 обр, к. Дж/моль H 2 O -228 H 2 S -33, 1 H 2 Se 73, 6 H 2 Te 138, 5 H 2 Po 160
Оценка устойчивости вещество ΔG 0 обр, к. Дж/моль H 2 O -228 H 2 S -33, 1 H 2 Se 73, 6 H 2 Te 138, 5 H 2 Po 160
 Сравнение конкурирующих реакций YCl 3(р-р)+Na 2 S(р-р) Обменная реакция 2 YCl 3 +6 Na 2 S=Y 2 S 3 +6 Na. Cl; Имеются термодинамические данные для молекул, в случае электролитов только для ионов. Расчет проводится для реакции в ионномолекулярном виде. 2 Y 3++3 S 2 -=Y 2 S 3 ΔG 0 обр -648 83, 6 -1130 ΔG 0 реакции=-1130 -[2*(-648)+3*83, 6]=-84, 8 к. Дж/моль
Сравнение конкурирующих реакций YCl 3(р-р)+Na 2 S(р-р) Обменная реакция 2 YCl 3 +6 Na 2 S=Y 2 S 3 +6 Na. Cl; Имеются термодинамические данные для молекул, в случае электролитов только для ионов. Расчет проводится для реакции в ионномолекулярном виде. 2 Y 3++3 S 2 -=Y 2 S 3 ΔG 0 обр -648 83, 6 -1130 ΔG 0 реакции=-1130 -[2*(-648)+3*83, 6]=-84, 8 к. Дж/моль
 2 YCl 3 Реакция гидролиза +3 Na S+6 H O=2 Y(OH) +3 H S +6 Na. Cl 2 2 3 2 2 Y 3++3 S 2 -+6 H 2 O= 2 Y(OH)3 +3 H 2 S ΔG 0 обр -648 83, 6 -238, 5 -1297 -33, 5 ΔG 0 реакции= ∑٧ jΔG 0 j- ∑٧ iΔG 0 i; ΔG 0 реакции =-218, 3 к. Дж/моль.
2 YCl 3 Реакция гидролиза +3 Na S+6 H O=2 Y(OH) +3 H S +6 Na. Cl 2 2 3 2 2 Y 3++3 S 2 -+6 H 2 O= 2 Y(OH)3 +3 H 2 S ΔG 0 обр -648 83, 6 -238, 5 -1297 -33, 5 ΔG 0 реакции= ∑٧ jΔG 0 j- ∑٧ iΔG 0 i; ΔG 0 реакции =-218, 3 к. Дж/моль.
 Оценка относительной устойчивости Ме в различных степенях окисления ΔG 0 реакции, к. Дж/моль +4 40, 6 +4 6, 3 +4 -136, 7 Ge O 2+Ge=2 Ge. O Sn O 2+Sn=2 Sn. O Pb O 2+Pb=2 Pb. O
Оценка относительной устойчивости Ме в различных степенях окисления ΔG 0 реакции, к. Дж/моль +4 40, 6 +4 6, 3 +4 -136, 7 Ge O 2+Ge=2 Ge. O Sn O 2+Sn=2 Sn. O Pb O 2+Pb=2 Pb. O


