Метод валентных связей.ppt
- Количество слайдов: 39
 Химическая связь
Химическая связь
 Химическая связь • Взаимодействие атомов приводит к возникновению химических связей, благодаря которым атомы объединяются в: ▫ ▫ ▫ молекулы; многоатомные свободные радикалы; молекулярные ионы многоатомные ионы; комплексы
Химическая связь • Взаимодействие атомов приводит к возникновению химических связей, благодаря которым атомы объединяются в: ▫ ▫ ▫ молекулы; многоатомные свободные радикалы; молекулярные ионы многоатомные ионы; комплексы
 Частицы с химическими связями • Молекула – мельчайшая частица вещества, сохраняющая его химические свойства. Молекулы электронейтральны и состоят из 2 и более атомов • Свободный радикал – частица с неспаренным электроном (R • ). Он может быть одноатомным и многоатомным • Молекулярный ион – многоатомная заряженная частица, образующаяся в результате отрыва электрона от молекулы (M • +, M+)
Частицы с химическими связями • Молекула – мельчайшая частица вещества, сохраняющая его химические свойства. Молекулы электронейтральны и состоят из 2 и более атомов • Свободный радикал – частица с неспаренным электроном (R • ). Он может быть одноатомным и многоатомным • Молекулярный ион – многоатомная заряженная частица, образующаяся в результате отрыва электрона от молекулы (M • +, M+)
 Типы химической связи • Ковалентная: ▫ неполярная (образуется между атомами с одинаковой электроотрицательностью); ▫ полярная (образуется между атомами с разной электроотрицательностью) • Ионная • Металлическая
Типы химической связи • Ковалентная: ▫ неполярная (образуется между атомами с одинаковой электроотрицательностью); ▫ полярная (образуется между атомами с разной электроотрицательностью) • Ионная • Металлическая
 Ковалентная связь • Ковалентная связь образована общей для двух атомов парой электронов • Ковалентная связь имеет характеристики: ▫ Энергия ▫ Длина ▫ Направленность (связи атома имеют определённое направление относительно друга). Направленность связей определяет геометрию молекул (валентные углы) ▫ Насыщаемость – строго определённое число связей, обусловленное числом неспаренных электронов атома
Ковалентная связь • Ковалентная связь образована общей для двух атомов парой электронов • Ковалентная связь имеет характеристики: ▫ Энергия ▫ Длина ▫ Направленность (связи атома имеют определённое направление относительно друга). Направленность связей определяет геометрию молекул (валентные углы) ▫ Насыщаемость – строго определённое число связей, обусловленное числом неспаренных электронов атома
 Энергия ковалентной связи • Это тепловой эффект гомолитического разрыва связи: Связь H-H Cl-Cl H-Cl Eсв, к. Дж/моль 432 239 427
Энергия ковалентной связи • Это тепловой эффект гомолитического разрыва связи: Связь H-H Cl-Cl H-Cl Eсв, к. Дж/моль 432 239 427
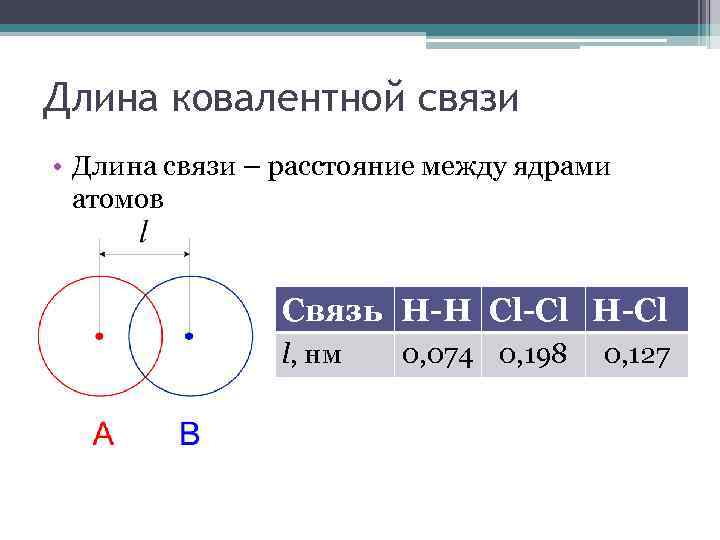 Длина ковалентной связи • Длина связи – расстояние между ядрами атомов Связь H-H Cl-Cl H-Cl l, нм 0, 074 0, 198 0, 127
Длина ковалентной связи • Длина связи – расстояние между ядрами атомов Связь H-H Cl-Cl H-Cl l, нм 0, 074 0, 198 0, 127
 Валентный угол образован направлениями химических связей, исходящими из одного атома Молекула φ, град 104, 45 107, 3 92, 3 180
Валентный угол образован направлениями химических связей, исходящими из одного атома Молекула φ, град 104, 45 107, 3 92, 3 180
 Метод валентных связей (МВС) • Два атома образуют химическую связь, если они имеют общую пару электронов (обмениваются электронами)
Метод валентных связей (МВС) • Два атома образуют химическую связь, если они имеют общую пару электронов (обмениваются электронами)
 Связь в молекуле водорода
Связь в молекуле водорода
 Связь в молекуле водорода (1, 2) = A(1)· B(2) – плотность вероятности нахождения электронов в области между ядрами (2, 1) = A(2)· B(1) ков = (1, 2) + (2, 1) p = [ (1, 2) + (2, 1)]2 = [ (2, 1) + (1, 2)]2 α = ± Например = 1, = 1 = 1, = -1 s = (1, 2) + (2, 1) – симметричная (содержит электроны с антипараллельными спинами) as = (1, 2) - (2, 1) – антисимметричная (содержит электроны с параллельными спинами)
Связь в молекуле водорода (1, 2) = A(1)· B(2) – плотность вероятности нахождения электронов в области между ядрами (2, 1) = A(2)· B(1) ков = (1, 2) + (2, 1) p = [ (1, 2) + (2, 1)]2 = [ (2, 1) + (1, 2)]2 α = ± Например = 1, = 1 = 1, = -1 s = (1, 2) + (2, 1) – симметричная (содержит электроны с антипараллельными спинами) as = (1, 2) - (2, 1) – антисимметричная (содержит электроны с параллельными спинами)
 Механизмы образования ковалентной связи • Обменный – каждый атом предоставляет 1 электрон
Механизмы образования ковалентной связи • Обменный – каждый атом предоставляет 1 электрон
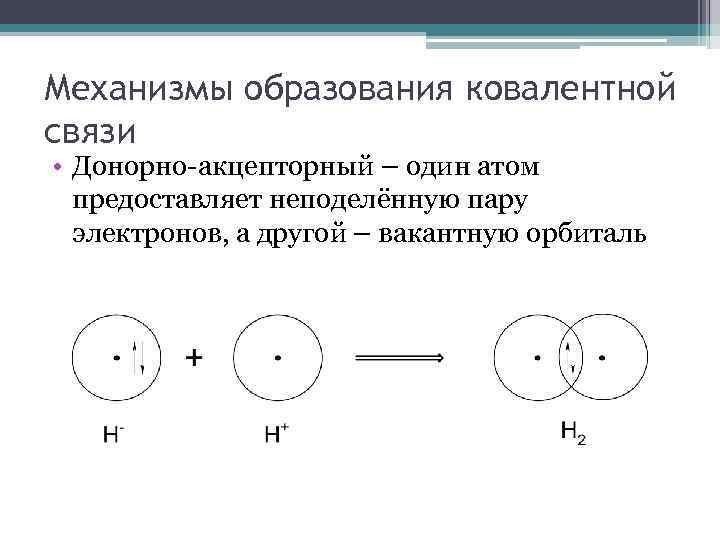 Механизмы образования ковалентной связи • Донорно-акцепторный – один атом предоставляет неподелённую пару электронов, а другой – вакантную орбиталь
Механизмы образования ковалентной связи • Донорно-акцепторный – один атом предоставляет неподелённую пару электронов, а другой – вакантную орбиталь
 Типы ковалентной связи • σ-Связь образована при перекрывании АО (s, p или d), когда область перекрывания АО лежит на линии, соединяющей ядра атомов • π-Связь образована при перекрывании АО (p или d), когда область перекрывания АО лежит сторонам от линии, соединяющей ядра атомов • δ-Связь образована при перекрывании d-АО, когда область перекрывания АО лежит сторонам от линии, соединяющей ядра атомов
Типы ковалентной связи • σ-Связь образована при перекрывании АО (s, p или d), когда область перекрывания АО лежит на линии, соединяющей ядра атомов • π-Связь образована при перекрывании АО (p или d), когда область перекрывания АО лежит сторонам от линии, соединяющей ядра атомов • δ-Связь образована при перекрывании d-АО, когда область перекрывания АО лежит сторонам от линии, соединяющей ядра атомов
 σ-Связь
σ-Связь
 π-Связь
π-Связь
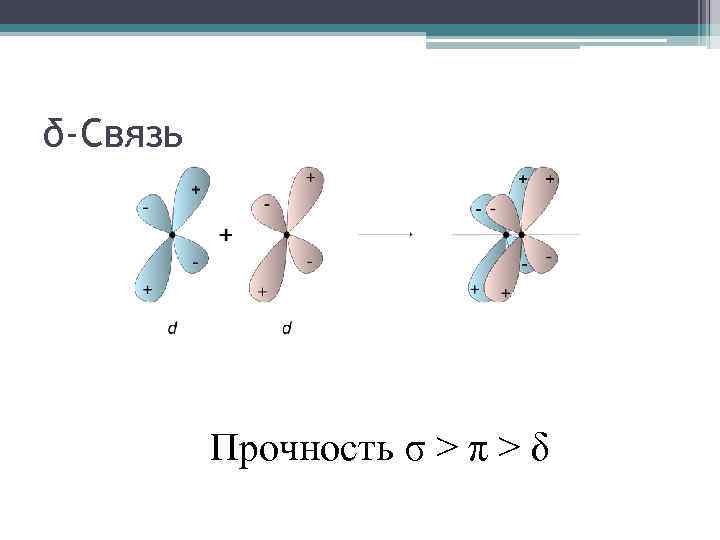 δ-Связь Прочность σ > π > δ
δ-Связь Прочность σ > π > δ
 Гибридизация АО • Гибридизация АО – математический приём, позволяющий заменить s-, p-, d-АО валентного электронного слоя гибридными АО, ориентация которых в пространстве объясняет реальное пространственное строение молекул
Гибридизация АО • Гибридизация АО – математический приём, позволяющий заменить s-, p-, d-АО валентного электронного слоя гибридными АО, ориентация которых в пространстве объясняет реальное пространственное строение молекул
 Гибридизация АО • Близкие по энергиям АО можно заменить таким же числом гибридных АО, энергия которых будет одинакова, а форма будет походить на форму исходных АО • Гибридные АО используются для образования только σ-связей или размещения неподелённых электронных пар
Гибридизация АО • Близкие по энергиям АО можно заменить таким же числом гибридных АО, энергия которых будет одинакова, а форма будет походить на форму исходных АО • Гибридные АО используются для образования только σ-связей или размещения неподелённых электронных пар
 sp-Гибридизация
sp-Гибридизация
 sp 2 -Гибридизация
sp 2 -Гибридизация
 sp 3 -Гибридизация
sp 3 -Гибридизация
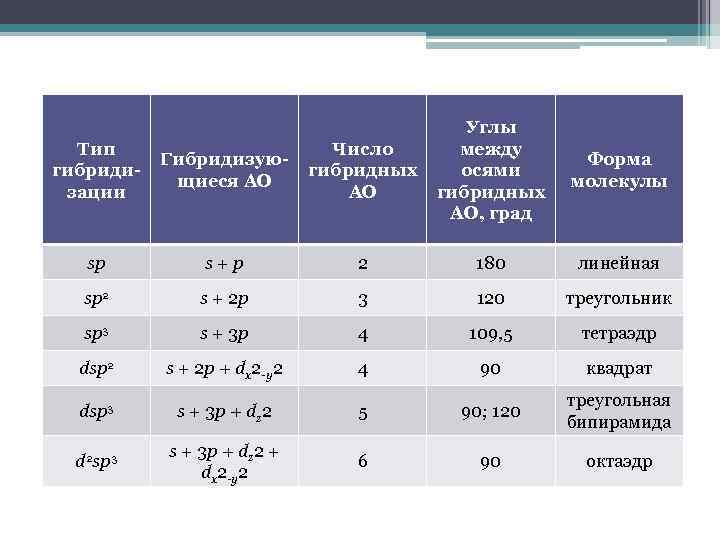 Тип гибридизации Гибридизующиеся АО Число гибридных АО Углы между осями гибридных АО, град sp s + p 2 180 линейная sp 2 s + 2 p 3 120 треугольник sp 3 s + 3 p 4 109, 5 тетраэдр dsp 2 s + 2 p + dx 2 -y 2 4 90 квадрат dsp 3 s + 3 p + dz 2 5 90; 120 треугольная бипирамида d 2 sp 3 s + 3 p + dz 2 + dx 2 -y 2 6 90 октаэдр Форма молекулы
Тип гибридизации Гибридизующиеся АО Число гибридных АО Углы между осями гибридных АО, град sp s + p 2 180 линейная sp 2 s + 2 p 3 120 треугольник sp 3 s + 3 p 4 109, 5 тетраэдр dsp 2 s + 2 p + dx 2 -y 2 4 90 квадрат dsp 3 s + 3 p + dz 2 5 90; 120 треугольная бипирамида d 2 sp 3 s + 3 p + dz 2 + dx 2 -y 2 6 90 октаэдр Форма молекулы
 Гибридизация и форма молекул
Гибридизация и форма молекул
 Теория отталкивания электронных пар валентных оболочек (Гиллеспи) • Форма молекулы определяется общим числом электронных пар (неподелённых пар электронов и пар электронов, участвующих в образовании σсвязей) • Эти пары электронов располагаются в пространстве так, чтобы их взаимодействие было минимальным • ЭXn. Em; q = n + m n – число σ-связывающих пар электронов; m – число неподелённых пар электронов • При определении геометрии молекул неподелённые пары электронов не учитываются
Теория отталкивания электронных пар валентных оболочек (Гиллеспи) • Форма молекулы определяется общим числом электронных пар (неподелённых пар электронов и пар электронов, участвующих в образовании σсвязей) • Эти пары электронов располагаются в пространстве так, чтобы их взаимодействие было минимальным • ЭXn. Em; q = n + m n – число σ-связывающих пар электронов; m – число неподелённых пар электронов • При определении геометрии молекул неподелённые пары электронов не учитываются
 ГИЛЛЕСПИ (Gillespie), Роналд Джеймс (1924) • Канадский физикохимик, один из создателей теории отталкивания электронных пар. В 1957 г. совместно с Р. Найхолмом разработал систему правил для рассмотрения и предсказания геометрических конфигураций молекул, известную как теория Гиллеспи – Найхолма или модель отталкивания электронных пар валентной оболочки (ОЭПВО)
ГИЛЛЕСПИ (Gillespie), Роналд Джеймс (1924) • Канадский физикохимик, один из создателей теории отталкивания электронных пар. В 1957 г. совместно с Р. Найхолмом разработал систему правил для рассмотрения и предсказания геометрических конфигураций молекул, известную как теория Гиллеспи – Найхолма или модель отталкивания электронных пар валентной оболочки (ОЭПВО)
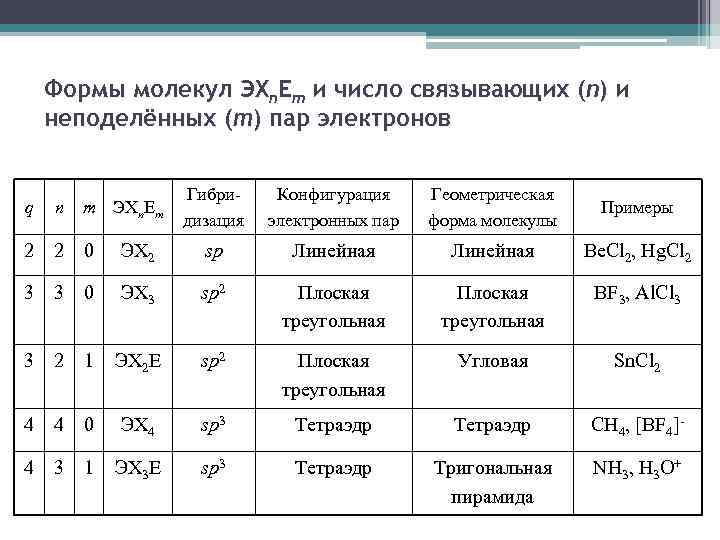 Формы молекул ЭXn. Em и число связывающих (n) и неподелённых (m) пар электронов Гибридизация Конфигурация электронных пар Геометрическая форма молекулы Примеры ЭX 2 sp Линейная Be. Cl 2, Hg. Cl 2 3 0 ЭX 3 sp 2 Плоская треугольная BF 3, Al. Cl 3 3 2 1 ЭX 2 E sp 2 Плоская треугольная Угловая Sn. Cl 2 4 4 0 ЭX 4 sp 3 Тетраэдр CH 4, [BF 4]- 4 3 1 ЭX 3 E sp 3 Тетраэдр Тригональная пирамида NH 3, H 3 O+ q n m ЭXn E m 2 2 0 3
Формы молекул ЭXn. Em и число связывающих (n) и неподелённых (m) пар электронов Гибридизация Конфигурация электронных пар Геометрическая форма молекулы Примеры ЭX 2 sp Линейная Be. Cl 2, Hg. Cl 2 3 0 ЭX 3 sp 2 Плоская треугольная BF 3, Al. Cl 3 3 2 1 ЭX 2 E sp 2 Плоская треугольная Угловая Sn. Cl 2 4 4 0 ЭX 4 sp 3 Тетраэдр CH 4, [BF 4]- 4 3 1 ЭX 3 E sp 3 Тетраэдр Тригональная пирамида NH 3, H 3 O+ q n m ЭXn E m 2 2 0 3
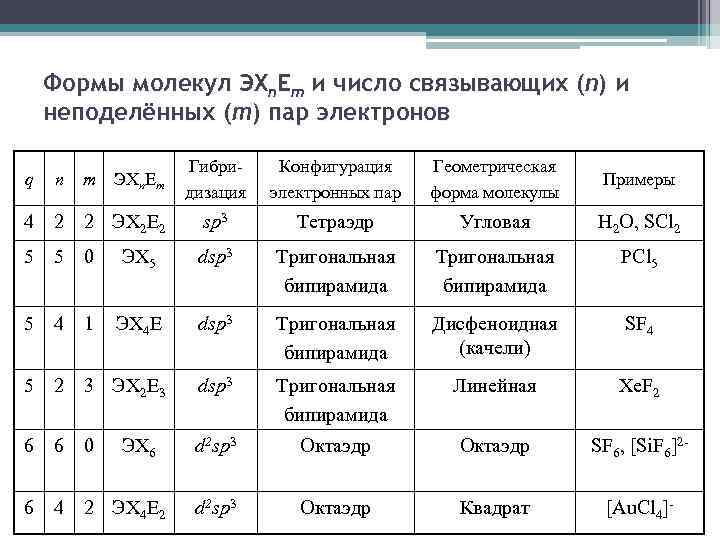 Формы молекул ЭXn. Em и число связывающих (n) и неподелённых (m) пар электронов m ЭXn E m Гибридизация Конфигурация электронных пар Геометрическая форма молекулы Примеры q n 4 2 2 ЭX 2 E 2 sp 3 Тетраэдр Угловая H 2 O, SCl 2 5 5 0 ЭX 5 dsp 3 Тригональная бипирамида PCl 5 5 4 1 ЭX 4 E dsp 3 Тригональная бипирамида Дисфеноидная (качели) SF 4 5 2 3 ЭX 2 E 3 dsp 3 Тригональная бипирамида Линейная Xe. F 2 6 6 0 d 2 sp 3 Октаэдр SF 6, [Si. F 6]2 - 6 4 2 ЭX 4 E 2 d 2 sp 3 Октаэдр Квадрат [Au. Cl 4]- ЭX 6
Формы молекул ЭXn. Em и число связывающих (n) и неподелённых (m) пар электронов m ЭXn E m Гибридизация Конфигурация электронных пар Геометрическая форма молекулы Примеры q n 4 2 2 ЭX 2 E 2 sp 3 Тетраэдр Угловая H 2 O, SCl 2 5 5 0 ЭX 5 dsp 3 Тригональная бипирамида PCl 5 5 4 1 ЭX 4 E dsp 3 Тригональная бипирамида Дисфеноидная (качели) SF 4 5 2 3 ЭX 2 E 3 dsp 3 Тригональная бипирамида Линейная Xe. F 2 6 6 0 d 2 sp 3 Октаэдр SF 6, [Si. F 6]2 - 6 4 2 ЭX 4 E 2 d 2 sp 3 Октаэдр Квадрат [Au. Cl 4]- ЭX 6
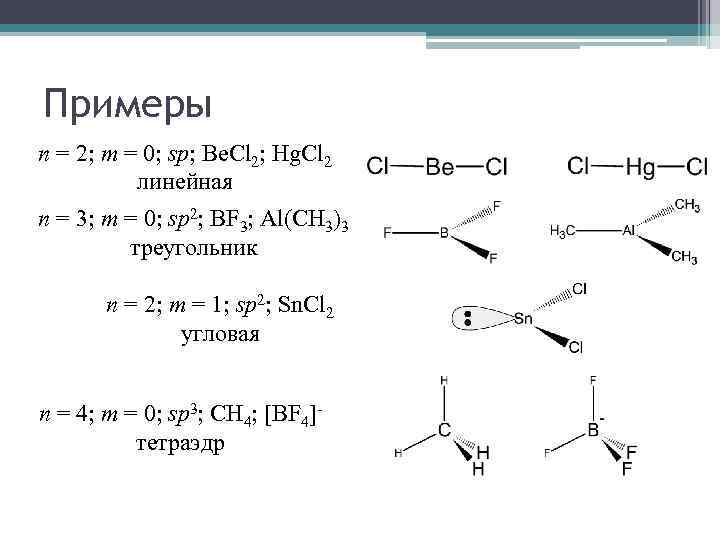 Примеры n = 2; m = 0; sp; Be. Cl 2; Hg. Cl 2 линейная n = 3; m = 0; sp 2; BF 3; Al(CH 3)3 треугольник n = 2; m = 1; sp 2; Sn. Cl 2 угловая n = 4; m = 0; sp 3; CH 4; [BF 4]тетраэдр
Примеры n = 2; m = 0; sp; Be. Cl 2; Hg. Cl 2 линейная n = 3; m = 0; sp 2; BF 3; Al(CH 3)3 треугольник n = 2; m = 1; sp 2; Sn. Cl 2 угловая n = 4; m = 0; sp 3; CH 4; [BF 4]тетраэдр
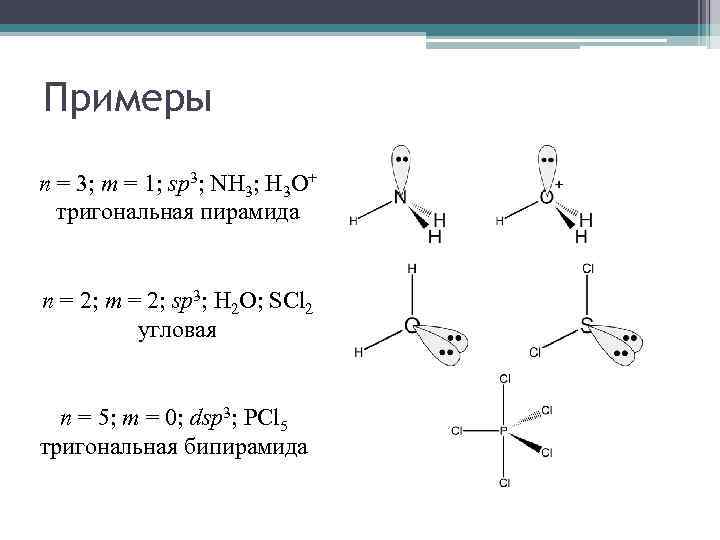 Примеры n = 3; m = 1; sp 3; NH 3; H 3 O+ тригональная пирамида n = 2; m = 2; sp 3; H 2 O; SCl 2 угловая n = 5; m = 0; dsp 3; PCl 5 тригональная бипирамида
Примеры n = 3; m = 1; sp 3; NH 3; H 3 O+ тригональная пирамида n = 2; m = 2; sp 3; H 2 O; SCl 2 угловая n = 5; m = 0; dsp 3; PCl 5 тригональная бипирамида
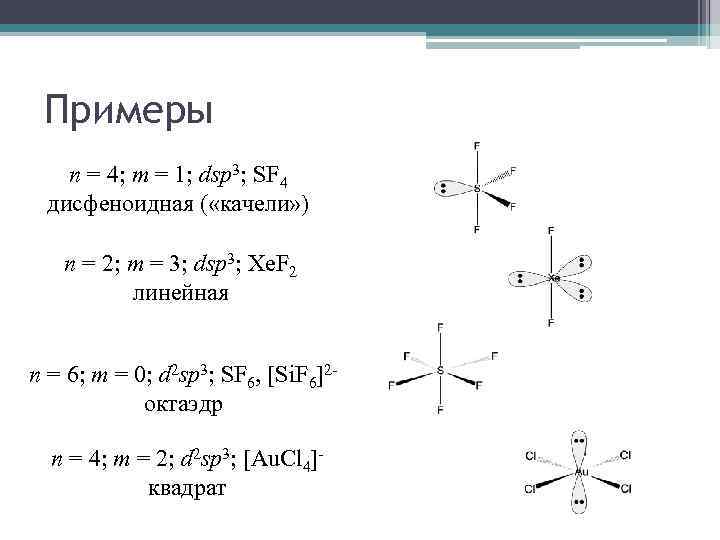 Примеры n = 4; m = 1; dsp 3; SF 4 дисфеноидная ( «качели» ) n = 2; m = 3; dsp 3; Xe. F 2 линейная n = 6; m = 0; d 2 sp 3; SF 6, [Si. F 6]2 октаэдр n = 4; m = 2; d 2 sp 3; [Au. Cl 4]квадрат
Примеры n = 4; m = 1; dsp 3; SF 4 дисфеноидная ( «качели» ) n = 2; m = 3; dsp 3; Xe. F 2 линейная n = 6; m = 0; d 2 sp 3; SF 6, [Si. F 6]2 октаэдр n = 4; m = 2; d 2 sp 3; [Au. Cl 4]квадрат
 Молекулы с π-связью COCl 2
Молекулы с π-связью COCl 2
 Полярность связей • Полярная связь образована атомами с разными ОЭО • Количественная характеристика полярности связи – электрический дипольный момент q – заряд на атоме - длина связи (вектор направлен от отрицательного заряда к положительному)
Полярность связей • Полярная связь образована атомами с разными ОЭО • Количественная характеристика полярности связи – электрический дипольный момент q – заряд на атоме - длина связи (вектор направлен от отрицательного заряда к положительному)
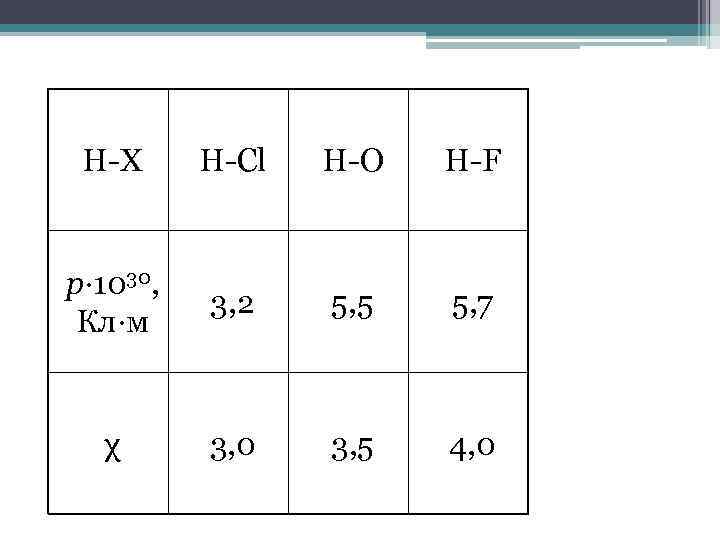 H-X H-Cl H-O H-F p∙ 1030, Кл∙м 3, 2 5, 5 5, 7 χ 3, 0 3, 5 4, 0
H-X H-Cl H-O H-F p∙ 1030, Кл∙м 3, 2 5, 5 5, 7 χ 3, 0 3, 5 4, 0
 Полярность молекул • Полярные молекулы содержат полярные связи • Электрический дипольный момент молекулы – векторная сумма электрических дипольных моментов связей
Полярность молекул • Полярные молекулы содержат полярные связи • Электрический дипольный момент молекулы – векторная сумма электрических дипольных моментов связей
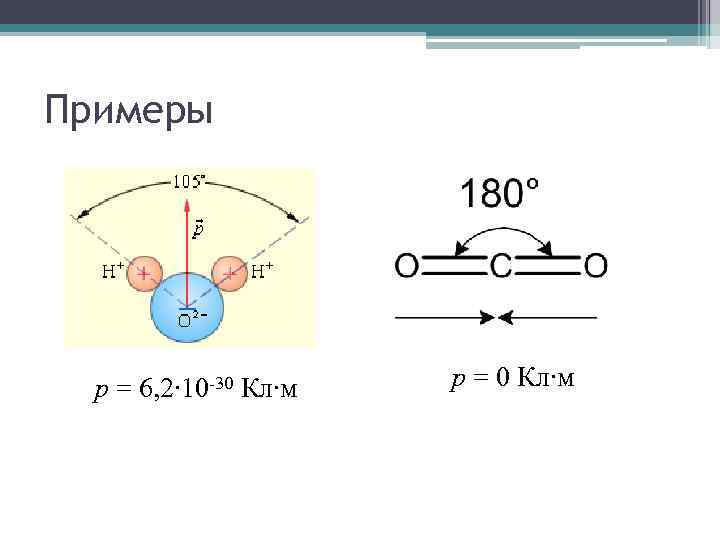 Примеры p = 6, 2∙ 10 -30 Кл∙м p = 0 Кл∙м
Примеры p = 6, 2∙ 10 -30 Кл∙м p = 0 Кл∙м
 Кислотность и полярность связей p∙ 1030, Кл∙м HF 6. 40 PH 3 H 2 S HCl 1, 83 3, 10 3, 47 HBr 2, 67 HI 1, 27
Кислотность и полярность связей p∙ 1030, Кл∙м HF 6. 40 PH 3 H 2 S HCl 1, 83 3, 10 3, 47 HBr 2, 67 HI 1, 27
 Магнитные свойства • Диамагнетики – в молекулах только спаренные электроны • Парамагнетики – в молекулах есть неспаренные электроны
Магнитные свойства • Диамагнетики – в молекулах только спаренные электроны • Парамагнетики – в молекулах есть неспаренные электроны


