Химическая связь.ppt
- Количество слайдов: 52
 Химическая связь
Химическая связь
 Химическая связь–электростатич. взаимодействие связывающее атомы в ионы, молекулы, кристаллы Основное условие - понижение полной энергии многоатомной системы по сравнению с энергией изолированных атомов Пример: А + В = АВ, ЕАВ EA + EB
Химическая связь–электростатич. взаимодействие связывающее атомы в ионы, молекулы, кристаллы Основное условие - понижение полной энергии многоатомной системы по сравнению с энергией изолированных атомов Пример: А + В = АВ, ЕАВ EA + EB
 Характеристики связи
Характеристики связи
 • Длина химической связи (l св) - расстояние между ядрами атомов в соед-ях • В однотипных соед-ях длина связи закономерно изменяется: HF – HCl – HBr – HI длина связи возрастает
• Длина химической связи (l св) - расстояние между ядрами атомов в соед-ях • В однотипных соед-ях длина связи закономерно изменяется: HF – HCl – HBr – HI длина связи возрастает
 • Энергия связи (Есв) – это энергия, выделяющаяся при образовании хим. связи или расходуемая на её разрыв • Взаимосвязь Есв и lсв: Молекула HF HCl HBr lсв, нм Есв к. Дж/моль HI 0, 092 0, 128 0, 142 0, 162 566 432 366 298
• Энергия связи (Есв) – это энергия, выделяющаяся при образовании хим. связи или расходуемая на её разрыв • Взаимосвязь Есв и lсв: Молекула HF HCl HBr lсв, нм Есв к. Дж/моль HI 0, 092 0, 128 0, 142 0, 162 566 432 366 298
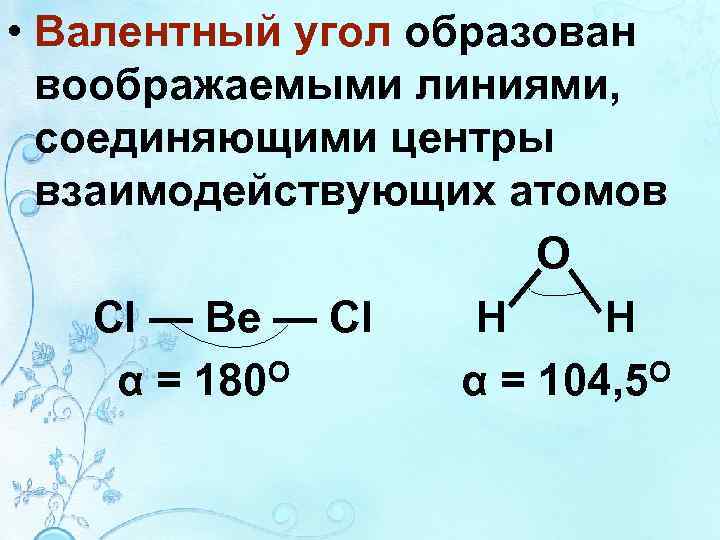 • Валентный угол образован воображаемыми линиями, соединяющими центры взаимодействующих атомов O Cl — Be — Cl H H α = 180 O α = 104, 5 O
• Валентный угол образован воображаемыми линиями, соединяющими центры взаимодействующих атомов O Cl — Be — Cl H H α = 180 O α = 104, 5 O
 Типы химических связей Распределение электронной плотности между взаимод-ми атомами определяет тип химической связи: • ковалентная • ионная • металлическая
Типы химических связей Распределение электронной плотности между взаимод-ми атомами определяет тип химической связи: • ковалентная • ионная • металлическая
 Ковалентная связь • наиболее общий вид химической связи, возникающий за счет образования общей электронной пары • обменный механизмкогда каждый из взаимодействующих атомов поставляет по одному электрону • донорно-акцепторный механизм электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
Ковалентная связь • наиболее общий вид химической связи, возникающий за счет образования общей электронной пары • обменный механизмкогда каждый из взаимодействующих атомов поставляет по одному электрону • донорно-акцепторный механизм электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
 ВИДЫ КОВАЛЕНТНОЙ СВЯЗИ ПОЛЯРНАЯ HCl, H 2 O НЕПОЛЯРНАЯ H 2, Cl 2, N 2.
ВИДЫ КОВАЛЕНТНОЙ СВЯЗИ ПОЛЯРНАЯ HCl, H 2 O НЕПОЛЯРНАЯ H 2, Cl 2, N 2.
 Обменный механизм образования ковалентной связи • Общие пары электронов образуются при спаривании неспаренных электронов, принадлежащих разным атомам. • При этом число неспаренных электронов у многих атомов ув-ся за счет распаривания спаренных электронов, если на вал. уровне есть свободные орбитали. • Этот процесс является переходом атома в возбужденное состояние.
Обменный механизм образования ковалентной связи • Общие пары электронов образуются при спаривании неспаренных электронов, принадлежащих разным атомам. • При этом число неспаренных электронов у многих атомов ув-ся за счет распаривания спаренных электронов, если на вал. уровне есть свободные орбитали. • Этот процесс является переходом атома в возбужденное состояние.

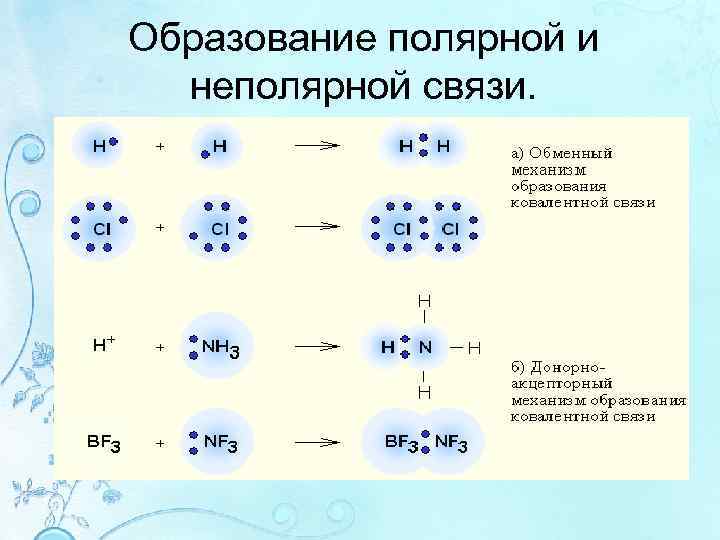 Образование полярной и неполярной связи.
Образование полярной и неполярной связи.
 Донорно-акцепторный механизм образования связи • связывающие эл-ные пары образ-ся объединением пары вал. электронов одного атома (донора) со свободной АО другого атома (акцептора) • Пример: BF 3 + F = BF 4 – – B F
Донорно-акцепторный механизм образования связи • связывающие эл-ные пары образ-ся объединением пары вал. электронов одного атома (донора) со свободной АО другого атома (акцептора) • Пример: BF 3 + F = BF 4 – – B F
 Ковалентная полярная связь образуется между атомами различных неметаллов. Схема образования ковалентной полярной связи: • • H* + • Cl: = H : Cl: • •
Ковалентная полярная связь образуется между атомами различных неметаллов. Схема образования ковалентной полярной связи: • • H* + • Cl: = H : Cl: • •
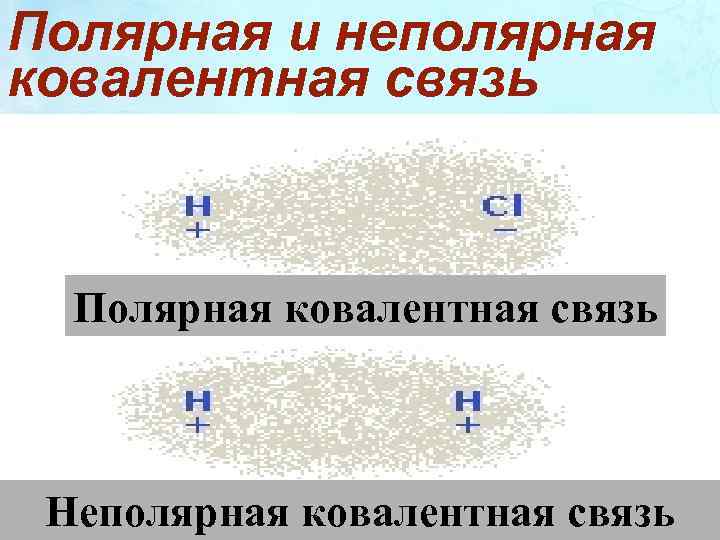 Полярная и неполярная ковалентная связь Полярная ковалентная связь Неполярная ковалентная связь
Полярная и неполярная ковалентная связь Полярная ковалентная связь Неполярная ковалентная связь
 Ковалентная связь Для объяснения механизма образования ковалентной хим. связи разработано несколько методов. Наиболее применимые: - метод валентных связей(ВС) - метод молекулярных орбиталей (МО)
Ковалентная связь Для объяснения механизма образования ковалентной хим. связи разработано несколько методов. Наиболее применимые: - метод валентных связей(ВС) - метод молекулярных орбиталей (МО)
 Метод валентных связей (ВС) • Связанные между собой атомы в молекуле удерживаются вместе при помощи одной или нескольких общих эл-ных пар • Химическая связь между двумя атомами локализована в месте перекрывания атомных орбиталей (локализованная двухцентровая связь)
Метод валентных связей (ВС) • Связанные между собой атомы в молекуле удерживаются вместе при помощи одной или нескольких общих эл-ных пар • Химическая связь между двумя атомами локализована в месте перекрывания атомных орбиталей (локализованная двухцентровая связь)
 Основные положения метода ВС • Ков. связь образуют два электрона с противоположными спинами, принадлежащие двум атомам • При образовании связи происходит перекрывание АО и увеличение электронной плотности между ними, что приводит к уменьшению энергии • Связь реализуется в направлении наибольшего перекрывания АО
Основные положения метода ВС • Ков. связь образуют два электрона с противоположными спинами, принадлежащие двум атомам • При образовании связи происходит перекрывание АО и увеличение электронной плотности между ними, что приводит к уменьшению энергии • Связь реализуется в направлении наибольшего перекрывания АО
 Валентность • определяется числом неспаренных электронов • Пример: атом Н (1 s 1) - валентность равна 1 атом Не (1 s 2) - валентность равна 0 • валентность может быть увеличена - промотированием атома - донорно-акцепторным взаимод.
Валентность • определяется числом неспаренных электронов • Пример: атом Н (1 s 1) - валентность равна 1 атом Не (1 s 2) - валентность равна 0 • валентность может быть увеличена - промотированием атома - донорно-акцепторным взаимод.
 Свойства ковалентной связи
Свойства ковалентной связи
 • Направленность хим. связи обусловлена перекрыванием электронных облаков • определяется направленностью в пространстве АО с l 0 • Атомные орбитали px-, py- и pzрасположены под углами 900 • d- орбитали: лепестки образуют угол 900, а между различными d- АО могут быть углы 1800, 900 и 450
• Направленность хим. связи обусловлена перекрыванием электронных облаков • определяется направленностью в пространстве АО с l 0 • Атомные орбитали px-, py- и pzрасположены под углами 900 • d- орбитали: лепестки образуют угол 900, а между различными d- АО могут быть углы 1800, 900 и 450
 • Насыщаемость – макс. возможное число связей, определяемое общим числом задействованных орбиталей • 1 -й период - макс. валентность = 1 • 2 -й период - макс. валентность = 4, т. к валентные 4 АО (2 s- и три 2 р) • 3 -й период - валентные 9 АО (3 s, три 3 р и пять 3 d), но макс. валентность практически не реализуется
• Насыщаемость – макс. возможное число связей, определяемое общим числом задействованных орбиталей • 1 -й период - макс. валентность = 1 • 2 -й период - макс. валентность = 4, т. к валентные 4 АО (2 s- и три 2 р) • 3 -й период - валентные 9 АО (3 s, три 3 р и пять 3 d), но макс. валентность практически не реализуется
 Кратность хим. связи - число общих электронных пар, реализующих связь между двумя атомами • Чем выше кратность связи, тем она прочнее (кратности больше 3 не бывает) • Кратность обусловлена характером перекрывания АО Молекула F 2 Кратность связи 1 Е св, к. Дж/моль 159 O 2 N 2 2 3 494 945
Кратность хим. связи - число общих электронных пар, реализующих связь между двумя атомами • Чем выше кратность связи, тем она прочнее (кратности больше 3 не бывает) • Кратность обусловлена характером перекрывания АО Молекула F 2 Кратность связи 1 Е св, к. Дж/моль 159 O 2 N 2 2 3 494 945
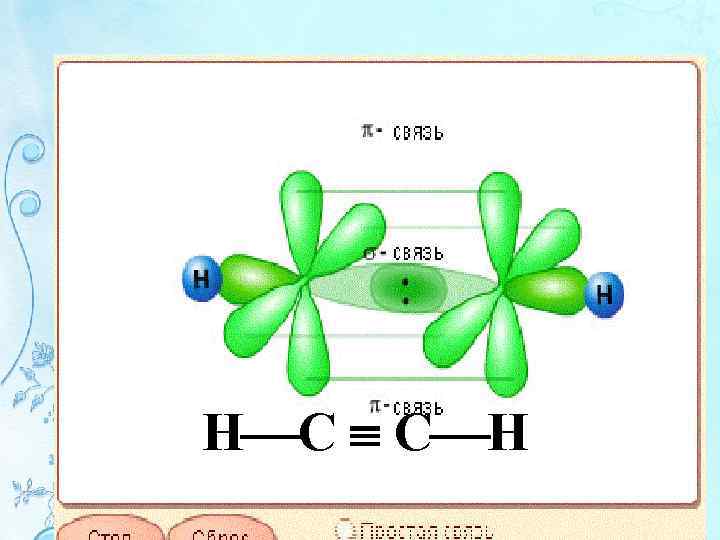
 Типы перекрывания атомных АО • -взаимодействие возникает при перекрывании орбиталей s – s и s – p, p – p, d – d вытянутых вдоль одной оси • - взаимодействие, перекрывание по линии, перпендикулярной линии связи • В молекуле N 2 - тройная связь (1 - и 2 -) N N
Типы перекрывания атомных АО • -взаимодействие возникает при перекрывании орбиталей s – s и s – p, p – p, d – d вытянутых вдоль одной оси • - взаимодействие, перекрывание по линии, перпендикулярной линии связи • В молекуле N 2 - тройная связь (1 - и 2 -) N N
 Типы перекрывания атомных АО • - (дельта) взаимодействие, при которой перекрываются d-орбитали четырьмя лепестками • По прочности хим. взаимодействия располагаются в следующей ряд: σ>π>δ • π и δ – взаимод-вия возникают как дополнительные к - взаимод-вию
Типы перекрывания атомных АО • - (дельта) взаимодействие, при которой перекрываются d-орбитали четырьмя лепестками • По прочности хим. взаимодействия располагаются в следующей ряд: σ>π>δ • π и δ – взаимод-вия возникают как дополнительные к - взаимод-вию
 H C C H
H C C H
 Гибридизация АО • Атом, взаимодействуя с несколькими одинаковыми партнерами, образует равнопрочные связи с участием электронов разных уровней. • Кроме того, углы между связями в подобных многоатомных молекулах не те, которые следовало бы ожидать из пространственного расположения взаимодействующих АО. Пример: в H 2 O – 104, 50, в NH 3 – 1070, в CH 4 – 109, 280 и т. д. • Для объяснения этих противоречий в теорию введено представление о гибридизации АО, т. е. о перемешивании орбиталей с различными квантовыми числами и получением гибридных АО.
Гибридизация АО • Атом, взаимодействуя с несколькими одинаковыми партнерами, образует равнопрочные связи с участием электронов разных уровней. • Кроме того, углы между связями в подобных многоатомных молекулах не те, которые следовало бы ожидать из пространственного расположения взаимодействующих АО. Пример: в H 2 O – 104, 50, в NH 3 – 1070, в CH 4 – 109, 280 и т. д. • Для объяснения этих противоречий в теорию введено представление о гибридизации АО, т. е. о перемешивании орбиталей с различными квантовыми числами и получением гибридных АО.
 Основные положения гибридизации • - Гибридизуются орбитали атома, реализующего связи с другими атомами • - Гибридизуются АО с близкой энергией • - Число гибридных орбиталей равно суммарному числу исходных орбиталей • - Гибридизация сопровождается изменением формы электронных облаков, поэтому хим. связи с участием гибр. орбиталей обладают большей прочностью, чем связи с “чистыми” АО
Основные положения гибридизации • - Гибридизуются орбитали атома, реализующего связи с другими атомами • - Гибридизуются АО с близкой энергией • - Число гибридных орбиталей равно суммарному числу исходных орбиталей • - Гибридизация сопровождается изменением формы электронных облаков, поэтому хим. связи с участием гибр. орбиталей обладают большей прочностью, чем связи с “чистыми” АО
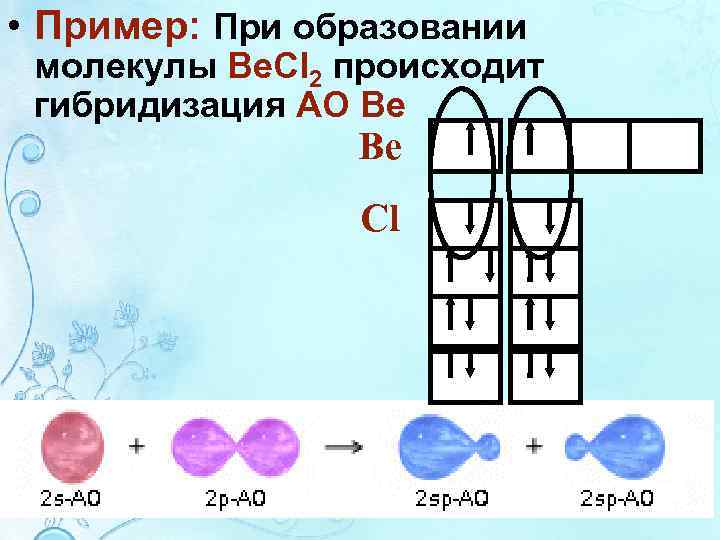 • Пример: При образовании молекулы Be. Cl 2 происходит гибридизация АО Be Be Cl
• Пример: При образовании молекулы Be. Cl 2 происходит гибридизация АО Be Be Cl
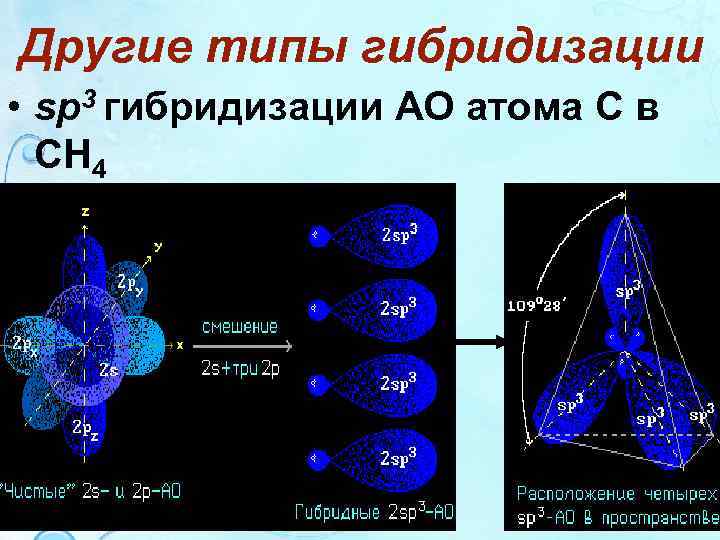 Другие типы гибридизации • sp 3 гибридизации АО атома С в СН 4
Другие типы гибридизации • sp 3 гибридизации АО атома С в СН 4
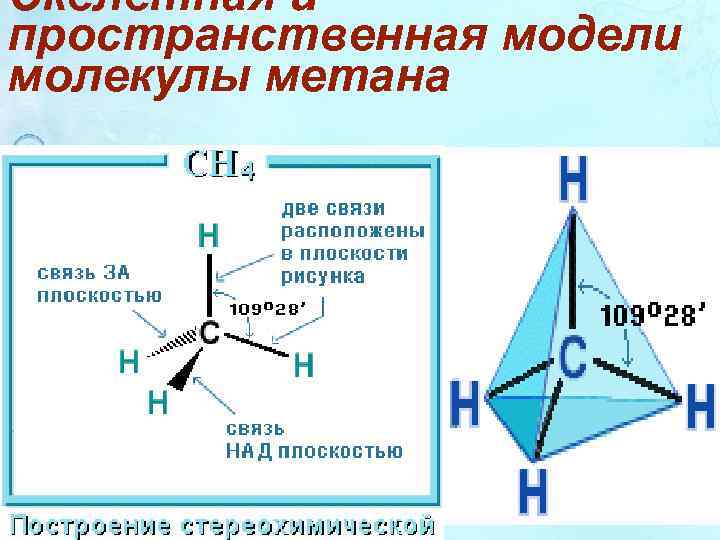 Скелетная и пространственная модели молекулы метана
Скелетная и пространственная модели молекулы метана
 Слабые стороны метода ВС • Не допускает присутствия в мол-х неспаренных электронов • Не объясняет существования частиц – молекулярных катионов, в которых хим. связь осуществляется не парой, а одним электроном (H 2+, Hе 2+ ) • Неожиданные параметры связи в молекулах и молекулярных ионах, вызванные переходами электронов
Слабые стороны метода ВС • Не допускает присутствия в мол-х неспаренных электронов • Не объясняет существования частиц – молекулярных катионов, в которых хим. связь осуществляется не парой, а одним электроном (H 2+, Hе 2+ ) • Неожиданные параметры связи в молекулах и молекулярных ионах, вызванные переходами электронов
 МО • МО - делокализованные и многоцентровые • Состояние эл-нов в молекулах соот-вует принципам min энергии, Паули и Гунда • Условия возникновения МО: - АО должны быть близкими по энергии -Атомные орбитали перекрываются - Расположение АО на линии связи должно быть одинаковым по симметрии - Из n АО образуется n МО - МО обозначают: , π, ,
МО • МО - делокализованные и многоцентровые • Состояние эл-нов в молекулах соот-вует принципам min энергии, Паули и Гунда • Условия возникновения МО: - АО должны быть близкими по энергии -Атомные орбитали перекрываются - Расположение АО на линии связи должно быть одинаковым по симметрии - Из n АО образуется n МО - МО обозначают: , π, ,
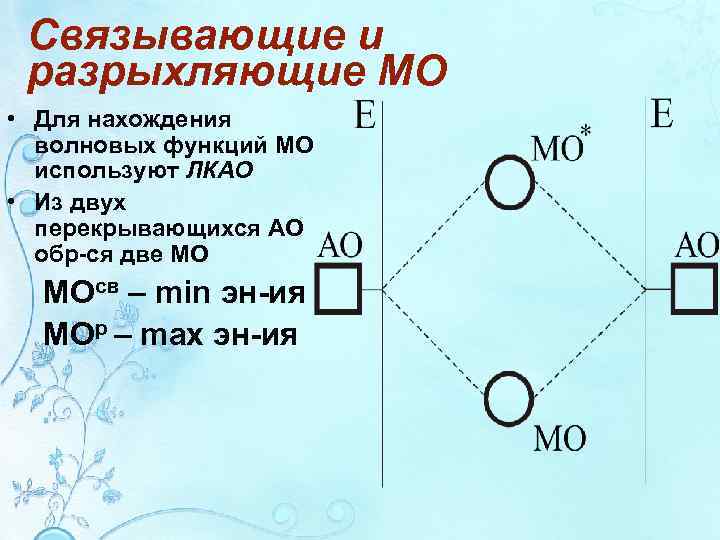 Связывающие и разрыхляющие МО • Для нахождения волновых функций МО используют ЛКАО • Из двух перекрывающихся АО обр-ся две МО МОсв – min эн-ия МОр – max эн-ия
Связывающие и разрыхляющие МО • Для нахождения волновых функций МО используют ЛКАО • Из двух перекрывающихся АО обр-ся две МО МОсв – min эн-ия МОр – max эн-ия
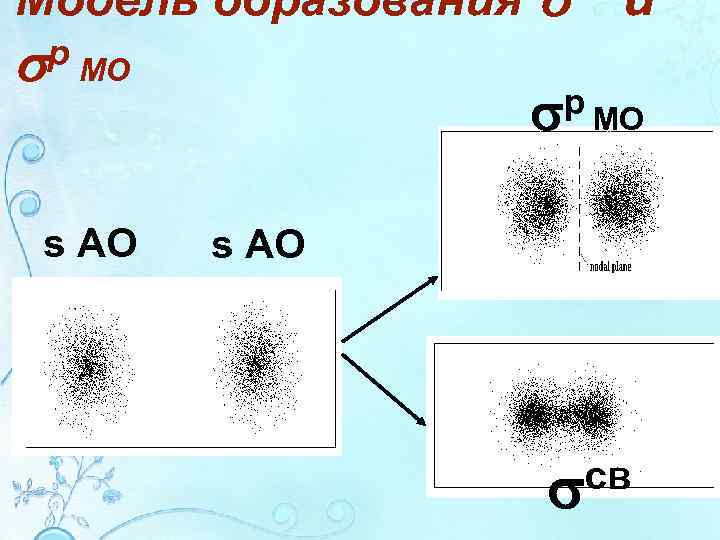 Модель образования р МО s AO и р МО s AO св
Модель образования р МО s AO и р МО s AO св
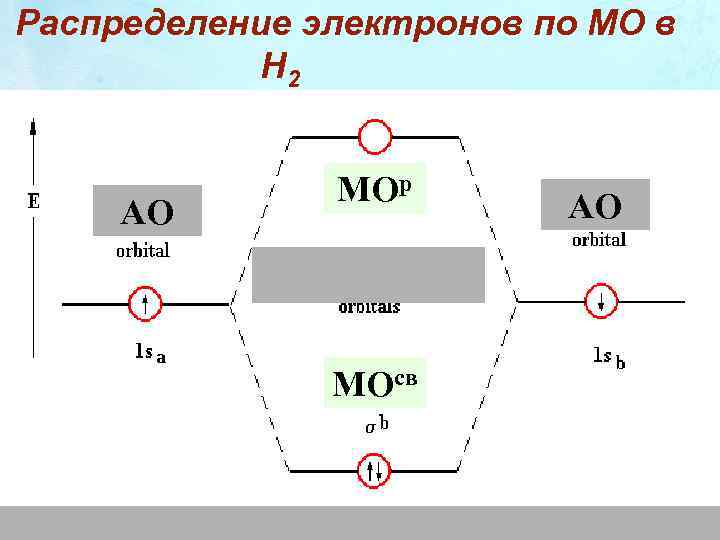 Распределение электронов по МО в Н 2 АО МОр МОсв АО
Распределение электронов по МО в Н 2 АО МОр МОсв АО

 Ионная связь образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому. ИОННАЯ СВЯЗЬ, образуемая в результате электростатического притяжения. Например: Na+ и Cl-, Li+ и F • • Na+ + Cl- = Na( : Cl: ) • •
Ионная связь образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому. ИОННАЯ СВЯЗЬ, образуемая в результате электростатического притяжения. Например: Na+ и Cl-, Li+ и F • • Na+ + Cl- = Na( : Cl: ) • •
 • Физические свойства веществ с ионным типом связи: твердые, тугоплавкие, не имеющие запаха, часто хорошо растворимые в воде. • Вещества с ионной связью, образуют ионную кристаллическую решетку.
• Физические свойства веществ с ионным типом связи: твердые, тугоплавкие, не имеющие запаха, часто хорошо растворимые в воде. • Вещества с ионной связью, образуют ионную кристаллическую решетку.
 Ионная связь • Энергия связи определяется силами электростатического взаимодействия противоположно заряженных ионов • Ионные соединения состоят из огромного числа ионов, связанных в одно целое силами электростатического притяжения
Ионная связь • Энергия связи определяется силами электростатического взаимодействия противоположно заряженных ионов • Ионные соединения состоят из огромного числа ионов, связанных в одно целое силами электростатического притяжения
 Свойства ионной связи
Свойства ионной связи
 Ненаправленность и ненасыщаемость • В ионном соединении каждый ион притягивает к себе независимо от направления неограниченное число противоположно заряженных ионов из-за сил электростатического взаимодействия • Взаимное отталкивание противоионов ограничивает их число в окружении каждого иона
Ненаправленность и ненасыщаемость • В ионном соединении каждый ион притягивает к себе независимо от направления неограниченное число противоположно заряженных ионов из-за сил электростатического взаимодействия • Взаимное отталкивание противоионов ограничивает их число в окружении каждого иона
 • Ионные соединения при обычных условиях – твердые и прочные, но хрупкие вещества • При плавлении и растворении в воде они распадаются на ионы (электролитическая диссоциация) и проводят электрический ток, т. е. являются электролитами
• Ионные соединения при обычных условиях – твердые и прочные, но хрупкие вещества • При плавлении и растворении в воде они распадаются на ионы (электролитическая диссоциация) и проводят электрический ток, т. е. являются электролитами
 Металлическая связь возникает в результате движения свободных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами.
Металлическая связь возникает в результате движения свободных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами.
 Физические свойства. • Валентные электроны принадлежат одновременно всем атомам металла, свободно перемещаясь по всему кристаллу. • Образуя единое электронное облако ( «электронный газ» ). • Электроны обладают свойствами волны, они «размазаны» по всему куску металла. • В этом типе связи электроны обусловливают высокую тепло- и электропроводность, металлический блеск
Физические свойства. • Валентные электроны принадлежат одновременно всем атомам металла, свободно перемещаясь по всему кристаллу. • Образуя единое электронное облако ( «электронный газ» ). • Электроны обладают свойствами волны, они «размазаны» по всему куску металла. • В этом типе связи электроны обусловливают высокую тепло- и электропроводность, металлический блеск
 ВЕЩЕСТВА С АТОМНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ • АЛМАЗ(С), КРЕМНИЙ (Si), КВАРЦ (Si. O 2). • Они состоят из атомов, связанных друг с другом в бесконечный трехмерный каркас. • Атомный каркас обладает высокой прочностью. • Кристаллы твердые, тугоплавкие, без запаха, в воде нерастворимы.
ВЕЩЕСТВА С АТОМНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ • АЛМАЗ(С), КРЕМНИЙ (Si), КВАРЦ (Si. O 2). • Они состоят из атомов, связанных друг с другом в бесконечный трехмерный каркас. • Атомный каркас обладает высокой прочностью. • Кристаллы твердые, тугоплавкие, без запаха, в воде нерастворимы.
 ВЕЩЕСТВА С МОЛЕКУЛЯРНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ • В УЗЛАХ – НАХОДЯТСЯ МОЛЕКУЛЫ. • УДЕРЖИВАЮТСЯ СЛАБЫМИ МЕЖМОЛЕКУЛЯРНЫМИ СИЛАМИ. • ВЕЩЕСТВА ЛЕГКОПЛАВКИ, ЧАСТО ИМЕЮТ ЗАПАХ. • ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ ПРЕДСТАВЛЯЮТ СОБОЙ ЖИДКОСТИ (ВОДА, БРОМ), ГАЗЫ (КИСЛОРОД, АЗОТ) ИЛИ ЛЕГКОПЛАВКИЕ ТВЕРДЫЕ ВЕЩЕСТВА (ИОД, СЕРА)
ВЕЩЕСТВА С МОЛЕКУЛЯРНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ • В УЗЛАХ – НАХОДЯТСЯ МОЛЕКУЛЫ. • УДЕРЖИВАЮТСЯ СЛАБЫМИ МЕЖМОЛЕКУЛЯРНЫМИ СИЛАМИ. • ВЕЩЕСТВА ЛЕГКОПЛАВКИ, ЧАСТО ИМЕЮТ ЗАПАХ. • ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ ПРЕДСТАВЛЯЮТ СОБОЙ ЖИДКОСТИ (ВОДА, БРОМ), ГАЗЫ (КИСЛОРОД, АЗОТ) ИЛИ ЛЕГКОПЛАВКИЕ ТВЕРДЫЕ ВЕЩЕСТВА (ИОД, СЕРА)
 ВОДОРОДНАЯ СВЯЗЬ • вид химической связи типа А — Н. . . А — Н , образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом А (N, O, S и др. ).
ВОДОРОДНАЯ СВЯЗЬ • вид химической связи типа А — Н. . . А — Н , образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом А (N, O, S и др. ).
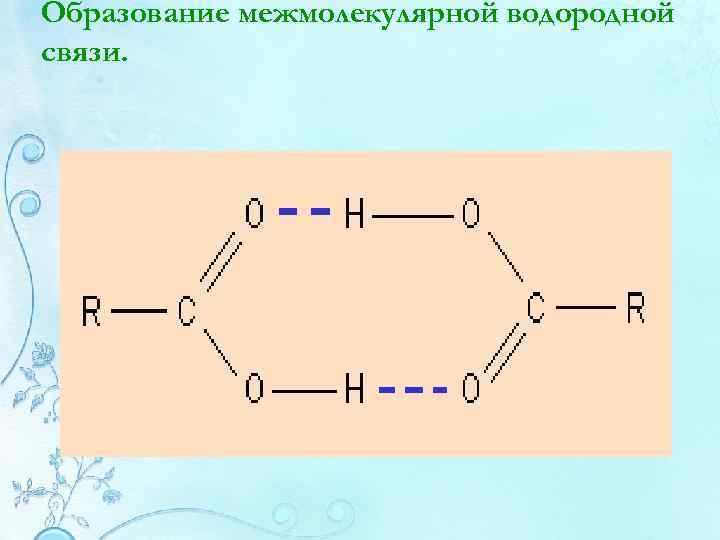 Образование межмолекулярной водородной связи.
Образование межмолекулярной водородной связи.
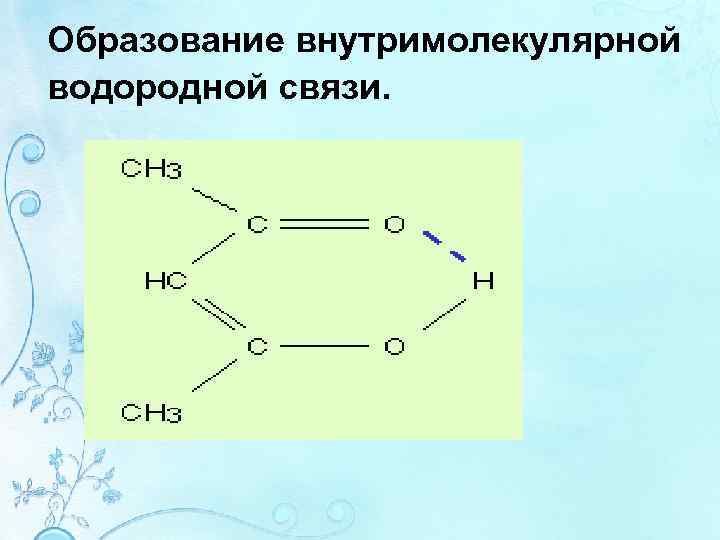 Образование внутримолекулярной водородной связи.
Образование внутримолекулярной водородной связи.
 Механизм образования водородной связи имеет частично электростатический, частично донорноакцепторный характер. Примеры межмолекулярной водородной связи:
Механизм образования водородной связи имеет частично электростатический, частично донорноакцепторный характер. Примеры межмолекулярной водородной связи:
 СПАСИБО за ВНИМАНИЕ!
СПАСИБО за ВНИМАНИЕ!


