Химическая связь.pptx
- Количество слайдов: 13

Химическая связь Выполнила студентка 402 -БХ группы Ракипова Ирина

Цели и задачи изучения данной темы Основная задача – формирование понятий о закономерностях образования химической связи, о закономерностях структуры и своеобразия периодической изменяемости свойств простых и сложных веществ.

Неорганические вещества простые сложные бинарные соединения Al. N, H 2 O и др. Ме переходные не. Me Na, (амфотерные) (в т. ч. Ca, элементы благородные Ba Al, Zn, Be и др. газы) и др. F 2, Cl 2 и др. ) гидроксиды кислоты H 2 SO 4, HNO 3 и др. соли Na. Cl, Cu. SO 4 и др. амфолиты основания Zn(OH)2, Na. OH, Ga(OH)3 и др. Ba(OH)2 и др.
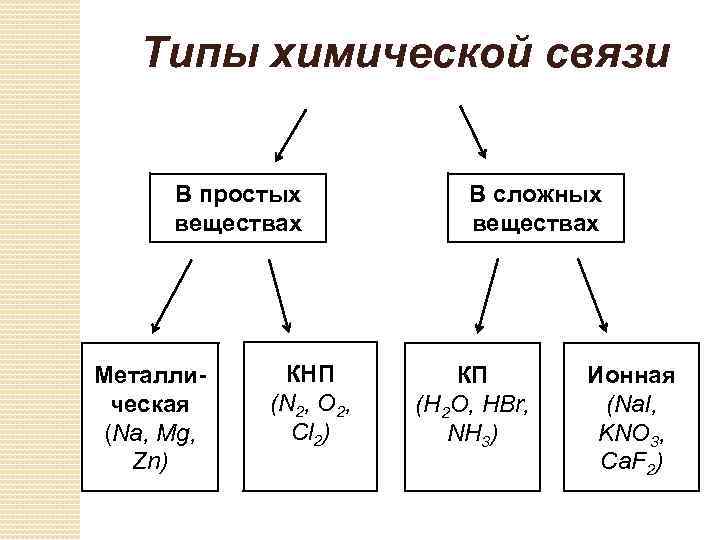
Типы химической связи В простых веществах Металлическая (Na, Mg, Zn) КНП (N 2, O 2, Cl 2) В сложных веществах КП (H 2 O, HBr, NH 3) Ионная (Na. I, KNO 3, Сa. F 2)
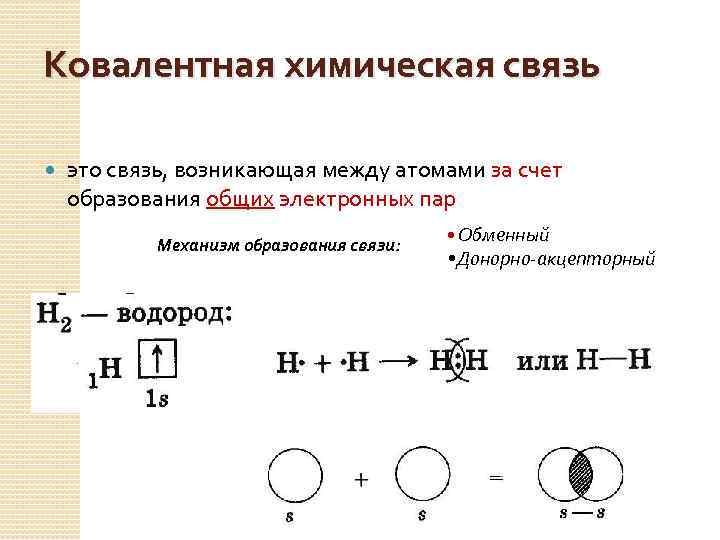
Ковалентная химическая связь это связь, возникающая между атомами за счет образования общих электронных пар Механизм образования связи: • Обменный • Донорно-акцепторный

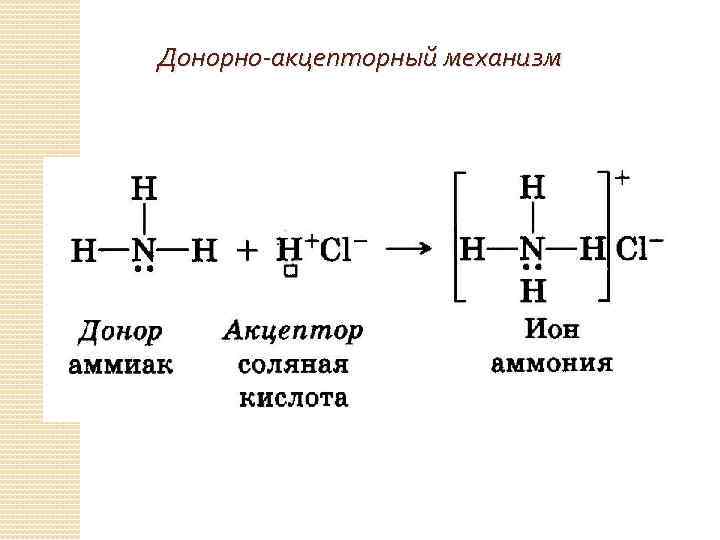
Донорно-акцепторный механизм
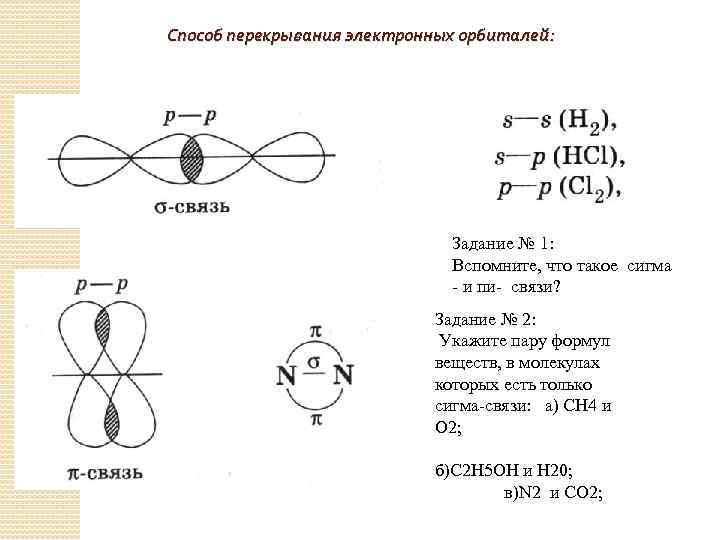
Способ перекрывания электронных орбиталей: Задание № 1: Вспомните, что такое сигма - и пи- связи? Задание № 2: Укажите пару формул веществ, в молекулах которых есть только сигма-связи: а) СН 4 и О 2; б)С 2 Н 5 ОН и Н 20; в)N 2 и CO 2;
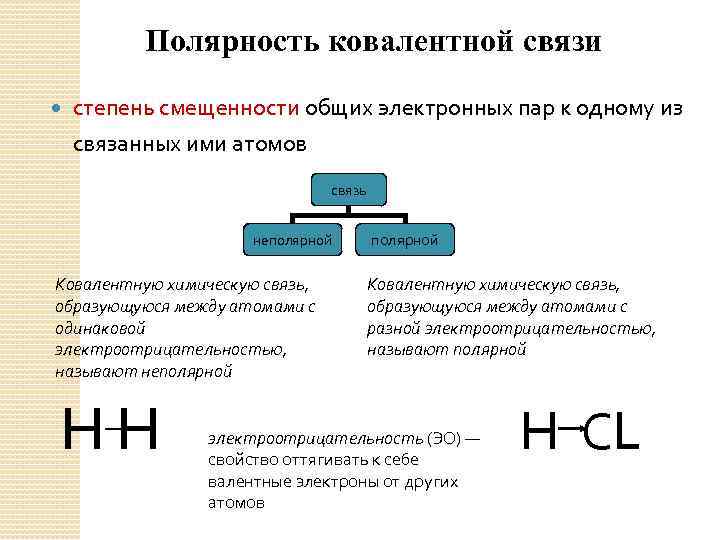
Полярность ковалентной связи степень смещенности общих электронных пар к одному из связанных ими атомов связь неполярной Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной HH полярной Ковалентную химическую связь, образующуюся между атомами с разной электроотрицательностью, называют полярной электроотрицательность (ЭО) — свойство оттягивать к себе валентные электроны от других атомов H СL
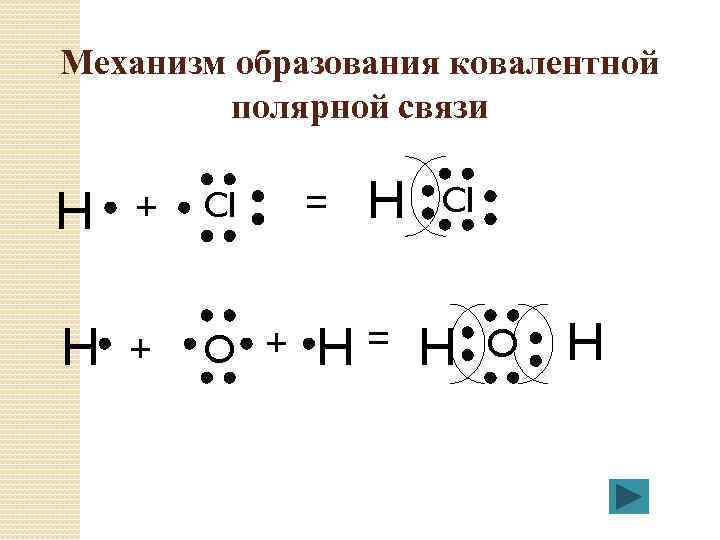
Механизм образования ковалентной полярной связи H + CI H + O + = H CI H O H
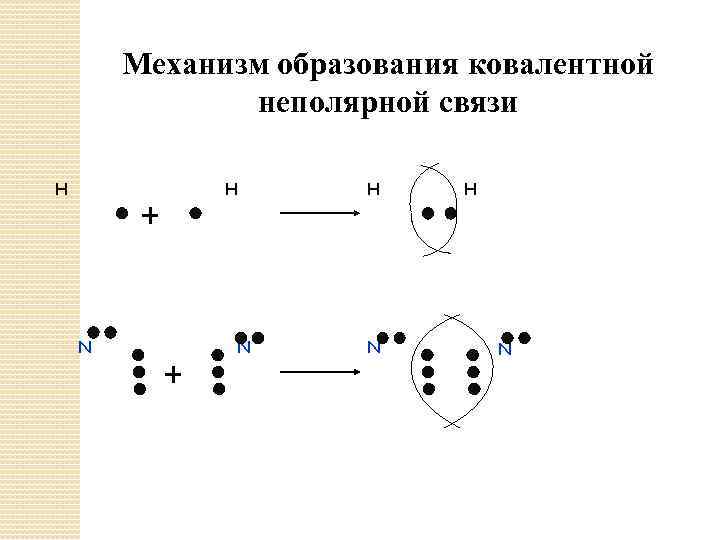
Механизм образования ковалентной неполярной связи H H + N H N
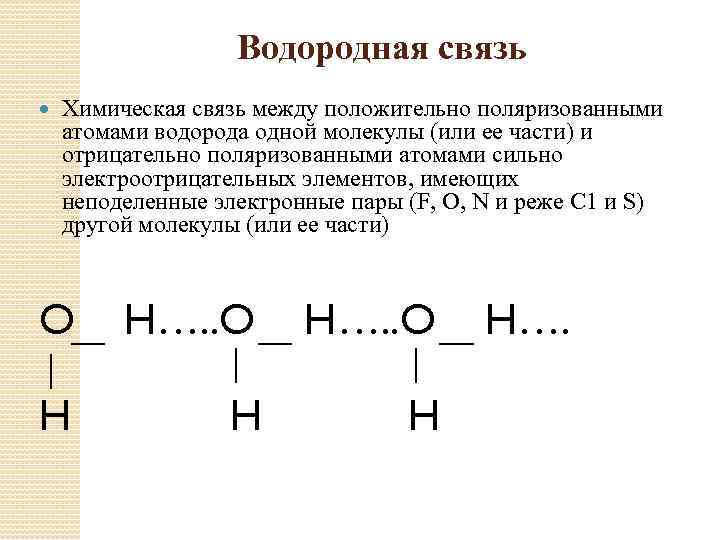
Водородная связь Химическая связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары (F, О, N и реже С 1 и S) другой молекулы (или ее части) O H…. . O H H….

Кроссворд М Е Т Д Л И Н А Н Е Л П У И Л О С О И Э Л Т Н Ч Н Я О Н Е Е П Е Р Е С Т Р О Й К А Н О Ч Я К Г А Л И А И Я Я В Я Я Р О Н С А Т Я Ь 1 – образование химической связи обусловлено взаимодействием атомных частиц и сопровождается … электронных оболочек (орбиталей) внешнего энергетического уровня; 2 – вид химической связи, образующийся в сложных веществах между атомными частицами неметаллов; 3 – количество теплоты, поглощаемое при разрыве связи или выделяемое при ее образовании; 4 – вид химической связи, образующийся в простых металлических веществах; 5 – вид химической связи, образующийся в простых веществах между частицами неметаллов; 6 – в виде свободных (изолированных) атомов существуют только благородные газы (гелий, неон, аргон, криптон, ксенон и радон), что обусловлено высокой … их электронных структур; 7 – вид химической связи, образующийся в сложных веществах между атомными частицами металлов и неметаллов; 8 – расстояние между ядрами связываемых атомных частиц.
Химическая связь.pptx