Химическая связь.pptx
- Количество слайдов: 18
 Химическая связь. Типы химических связей и их характеристики.
Химическая связь. Типы химических связей и их характеристики.
 Валентность атомов • Валентный уровень атома кислорода содержит 2 неспаренных электрона, поэтому валентность О в соединениях = 2. • Валентный уровень атома азота содержит 3 неспаренных электрона, поэтому валентность N в большинстве соединений = 3.
Валентность атомов • Валентный уровень атома кислорода содержит 2 неспаренных электрона, поэтому валентность О в соединениях = 2. • Валентный уровень атома азота содержит 3 неспаренных электрона, поэтому валентность N в большинстве соединений = 3.
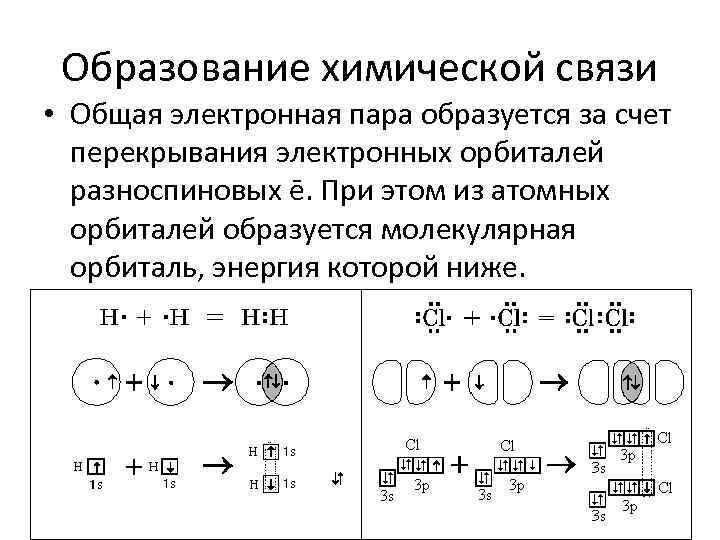 Образование химической связи • Общая электронная пара образуется за счет перекрывания электронных орбиталей разноспиновых ē. При этом из атомных орбиталей образуется молекулярная орбиталь, энергия которой ниже.
Образование химической связи • Общая электронная пара образуется за счет перекрывания электронных орбиталей разноспиновых ē. При этом из атомных орбиталей образуется молекулярная орбиталь, энергия которой ниже.
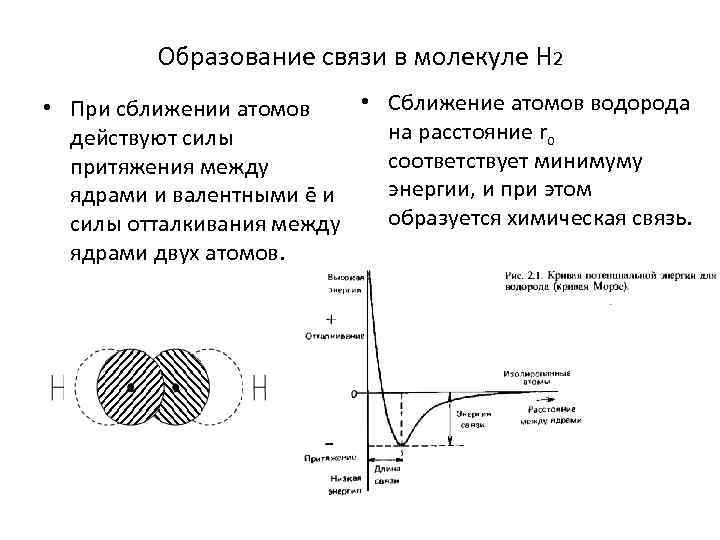 Образование связи в молекуле Н 2 • Сближение атомов водорода • При сближении атомов на расстояние ro действуют силы соответствует минимуму притяжения между энергии, и при этом ядрами и валентными ē и образуется химическая связь. силы отталкивания между ядрами двух атомов.
Образование связи в молекуле Н 2 • Сближение атомов водорода • При сближении атомов на расстояние ro действуют силы соответствует минимуму притяжения между энергии, и при этом ядрами и валентными ē и образуется химическая связь. силы отталкивания между ядрами двух атомов.
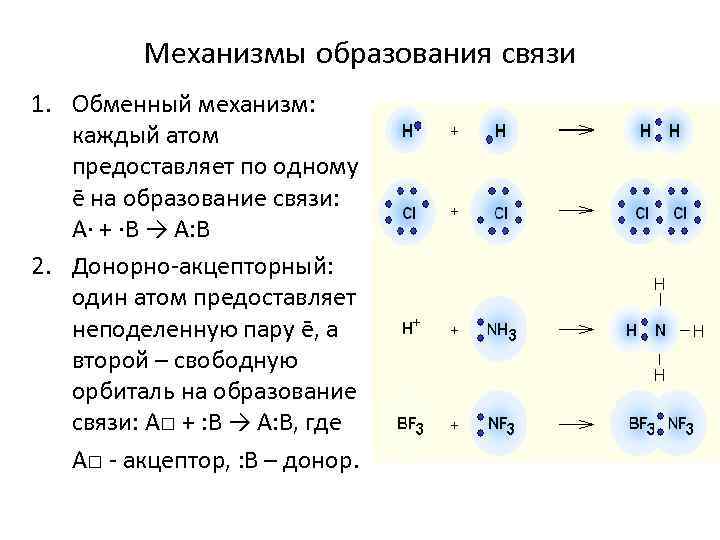 Механизмы образования связи 1. Обменный механизм: каждый атом предоставляет по одному ē на образование связи: A· + ·В → А: В 2. Донорно-акцепторный: один атом предоставляет неподеленную пару ē, а второй – свободную орбиталь на образование связи: А□ + : В → А: В, где А□ - акцептор, : В – донор.
Механизмы образования связи 1. Обменный механизм: каждый атом предоставляет по одному ē на образование связи: A· + ·В → А: В 2. Донорно-акцепторный: один атом предоставляет неподеленную пару ē, а второй – свободную орбиталь на образование связи: А□ + : В → А: В, где А□ - акцептор, : В – донор.
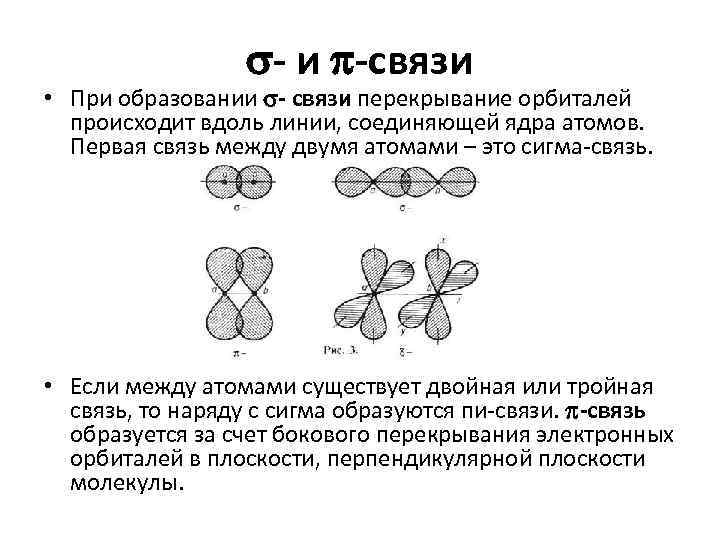 - и -связи • При образовании - связи перекрывание орбиталей происходит вдоль линии, соединяющей ядра атомов. Первая связь между двумя атомами – это сигма-связь. • Если между атомами существует двойная или тройная связь, то наряду с сигма образуются пи-связи. -связь образуется за счет бокового перекрывания электронных орбиталей в плоскости, перпендикулярной плоскости молекулы.
- и -связи • При образовании - связи перекрывание орбиталей происходит вдоль линии, соединяющей ядра атомов. Первая связь между двумя атомами – это сигма-связь. • Если между атомами существует двойная или тройная связь, то наряду с сигма образуются пи-связи. -связь образуется за счет бокового перекрывания электронных орбиталей в плоскости, перпендикулярной плоскости молекулы.
 Одинарные и кратные связи • Между атомами фтора в молекуле F 2 связь одинарная, -связь. • Между атомами азота в молекуле N 2 тройная связь, состоящая из одной -связи и двух -связей.
Одинарные и кратные связи • Между атомами фтора в молекуле F 2 связь одинарная, -связь. • Между атомами азота в молекуле N 2 тройная связь, состоящая из одной -связи и двух -связей.
 Характеристики химической связи • Длина связи – это расстояние между ядрами двух связанных атомов. • Энергия связи – это энергия, необходимая для разрыва связи. (Е связи = 125 -1050 к. Дж/моль) • Кратность связи определяется числом электронных пар, связывающих два взаимодействующих атома. • Чем меньше атомы и больше кратность связи, тем больше ее энергия и меньше длина.
Характеристики химической связи • Длина связи – это расстояние между ядрами двух связанных атомов. • Энергия связи – это энергия, необходимая для разрыва связи. (Е связи = 125 -1050 к. Дж/моль) • Кратность связи определяется числом электронных пар, связывающих два взаимодействующих атома. • Чем меньше атомы и больше кратность связи, тем больше ее энергия и меньше длина.
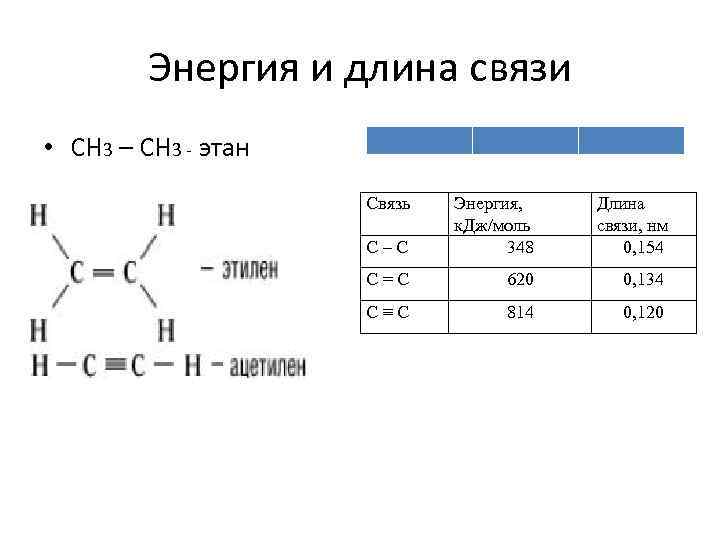 Энергия и длина связи • СН 3 – СН 3 - этан Связь С–С Энергия, к. Дж/моль 348 Длина связи, нм 0, 154 С=С 620 0, 134 С≡С 814 0, 120
Энергия и длина связи • СН 3 – СН 3 - этан Связь С–С Энергия, к. Дж/моль 348 Длина связи, нм 0, 154 С=С 620 0, 134 С≡С 814 0, 120
 Виды ковалентной связи • Ковалентная неполярная связь образуется между атомами с одинаковыми значениями электроотрицательности (ЭО). Атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такую связь, как правило, имеют простые вещества, например: О 2, N 2, Cl 2. • Ковалентная полярная связь образуется между двумя неметаллами с разными ЭО. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд.
Виды ковалентной связи • Ковалентная неполярная связь образуется между атомами с одинаковыми значениями электроотрицательности (ЭО). Атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такую связь, как правило, имеют простые вещества, например: О 2, N 2, Cl 2. • Ковалентная полярная связь образуется между двумя неметаллами с разными ЭО. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд.
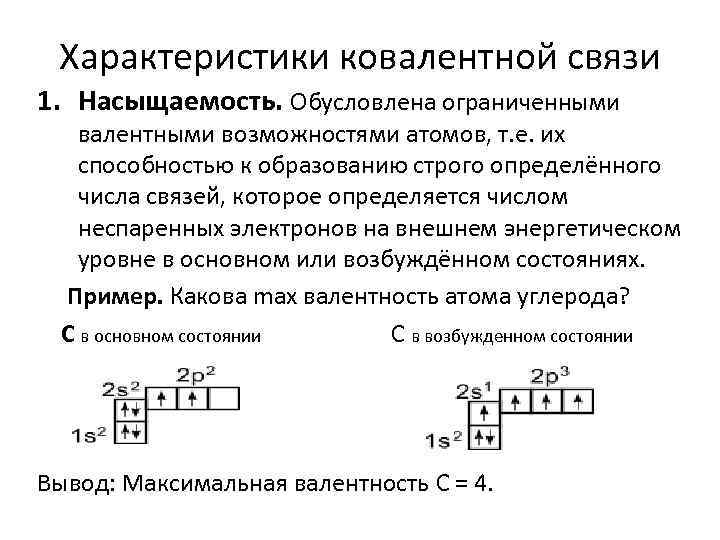 Характеристики ковалентной связи 1. Насыщаемость. Обусловлена ограниченными валентными возможностями атомов, т. е. их способностью к образованию строго определённого числа связей, которое определяется числом неспаренных электронов на внешнем энергетическом уровне в основном или возбуждённом состояниях. Пример. Какова max валентность атома углерода? С в основном состоянии С в возбужденном состоянии Вывод: Максимальная валентность С = 4.
Характеристики ковалентной связи 1. Насыщаемость. Обусловлена ограниченными валентными возможностями атомов, т. е. их способностью к образованию строго определённого числа связей, которое определяется числом неспаренных электронов на внешнем энергетическом уровне в основном или возбуждённом состояниях. Пример. Какова max валентность атома углерода? С в основном состоянии С в возбужденном состоянии Вывод: Максимальная валентность С = 4.
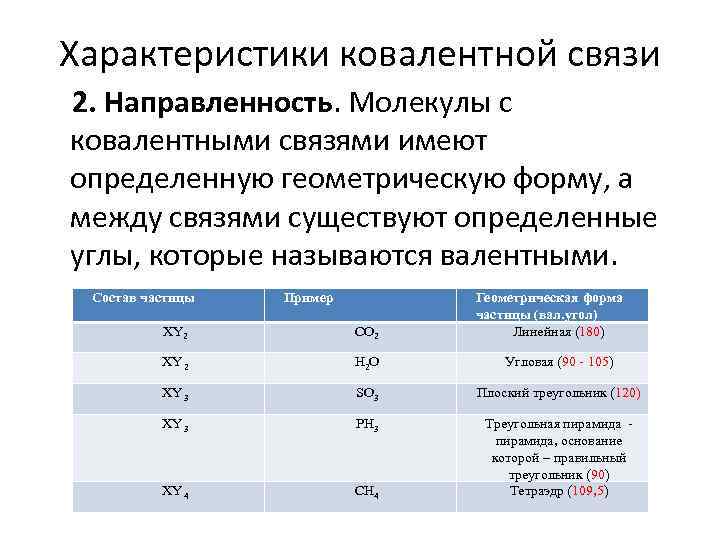 Характеристики ковалентной связи 2. Направленность. Молекулы с ковалентными связями имеют определенную геометрическую форму, а между связями существуют определенные углы, которые называются валентными. Состав частицы Пример Геометрическая форма частицы (вал. угол) Линейная (180) XY 2 СО 2 XY 2 Н 2 О Угловая (90 - 105) XY 3 SO 3 Плоский треугольник (120) XY 3 РН 3 XY 4 СН 4 Треугольная пирамида, основание которой – правильный треугольник (90) Тетраэдр (109, 5)
Характеристики ковалентной связи 2. Направленность. Молекулы с ковалентными связями имеют определенную геометрическую форму, а между связями существуют определенные углы, которые называются валентными. Состав частицы Пример Геометрическая форма частицы (вал. угол) Линейная (180) XY 2 СО 2 XY 2 Н 2 О Угловая (90 - 105) XY 3 SO 3 Плоский треугольник (120) XY 3 РН 3 XY 4 СН 4 Треугольная пирамида, основание которой – правильный треугольник (90) Тетраэдр (109, 5)
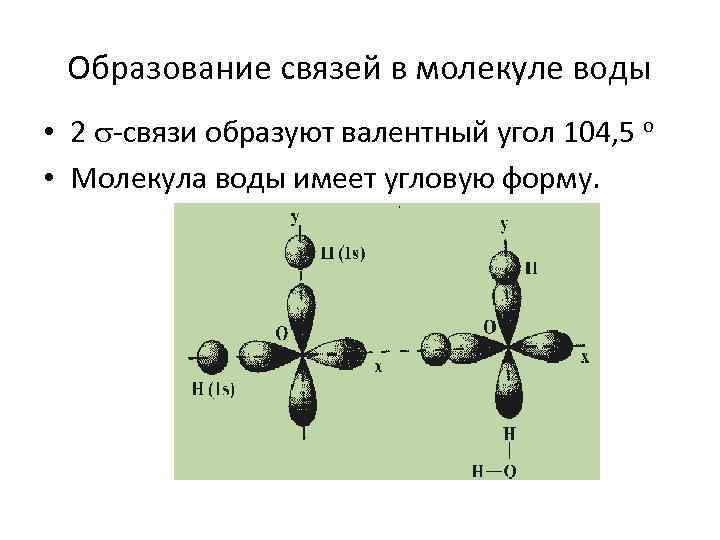 Образование связей в молекуле воды • 2 -связи образуют валентный угол 104, 5 о • Молекула воды имеет угловую форму.
Образование связей в молекуле воды • 2 -связи образуют валентный угол 104, 5 о • Молекула воды имеет угловую форму.
 3. Полярность связи - Неполярная связь - Полярная связь Если электроотрицательность атомов, образующих атомов различная, то электронная пара смещается в молекулу, одинакова или сторону более электроотрицат. очень близка, то общая атома. Степень полярности электронная пара располагается симметрично такой связи оценивается значением электрического по отношению к обоим ядрам. момента диполя- , равного произведению эффективного заряда на длину диполя =q·l.
3. Полярность связи - Неполярная связь - Полярная связь Если электроотрицательность атомов, образующих атомов различная, то электронная пара смещается в молекулу, одинакова или сторону более электроотрицат. очень близка, то общая атома. Степень полярности электронная пара располагается симметрично такой связи оценивается значением электрического по отношению к обоим ядрам. момента диполя- , равного произведению эффективного заряда на длину диполя =q·l.
 Ионная связь – связь между атомами с резко отличающейся ЭО ( ˃ 1, 7) за счет электростатического притяжения между ионами.
Ионная связь – связь между атомами с резко отличающейся ЭО ( ˃ 1, 7) за счет электростатического притяжения между ионами.
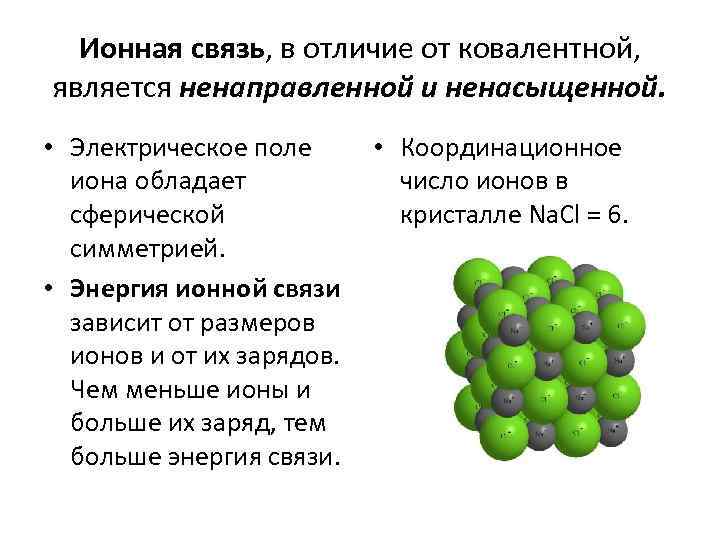 Ионная связь, в отличие от ковалентной, является ненаправленной и ненасыщенной. • Электрическое поле • Координационное иона обладает число ионов в сферической кристалле Na. Cl = 6. симметрией. • Энергия ионной связи зависит от размеров ионов и от их зарядов. Чем меньше ионы и больше их заряд, тем больше энергия связи.
Ионная связь, в отличие от ковалентной, является ненаправленной и ненасыщенной. • Электрическое поле • Координационное иона обладает число ионов в сферической кристалле Na. Cl = 6. симметрией. • Энергия ионной связи зависит от размеров ионов и от их зарядов. Чем меньше ионы и больше их заряд, тем больше энергия связи.
 Металлическая связь - образуется за счет валентных ē атомов металлов, которые объединяют положительно заряженные ион-атомы. Следствием свободного перемещения валентных ē являются такие свойства металлов, как тепло- и электропроводность, ковкость и пластичность.
Металлическая связь - образуется за счет валентных ē атомов металлов, которые объединяют положительно заряженные ион-атомы. Следствием свободного перемещения валентных ē являются такие свойства металлов, как тепло- и электропроводность, ковкость и пластичность.
 Водородная связь • Особый вид химической связи. Образуется за счет кулоновского притяжения между атомом водорода и другим сильно электроотрицательным элементом (фтор, кислород, азот). Примеры: • Следствие образования водородных связей между молекулами воды – Ткип. (Н 2 О)=100 о. С • НF, растворенный в воде – слабый электролит в отличие от других галогеноводородный кислот.
Водородная связь • Особый вид химической связи. Образуется за счет кулоновского притяжения между атомом водорода и другим сильно электроотрицательным элементом (фтор, кислород, азот). Примеры: • Следствие образования водородных связей между молекулами воды – Ткип. (Н 2 О)=100 о. С • НF, растворенный в воде – слабый электролит в отличие от других галогеноводородный кислот.


