khim_sv.pptx
- Количество слайдов: 35
 Химическая связь
Химическая связь
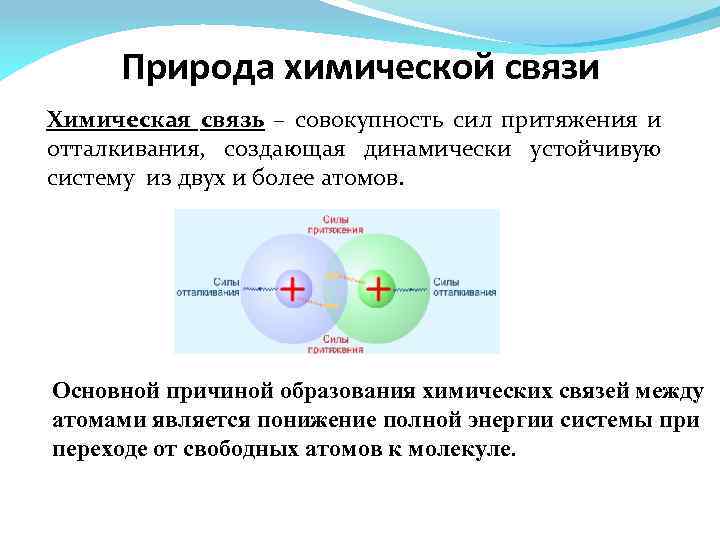 Природа химической связи Химическая связь – совокупность сил притяжения и отталкивания, создающая динамически устойчивую систему из двух и более атомов. Основной причиной образования химических связей между атомами является понижение полной энергии системы при переходе от свободных атомов к молекуле.
Природа химической связи Химическая связь – совокупность сил притяжения и отталкивания, создающая динамически устойчивую систему из двух и более атомов. Основной причиной образования химических связей между атомами является понижение полной энергии системы при переходе от свободных атомов к молекуле.
 ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ 1. Энергия связи (Прочность связи) 2. Длина связи 3. Полярность связи 4. Валентный угол 5. Поляризуемость связи
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ 1. Энергия связи (Прочность связи) 2. Длина связи 3. Полярность связи 4. Валентный угол 5. Поляризуемость связи
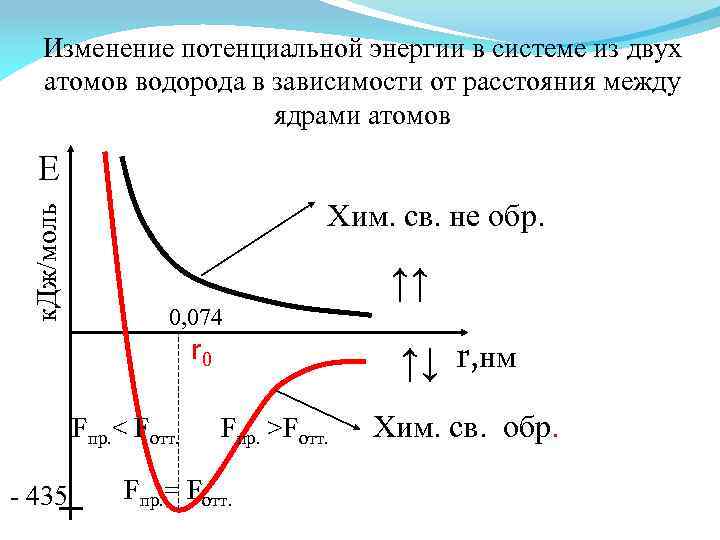 Изменение потенциальной энергии в системе из двух атомов водорода в зависимости от расстояния между ядрами атомов к. Дж/моль Е Хим. св. не обр. ↑↑ 0, 074 r 0 Fпр. < Fотт. - 435 ↑↓ r, нм Fпр. >Fотт. Fпр. = Fотт. Хим. св. обр.
Изменение потенциальной энергии в системе из двух атомов водорода в зависимости от расстояния между ядрами атомов к. Дж/моль Е Хим. св. не обр. ↑↑ 0, 074 r 0 Fпр. < Fотт. - 435 ↑↓ r, нм Fпр. >Fотт. Fпр. = Fотт. Хим. св. обр.
 1. Энергия химической связи (Есв) - доля энергии расщепления молекулы газообразного вещества на газообразные атомы, приходящаяся на одну связь Н 2 О(г) = 2 Н(г) + О(г), ΔH-энергия диссоциации Н—О —Н Н 2 О - газ Е= ΔH/2, (т. к. 2 связи) 2. Длина связи (lсв) – среднее равновесное расстояние между ядрами химически связанных атомов в молекуле.
1. Энергия химической связи (Есв) - доля энергии расщепления молекулы газообразного вещества на газообразные атомы, приходящаяся на одну связь Н 2 О(г) = 2 Н(г) + О(г), ΔH-энергия диссоциации Н—О —Н Н 2 О - газ Е= ΔH/2, (т. к. 2 связи) 2. Длина связи (lсв) – среднее равновесное расстояние между ядрами химически связанных атомов в молекуле.
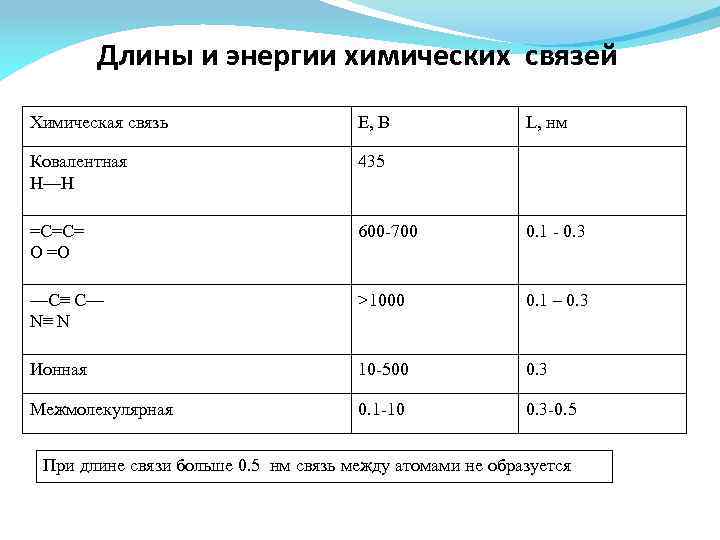 Длины и энергии химических связей Химическая связь Е, В Ковалентная Н—Н 435 =С=С= О =О 600 -700 0. 1 - 0. 3 —С≡ С— N≡ N >1000 0. 1 – 0. 3 Ионная 10 -500 0. 3 Межмолекулярная 0. 1 -10 0. 3 -0. 5 L, нм При длине связи больше 0. 5 нм связь между атомами не образуется
Длины и энергии химических связей Химическая связь Е, В Ковалентная Н—Н 435 =С=С= О =О 600 -700 0. 1 - 0. 3 —С≡ С— N≡ N >1000 0. 1 – 0. 3 Ионная 10 -500 0. 3 Межмолекулярная 0. 1 -10 0. 3 -0. 5 L, нм При длине связи больше 0. 5 нм связь между атомами не образуется
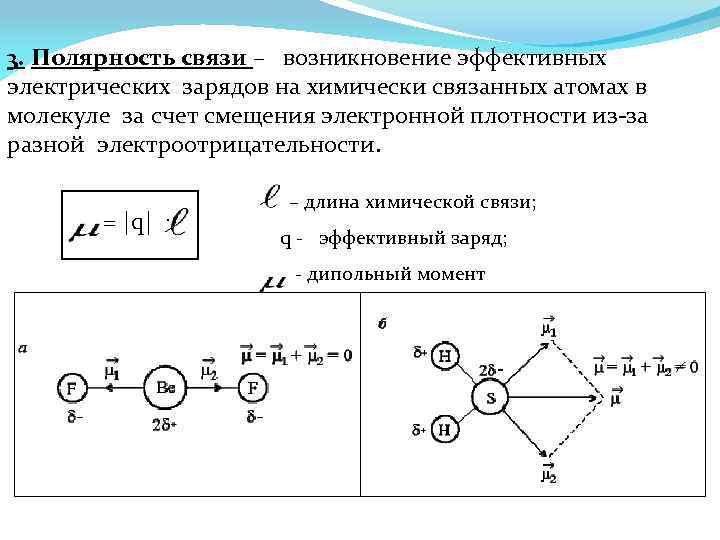 3. Полярность связи – возникновение эффективных электрических зарядов на химически связанных атомах в молекуле за счет смещения электронной плотности из-за разной электроотрицательности. = |q| · – длина химической связи; q - эффективный заряд; - дипольный момент
3. Полярность связи – возникновение эффективных электрических зарядов на химически связанных атомах в молекуле за счет смещения электронной плотности из-за разной электроотрицательности. = |q| · – длина химической связи; q - эффективный заряд; - дипольный момент
 Чем больше разность электроотрицательностей, взаимодействующих атомов, тем более полярна связь. Степень ионности Δǽ= |ЭО 1 -ЭО 2| Δǽ = 0 – 0. 4 – ковалентная неполярная Δǽ =0. 4 -2. 0 – ковалентная полярная связь; Δǽ > 2. 1 - ионная Дипольный момент молекулы зависит: от полярности связей; от геометрии молекулы; от наличия неподелённых пар электронов.
Чем больше разность электроотрицательностей, взаимодействующих атомов, тем более полярна связь. Степень ионности Δǽ= |ЭО 1 -ЭО 2| Δǽ = 0 – 0. 4 – ковалентная неполярная Δǽ =0. 4 -2. 0 – ковалентная полярная связь; Δǽ > 2. 1 - ионная Дипольный момент молекулы зависит: от полярности связей; от геометрии молекулы; от наличия неподелённых пар электронов.
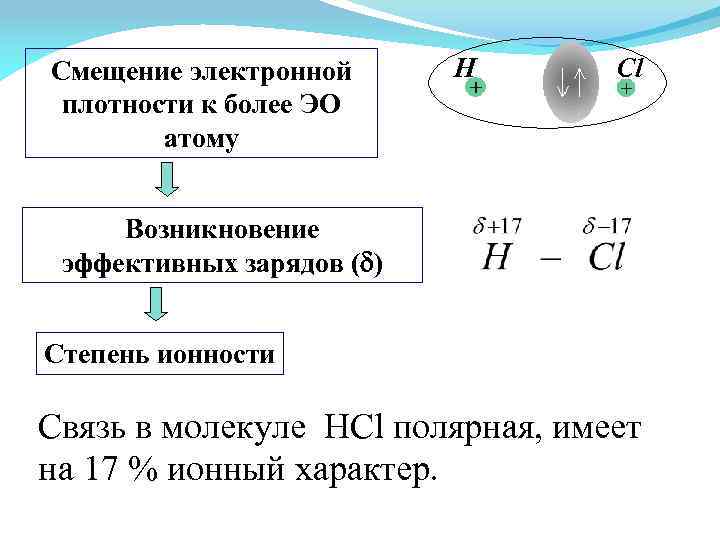 Смещение электронной плотности к более ЭО атому H Cl Возникновение эффективных зарядов ( ) Степень ионности Cвязь в молекуле HCl полярная, имеет на 17 % ионный характер.
Смещение электронной плотности к более ЭО атому H Cl Возникновение эффективных зарядов ( ) Степень ионности Cвязь в молекуле HCl полярная, имеет на 17 % ионный характер.
 т. е. степень ионности равна 83%. Полного перетягивания связующих пар электронов от более электроположительного к более электроотрицательному атому и образования 100 % -ной ионной связи практически не наблюдается.
т. е. степень ионности равна 83%. Полного перетягивания связующих пар электронов от более электроположительного к более электроотрицательному атому и образования 100 % -ной ионной связи практически не наблюдается.
 Поляризуемость химической связи - это способность химической связи приобретать дипольный момент(μинд) под действием внешнего электрического поля, обладающего напряженностью(Н). инд=α * Н μ α – поляризуемость Н –напряженность электрического поля μ – приобретенный дипольный момент
Поляризуемость химической связи - это способность химической связи приобретать дипольный момент(μинд) под действием внешнего электрического поля, обладающего напряженностью(Н). инд=α * Н μ α – поляризуемость Н –напряженность электрического поля μ – приобретенный дипольный момент
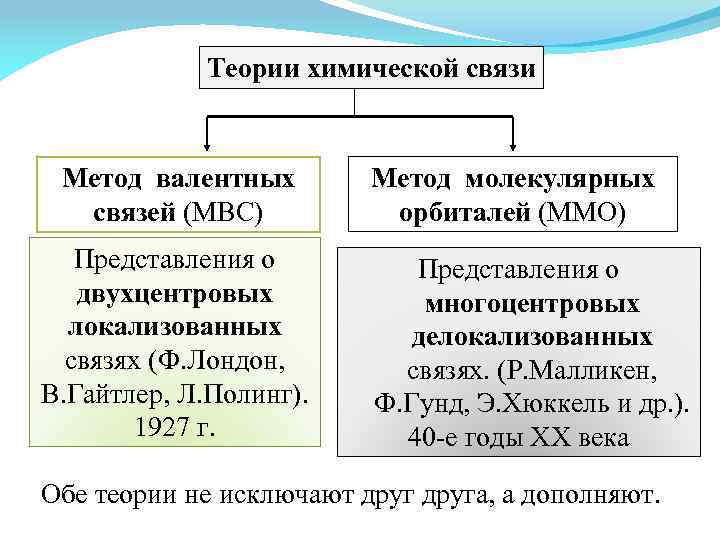 Теории химической связи Метод валентных связей (МВС) Представления о двухцентровых локализованных связях (Ф. Лондон, В. Гайтлер, Л. Полинг). 1927 г. Метод молекулярных орбиталей (ММО) Представления о многоцентровых делокализованных связях. (Р. Малликен, Ф. Гунд, Э. Хюккель и др. ). 40 -е годы ХХ века Обе теории не исключают друга, а дополняют.
Теории химической связи Метод валентных связей (МВС) Представления о двухцентровых локализованных связях (Ф. Лондон, В. Гайтлер, Л. Полинг). 1927 г. Метод молекулярных орбиталей (ММО) Представления о многоцентровых делокализованных связях. (Р. Малликен, Ф. Гунд, Э. Хюккель и др. ). 40 -е годы ХХ века Обе теории не исключают друга, а дополняют.
 Основные положения метода ВС 1. Химическая связь между атомами образуется в результате образования общих электронных пар. 2. Общие электронные пары образуют лишь неспаренные электроны с антипараллельными спинами. 3. При образовании химической связи происходит частичное перекрывание АО, что приводит к увеличению электронной плотности в межъядерном пространстве. 4. Химическая связь тем прочнее, чем в большей степени перекрываются взаимодействующие АО.
Основные положения метода ВС 1. Химическая связь между атомами образуется в результате образования общих электронных пар. 2. Общие электронные пары образуют лишь неспаренные электроны с антипараллельными спинами. 3. При образовании химической связи происходит частичное перекрывание АО, что приводит к увеличению электронной плотности в межъядерном пространстве. 4. Химическая связь тем прочнее, чем в большей степени перекрываются взаимодействующие АО.
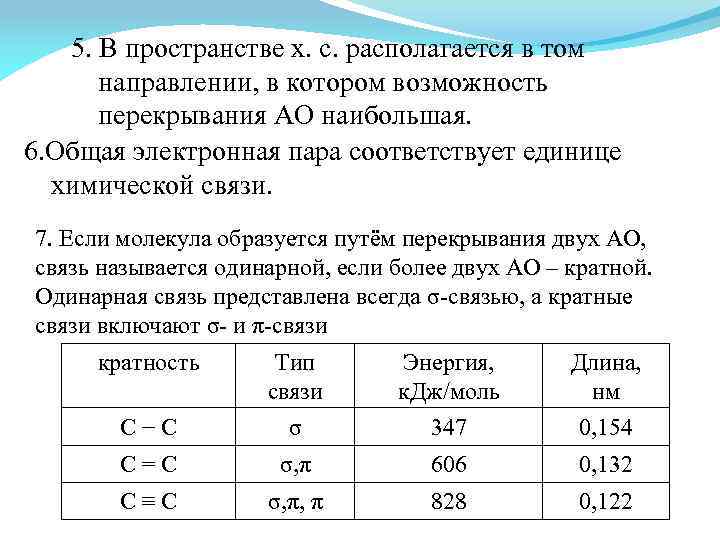 5. В пространстве х. с. располагается в том направлении, в котором возможность перекрывания АО наибольшая. 6. Общая электронная пара соответствует единице химической связи. 7. Если молекула образуется путём перекрывания двух АО, связь называется одинарной, если более двух АО – кратной. Одинарная связь представлена всегда σ-связью, а кратные связи включают σ- и π-связи кратность Тип связи Энергия, к. Дж/моль Длина, нм С−С σ 347 0, 154 С=С σ, π 606 0, 132 С≡С σ, π, π 828 0, 122
5. В пространстве х. с. располагается в том направлении, в котором возможность перекрывания АО наибольшая. 6. Общая электронная пара соответствует единице химической связи. 7. Если молекула образуется путём перекрывания двух АО, связь называется одинарной, если более двух АО – кратной. Одинарная связь представлена всегда σ-связью, а кратные связи включают σ- и π-связи кратность Тип связи Энергия, к. Дж/моль Длина, нм С−С σ 347 0, 154 С=С σ, π 606 0, 132 С≡С σ, π, π 828 0, 122
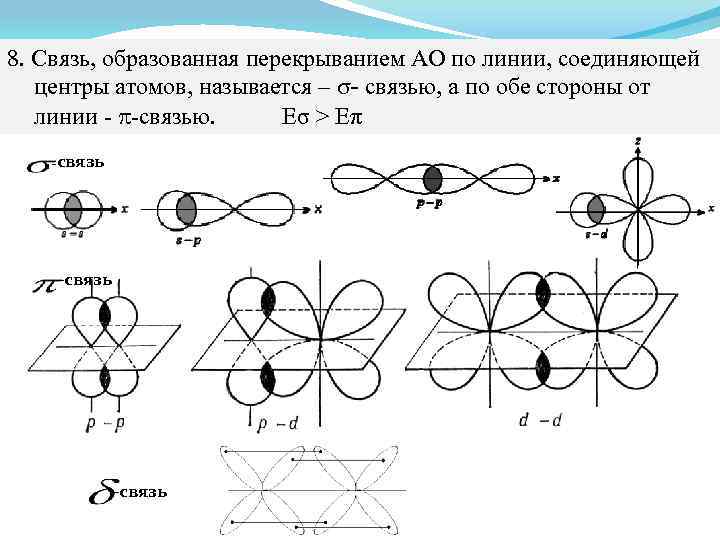 8. Связь, образованная перекрыванием АО по линии, соединяющей. центры атомов, называется – σ- связью, а по обе стороны от линии - -связью. Еσ > Еπ -связь
8. Связь, образованная перекрыванием АО по линии, соединяющей. центры атомов, называется – σ- связью, а по обе стороны от линии - -связью. Еσ > Еπ -связь
 Основные виды химической связи Ковалентная (полярная и неполярная) Донорно-акцепторная Ионная Водородная Межмолекулярная Металлическая
Основные виды химической связи Ковалентная (полярная и неполярная) Донорно-акцепторная Ионная Водородная Межмолекулярная Металлическая
 Ковалентная связь Химическая связь, образованная двумя атомами путем обобществления пары электронов, называется ковалентной связью Ковалентная неполярная связь - связь между атомами с практически равной электроотрицательностью (0 - 0. 4) . Электронное облако, образованное общей парой электронов распределяется симметрично относительно ядер обоих атомов(Н 2, N 2, Br 2 ) Ковалентная полярная связь - связь между атомами с различной электроотрицательностью (0. 5 - 2. 0) и несимметричным расположением общей электронной пары.
Ковалентная связь Химическая связь, образованная двумя атомами путем обобществления пары электронов, называется ковалентной связью Ковалентная неполярная связь - связь между атомами с практически равной электроотрицательностью (0 - 0. 4) . Электронное облако, образованное общей парой электронов распределяется симметрично относительно ядер обоих атомов(Н 2, N 2, Br 2 ) Ковалентная полярная связь - связь между атомами с различной электроотрицательностью (0. 5 - 2. 0) и несимметричным расположением общей электронной пары.
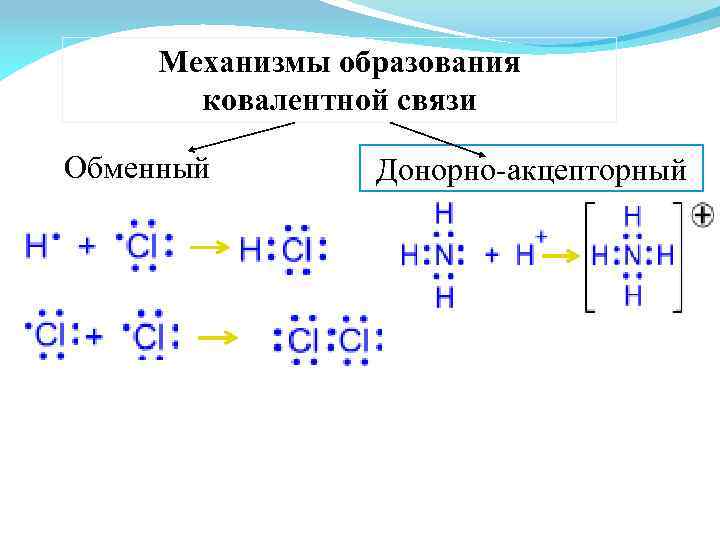 Механизмы образования ковалентной связи Обменный Донорно-акцепторный
Механизмы образования ковалентной связи Обменный Донорно-акцепторный
 Обменный механизм Каждый атом дает по одному неспаренному электрону в общую электронную пару
Обменный механизм Каждый атом дает по одному неспаренному электрону в общую электронную пару
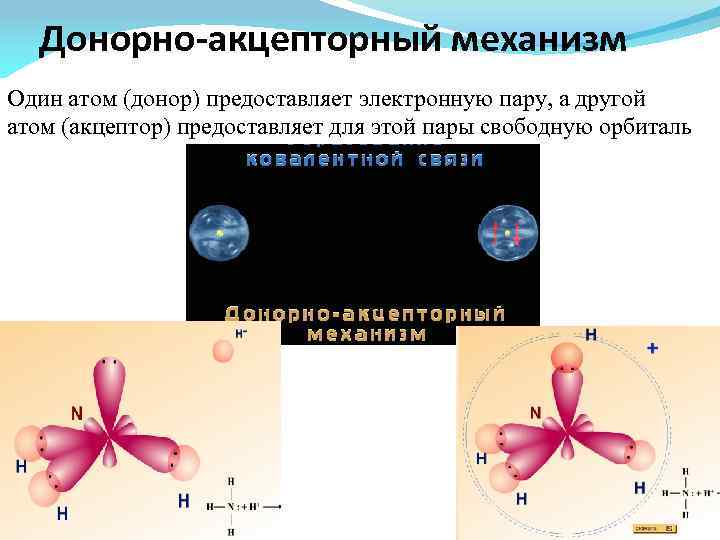 Донорно-акцепторный механизм Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь
Донорно-акцепторный механизм Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь
 Гибридизация атомных орбиталей При гибридизации первоначальная форма и энергия орбиталей взаимоизменяются и образуются орбитали с новой, но уже одинаковой формой и энергией. Число гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации. Формы и энергии гибридных орбиталей одинаковы.
Гибридизация атомных орбиталей При гибридизации первоначальная форма и энергия орбиталей взаимоизменяются и образуются орбитали с новой, но уже одинаковой формой и энергией. Число гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации. Формы и энергии гибридных орбиталей одинаковы.
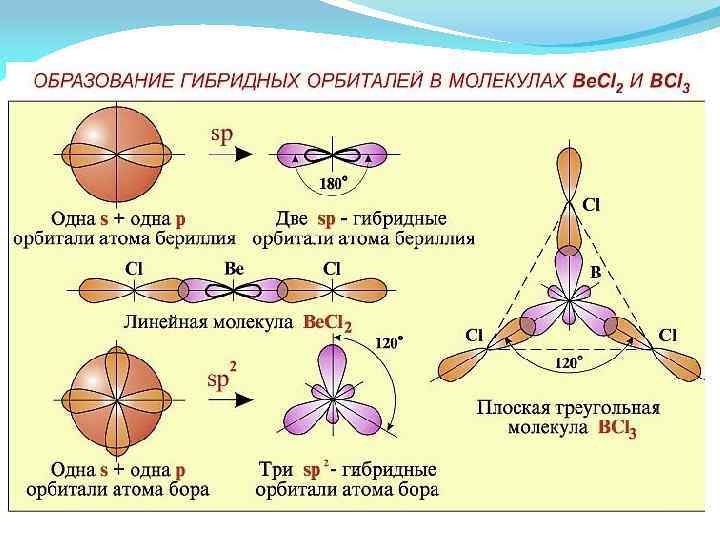
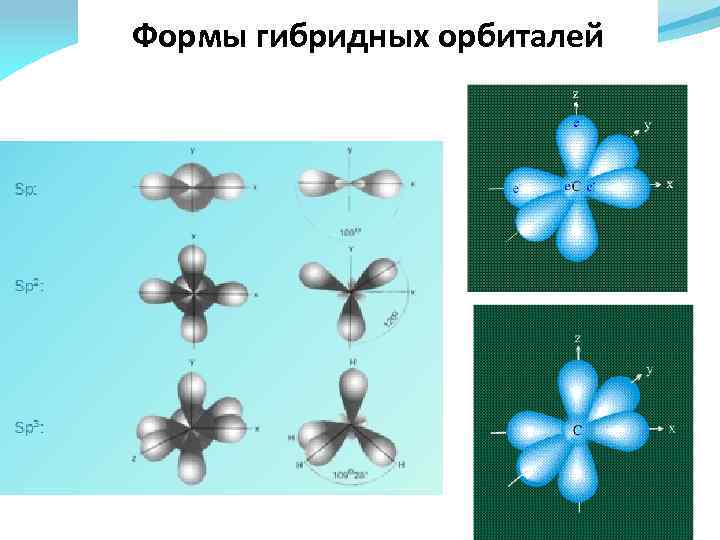 Формы гибридных орбиталей
Формы гибридных орбиталей
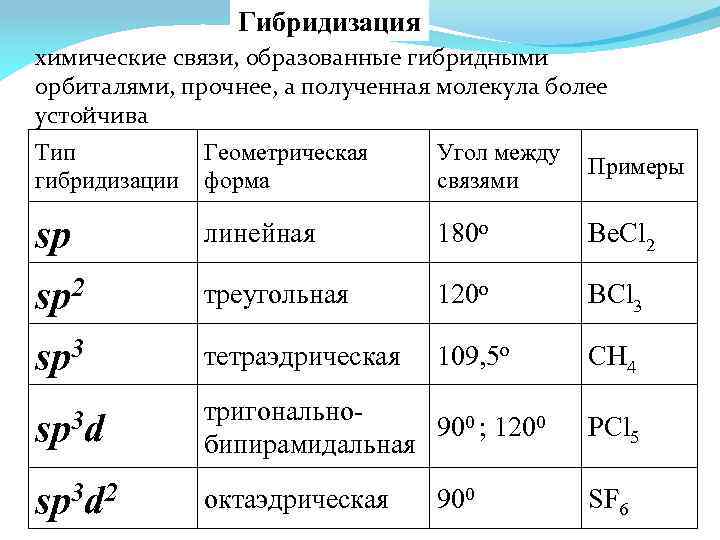 Гибридизация химические связи, образованные гибридными орбиталями, прочнее, а полученная молекула более устойчива Тип гибридизации Геометрическая форма Угол между связями Примеры sp линейная 180 o Be. Cl 2 sp 2 треугольная 120 o BCl 3 sp 3 тетраэдрическая 109, 5 o CH 4 sp 3 d тригонально 900 ; 1200 бипирамидальная РСl 5 sp 3 d 2 октаэдрическая SF 6 900
Гибридизация химические связи, образованные гибридными орбиталями, прочнее, а полученная молекула более устойчива Тип гибридизации Геометрическая форма Угол между связями Примеры sp линейная 180 o Be. Cl 2 sp 2 треугольная 120 o BCl 3 sp 3 тетраэдрическая 109, 5 o CH 4 sp 3 d тригонально 900 ; 1200 бипирамидальная РСl 5 sp 3 d 2 октаэдрическая SF 6 900
 Ионная связь Чем больше разница электроотрицательностей атомов, тем более полярна связь. Ионная связь является предельным случаем ковалентной полярной связи Δχ = 0 – 0. 4 – ковалентная неполярная Δχ =0. 4 -2. 0 – ковалентная полярная связь; Δχ > 2. 1 - ионная Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении
Ионная связь Чем больше разница электроотрицательностей атомов, тем более полярна связь. Ионная связь является предельным случаем ковалентной полярной связи Δχ = 0 – 0. 4 – ковалентная неполярная Δχ =0. 4 -2. 0 – ковалентная полярная связь; Δχ > 2. 1 - ионная Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении
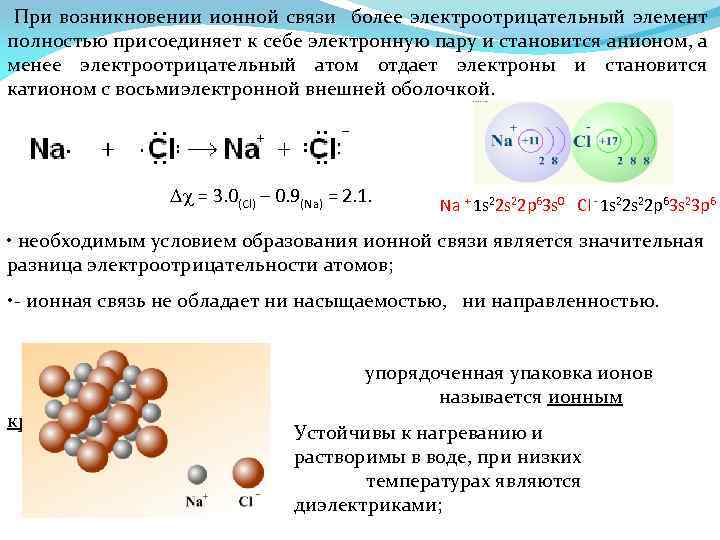 При возникновении ионной связи более электроотрицательный элемент полностью присоединяет к себе электронную пару и становится анионом, а менее электроотрицательный атом отдает электроны и становится катионом с восьмиэлектронной внешней оболочкой. Dc = 3. 0(Cl) – 0. 9(Na) = 2. 1. Nа + 1 s 22 р63 s 0 Сl - 1 s 22 р63 s 23 р6 • необходимым условием образования ионной связи является значительная разница электроотрицательности атомов; • - ионная связь не обладает ни насыщаемостью, ни направленностью. кристаллом, упорядоченная упаковка ионов называется ионным Устойчивы к нагреванию и растворимы в воде, при низких температурах являются диэлектриками;
При возникновении ионной связи более электроотрицательный элемент полностью присоединяет к себе электронную пару и становится анионом, а менее электроотрицательный атом отдает электроны и становится катионом с восьмиэлектронной внешней оболочкой. Dc = 3. 0(Cl) – 0. 9(Na) = 2. 1. Nа + 1 s 22 р63 s 0 Сl - 1 s 22 р63 s 23 р6 • необходимым условием образования ионной связи является значительная разница электроотрицательности атомов; • - ионная связь не обладает ни насыщаемостью, ни направленностью. кристаллом, упорядоченная упаковка ионов называется ионным Устойчивы к нагреванию и растворимы в воде, при низких температурах являются диэлектриками;
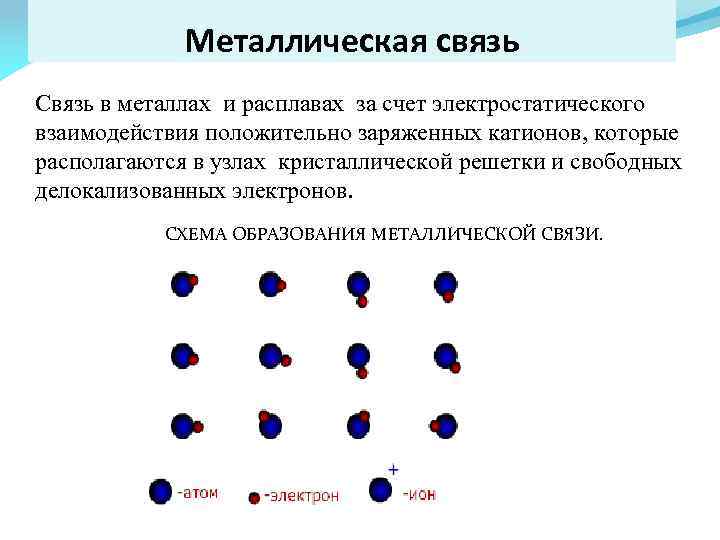 Металлическая связь Связь в металлах и расплавах за счет электростатического взаимодействия положительно заряженных катионов, которые располагаются в узлах кристаллической решетки и свободных делокализованных электронов. СХЕМА ОБРАЗОВАНИЯ МЕТАЛЛИЧЕСКОЙ СВЯЗИ.
Металлическая связь Связь в металлах и расплавах за счет электростатического взаимодействия положительно заряженных катионов, которые располагаются в узлах кристаллической решетки и свободных делокализованных электронов. СХЕМА ОБРАЗОВАНИЯ МЕТАЛЛИЧЕСКОЙ СВЯЗИ.
 Свойства соединений с металлической связью • в образовании металлического кристалла (с металлической связью) участвует большое число атомных орбиталей с одинаковой энергией, которые сближаются, перекрываются, образуя молекулярные орбитали с одинаковой энергией (электронная зона). В пределах этой электронной зоны свободные электроны могут перемещаться по всему кристаллу, не выделяя и не поглощая энергию; • вещества, с металлической связью, обладают высокой плотностью, твердостью, высокой температурой кипения и температурой плавления, высокой электропроводностью, ковкостью и пластичностью.
Свойства соединений с металлической связью • в образовании металлического кристалла (с металлической связью) участвует большое число атомных орбиталей с одинаковой энергией, которые сближаются, перекрываются, образуя молекулярные орбитали с одинаковой энергией (электронная зона). В пределах этой электронной зоны свободные электроны могут перемещаться по всему кристаллу, не выделяя и не поглощая энергию; • вещества, с металлической связью, обладают высокой плотностью, твердостью, высокой температурой кипения и температурой плавления, высокой электропроводностью, ковкостью и пластичностью.
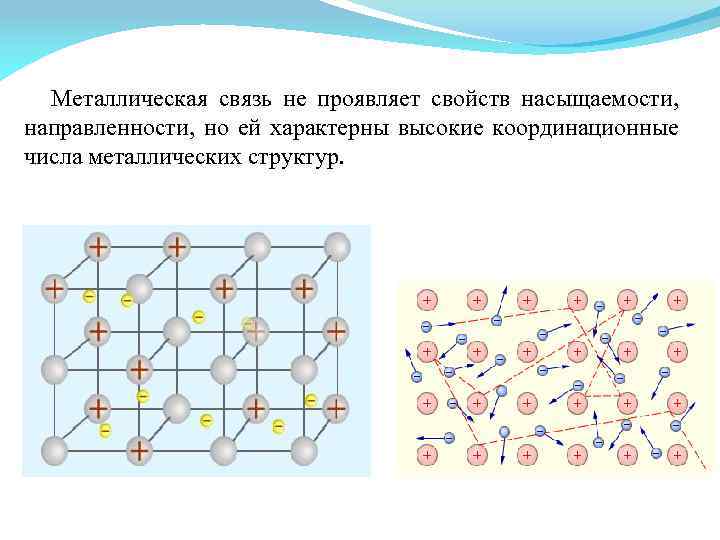 Металлическая связь не проявляет свойств насыщаемости, направленности, но ей характерны высокие координационные числа металлических структур.
Металлическая связь не проявляет свойств насыщаемости, направленности, но ей характерны высокие координационные числа металлических структур.
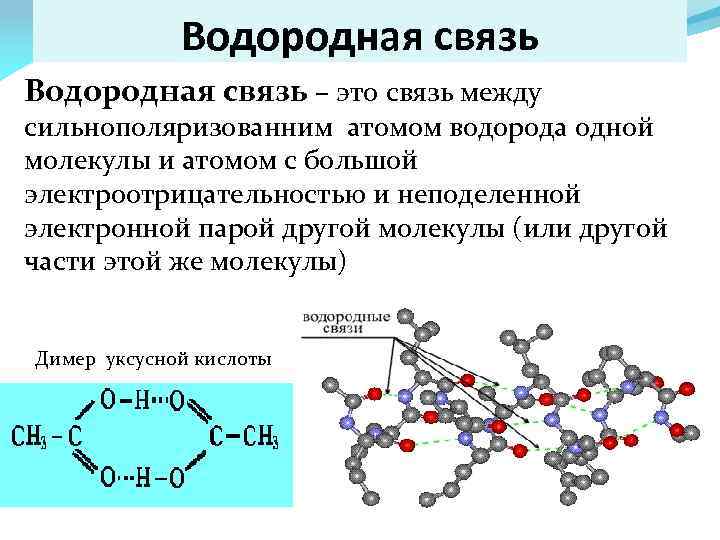 Водородная связь – это связь между сильнополяризованним атомом водорода одной молекулы и атомом с большой электроотрицательностью и неподеленной электронной парой другой молекулы (или другой части этой же молекулы) Димер уксусной кислоты
Водородная связь – это связь между сильнополяризованним атомом водорода одной молекулы и атомом с большой электроотрицательностью и неподеленной электронной парой другой молекулы (или другой части этой же молекулы) Димер уксусной кислоты
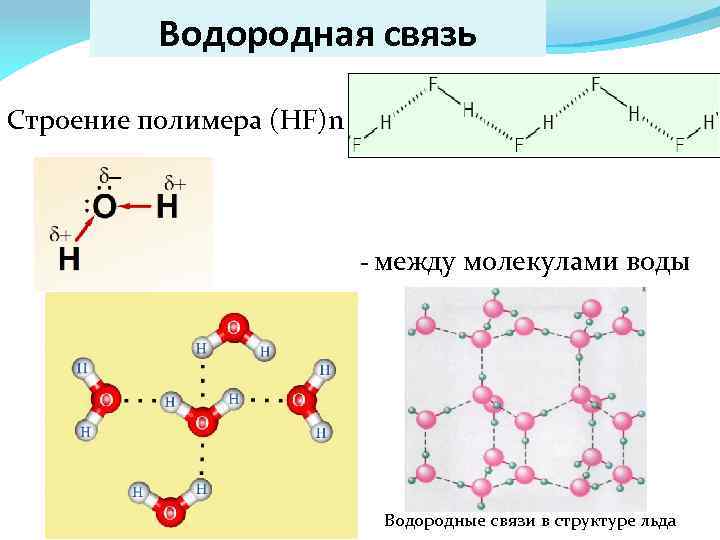 Водородная связь Строение полимера (HF)n - между молекулами воды Водородные связи в структуре льда
Водородная связь Строение полимера (HF)n - между молекулами воды Водородные связи в структуре льда
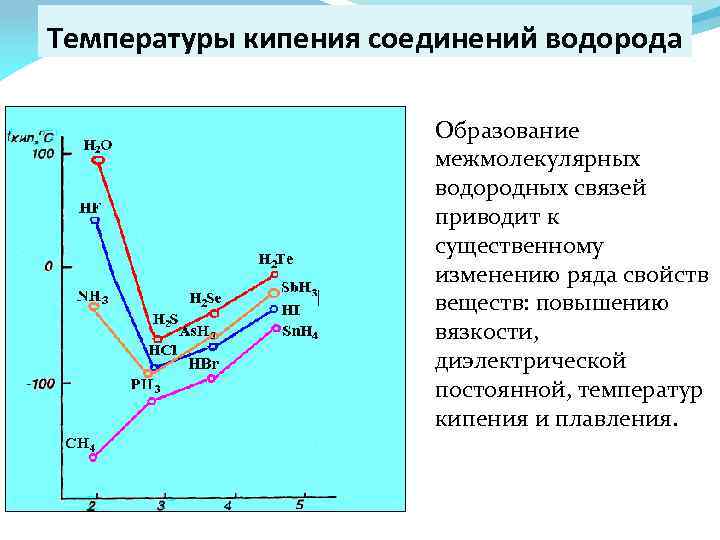 Температуры кипения соединений водорода Образование межмолекулярных водородных связей приводит к существенному изменению ряда свойств веществ: повышению вязкости, диэлектрической постоянной, температур кипения и плавления.
Температуры кипения соединений водорода Образование межмолекулярных водородных связей приводит к существенному изменению ряда свойств веществ: повышению вязкости, диэлектрической постоянной, температур кипения и плавления.
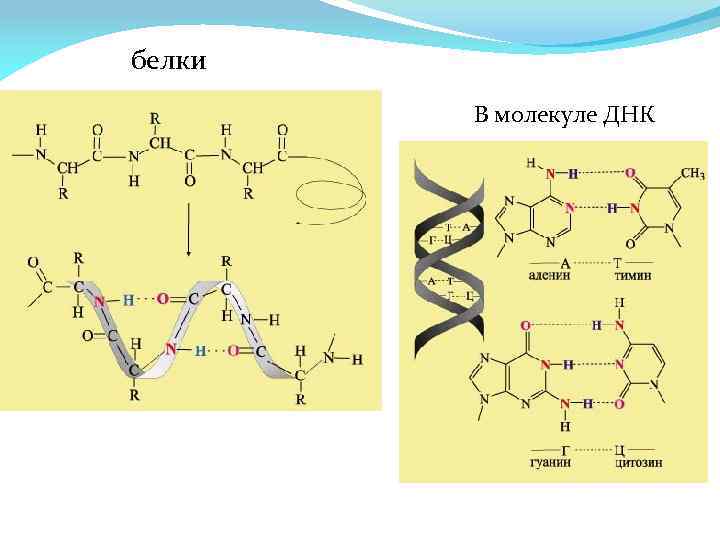 белки В молекуле ДНК
белки В молекуле ДНК
 Межмолекулярные взаимодействия Межмолекулярное взаимодействие – взаимодействие электронейтральных валентнонасыщенных молекул между собой по электростатическому взаимодействию. • эти взаимодействия обусловлены действием сил Ван- дер-Ваальса; • проявляется на значительно больших расстояниях и характеризуется отсутствием насыщаемости и небольшими энергиями;
Межмолекулярные взаимодействия Межмолекулярное взаимодействие – взаимодействие электронейтральных валентнонасыщенных молекул между собой по электростатическому взаимодействию. • эти взаимодействия обусловлены действием сил Ван- дер-Ваальса; • проявляется на значительно больших расстояниях и характеризуется отсутствием насыщаемости и небольшими энергиями;
 . Межмолекулярные взаимодействия • подразделяется на: ориентационное – взаимодействие между полярными молекулами (диполь – дипольное); HCl, H 2 O индукционное - взаимодействие между полярной и неполярной молекулами (постоянный диполь – наведенный диполь); дисперсионное - взаимодействие между неполярными молекулами (наведенный диполь – наведенный диполь). Дисперсионные силы действуют между частицами любого вещества.
. Межмолекулярные взаимодействия • подразделяется на: ориентационное – взаимодействие между полярными молекулами (диполь – дипольное); HCl, H 2 O индукционное - взаимодействие между полярной и неполярной молекулами (постоянный диполь – наведенный диполь); дисперсионное - взаимодействие между неполярными молекулами (наведенный диполь – наведенный диполь). Дисперсионные силы действуют между частицами любого вещества.


