1_Khim_svyaz_El_eff_Sopryazhenie_Arom-t.pptx
- Количество слайдов: 75
 Химическая связь и взаимное влияние атомов в органических соединениях. Лекция № 1. Чуркина Светлана Илларионовна, доцент, к. х. н.
Химическая связь и взаимное влияние атомов в органических соединениях. Лекция № 1. Чуркина Светлана Илларионовна, доцент, к. х. н.
 БИООРГАНИЧЕСКАЯ ХИМИЯ изучает строение, свойства и биологические функции веществ, участвующих в процессах жизнедеятельности.
БИООРГАНИЧЕСКАЯ ХИМИЯ изучает строение, свойства и биологические функции веществ, участвующих в процессах жизнедеятельности.
 Объекты биоорганической химии • Биополимеры (и их структурные компоненты) - высокомолекулярные природные соединения - белки, нуклеиновые кислоты, полисахариды, липиды, а также их производные.
Объекты биоорганической химии • Биополимеры (и их структурные компоненты) - высокомолекулярные природные соединения - белки, нуклеиновые кислоты, полисахариды, липиды, а также их производные.
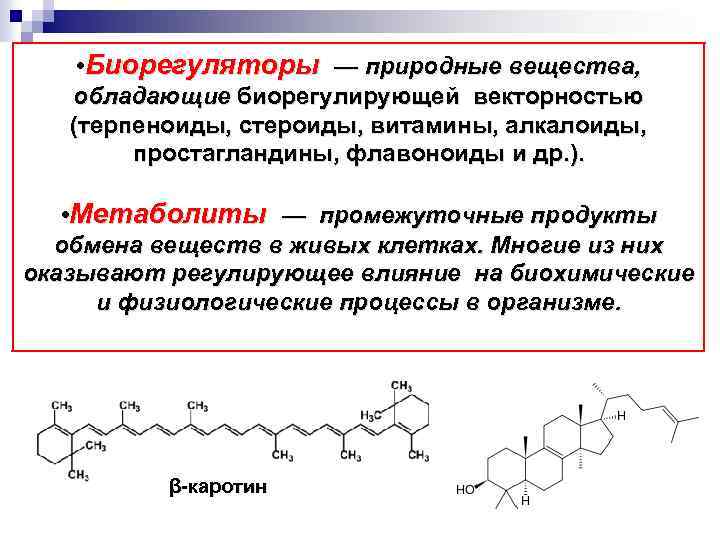 • Биорегуляторы — природные вещества, обладающие биорегулирующей векторностью (терпеноиды, стероиды, витамины, алкалоиды, простагландины, флавоноиды и др. ). • Метаболиты — промежуточные продукты обмена веществ в живых клетках. Многие из них оказывают регулирующее влияние на биохимические и физиологические процессы в организме. β-каротин
• Биорегуляторы — природные вещества, обладающие биорегулирующей векторностью (терпеноиды, стероиды, витамины, алкалоиды, простагландины, флавоноиды и др. ). • Метаболиты — промежуточные продукты обмена веществ в живых клетках. Многие из них оказывают регулирующее влияние на биохимические и физиологические процессы в организме. β-каротин
 « Целью курса «Биоорганическая химия» , как учебной дисциплины, является формирование знаний взаимосвязи строения и химических свойств биологически важных классов органических соединений, биополимеров и их структурных компонентов, т. е. платформы для восприятия биологических и медицинских знаний на молекулярном уровне. »
« Целью курса «Биоорганическая химия» , как учебной дисциплины, является формирование знаний взаимосвязи строения и химических свойств биологически важных классов органических соединений, биополимеров и их структурных компонентов, т. е. платформы для восприятия биологических и медицинских знаний на молекулярном уровне. »
 “Натура тем паче всего удивительна, что в простоте своей многохитростна и от малого числа причин производит неисчислимые образы свойств, перемен и неисчислимые образы явлений» М. В. Ломоносов 1711 -1765
“Натура тем паче всего удивительна, что в простоте своей многохитростна и от малого числа причин производит неисчислимые образы свойств, перемен и неисчислимые образы явлений» М. В. Ломоносов 1711 -1765

 СТРОЕНие АТОМА УГЛЕРОДА
СТРОЕНие АТОМА УГЛЕРОДА
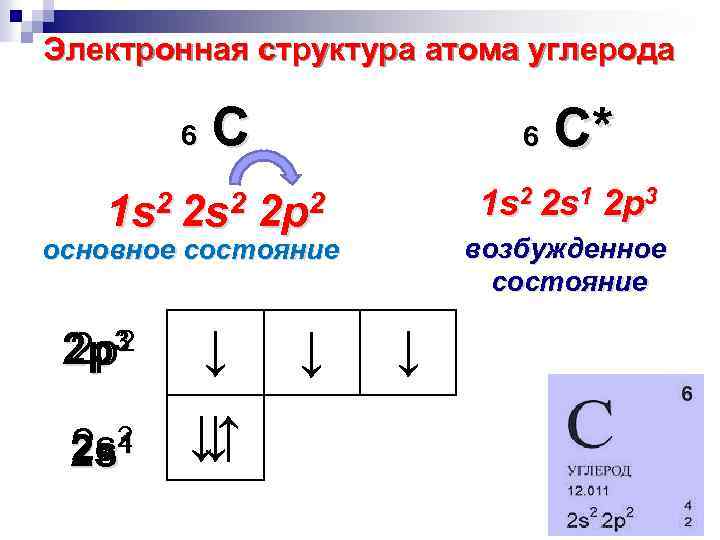 Электронная структура атома углерода 6 С С* 6 1 s 2 2 s 1 2 p 3 1 s 2 2 p 2 возбужденное состояние основное состояние 3 2 2 p 2 p 2 2 s 2 s 1 ↓ ↓↑ ↓ ↓ ↓
Электронная структура атома углерода 6 С С* 6 1 s 2 2 s 1 2 p 3 1 s 2 2 p 2 возбужденное состояние основное состояние 3 2 2 p 2 p 2 2 s 2 s 1 ↓ ↓↑ ↓ ↓ ↓
 Гибридизация – выравнивание электронных облаков по форме и энергии
Гибридизация – выравнивание электронных облаков по форме и энергии
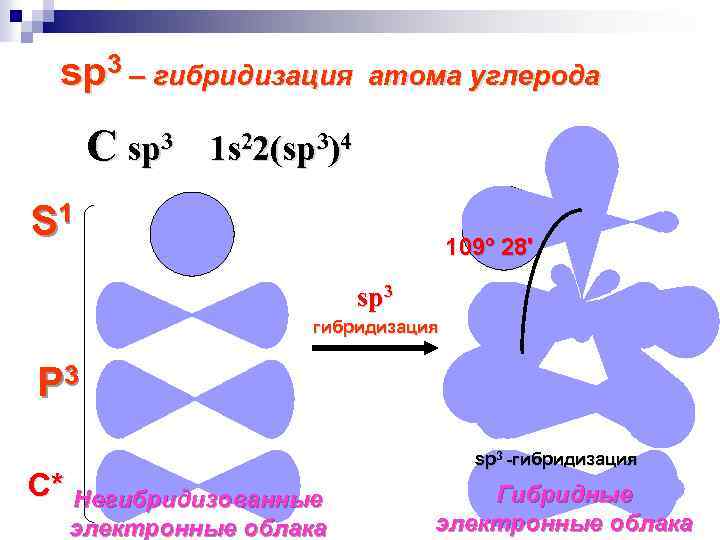 sp 3 – гибридизация атома углерода C sp 3 1 s 22(sp 3)4 S 1 109º 28' sp 3 гибридизация P 3 С* Негибридизованные электронные облака sp 3 -гибридизация Гибридные электронные облака
sp 3 – гибридизация атома углерода C sp 3 1 s 22(sp 3)4 S 1 109º 28' sp 3 гибридизация P 3 С* Негибридизованные электронные облака sp 3 -гибридизация Гибридные электронные облака
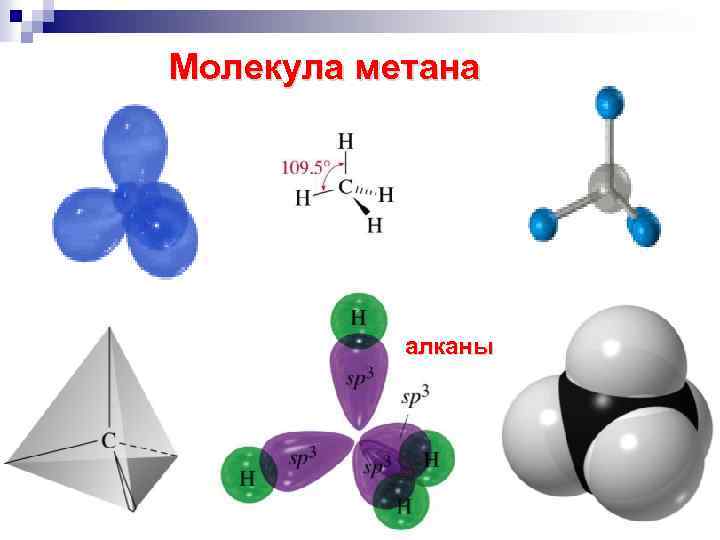 Молекула метана алканы
Молекула метана алканы
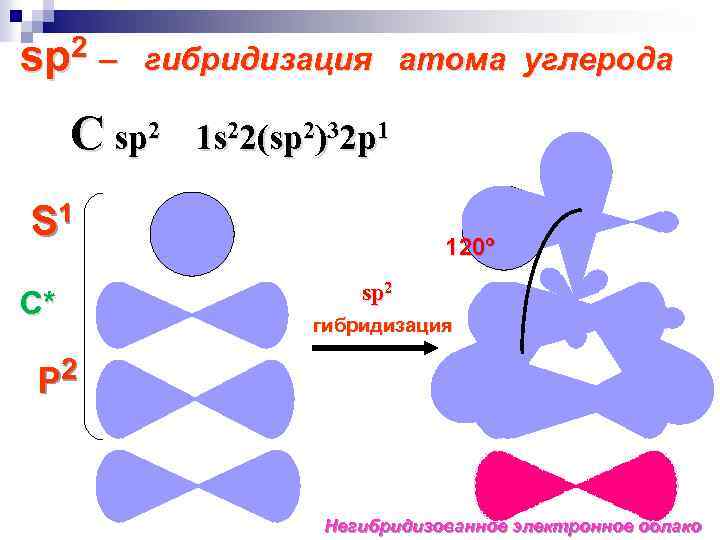 sp 2 – гибридизация атома углерода C sp 2 1 s 22(sp 2)32 p 1 S 1 С* 120º sp 2 гибридизация 2 P Негибридизованное электронное облако
sp 2 – гибридизация атома углерода C sp 2 1 s 22(sp 2)32 p 1 S 1 С* 120º sp 2 гибридизация 2 P Негибридизованное электронное облако
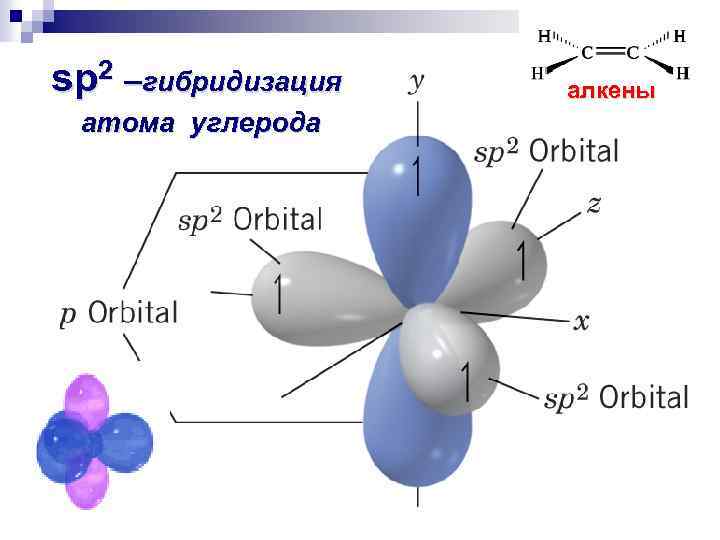 sp 2 –гибридизация атома углерода алкены
sp 2 –гибридизация атома углерода алкены
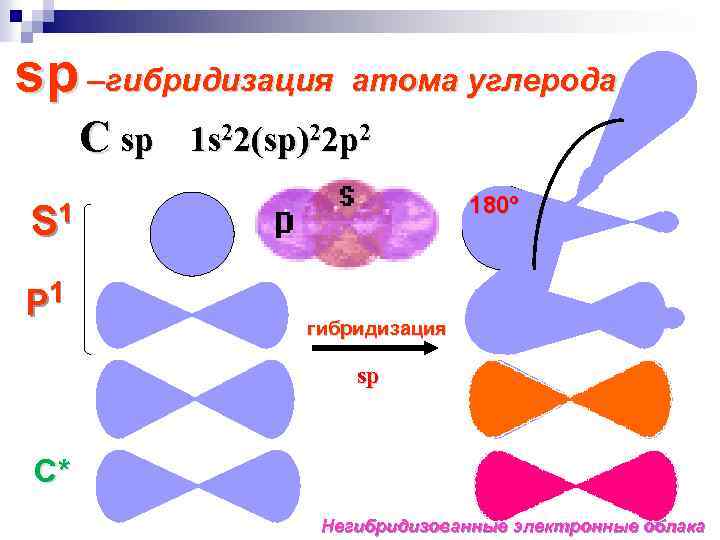 sp –гибридизация атома углерода C sp 1 s 22(sp)22 p 2 180º S 1 P 1 гибридизация sp С* Негибридизованные электронные облака
sp –гибридизация атома углерода C sp 1 s 22(sp)22 p 2 180º S 1 P 1 гибридизация sp С* Негибридизованные электронные облака
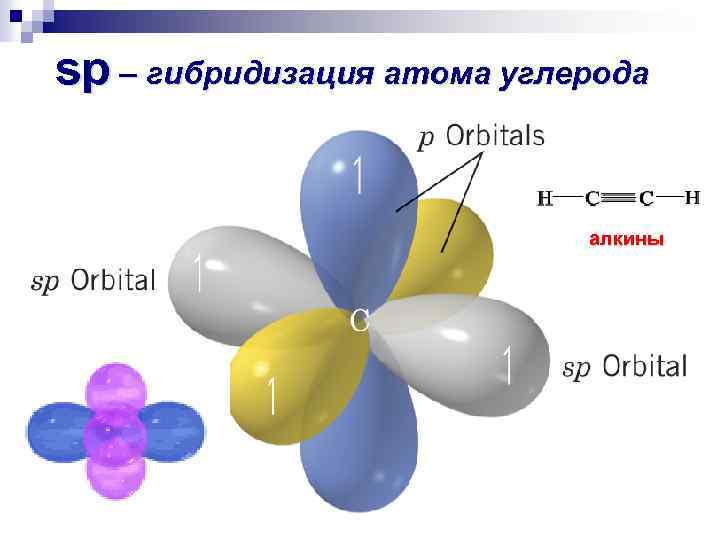 sp – гибридизация атома углерода алкины
sp – гибридизация атома углерода алкины
 Химическая связь в органических соединениях Химическая связь – взаимодействие между 2 атомами, осуществляемое путем обмена электронами и приводящее к образованию молекул.
Химическая связь в органических соединениях Химическая связь – взаимодействие между 2 атомами, осуществляемое путем обмена электронами и приводящее к образованию молекул.
 Типы химической связи: молекулярная орбиталь полностью смещена от одного атома к другому 1. Ионная связь —притяжение ионов как разноименно заряженных тел.
Типы химической связи: молекулярная орбиталь полностью смещена от одного атома к другому 1. Ионная связь —притяжение ионов как разноименно заряженных тел.
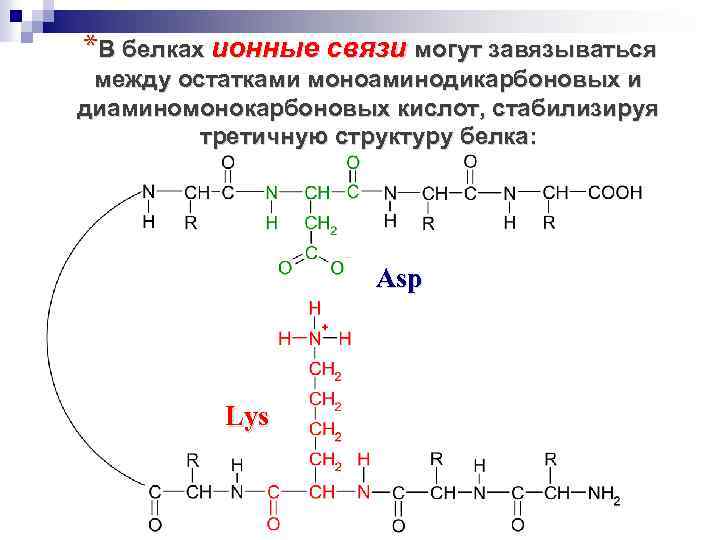 *В белках ионные связи могут завязываться между остатками моноаминодикарбоновых и диаминомонокарбоновых кислот, стабилизируя третичную структуру белка: Asp Lys
*В белках ионные связи могут завязываться между остатками моноаминодикарбоновых и диаминомонокарбоновых кислот, стабилизируя третичную структуру белка: Asp Lys
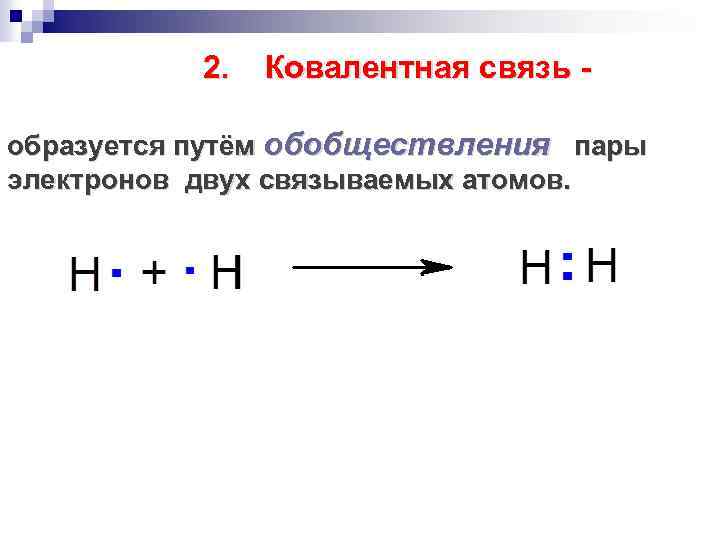 2. Ковалентная связь - образуется путём обобществления пары электронов двух связываемых атомов.
2. Ковалентная связь - образуется путём обобществления пары электронов двух связываемых атомов.
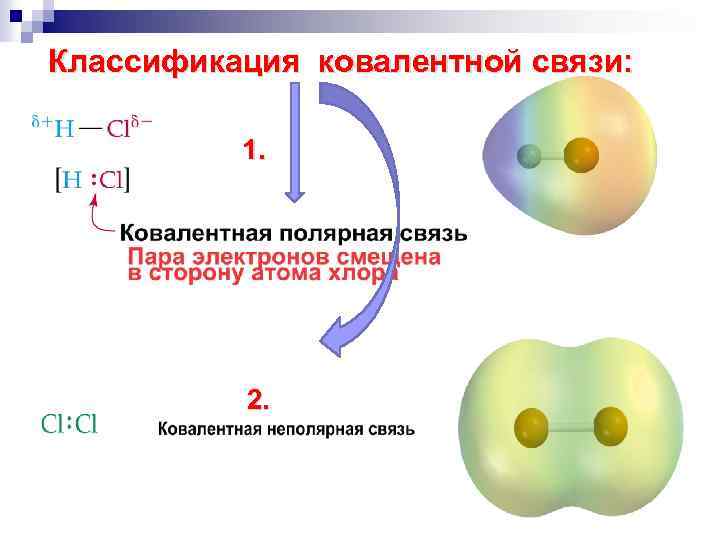 Классификация ковалентной связи: 1. 2.
Классификация ковалентной связи: 1. 2.
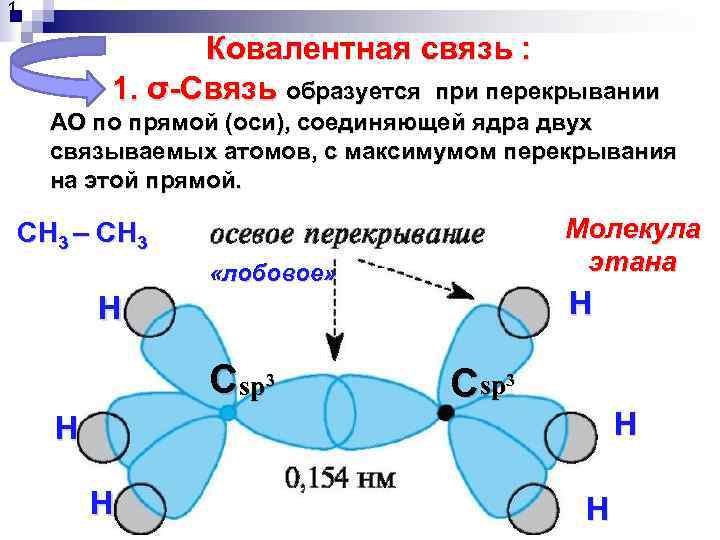 1. Ковалентная связь : 1. σ-Связь образуется при перекрывании АО по прямой (оси), соединяющей ядра двух связываемых атомов, с максимумом перекрывания на этой прямой. Молекула этана СН 3 – СН 3 «лобовое» Н Н Сsp 3 Н Н
1. Ковалентная связь : 1. σ-Связь образуется при перекрывании АО по прямой (оси), соединяющей ядра двух связываемых атомов, с максимумом перекрывания на этой прямой. Молекула этана СН 3 – СН 3 «лобовое» Н Н Сsp 3 Н Н
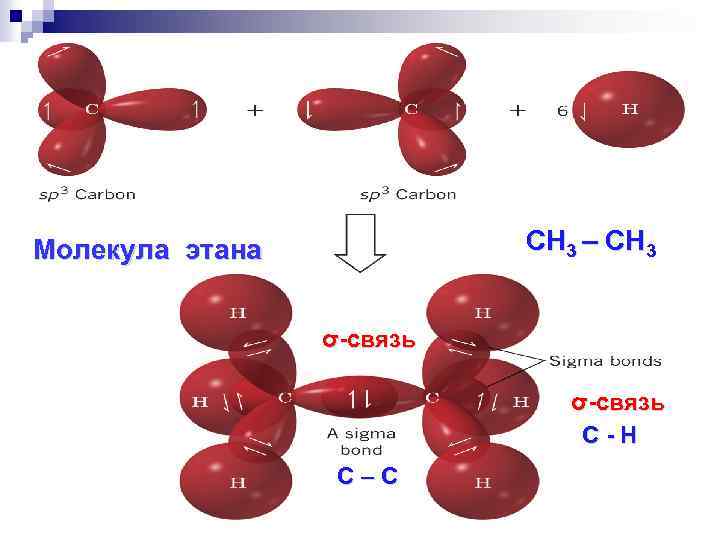 СН 3 – СН 3 Молекула этана σ-связь С - Н С – С
СН 3 – СН 3 Молекула этана σ-связь С - Н С – С
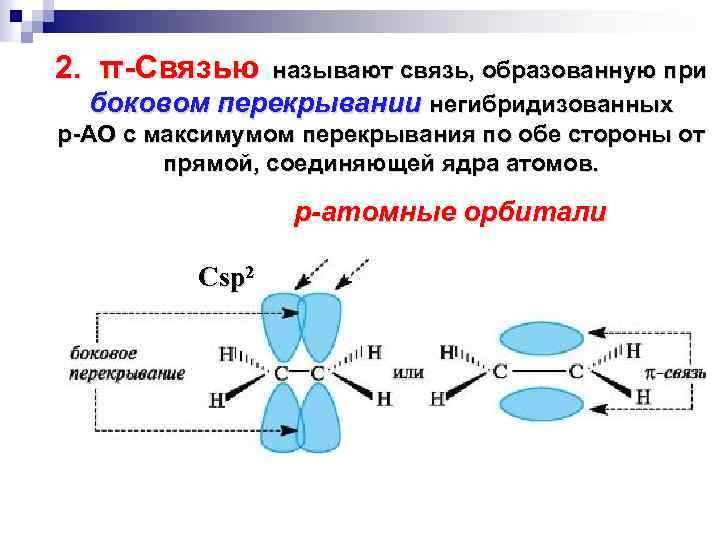 2. π-Связью называют связь, образованную при боковом перекрывании негибридизованных p-АО с максимумом перекрывания по обе стороны от прямой, соединяющей ядра атомов. Сsp 2 р-атомные орбитали
2. π-Связью называют связь, образованную при боковом перекрывании негибридизованных p-АО с максимумом перекрывания по обе стороны от прямой, соединяющей ядра атомов. Сsp 2 р-атомные орбитали
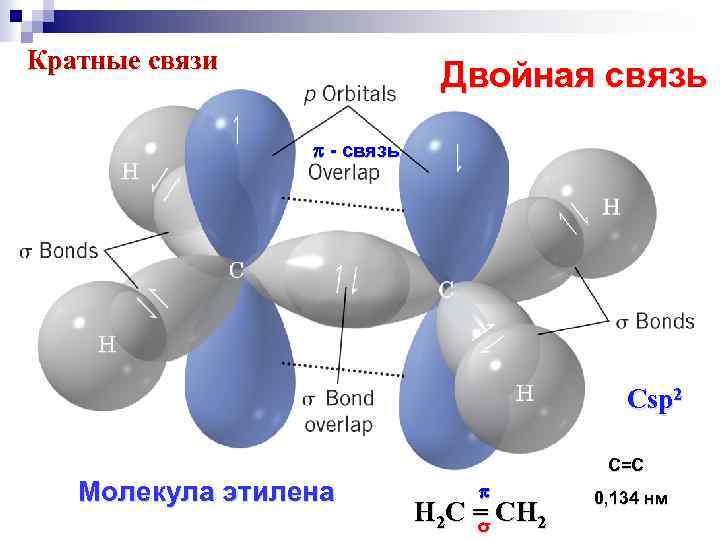 Кратные связи Двойная связь - связь Сsp 2 Молекула этилена С=С H 2 C = CH 2 σ 0, 134 нм
Кратные связи Двойная связь - связь Сsp 2 Молекула этилена С=С H 2 C = CH 2 σ 0, 134 нм
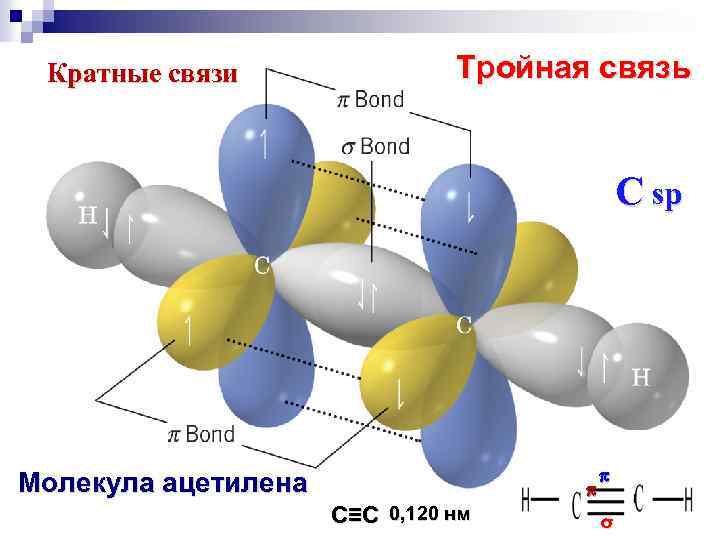 Кратные связи Тройная связь C sp Молекула ацетилена С≡С 0, 120 нм σ
Кратные связи Тройная связь C sp Молекула ацетилена С≡С 0, 120 нм σ
 Характеристики ковалентных связей. Полярность связи ( поляризация) - неравномерное распределение электронной плотности Электроотрицательность (ЭО) сила притягивания и удерживания электронного облака ядром атома
Характеристики ковалентных связей. Полярность связи ( поляризация) - неравномерное распределение электронной плотности Электроотрицательность (ЭО) сила притягивания и удерживания электронного облака ядром атома
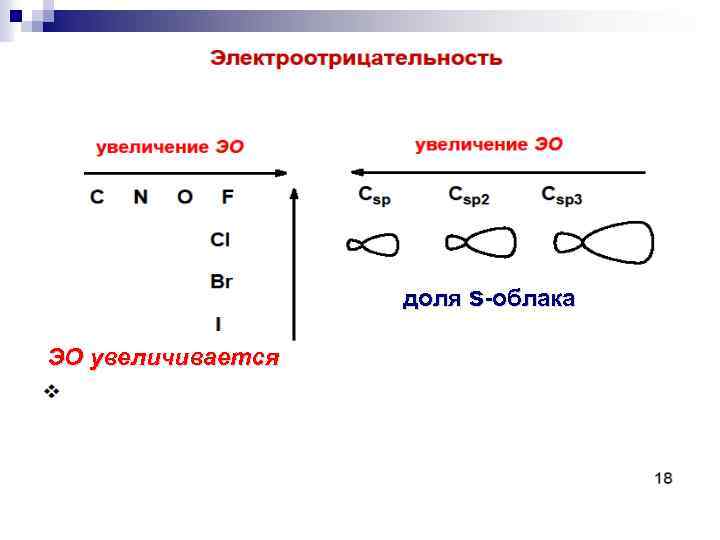 доля s-облака ЭО увеличивается
доля s-облака ЭО увеличивается
 . Шкала электроотрицательности по Полингу: F O Cl, N Br J C, S H 4, 0 3, 5 3, 0 2, 8 2, 6 2, 5 2, 2
. Шкала электроотрицательности по Полингу: F O Cl, N Br J C, S H 4, 0 3, 5 3, 0 2, 8 2, 6 2, 5 2, 2
 Классификация ковалентных связей по способу образования Обменный механизм. Каждый атом предоставляет 1 электрон для образования общей пары
Классификация ковалентных связей по способу образования Обменный механизм. Каждый атом предоставляет 1 электрон для образования общей пары
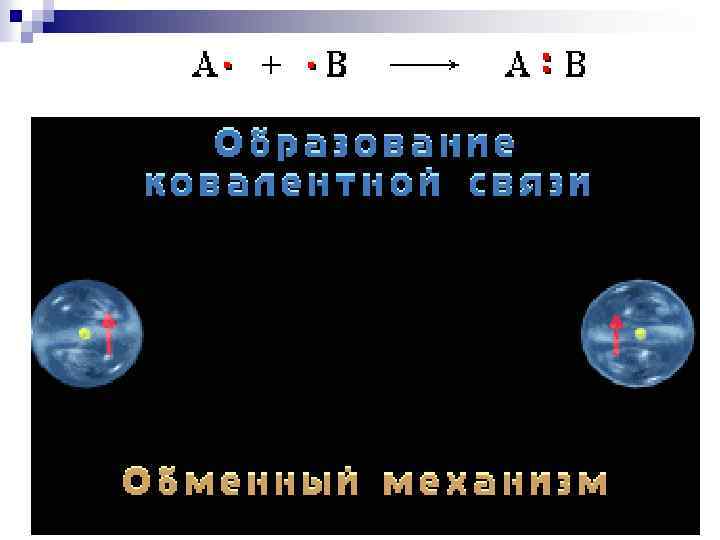
 Донорно-акцепторный механизм Связь между атомами А и В образуется с помощью общей пары электронов: донор акцептор
Донорно-акцепторный механизм Связь между атомами А и В образуется с помощью общей пары электронов: донор акцептор

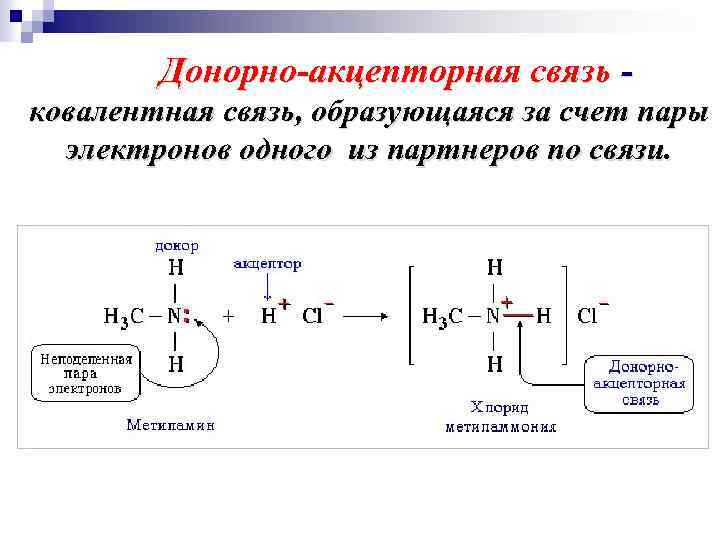 Донорно-акцепторная связь ковалентная связь, образующаяся за счет пары электронов одного из партнеров по связи.
Донорно-акцепторная связь ковалентная связь, образующаяся за счет пары электронов одного из партнеров по связи.
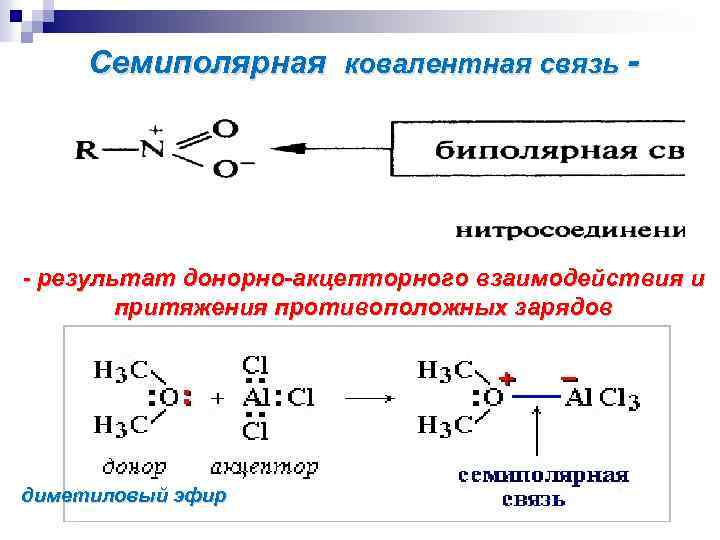 Семиполярная ковалентная связь - - результат донорно-акцепторного взаимодействия и притяжения противоположных зарядов диметиловый эфир
Семиполярная ковалентная связь - - результат донорно-акцепторного взаимодействия и притяжения противоположных зарядов диметиловый эфир
 В. Латимер и Р. Родебуш, 1920 Водородная связь – связь между атомом Н одной молекулы и электроотрицательным атомом (О, N ) другой молекулы: δ+ δ+
В. Латимер и Р. Родебуш, 1920 Водородная связь – связь между атомом Н одной молекулы и электроотрицательным атомом (О, N ) другой молекулы: δ+ δ+
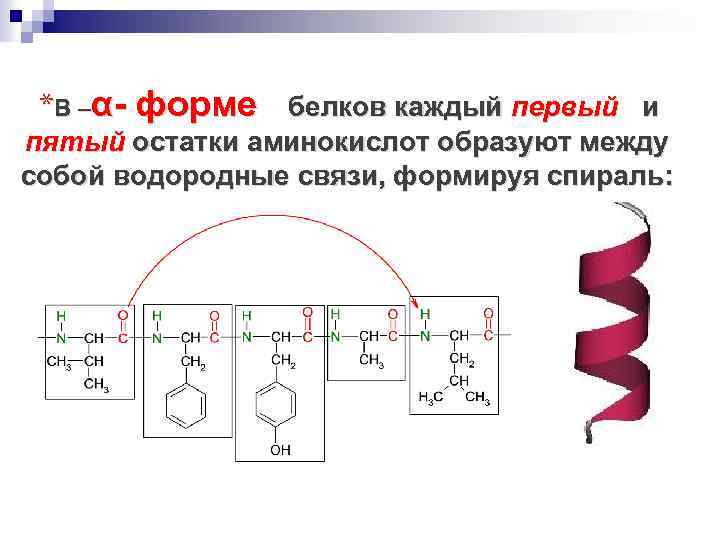 *В –α- форме белков каждый первый и пятый остатки аминокислот образуют между собой водородные связи, формируя спираль:
*В –α- форме белков каждый первый и пятый остатки аминокислот образуют между собой водородные связи, формируя спираль:
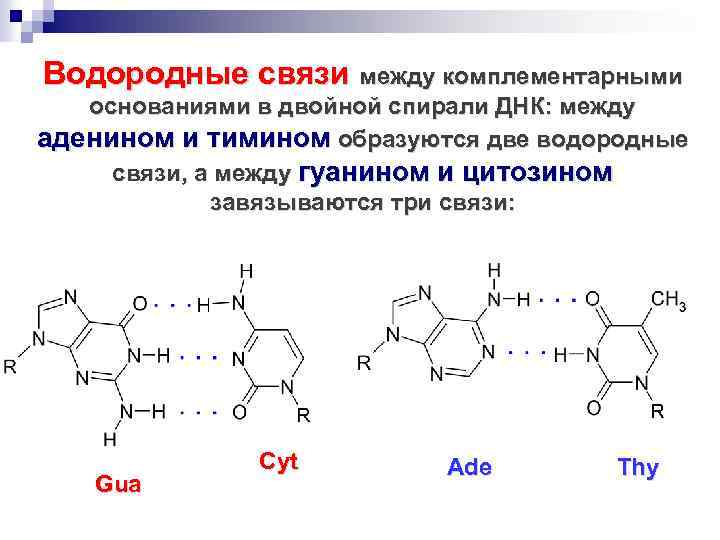 Водородные связи между комплементарными основаниями в двойной спирали ДНК: между аденином и тимином образуются две водородные связи, а между гуанином и цитозином завязываются три связи: Gua Cyt Ade Thy
Водородные связи между комплементарными основаниями в двойной спирали ДНК: между аденином и тимином образуются две водородные связи, а между гуанином и цитозином завязываются три связи: Gua Cyt Ade Thy
 Ковалентная связь Локализованной, двухцентровой, называется двойная связь, в которой электронная плотность -связи охватывает только два ядра связываемых атомов. n Делокализованная -связь охватывает более двух атомов. n
Ковалентная связь Локализованной, двухцентровой, называется двойная связь, в которой электронная плотность -связи охватывает только два ядра связываемых атомов. n Делокализованная -связь охватывает более двух атомов. n
 > С = С – Х
> С = С – Х
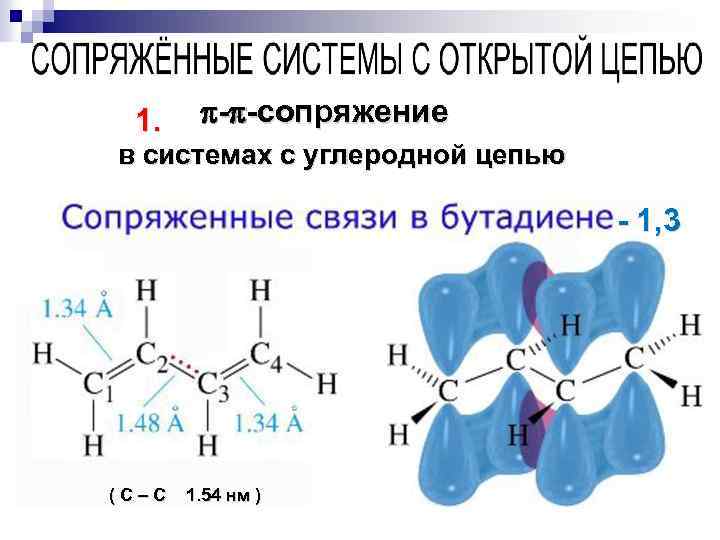 1. - -сопряжение в системах с углеродной цепью - 1, 3 ( С – С 1. 54 нм )
1. - -сопряжение в системах с углеродной цепью - 1, 3 ( С – С 1. 54 нм )
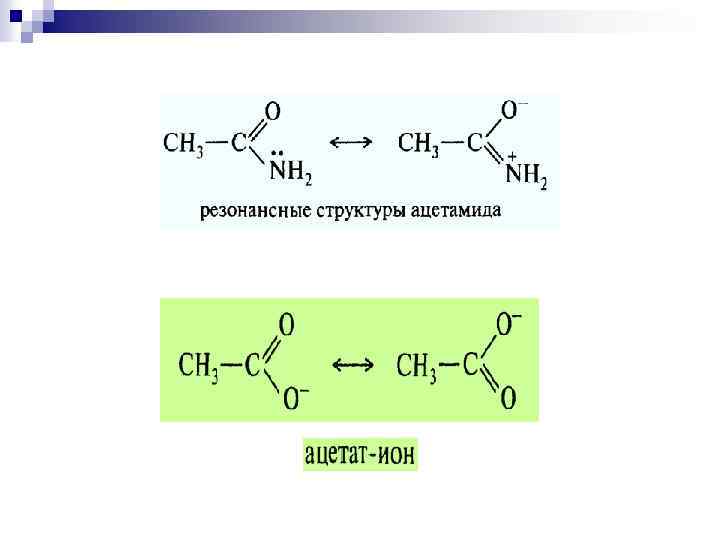
 Теория резонанса. Распределение электронов в молекулах является комбинацией (резонансом) канонических гибридных структур
Теория резонанса. Распределение электронов в молекулах является комбинацией (резонансом) канонических гибридных структур
 , -Сопряжение в системах с углеродной цепью:
, -Сопряжение в системах с углеродной цепью:
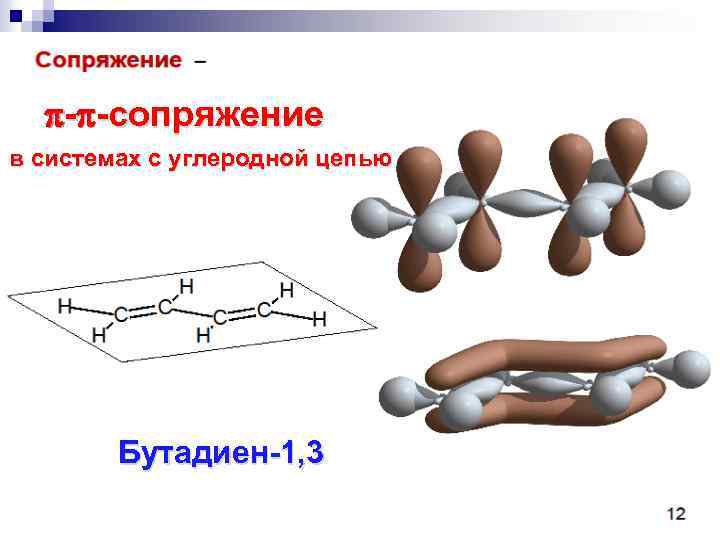 - -сопряжение в системах с углеродной цепью Бутадиен-1, 3
- -сопряжение в системах с углеродной цепью Бутадиен-1, 3
 2. - -Сопряжение α, β-ненасыщенные карбонильные соединения
2. - -Сопряжение α, β-ненасыщенные карбонильные соединения
 р, - сопряжение 1.
р, - сопряжение 1.
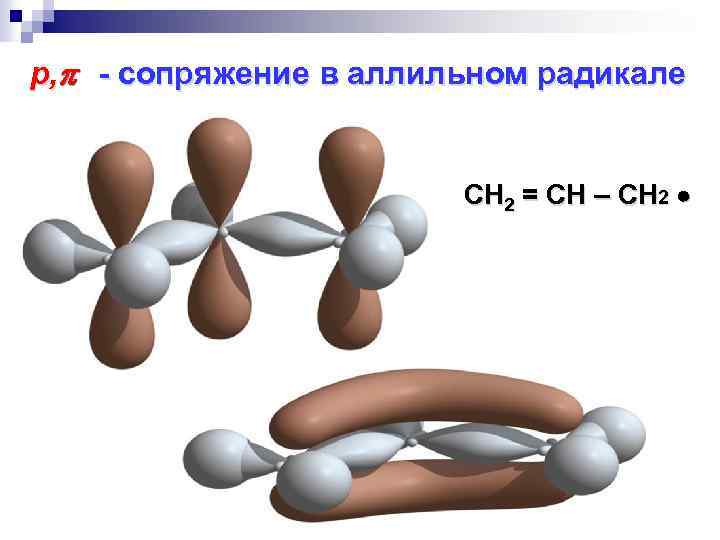 р, - сопряжение в аллильном радикале СН 2 = СН – СН 2
р, - сопряжение в аллильном радикале СН 2 = СН – СН 2
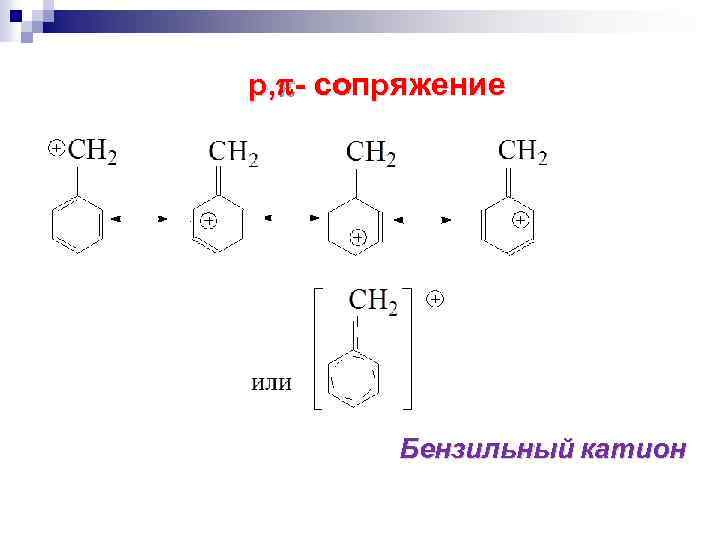 р, - сопряжение Бензильный катион
р, - сопряжение Бензильный катион
 2. р, -сопряжение с гетероатомом в цепи винилбромид
2. р, -сопряжение с гетероатомом в цепи винилбромид
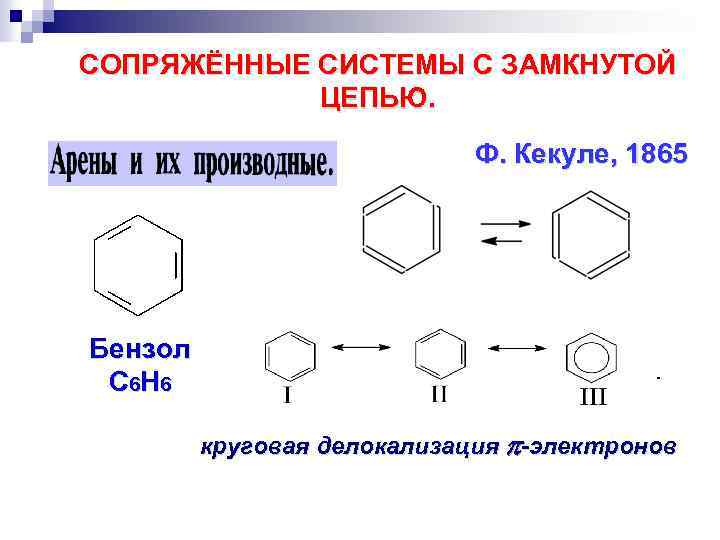 СОПРЯЖЁННЫЕ СИСТЕМЫ С ЗАМКНУТОЙ ЦЕПЬЮ. Ф. Кекуле, 1865 Бензол С 6 Н 6 круговая делокализация -электронов
СОПРЯЖЁННЫЕ СИСТЕМЫ С ЗАМКНУТОЙ ЦЕПЬЮ. Ф. Кекуле, 1865 Бензол С 6 Н 6 круговая делокализация -электронов
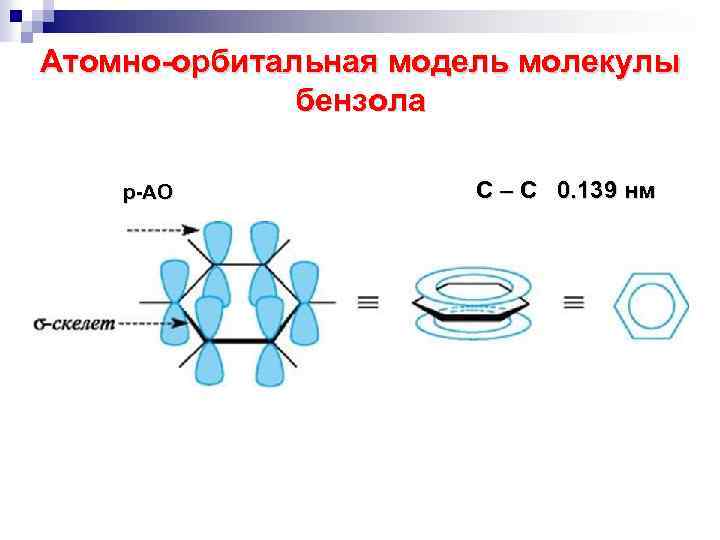 Атомно-орбитальная модель молекулы бензола р-АО С – С 0. 139 нм
Атомно-орбитальная модель молекулы бензола р-АО С – С 0. 139 нм
 Ароматичность — особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую стабильность
Ароматичность — особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую стабильность
 Ароматичность Эрих Арманд Артур Йозеф Хюккель ( Erich Armand Arthur Joseph Hückel ) 1896, Берлин — 1980, Марбург немецкий физик и химик, один из основоположников квантовой химии
Ароматичность Эрих Арманд Артур Йозеф Хюккель ( Erich Armand Arthur Joseph Hückel ) 1896, Берлин — 1980, Марбург немецкий физик и химик, один из основоположников квантовой химии
 Правило Хюккеля Система ароматична, если она обладает совокупностью следующих признаков: n а) все атомы в цикле находятся в sр2 гибридизации ( -скелет плоскостной); n б) молекула имеет циклическую систему сопряжения; n в) в сопряжении участвует (4 n+2) - -электронов, где n — целое число ( n=0, 1, 2, 3, 4 … )
Правило Хюккеля Система ароматична, если она обладает совокупностью следующих признаков: n а) все атомы в цикле находятся в sр2 гибридизации ( -скелет плоскостной); n б) молекула имеет циклическую систему сопряжения; n в) в сопряжении участвует (4 n+2) - -электронов, где n — целое число ( n=0, 1, 2, 3, 4 … )

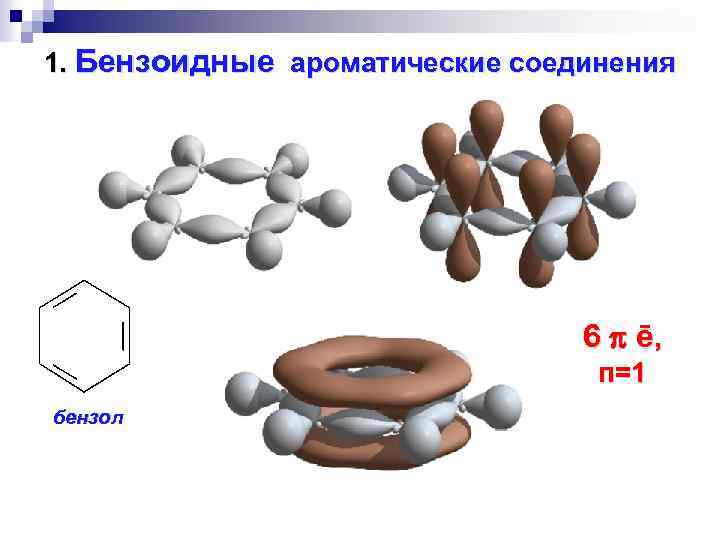 1. Бензоидные ароматические соединения 6 ē, п=1 бензол
1. Бензоидные ароматические соединения 6 ē, п=1 бензол
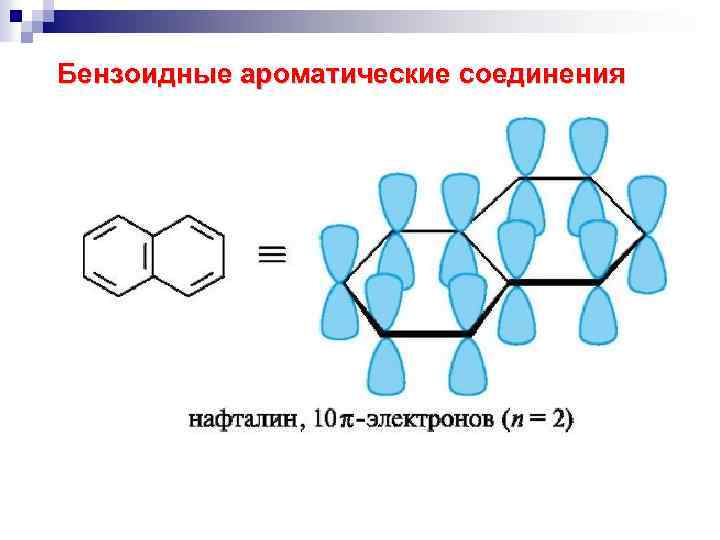 Бензоидные ароматические соединения
Бензоидные ароматические соединения
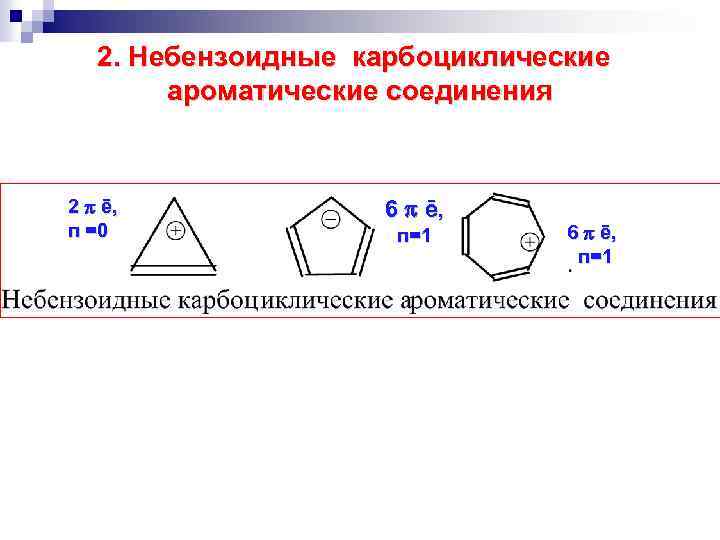 2. Небензоидные карбоциклические ароматические соединения 2 ē, п =0 6 ē, п=1
2. Небензоидные карбоциклические ароматические соединения 2 ē, п =0 6 ē, п=1
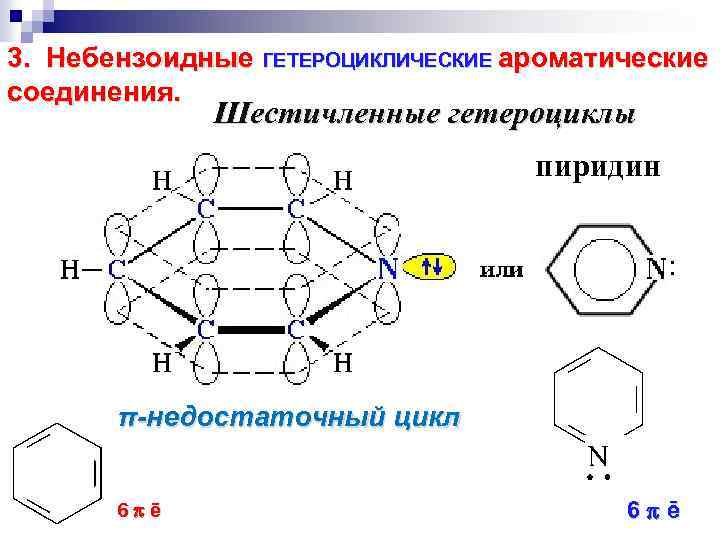 3. Небензоидные ГЕТЕРОЦИКЛИЧЕСКИЕ ароматические соединения. Шестичленные гетероциклы пиридин π-недостаточный цикл 6 ē
3. Небензоидные ГЕТЕРОЦИКЛИЧЕСКИЕ ароматические соединения. Шестичленные гетероциклы пиридин π-недостаточный цикл 6 ē
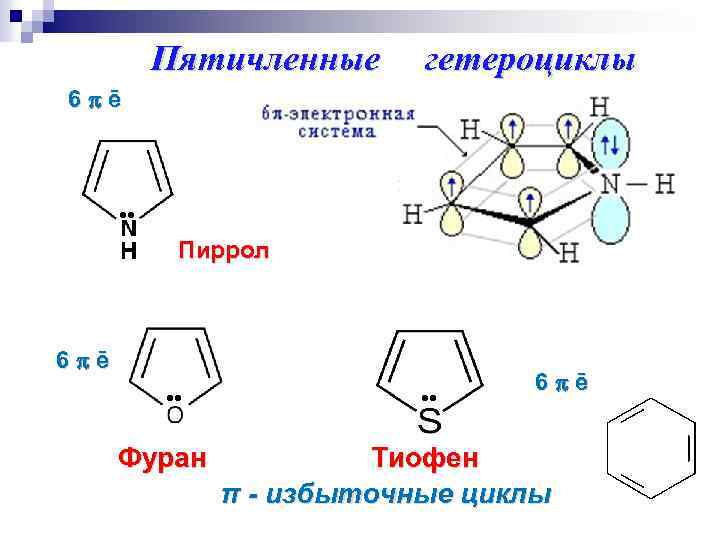 Пятичленные гетероциклы 6 ē Пиррол 6 ē Фуран 6 ē Тиофен π - избыточные циклы
Пятичленные гетероциклы 6 ē Пиррол 6 ē Фуран 6 ē Тиофен π - избыточные циклы
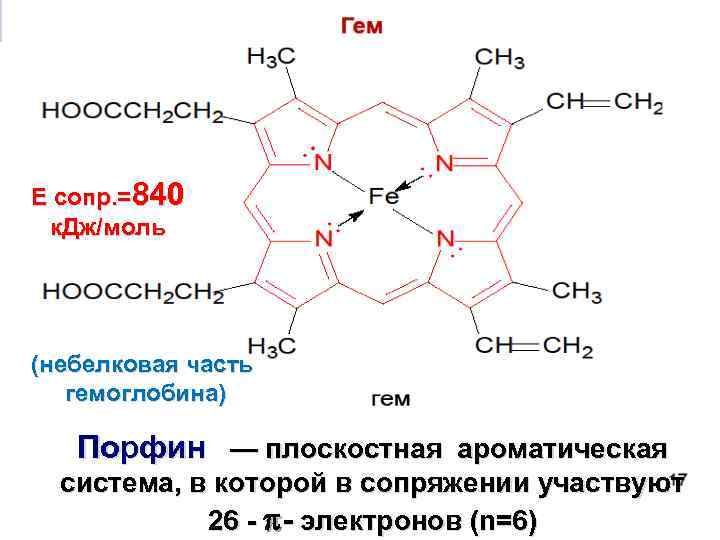 Е сопр. =840 к. Дж/моль (небелковая часть гемоглобина) Порфин — плоскостная ароматическая система, в которой в сопряжении участвуют 26 - - электронов (n=6)
Е сопр. =840 к. Дж/моль (небелковая часть гемоглобина) Порфин — плоскостная ароматическая система, в которой в сопряжении участвуют 26 - - электронов (n=6)
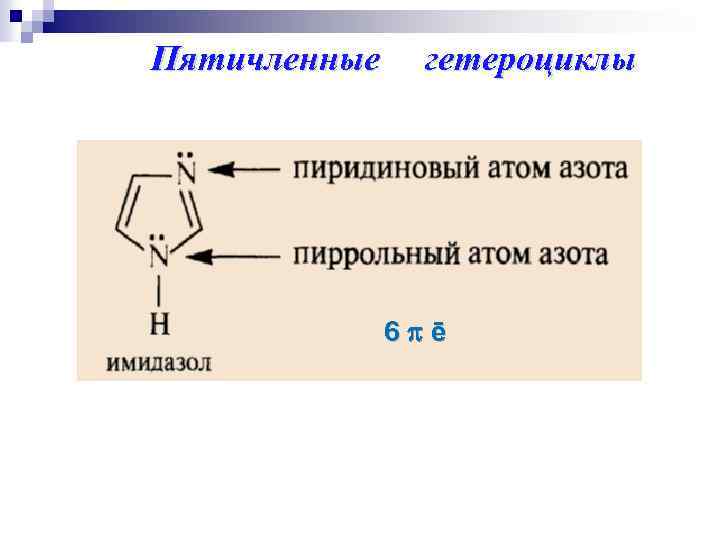 Пятичленные гетероциклы 6 ē
Пятичленные гетероциклы 6 ē
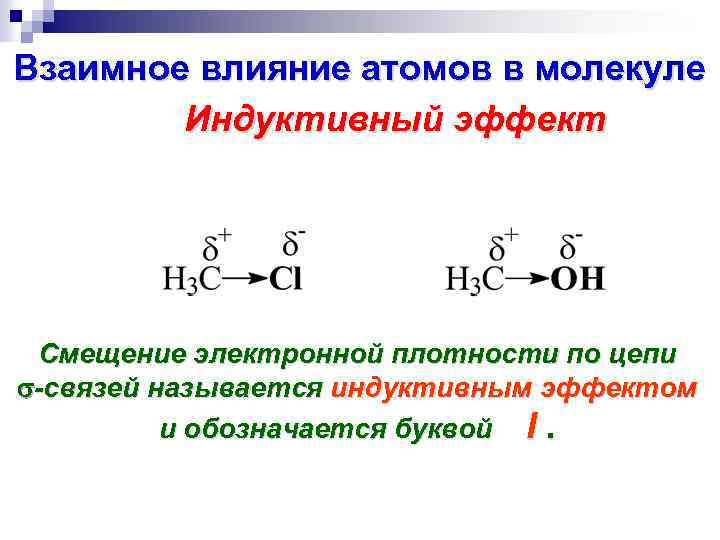 Взаимное влияние атомов в молекуле Индуктивный эффект Смещение электронной плотности по цепи -связей называется индуктивным эффектом и обозначается буквой I.
Взаимное влияние атомов в молекуле Индуктивный эффект Смещение электронной плотности по цепи -связей называется индуктивным эффектом и обозначается буквой I.
 Индуктивный эффект Электроноакцепторные заместители X, т. е. атом или группа атомов, смещающие электронную плотность -связи от атома углерода, проявляют отрицательный индуктивный эффект ( - I - эффект). C X Электронодонорные заместители X, т. е. атом или группа атомов, смещающие электронную плотность к атому углерода, проявляют положительный индуктивный эффект ( +I - эффект). C X
Индуктивный эффект Электроноакцепторные заместители X, т. е. атом или группа атомов, смещающие электронную плотность -связи от атома углерода, проявляют отрицательный индуктивный эффект ( - I - эффект). C X Электронодонорные заместители X, т. е. атом или группа атомов, смещающие электронную плотность к атому углерода, проявляют положительный индуктивный эффект ( +I - эффект). C X
 –I эффект проявляют 1. заместители, которые содержат атомы с большей ЭО, чем у углерода: -F, -Cl, -Br, -OH, -NH 2, -NO 2, >C=O, -COOH и др. ; 2. катионы. –I
–I эффект проявляют 1. заместители, которые содержат атомы с большей ЭО, чем у углерода: -F, -Cl, -Br, -OH, -NH 2, -NO 2, >C=O, -COOH и др. ; 2. катионы. –I
 +I эффект проявляют заместители, содержащие атомы с низкой ЭО: 1. - насыщенные углеводородные радикалы (-CH 3, -C 2 H 5) и т. п. , (СН 3)3 С- > (СН 3)2 СН- > СН 3 — СН 2 - > CН 3 трет. бутил изопропил этил метил 2. - металлы (-Mg-, -Li); 3. - анионы
+I эффект проявляют заместители, содержащие атомы с низкой ЭО: 1. - насыщенные углеводородные радикалы (-CH 3, -C 2 H 5) и т. п. , (СН 3)3 С- > (СН 3)2 СН- > СН 3 — СН 2 - > CН 3 трет. бутил изопропил этил метил 2. - металлы (-Mg-, -Li); 3. - анионы
 I – эффект затухает по цепи, распространяется на 3 -4 σ- связи
I – эффект затухает по цепи, распространяется на 3 -4 σ- связи
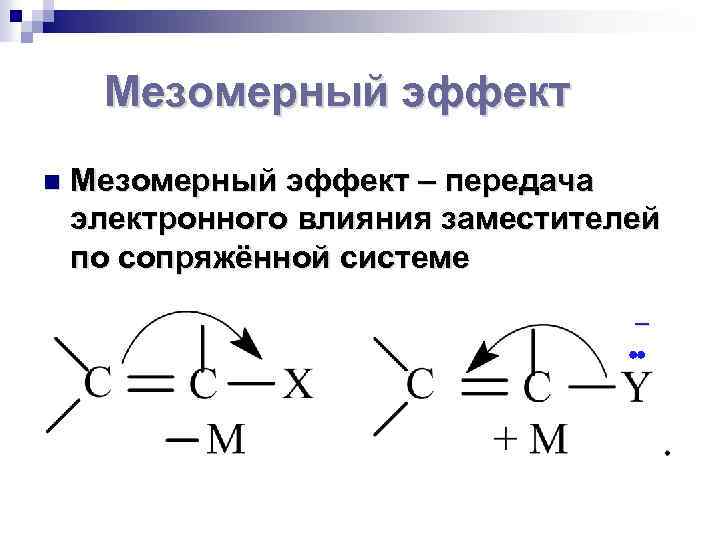 Мезомерный эффект n Мезомерный эффект – передача электронного влияния заместителей по сопряжённой системе _
Мезомерный эффект n Мезомерный эффект – передача электронного влияния заместителей по сопряжённой системе _
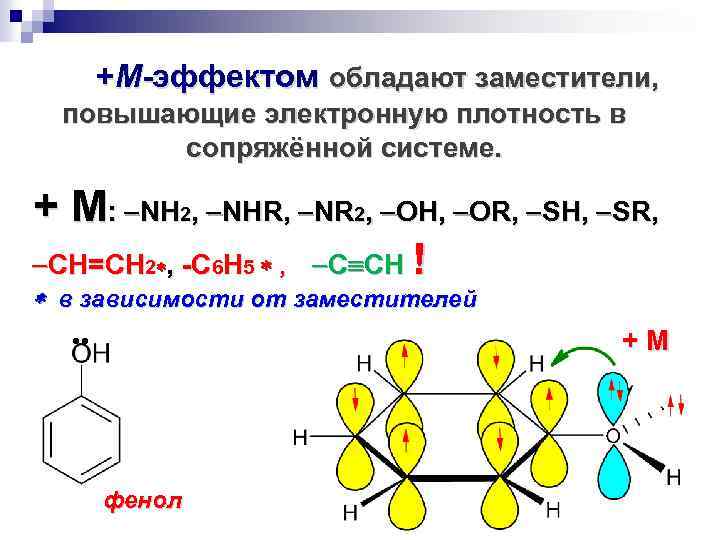 +М-эффектом обладают заместители, повышающие электронную плотность в сопряжённой системе. + М: NH 2, NHR, NR 2, OH, OR, SH, SR, CH=CH 2 , -С 6 Н 5 , C CH ! в зависимости от заместителей + М фенол
+М-эффектом обладают заместители, повышающие электронную плотность в сопряжённой системе. + М: NH 2, NHR, NR 2, OH, OR, SH, SR, CH=CH 2 , -С 6 Н 5 , C CH ! в зависимости от заместителей + М фенол
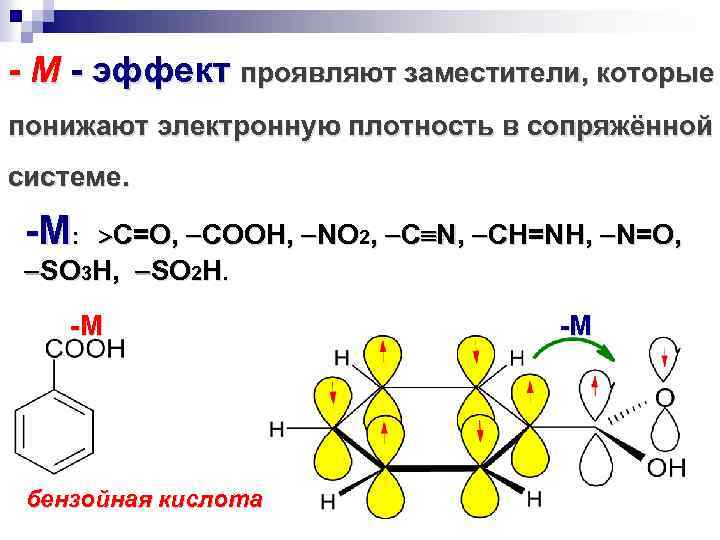 - М - эффект проявляют заместители, которые понижают электронную плотность в сопряжённой системе. -M: C=O, COOH, NO 2, C N, CH=NH, N=O, SO 3 H, SO 2 H. -M бензойная кислота -M
- М - эффект проявляют заместители, которые понижают электронную плотность в сопряжённой системе. -M: C=O, COOH, NO 2, C N, CH=NH, N=O, SO 3 H, SO 2 H. -M бензойная кислота -M
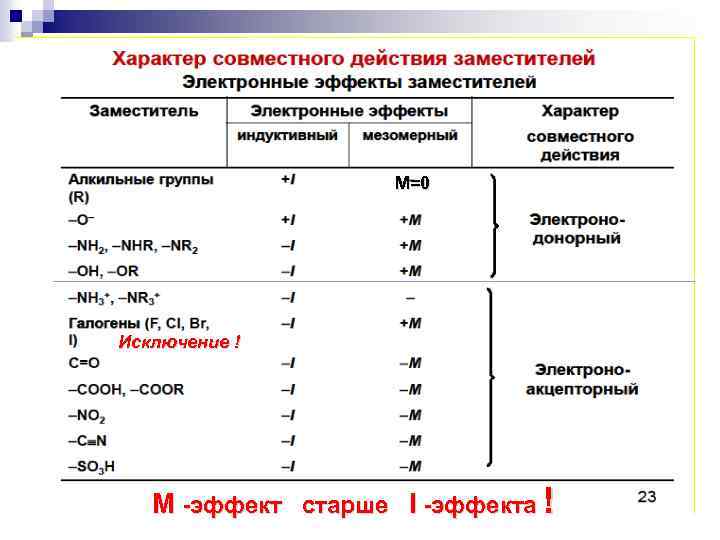 М=0 Исключение ! М -эффект старше I -эффекта !
М=0 Исключение ! М -эффект старше I -эффекта !
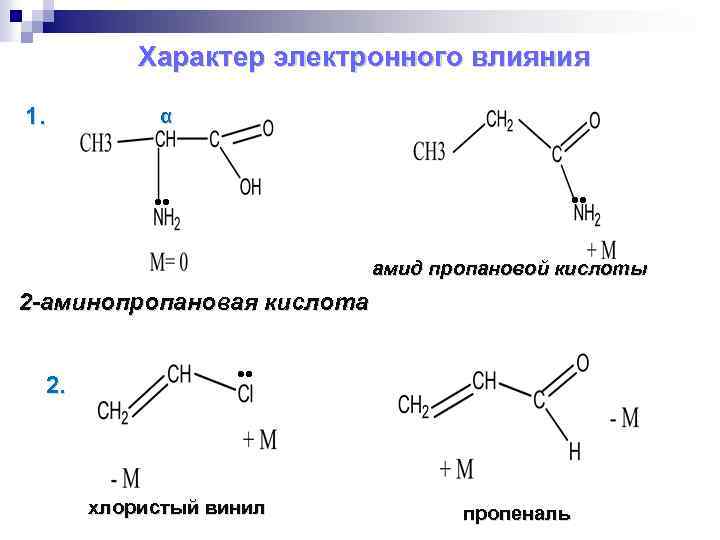 Характер электронного влияния 1. α амид пропановой кислоты 2 -аминопропановая кислота 2. хлористый винил пропеналь
Характер электронного влияния 1. α амид пропановой кислоты 2 -аминопропановая кислота 2. хлористый винил пропеналь
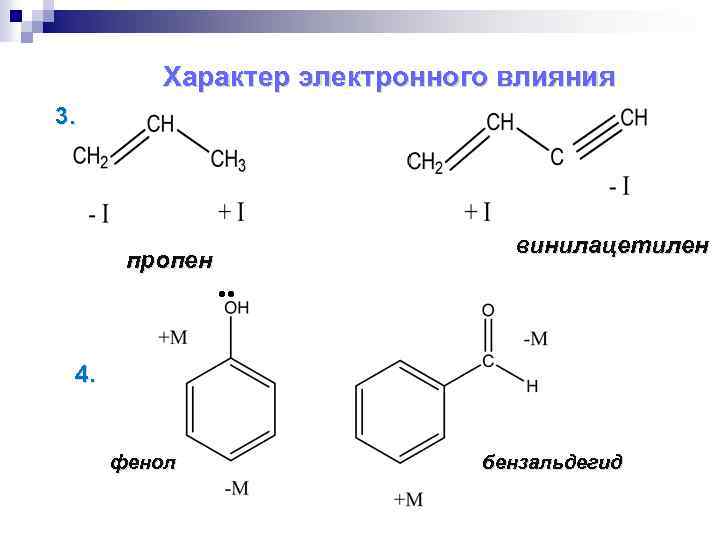 Характер электронного влияния 3. винилацетилен пропен 4. фенол бензальдегид
Характер электронного влияния 3. винилацетилен пропен 4. фенол бензальдегид
 Спасибо за внимание !
Спасибо за внимание !


