ОБЩАЯ 3 хим связь-гибридизация.pptx
- Количество слайдов: 28

Химическая связь. Гибридизация. Лекция 4
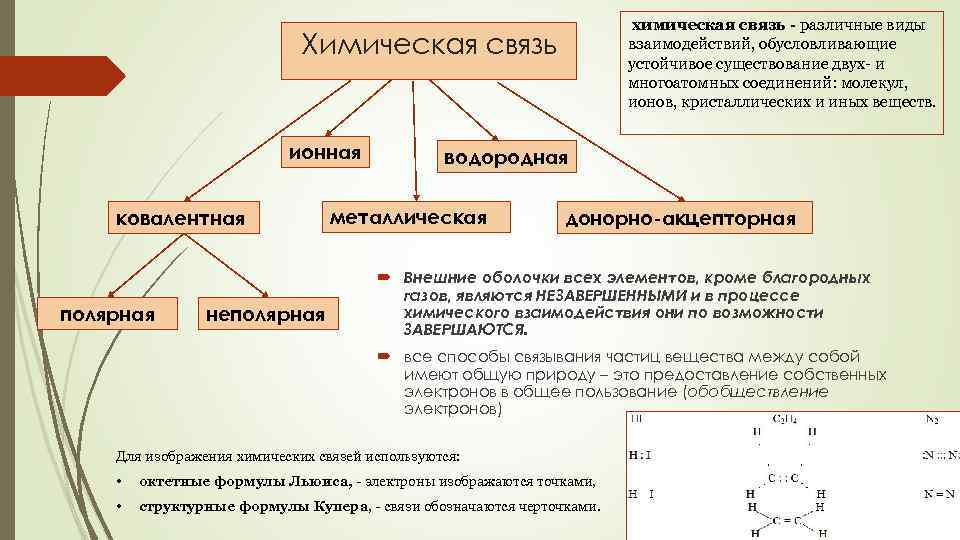
химическая связь - различные виды взаимодействий, обусловливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических и иных веществ. Химическая связь ионная ковалентная полярная неполярная водородная металлическая донорно-акцепторная Внешние оболочки всех элементов, кроме благородных газов, являются НЕЗАВЕРШЕННЫМИ и в процессе химического взаимодействия они по возможности ЗАВЕРШАЮТСЯ. все способы связывания частиц вещества между собой имеют общую природу – это предоставление собственных электронов в общее пользование (обобществление электронов) Для изображения химических связей используются: • октетные формулы Льюиса, - электроны изображаются точками, • структурные формулы Купера, - связи обозначаются черточками.
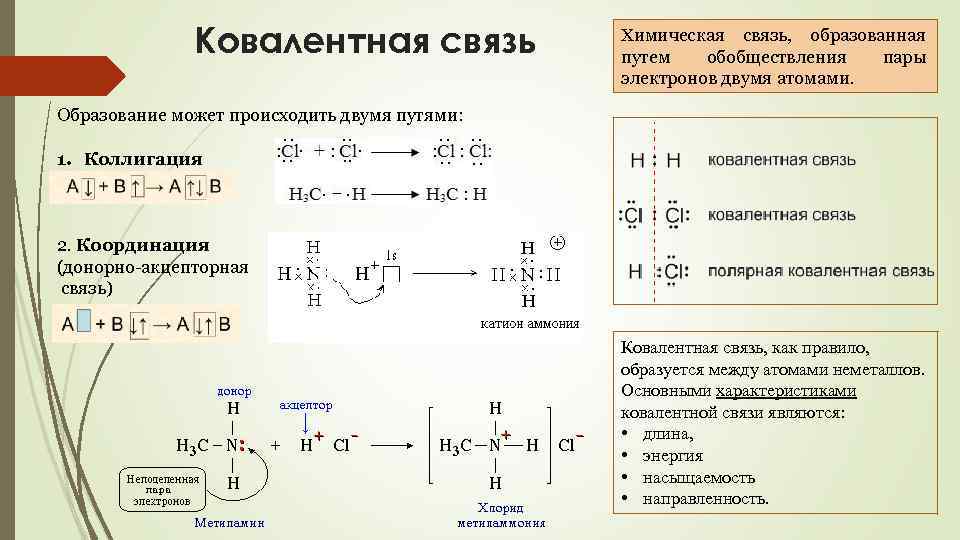
Ковалентная связь Химическая связь, образованная путем обобществления пары электронов двумя атомами. Образование может происходить двумя путями: 1. Коллигация 2. Координация (донорно-акцепторная связь) Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются: • длина, • энергия • насыщаемость • направленность.

Ковалентная неполярная связь атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных элементов.
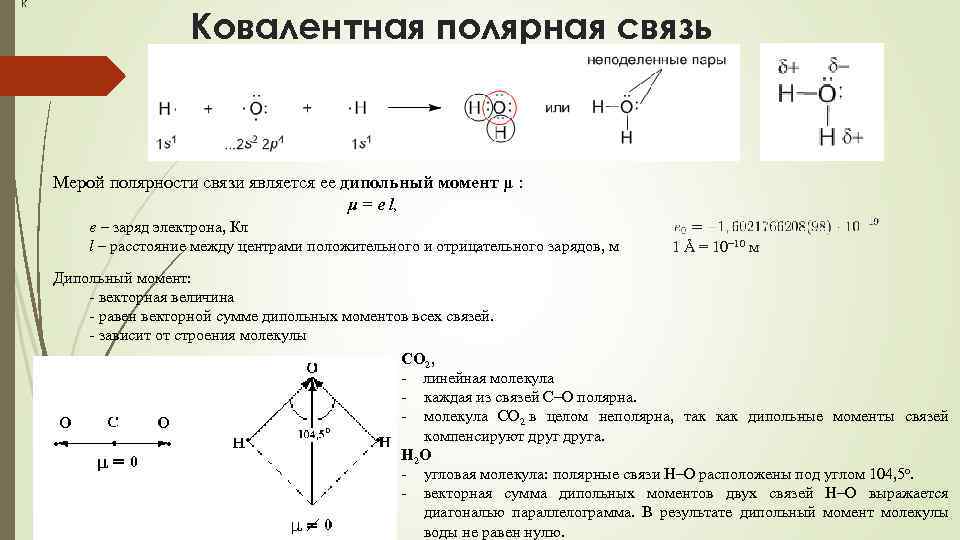
К Ковалентная полярная связь Мерой полярности связи является ее дипольный момент μ : μ = е l, е – заряд электрона, Кл l – расстояние между центрами положительного и отрицательного зарядов, м 1 Å = 10− 10 м Дипольный момент: - векторная величина - равен векторной сумме дипольных моментов всех связей. - зависит от строения молекулы СО 2, - линейная молекула - каждая из связей С–О полярна. - молекула СО 2 в целом неполярна, так как дипольные моменты связей компенсируют друга. Н 2 О - угловая молекула: полярные связи Н–О расположены под углом 104, 5 o. - векторная сумма дипольных моментов двух связей Н–О выражается диагональю параллелограмма. В результате дипольный момент молекулы воды не равен нулю.

Ионная связь Ионная химическая связь представляет собой электростатическое взаимодействие положительных и отрицательных заряженных ионов в химическом соединении. Такая связь возникает лишь в случае большой разности в электроотрицательности атомов, например Li. F, K 2 O, Na. Cl. Проявляется в твердых веществах с ионной кристаллической решеткой. 1. Ионная связь является прочной химической связью. Энергия этой связи составляет величины порядка 300 – 700 к. Дж/моль. 2. В отличие от ковалентной связи, ионная связь является ненаправленной, поскольку ион может притягивать к себе ионы противоположного знака в любом направлении. 3. В отличие от ковалентной связи, ионная связь является ненасыщенной, так как взаимодействие ионов противоположного знака не приводит к полной взаимной компенсации их силовых полей. 4. В процессе образования молекул с ионной связью не происходит полной передачи электронов, поэтому стопроцентной ионной связи в природе не существует. В молекуле Na. Cl химическая связь лишь на 80% ионная. 5. Соединения с ионной связью – это твердые кристаллические вещества, имеющие высокие температуры плавления и кипения. 6. Большинство ионных соединений растворяются в воде. Растворы и расплавы ионных соединений проводят электрический ток.

Полярность связи Критерий полярности – разница электроотрицательностей Δ X Для чисто ковалентной связи Δ X = 0. Если величина Δ X меньше, чем 0, 4 – такую связь тоже условно называют ковалентной. связь F—F в молекуле фтора F 2: ΔX = (3, 98 - 3, 98) = 0 связь O=O в молекуле кислорода O 2: Δ X = (3, 44 - 3, 44) = 0 При разности электроотрицательностей от 0, 4 до 2, 0 связь называют полярной ковалентной: связь H—F в молекуле фтороводорода HF: Δ X = (3, 98 - 2, 20) = 1, 78 связь C—Cl в молекуле CСl 4: Δ X = (3, 16 - 2, 55) = 0, 61 связи с разностью электроотрицательностей больше 2, 0 считаются ионными: связь Na—Cl в соединении Na. Cl: Δ X = (3, 16 - 0, 93) = 2, 23 связь K—O в соединении K 2 O: Δ X = (3, 44 - 0, 82) = 2, 62

Металлическая связь характерна только для металлов: атомы металлов имеют большое число валентных атомных орбиталей и недостаток электронов. При сближении атомов в результате образования кристаллической решетки валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла (электронный газ) Характеристики металлической связи: ненаправленная ненасыщенная Прочная - энергия металлической связи примерно в три – четыре раза меньше энергии ковалентной связи. Вследствие большой подвижности электронного газа металлы характеризуются высокой электро- и теплопроводностью.

Водородная связь • • Водородная связь по природе относится к электростатическим и образуется в том случае, когда атом водорода связан с электроотрицательным элементом, т. е. когда ковалентная связь поляризована. Механизм образования водородной связи имеет частично электростатический, частично донорно – акцепторный характер. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором - атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость. Водородную связь принято обозначать точками: Н ··· F. Водородная связь проявляется тем сильнее, чем больше электроотрицательность атома-партнера и чем меньше его размеры. Она характерна прежде всего для соединений фтора, а также кислорода, в меньшей степени азота, в еще меньшей степени для хлора и серы. Может быть не только межмолекулярная, но и внутримолекулярная водородная связь. Водородные связи очень распространены, они проявляются не только в воде, спиртах, кислотах, но и в кристаллических веществах, полимерах, белках.
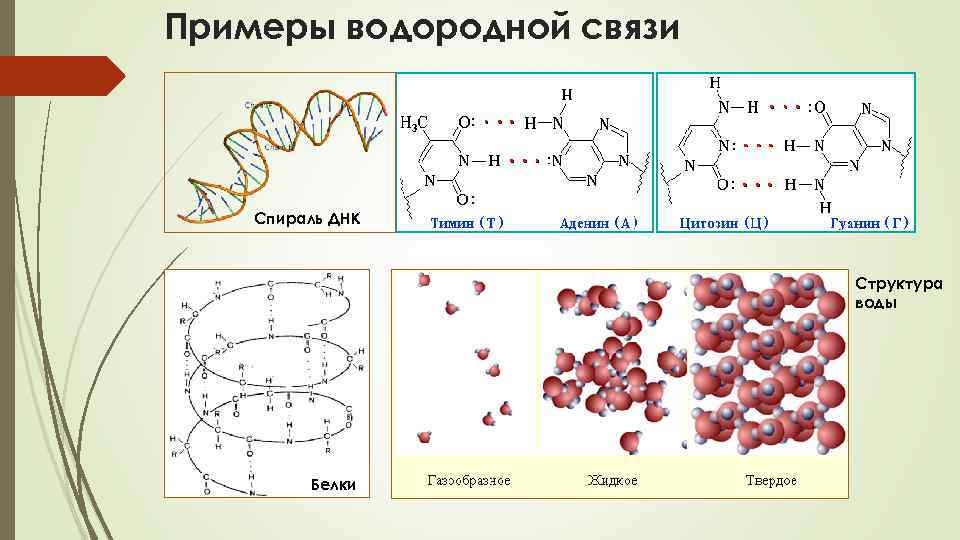
Примеры водородной связи Спираль ДНК Структура воды Белки

Характеристики химической связи Полярность связи - степень смещения электронной плотности, приводящего к возникновению разнополярных полюсов. Молекула с ковалентной связью может быть неполярной, если связанные этой связью атомы имеют одинаковые электроотрицательности: Н 3 С - СН 3 Н - Н Если же один из атомов обладает большей электроотрицательностью, то электронная плотность в этом случае будет смещена в его сторону. Такая молекула будет полярной. Например, Н 3 С → Cl Поляризуемость - способность связи изменять свою полярность под действием внешнего электромагнитного поля. Такое поле может создавать и атакующий реагент, и растворитель. Направленность - образование связи происходит не в любых направлениях пространства, а только в определенных. Углы, которые образуют ковалентные связи между собой, - валентные углы. Длина связи (l; [нм, Ã]) - расстояние между ядрами атомов. Кратность связи - количество электронных пар, связывающих два атома или группу атомов. Чем больше кратность, тем меньше длина связи и больше энергия. Энергия (Е, к. Дж/моль) - это та энергия, которая выделяется при образовании химической связи или поглощается при ее разрыве. Чем выше энергия связи, тем прочнее связь.

Квантово-механические представления о природе ковалентной связи ковалентная связь возникает при квантово-механическом взаимодействии всех электронов всех взаимодействующих атомов. при образовании химической связи роль электронов, находящихся на внутренних и внешних электронных оболочках, существенно различна. Поэтому удалось создать различные приближенные методы описания химической связи. Для качественного понимания структуры химических соединений используются два метода – метод валентных связей (МВС) и метод молекулярных орбиталей (МО).

Метод валентных связей (МВС) Основные положения: Атомы в молекуле сохраняют свою индивидуальность. Электронная пара заселяет орбиталь то одного, то другого атома (В. Гейтлер и Ф. Лондон, 1927 г. ) Ковалентную химическую связь образуют два электрона с противоположными спинами, принадлежащие двум атомам. При образовании ковалентной химической связи происходит перекрывание волновых функций электронов (электронных орбиталей), при этом связь будет тем прочнее, чем больше это перекрывание. Ковалентная химическая связь располагается в том направлении, в котором возможность перекрывания волновых функций электронов, образующих связь будет наибольшей. Валентность атома определяется: в нормальном (невозбужденном) состоянии • числом неспаренных электронов, участвующих в образовании общих электронных пар с электронами других атомов; • наличием донорной способности (за счёт одной неподелённой электронной пары). В возбужденном состоянии: • числом неспаренных электронов; • числом вакантных орбиталей, способных акцептировать электронные пары доноров. Валентность выражается небольшими целыми числами и не имеет знака. Мерой валентности является число химических связей, которыми данный атом соединён с другими.
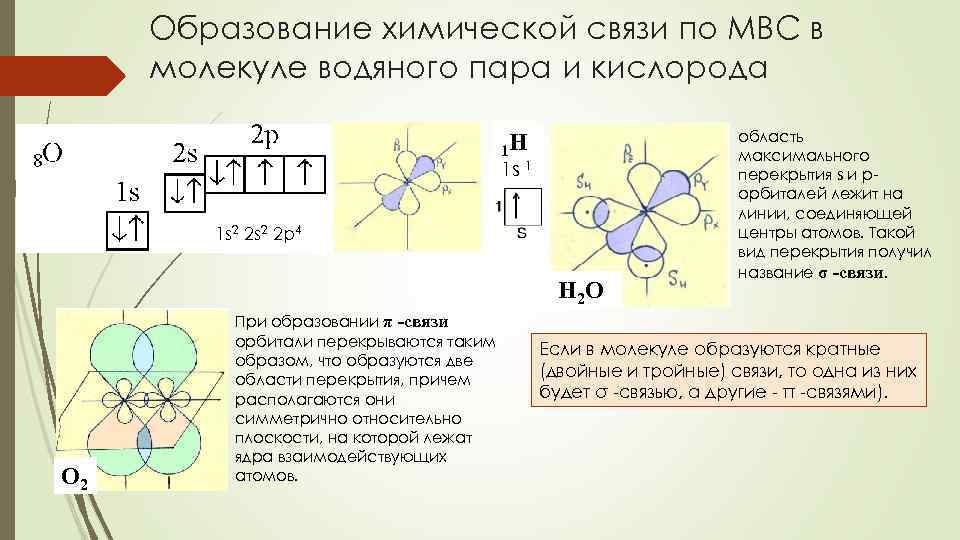
Образование химической связи по МВС в молекуле водяного пара и кислорода 1 Н 1 s 1 1 s 2 2 p 4 Н 2 О О 2 При образовании π -связи орбитали перекрываются таким образом, что образуются две области перекрытия, причем располагаются они симметрично относительно плоскости, на которой лежат ядра взаимодействующих атомов. область максимального перекрытия s и pорбиталей лежит на линии, соединяющей центры атомов. Такой вид перекрытия получил название σ -связи. Если в молекуле образуются кратные (двойные и тройные) связи, то одна из них будет σ -связью, а другие - π -связями).
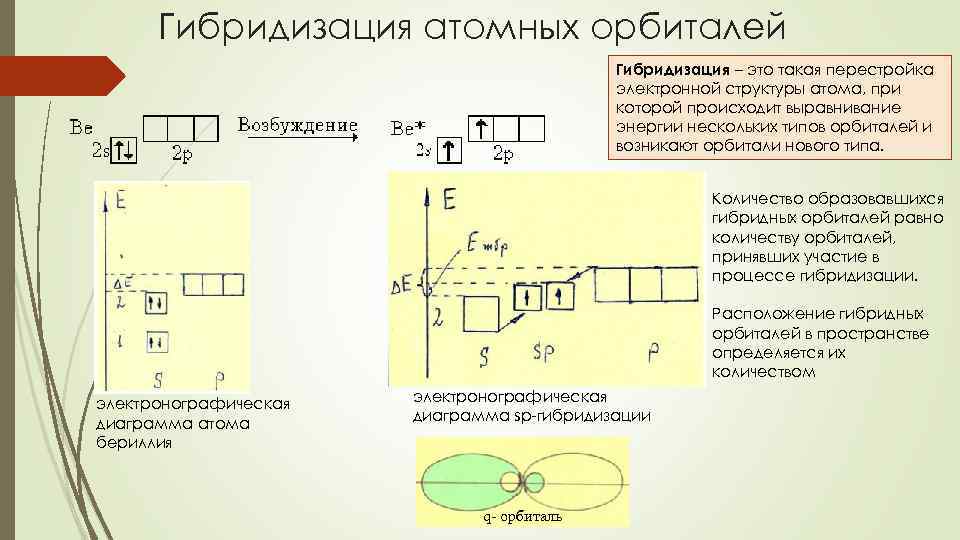
Гибридизация атомных орбиталей Гибридизация – это такая перестройка электронной структуры атома, при которой происходит выравнивание энергии нескольких типов орбиталей и возникают орбитали нового типа. Количество образовавшихся гибридных орбиталей равно количеству орбиталей, принявших участие в процессе гибридизации. Расположение гибридных орбиталей в пространстве определяется их количеством электронографическая диаграмма атома бериллия электронографическая диаграмма sp-гибридизации q- орбиталь
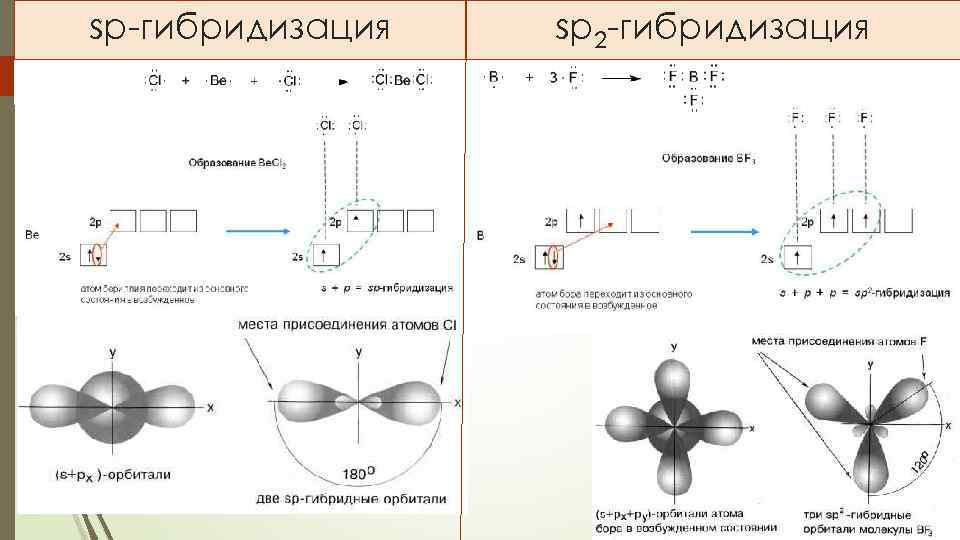
sp-гибридизация sp 2 -гибридизация
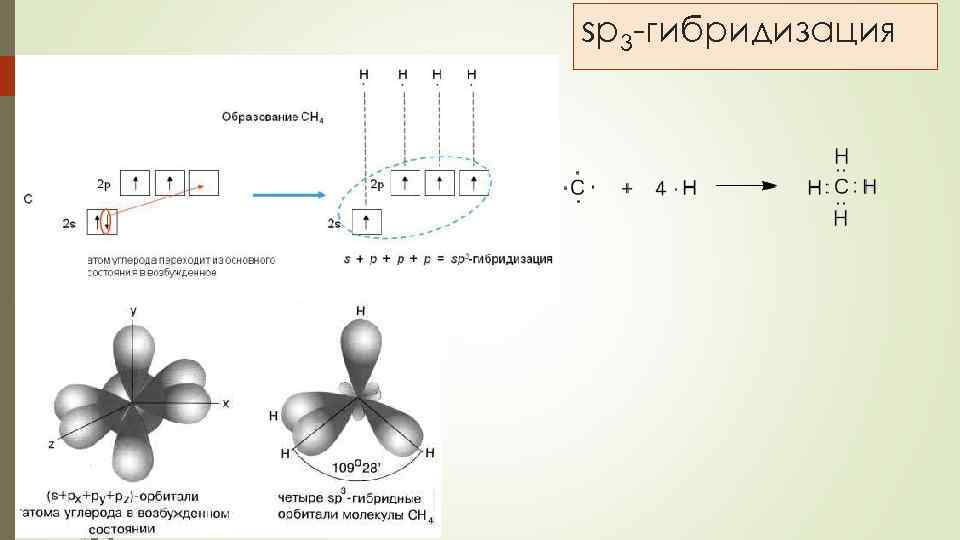
sp 3 -гибридизация
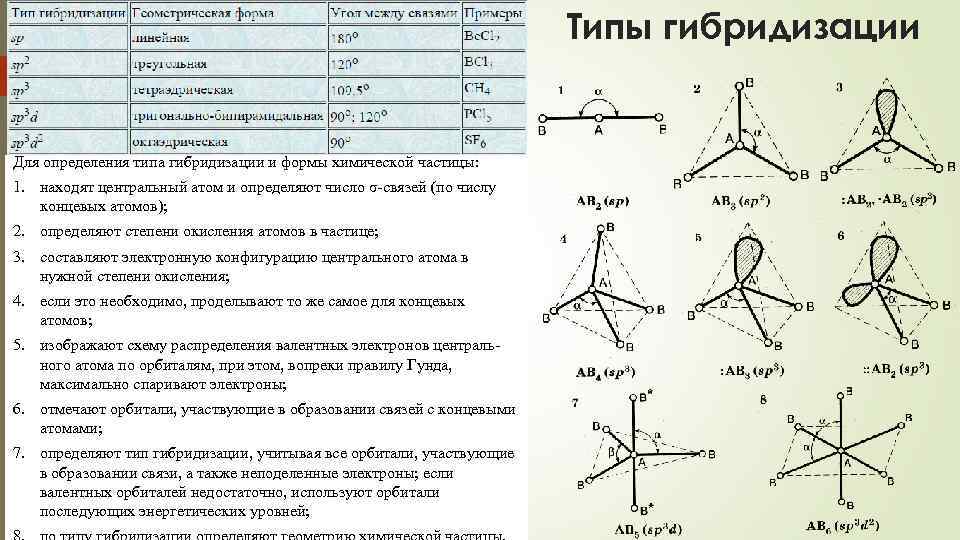
Типы гибридизации Для определения типа гибридизации и формы химической частицы: 1. находят центральный атом и определяют число σ-связей (по числу концевых атомов); 2. определяют степени окисления атомов в частице; 3. составляют электронную конфигурацию центрального атома в нужной степени окисления; 4. если это необходимо, проделывают то же самое для концевых атомов; 5. изображают схему распределения валентных электронов центрального атома по орбиталям, при этом, вопреки правилу Гунда, максимально спаривают электроны; 6. отмечают орбитали, участвующие в образовании связей с концевыми атомами; 7. определяют тип гибридизации, учитывая все орбитали, участвующие в образовании связи, а также неподеленные электроны; если валентных орбиталей недостаточно, используют орбитали последующих энергетических уровней;
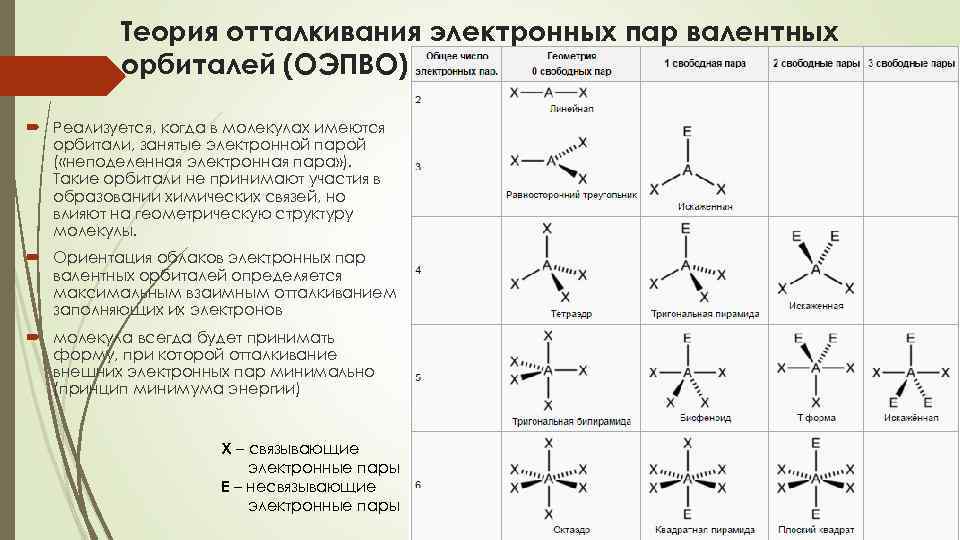
Теория отталкивания электронных пар валентных орбиталей (ОЭПВО) Реализуется, когда в молекулах имеются орбитали, занятые электронной парой ( «неподеленная электронная пара» ). Такие орбитали не принимают участия в образовании химических связей, но влияют на геометрическую структуру молекулы. Ориентация облаков электронных пар валентных орбиталей определяется максимальным взаимным отталкиванием заполняющих их электронов молекула всегда будет принимать форму, при которой отталкивание внешних электронных пар минимально (принцип минимума энергии) Х – связывающие электронные пары Е – несвязывающие электронные пары

Кратные связи делокализованная π-связь метод наложения валентных схем на примере азидоводорода HN 3 в молекуле остаются два неспаренных электрона, что делает схемы маловероятными один из s-электронов центрального атома переносим на “верхний” атом азота: Наложим полученные схемы друг на друга результирующая структура: Центральный атом азота достиг своей максимальной валентности, равной четырем, но у него одна из π-связей делокализована.

Метод молекулярных орбиталей (ММО) АО взаимодействующих друг с другом атомов утрачивают свою индивидуальность и образуют обобщенные МО, т. е. электроны в молекулах «принадлежат» не какому-то конкретному атому, а квантово- механически движутся по всей молекулярной структуре. Существует несколько разновидностей метода МО, учитывающих большее или меньшее число факторов. Наиболее простым является приближение, которое учитывает только линейные эффекты взаимодействия электронов. Это приближение называется методом МО ЛКАО (линейной комбинации атомных орбиталей). это утверждение для простейшего случая взаимодействия двух орбиталей записывается так: где ψМО ψАО 1 ψАО 2 aиb - волновая функция МО, - волновая функция АО первого атома, - волновая функция АО второго атома, – численные коэфф. , характеризующие вклад данной АО в общую структуру МО. Из уравнения видно, что при взаимодействии двух АО получаются две МО. Одна из них называется связывающей , а другая – разрыхляющей

Метод молекулярных орбиталей (ММО) Если атомные орбитали (АО) обозначаются s, p, d, f, то МО - σ, π, δ, φ. Если образование МО требует затраты энергии, то образующуюся МО называют разрыхляющей, если образование МО сопровождается выделением энергии - связывающей. Схема образования связывающей МО Схема образования разрыхляющей МО
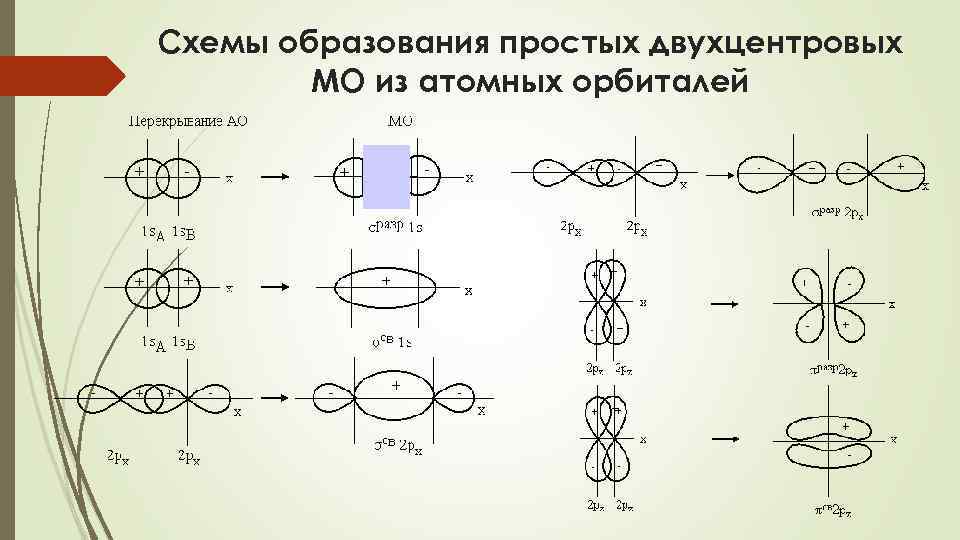
Схемы образования простых двухцентровых МО из атомных орбиталей
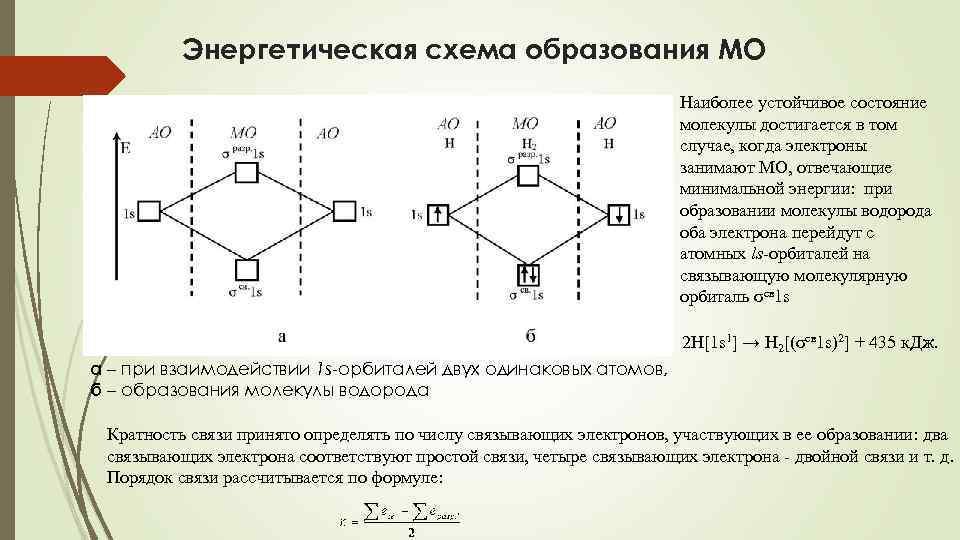
Энергетическая схема образования МО Наиболее устойчивое состояние молекулы достигается в том случае, когда электроны занимают МО, отвечающие минимальной энергии: при образовании молекулы водорода оба электрона перейдут с атомных ls-орбиталей на связывающую молекулярную орбиталь σсв 1 s 2 H[1 s 1] → H 2[(σсв 1 s)2] + 435 к. Дж. а – при взаимодействии 1 s-орбиталей двух одинаковых атомов, б – образования молекулы водорода Кратность связи принято определять по числу связывающих электронов, участвующих в ее образовании: два связывающих электрона соответствуют простой связи, четыре связывающих электрона - двойной связи и т. д. Порядок связи рассчитывается по формуле:
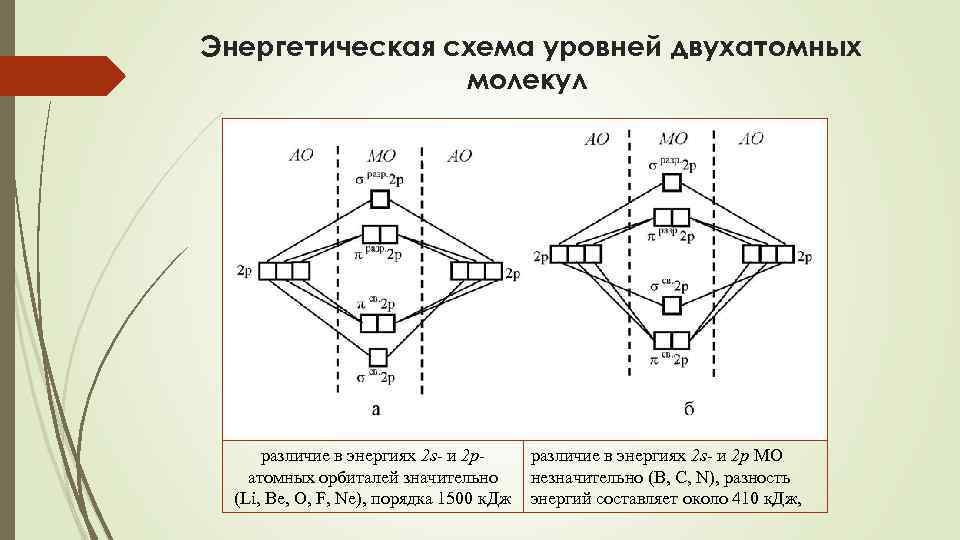
Энергетическая схема уровней двухатомных молекул различие в энергиях 2 s- и 2 pатомных орбиталей значительно (Li, Be, O, F, Ne), порядка 1500 к. Дж различие в энергиях 2 s- и 2 p МО незначительно (B, C, N), разность энергий составляет около 410 к. Дж,
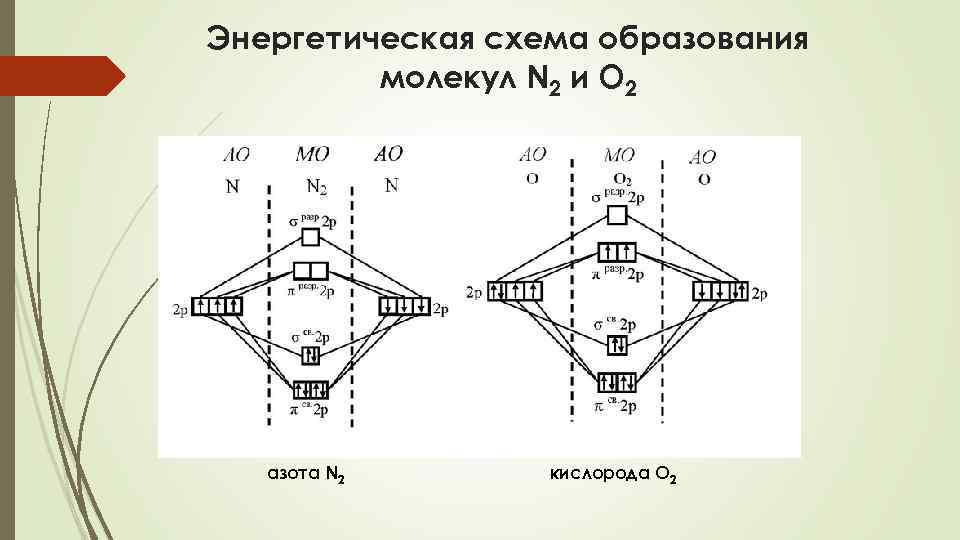
Энергетическая схема образования молекул N 2 и О 2 азота N 2 кислорода O 2
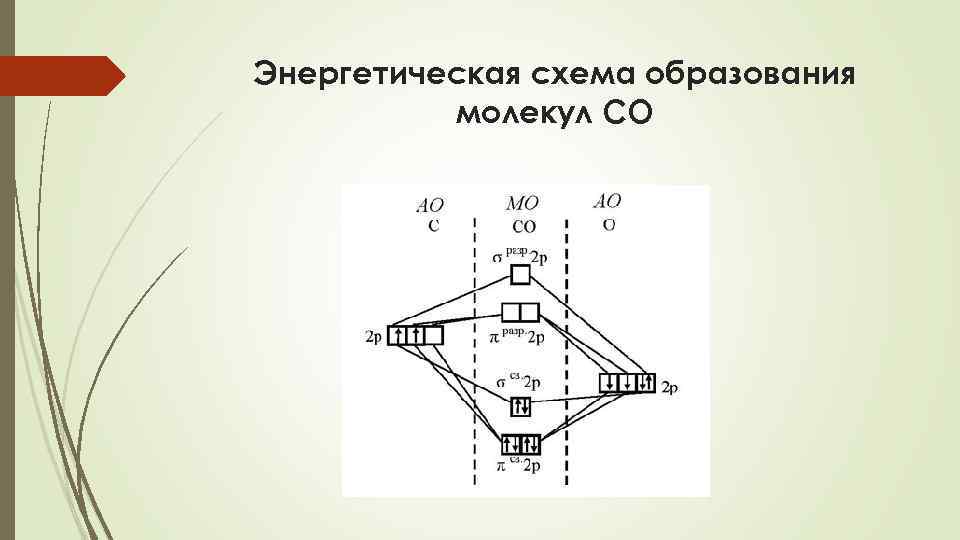
Энергетическая схема образования молекул СO
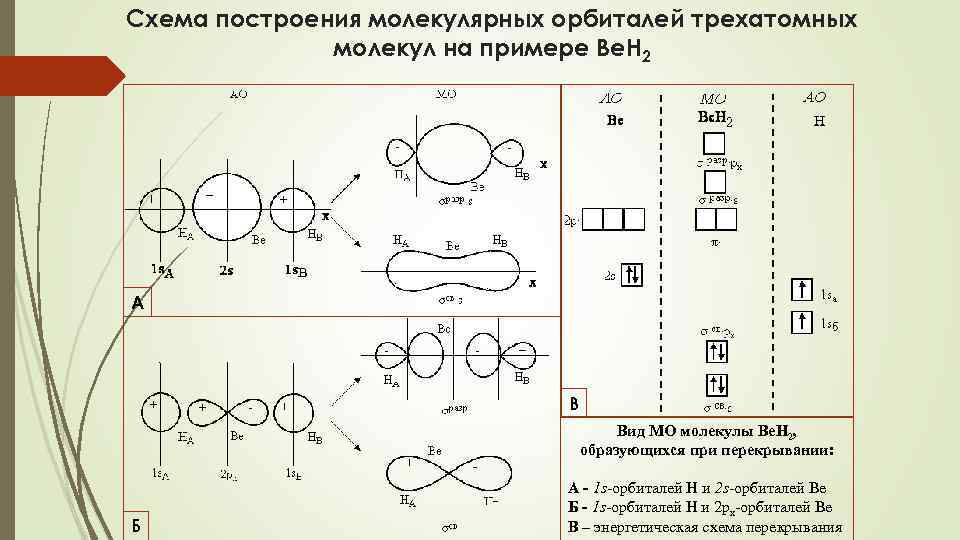
Схема построения молекулярных орбиталей трехатомных молекул на примере Be. H 2 А В Б Вид МО молекулы Ве. Н 2, образующихся при перекрывании: А - 1 s-орбиталей Н и 2 s-орбиталей Ве Б - 1 s-орбиталей Н и 2 px-орбиталей Ве В – энергетическая схема перекрывания
ОБЩАЯ 3 хим связь-гибридизация.pptx