ХС и строение вещества.ppt
- Количество слайдов: 39
 Химическая связь 1
Химическая связь 1
 Химическая связь – взаимодействие, которое связывает отдельные атомы в молекулы, кристаллы, комплексы и сопровождается снижением полной энергии системы. Типы химической связи: 1. Ковалентная 2. Ионная 3. Металлическая 2
Химическая связь – взаимодействие, которое связывает отдельные атомы в молекулы, кристаллы, комплексы и сопровождается снижением полной энергии системы. Типы химической связи: 1. Ковалентная 2. Ионная 3. Металлическая 2
 Ковалентная связь Тип связи, возникающей за счет обобществления электронов. Бывает полярной (HCl, H 2 O) и неполярной (N 2, H 2). Механизмы образования: 1. Обменный (Н 2; НСl) 2. Донорно-акцепторный: NH 3+ H+= [NH 4]+ Обменный: Образование неполярной связи (Н 2) Изолированные атомы, имеющие противоположно направленные спины, притягиваются друг к другу, их атомные орбитали (АО) перекрываются с образованием молекулярной (МО): 3
Ковалентная связь Тип связи, возникающей за счет обобществления электронов. Бывает полярной (HCl, H 2 O) и неполярной (N 2, H 2). Механизмы образования: 1. Обменный (Н 2; НСl) 2. Донорно-акцепторный: NH 3+ H+= [NH 4]+ Обменный: Образование неполярной связи (Н 2) Изолированные атомы, имеющие противоположно направленные спины, притягиваются друг к другу, их атомные орбитали (АО) перекрываются с образованием молекулярной (МО): 3
 Схематически: Н· + ·Н →Н: Н или Н-Н. Если электроны имеют одинаковое направление – связь не образуется. Для объяснения ковалентной связи используется два метода: 1. Метод валентных связей (МВС) 2. Метод молекулярных орбиталей (ММО). 4
Схематически: Н· + ·Н →Н: Н или Н-Н. Если электроны имеют одинаковое направление – связь не образуется. Для объяснения ковалентной связи используется два метода: 1. Метод валентных связей (МВС) 2. Метод молекулярных орбиталей (ММО). 4
 Основа МВС 1. Ковалентная связь образуется между двумя атомами за счет двух электронов с антипараллельными спинами 2. Связь располагается в том направлении, в котором возможность перекрывания ЭО наибольшая 3. Ковалентная связь является тем более прочной, чем более прочно перекрываются ЭО. 5
Основа МВС 1. Ковалентная связь образуется между двумя атомами за счет двух электронов с антипараллельными спинами 2. Связь располагается в том направлении, в котором возможность перекрывания ЭО наибольшая 3. Ковалентная связь является тем более прочной, чем более прочно перекрываются ЭО. 5
 Количественная мера валентности -число ковалентных связей, образованных атомов. Свойства ковалентной связи: 1. Направленность 2 Насыщаемость 3. Длина связи l 4. Энергия связи E При образовании неполярной связи область перекрывания АО расположена симметрично относительно ядер атомов, а в случае полярной - она смещена к более электроотрицательному элементу. 6
Количественная мера валентности -число ковалентных связей, образованных атомов. Свойства ковалентной связи: 1. Направленность 2 Насыщаемость 3. Длина связи l 4. Энергия связи E При образовании неполярной связи область перекрывания АО расположена симметрично относительно ядер атомов, а в случае полярной - она смещена к более электроотрицательному элементу. 6
 Это ведет к образованию диполя. Мера полярности связи – электрический момент диполя (ЭМД): = q·l. выражается в дебаях 1 D=3, 33 · 10 -33 Кл·м. В МВС в образовании связи участвуют не все гибридные орбитали. Те, которые не участвуют в образовании связи, -несвязывающие (НП), а электронные пары на них – неподеленными. И наоборот для связывающих орбиталей. По степени отталкивания: НП-НП >НП-СП >СП-СП Это объясняет геометрическую структуру молекул. 7
Это ведет к образованию диполя. Мера полярности связи – электрический момент диполя (ЭМД): = q·l. выражается в дебаях 1 D=3, 33 · 10 -33 Кл·м. В МВС в образовании связи участвуют не все гибридные орбитали. Те, которые не участвуют в образовании связи, -несвязывающие (НП), а электронные пары на них – неподеленными. И наоборот для связывающих орбиталей. По степени отталкивания: НП-НП >НП-СП >СП-СП Это объясняет геометрическую структуру молекул. 7
 Метод молекулярных орбиталей (ММО) МВС не всегда объясняет спектральные и магнитные характеристики. Они объясняются ММО. С позиций ММО каждый электрон принадлежит всей молекуле и движется в поле всех ее ядер и электронов, т. е. находится в орбитали, охватывающей всю молекулу. Такая орбиталь называется молекулярной (МО). 8
Метод молекулярных орбиталей (ММО) МВС не всегда объясняет спектральные и магнитные характеристики. Они объясняются ММО. С позиций ММО каждый электрон принадлежит всей молекуле и движется в поле всех ее ядер и электронов, т. е. находится в орбитали, охватывающей всю молекулу. Такая орбиталь называется молекулярной (МО). 8
 Совокупность всех МО молекулы рассматривается как ее электронная конфигурация. Описать молекулу в соответствии с ММО означает определить тип ее орбиталей, их энергию и выяснить характер размещения электронов по орбиталям в порядке возрастания их энергии. Используются упрощенные подходы, наиболее известен из которых метод линейной комбинации атомных орбиталей (МО ЛКАО). 9
Совокупность всех МО молекулы рассматривается как ее электронная конфигурация. Описать молекулу в соответствии с ММО означает определить тип ее орбиталей, их энергию и выяснить характер размещения электронов по орбиталям в порядке возрастания их энергии. Используются упрощенные подходы, наиболее известен из которых метод линейной комбинации атомных орбиталей (МО ЛКАО). 9
 МО представляются в виде линейных комбинаций атомных орбиталей исходных атомов, т. е. как результат сложения и вычитания волновых функций , характеризующих атомные орбитали. Для молекулы АВ волновые функции МО – линейная комбинация атомных орбиталей А и В: АВ+=С 1 А +С 2 В и АВ- =С 3 А -С 4 В С 1, С 2, С 3, С 4 учитывают долю участия АО в образовании МО. 10
МО представляются в виде линейных комбинаций атомных орбиталей исходных атомов, т. е. как результат сложения и вычитания волновых функций , характеризующих атомные орбитали. Для молекулы АВ волновые функции МО – линейная комбинация атомных орбиталей А и В: АВ+=С 1 А +С 2 В и АВ- =С 3 А -С 4 В С 1, С 2, С 3, С 4 учитывают долю участия АО в образовании МО. 10
 При комбинации двух АО возникают две МО. Одна МО (сложение АО) характеризуется повышенной электронной плотностью в межъядерном пространстве, связывает атомы между собой (связывающая МО). Энергия такой орбитали меньше энергии исходных АО. Другая МО (вычитание АО) имеет пространственный разрыв электронной плотности между ядрами (ядра атомов отталкиваются друг от друга). Такая МО называется разрыхляющей. Она менее энергетически выгодна, чем исходные АО. 11
При комбинации двух АО возникают две МО. Одна МО (сложение АО) характеризуется повышенной электронной плотностью в межъядерном пространстве, связывает атомы между собой (связывающая МО). Энергия такой орбитали меньше энергии исходных АО. Другая МО (вычитание АО) имеет пространственный разрыв электронной плотности между ядрами (ядра атомов отталкиваются друг от друга). Такая МО называется разрыхляющей. Она менее энергетически выгодна, чем исходные АО. 11
 Условия образования МО 1) Число образующихся МО равно числу исходных АО; 2) АО должны быть достаточно протяженными в пространстве, чтобы перекрываться в заметной степени( АО внутренних слоев в системе МО не учитываются); 3) АО, образующие МО, должны иметь близкие значения энергии; 4) взаимодействующие АО должны иметь одинаковую симметрию относительно линии связи в молекуле. 12
Условия образования МО 1) Число образующихся МО равно числу исходных АО; 2) АО должны быть достаточно протяженными в пространстве, чтобы перекрываться в заметной степени( АО внутренних слоев в системе МО не учитываются); 3) АО, образующие МО, должны иметь близкие значения энергии; 4) взаимодействующие АО должны иметь одинаковую симметрию относительно линии связи в молекуле. 12
 МО в зависимости от симметрии относительно линии связи подразделяются на -, - или орбитали (по аналогии с атомными s-, p -, d-, f-орбиталями). Образование МО из исходных АО обычно иллюстрируется с помощью энергетической диаграммы, на которой схематически изображаются атомные и молекулярные орбитали, расположенные в порядке возрастания их энергий. 13
МО в зависимости от симметрии относительно линии связи подразделяются на -, - или орбитали (по аналогии с атомными s-, p -, d-, f-орбиталями). Образование МО из исходных АО обычно иллюстрируется с помощью энергетической диаграммы, на которой схематически изображаются атомные и молекулярные орбитали, расположенные в порядке возрастания их энергий. 13
 Энергетическая диаграмма Н 2 Разрыхляющая MO 1 s AO *1 s 1 s 1 s AO Связывающая МО Е 14
Энергетическая диаграмма Н 2 Разрыхляющая MO 1 s AO *1 s 1 s 1 s AO Связывающая МО Е 14
 Принципы распределения электронов 1) электроны заполняют молекулярные орбитали в порядке возрастания их энергий, начиная с наиболее низких; 2) на каждой МО может находиться не более двух электронов (принцип Паули); 3) при наличии однотипных орбиталей их заполнение происходит в соответствии с правилом Хунда. 15
Принципы распределения электронов 1) электроны заполняют молекулярные орбитали в порядке возрастания их энергий, начиная с наиболее низких; 2) на каждой МО может находиться не более двух электронов (принцип Паули); 3) при наличии однотипных орбиталей их заполнение происходит в соответствии с правилом Хунда. 15
 Для возникновения молекулы надо, чтобы число электронов на связывающих МО (nе_ на МОсвяз) было больше, чем на разрыхляющих молекулярных орбиталях (nе_ на МОразр). Число связей между атомами (валентность в МВС) – порядок связи: Порядок связи= =0, 5(nе_ на МОсвяз- nе_ на МОразр) Для водорода: (2 -0)/2=1 Для молекулы гелия: (2 -2)/2=0 (молекула не образуется!) Для кислорода: (8 -4)/2=2 16
Для возникновения молекулы надо, чтобы число электронов на связывающих МО (nе_ на МОсвяз) было больше, чем на разрыхляющих молекулярных орбиталях (nе_ на МОразр). Число связей между атомами (валентность в МВС) – порядок связи: Порядок связи= =0, 5(nе_ на МОсвяз- nе_ на МОразр) Для водорода: (2 -0)/2=1 Для молекулы гелия: (2 -2)/2=0 (молекула не образуется!) Для кислорода: (8 -4)/2=2 16
 Ионная связь - это тип связи, энергия которой в основном определяется электростатическими силами притяжения ионов. Это предельный случай ковалентной полярной связи, образованной атомами с сильно различающимися э/о. Возникает между атомами элементов групп IA, 2 А и группы VIIА. В этих соединениях не происходит полного перехода электрона от одного атома к другому и электронная плотность между ионами не равна нулю. Говорят о степени ионности связи. Условно принято считать, что при >1, 9 степень ионности >50 %, и атомы рассматриваются как ионы с целочисленными зарядами. 17
Ионная связь - это тип связи, энергия которой в основном определяется электростатическими силами притяжения ионов. Это предельный случай ковалентной полярной связи, образованной атомами с сильно различающимися э/о. Возникает между атомами элементов групп IA, 2 А и группы VIIА. В этих соединениях не происходит полного перехода электрона от одного атома к другому и электронная плотность между ионами не равна нулю. Говорят о степени ионности связи. Условно принято считать, что при >1, 9 степень ионности >50 %, и атомы рассматриваются как ионы с целочисленными зарядами. 17
 Ионы представляются в виде электрических зарядов со сферической симметрией силового поля. Ионная связь - ненаправленная и ненасыщаемая. Вокруг каждого иона расположено (координировано) ограниченное число противоионов. Координационное число (КЧ) иона определяется соотношением размеров ионов разного знака. При соотношении 0, 41 0, 73 имеет место октаэдрическая координация ионов с КЧ, равным 6, а при соотношении в пределах 0, 73 1, 37 - кубическая с координационным числом, равным 8. 18
Ионы представляются в виде электрических зарядов со сферической симметрией силового поля. Ионная связь - ненаправленная и ненасыщаемая. Вокруг каждого иона расположено (координировано) ограниченное число противоионов. Координационное число (КЧ) иона определяется соотношением размеров ионов разного знака. При соотношении 0, 41 0, 73 имеет место октаэдрическая координация ионов с КЧ, равным 6, а при соотношении в пределах 0, 73 1, 37 - кубическая с координационным числом, равным 8. 18
 Октаэдрическая, Na. Cl Кубическая, Cs. Cl 19
Октаэдрическая, Na. Cl Кубическая, Cs. Cl 19
 Металлическая связь Металлы (кроме Hg) существуют в виде кристаллов. Характерная особенность этих кристаллов - высокие значения КЧ. Взаимодействие, удерживающее атомы металлов в кристалле, называется металлической связью. Металл - молекула, построенная из катионов, связанных между собой свободными валентными электронами (электронным газом). Небольшое количество электронов обеспечивает связывание всех атомов в кристалле металла. Связь является не локализованной и ненаправленной. Именно этим объясняется пластичность металлов способность необратимо менять свою форму под действием механических сил. 20
Металлическая связь Металлы (кроме Hg) существуют в виде кристаллов. Характерная особенность этих кристаллов - высокие значения КЧ. Взаимодействие, удерживающее атомы металлов в кристалле, называется металлической связью. Металл - молекула, построенная из катионов, связанных между собой свободными валентными электронами (электронным газом). Небольшое количество электронов обеспечивает связывание всех атомов в кристалле металла. Связь является не локализованной и ненаправленной. Именно этим объясняется пластичность металлов способность необратимо менять свою форму под действием механических сил. 20
 Кристаллическое состояние Для КС характерно строго определенное расположение частиц во всем объеме кристалла, т. е в расположении частиц существует дальний порядок. Анизотропия - различие физических свойств кристалла в разных направлениях. Кристаллическая решетка - характерное для кристалла расположение атомов, ионов или молекул, обладающее периодической повторяемостью в трех измерениях. 21
Кристаллическое состояние Для КС характерно строго определенное расположение частиц во всем объеме кристалла, т. е в расположении частиц существует дальний порядок. Анизотропия - различие физических свойств кристалла в разных направлениях. Кристаллическая решетка - характерное для кристалла расположение атомов, ионов или молекул, обладающее периодической повторяемостью в трех измерениях. 21
 1. В узлах атомной кристаллической решетки находятся атомы одинаковых или различных элементов, соединенные между собой ковалентными связями, например, С(алмаз). 2. Ионные КР построены из + и - заряженных ионов, между которыми действуют электростатические (кулоновские) силы притяжения, например, Na. Cl. 22
1. В узлах атомной кристаллической решетки находятся атомы одинаковых или различных элементов, соединенные между собой ковалентными связями, например, С(алмаз). 2. Ионные КР построены из + и - заряженных ионов, между которыми действуют электростатические (кулоновские) силы притяжения, например, Na. Cl. 22
 3. Металлическая КР состоит из Меn+, между которыми свободно перемещаются валентные электроны. Отрицательный заряд электронов компенсирует + заряды Меn+ и удерживает их в узлах КР 4. В узлах молекулярной КР - молекулы, связанные слабыми межмолекулярными связями. Между неполярными молекулами действуют дисперсионные силы; между полярными – дисперсионные, ориентационные и индукционные силы. 23
3. Металлическая КР состоит из Меn+, между которыми свободно перемещаются валентные электроны. Отрицательный заряд электронов компенсирует + заряды Меn+ и удерживает их в узлах КР 4. В узлах молекулярной КР - молекулы, связанные слабыми межмолекулярными связями. Между неполярными молекулами действуют дисперсионные силы; между полярными – дисперсионные, ориентационные и индукционные силы. 23
 Энергия кристаллической решетки равна энергии, которую необходимо затратить на удаление составных частей КР на бесконечно большое расстояние друг от друга ( к. Дж/моль). Полиморфизм (многоформенность) – способность одного и того же вещества образовывать различные кристаллические формы в зависимости от условий. Полиморфные модификации: алмаз, графит, карбин. Существование различных веществ в одной кристаллической форме называется изоморфизмом, а такие вещества изоморфными. 24
Энергия кристаллической решетки равна энергии, которую необходимо затратить на удаление составных частей КР на бесконечно большое расстояние друг от друга ( к. Дж/моль). Полиморфизм (многоформенность) – способность одного и того же вещества образовывать различные кристаллические формы в зависимости от условий. Полиморфные модификации: алмаз, графит, карбин. Существование различных веществ в одной кристаллической форме называется изоморфизмом, а такие вещества изоморфными. 24
 Зонная теория проводимости кристаллов Кристалл - единая система взаимодействующих частиц. Зонная теория - это теория МО для системы с большим (N=1023) числом частиц. В кристалле количество молекулярных орбиталей должно равняться сумме орбиталей атомов, образующих кристалл. Взаимодействие большого числа атомов приводит к появлению сплошного спектра энергий молекулярных орбиталей, т. е. к образованию энергетической зоны. 25
Зонная теория проводимости кристаллов Кристалл - единая система взаимодействующих частиц. Зонная теория - это теория МО для системы с большим (N=1023) числом частиц. В кристалле количество молекулярных орбиталей должно равняться сумме орбиталей атомов, образующих кристалл. Взаимодействие большого числа атомов приводит к появлению сплошного спектра энергий молекулярных орбиталей, т. е. к образованию энергетической зоны. 25
 Электроны находятся на строго определенных энергетических уровнях и в кристалле также существуют зоны разрешенных и запрещенных энергий. Энергетические уровни, на которых находятся валентные электроны, образуют валентную зону. Совокупность свободных, не занятых электронами уровней (валентных орбиталей), расположенных энергетически выше валентной зоны, в некоторых случаях в пределах ее, называется зоной проводимости. 26
Электроны находятся на строго определенных энергетических уровнях и в кристалле также существуют зоны разрешенных и запрещенных энергий. Энергетические уровни, на которых находятся валентные электроны, образуют валентную зону. Совокупность свободных, не занятых электронами уровней (валентных орбиталей), расположенных энергетически выше валентной зоны, в некоторых случаях в пределах ее, называется зоной проводимости. 26
 В зависимости от природы атомов и типа КР валентная зона и зона проводимости могут перекрываться или не перекрываться. В последнем случае между валентной зоной и зоной проводимости возникает энергетический разрыв, называемый запрещенной зоной. В зависимости от ширины запрещенной зоны Е все кристаллические вещества подразделяются на проводники (металлы), полупроводники и диэлектрики (изоляторы). В металлах валентная зона и зона проводимости перекрываются между собой, т. е. Е =0. 27
В зависимости от природы атомов и типа КР валентная зона и зона проводимости могут перекрываться или не перекрываться. В последнем случае между валентной зоной и зоной проводимости возникает энергетический разрыв, называемый запрещенной зоной. В зависимости от ширины запрещенной зоны Е все кристаллические вещества подразделяются на проводники (металлы), полупроводники и диэлектрики (изоляторы). В металлах валентная зона и зона проводимости перекрываются между собой, т. е. Е =0. 27
 Na Si E E 3 p 3 s r 0 r 4 s 3 p 3 s 3 2 1 1 -валентная зона 2 -запрещенная зона 3 -зона проводимости r 0 r 28
Na Si E E 3 p 3 s r 0 r 4 s 3 p 3 s 3 2 1 1 -валентная зона 2 -запрещенная зона 3 -зона проводимости r 0 r 28
 Вещества, у которых ширина запрещенной зоны составляет 0, 1 -4, 0 э. В, относятся к полупроводникам. У проводников с увеличением температуры электрическая проводимость растет, у полупроводников уменьшается. Вещества, у которых ширина запрещенной зоны превышает 4 э. В, относятся к изоляторам (алмаз). Для ионных кристаллов ширина запрещенной зоны составляет около 6 э. В. У молекулярных кристаллов энергетические уровни локализованы в пределах молекул и энергетические зоны не возникают. Поэтому указанные вещества относятся к изоляторам. 29
Вещества, у которых ширина запрещенной зоны составляет 0, 1 -4, 0 э. В, относятся к полупроводникам. У проводников с увеличением температуры электрическая проводимость растет, у полупроводников уменьшается. Вещества, у которых ширина запрещенной зоны превышает 4 э. В, относятся к изоляторам (алмаз). Для ионных кристаллов ширина запрещенной зоны составляет около 6 э. В. У молекулярных кристаллов энергетические уровни локализованы в пределах молекул и энергетические зоны не возникают. Поэтому указанные вещества относятся к изоляторам. 29
 Жидкое состояние Изотропия - одинаковость физических свойств по всем направлениям Текучесть - способность легко изменять внешнюю форму под воздействием малых нагрузок. По высокой плотности и малой сжимаемости Ж близки к твердым телам. В жидкостях существует ближний порядок в расположении молекул, т. е. число соседних молекул у каждой молекулы, а также их взаимное расположение в среднем для всех молекул в объеме жидкости одинаково. Сильно выражена самодиффузия, т. е. непрерывные переходы молекул с места на место. 30
Жидкое состояние Изотропия - одинаковость физических свойств по всем направлениям Текучесть - способность легко изменять внешнюю форму под воздействием малых нагрузок. По высокой плотности и малой сжимаемости Ж близки к твердым телам. В жидкостях существует ближний порядок в расположении молекул, т. е. число соседних молекул у каждой молекулы, а также их взаимное расположение в среднем для всех молекул в объеме жидкости одинаково. Сильно выражена самодиффузия, т. е. непрерывные переходы молекул с места на место. 30
 Аморфное состояние характеризуется изотропностью и отсутствием четко фиксируемой точки плавления. В расположении частиц наблюдается только ближний порядок. Аморфные вещества встречаются в двух формах: однородного компактного твердого материала, получаемого при переохлаждении жидкости (стекло), и дисперсного материала (порошка). Стекло можно определить и как продукт плавления, перешедший при охлаждении в твердое состояние без кристаллизации. Аморфное состояние вещества является термодинамически нестабильным и при благоприятных условиях переходит в кристаллическое. 31
Аморфное состояние характеризуется изотропностью и отсутствием четко фиксируемой точки плавления. В расположении частиц наблюдается только ближний порядок. Аморфные вещества встречаются в двух формах: однородного компактного твердого материала, получаемого при переохлаждении жидкости (стекло), и дисперсного материала (порошка). Стекло можно определить и как продукт плавления, перешедший при охлаждении в твердое состояние без кристаллизации. Аморфное состояние вещества является термодинамически нестабильным и при благоприятных условиях переходит в кристаллическое. 31
 Межмолекулярное взаимодействие Молекулы способны к взаимодействию между собой, что обусловливает переход вещества из одного агрегатного состояния в другое. Силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса) имеют электрическую природу, проявляются на больших расстояниях и характеризуются отсутствием насыщаемости. 32
Межмолекулярное взаимодействие Молекулы способны к взаимодействию между собой, что обусловливает переход вещества из одного агрегатного состояния в другое. Силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса) имеют электрическую природу, проявляются на больших расстояниях и характеризуются отсутствием насыщаемости. 32
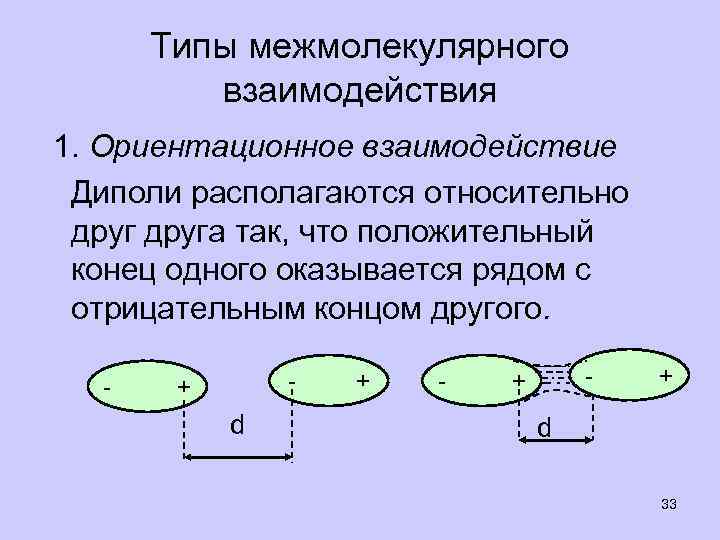 Типы межмолекулярного взаимодействия 1. Ориентационное взаимодействие Диполи располагаются относительно друга так, что положительный конец одного оказывается рядом с отрицательным концом другого. - - + d + - - + + d 33
Типы межмолекулярного взаимодействия 1. Ориентационное взаимодействие Диполи располагаются относительно друга так, что положительный конец одного оказывается рядом с отрицательным концом другого. - - + d + - - + + d 33
 2. Индукционное взаимодействие Электростатическое взаимодействие полярной и неполярной молекулы. Под действием полярной молекулы в неполярной возникает наведенный диполь. Энергия взаимодействия определяется электрическим моментом диполярной молекулы и поляризуемостью неполярной. 34
2. Индукционное взаимодействие Электростатическое взаимодействие полярной и неполярной молекулы. Под действием полярной молекулы в неполярной возникает наведенный диполь. Энергия взаимодействия определяется электрическим моментом диполярной молекулы и поляризуемостью неполярной. 34
 3. Дисперсионное взаимодействие возникает в результате взаимного притяжения мгновенных диполей. Они возникают в неполярных молекулах изза несовпадения электрических центров тяжести облака и ядер при колебаниях. Наиболее универсальное взаимодействие, проявляется между любыми молекулами. Делает возможным перевод в Ж или Т состояние веществ, состоящих из неполярных молекул (H 2, N 2, O 2, He, Ar). Энергия взаимодействия определяется поляризуемостью молекул. 35
3. Дисперсионное взаимодействие возникает в результате взаимного притяжения мгновенных диполей. Они возникают в неполярных молекулах изза несовпадения электрических центров тяжести облака и ядер при колебаниях. Наиболее универсальное взаимодействие, проявляется между любыми молекулами. Делает возможным перевод в Ж или Т состояние веществ, состоящих из неполярных молекул (H 2, N 2, O 2, He, Ar). Энергия взаимодействия определяется поляризуемостью молекул. 35
 + - Относительная величина вклада отдельных составляющих в общую энергию межмолекулярного взаимодействия зависит от двух характеристик молекулы - ее полярности и поляризуемости. 36
+ - Относительная величина вклада отдельных составляющих в общую энергию межмолекулярного взаимодействия зависит от двух характеристик молекулы - ее полярности и поляризуемости. 36
 Водородная связь Она осуществляется между катионом водорода одной молекулы и анионом другой молекулы: НХ, где X - атом одного из наиболее электроотрицательных элементов - F, О, N, реже Сl или S. Механизм возникновения водородной связи в значительной степени обусловлен и донорно-акцепторным взаимодействием, где донором является атом электроотрицательного элемента одной молекулы, а акцептором - атом водорода другой. Поэтому водородная связь обладает свойствами направленности и насыщаемости. 37
Водородная связь Она осуществляется между катионом водорода одной молекулы и анионом другой молекулы: НХ, где X - атом одного из наиболее электроотрицательных элементов - F, О, N, реже Сl или S. Механизм возникновения водородной связи в значительной степени обусловлен и донорно-акцепторным взаимодействием, где донором является атом электроотрицательного элемента одной молекулы, а акцептором - атом водорода другой. Поэтому водородная связь обладает свойствами направленности и насыщаемости. 37
 Энергия водородной связи примерно на порядок ниже энергии химической связи, но в несколько раз выше энергии межмолекулярного взаимодействия. Наличие водородной связи существенно влияет на физические и химические свойства веществ. В частности, аномально высокие температуры плавления и кипения H 2 O, HF, NH 3 объясняются образованием ассоциатов за счет водородной связи. 38
Энергия водородной связи примерно на порядок ниже энергии химической связи, но в несколько раз выше энергии межмолекулярного взаимодействия. Наличие водородной связи существенно влияет на физические и химические свойства веществ. В частности, аномально высокие температуры плавления и кипения H 2 O, HF, NH 3 объясняются образованием ассоциатов за счет водородной связи. 38
 Межмолекулярная связь Н Н О Внутримолекулярная связь (белки) Н О С Н О 39
Межмолекулярная связь Н Н О Внутримолекулярная связь (белки) Н О С Н О 39


