Химическая кинетика.ppt
- Количество слайдов: 53
 Химическая кинетика. Равновесие. Химическая кинетика изучает скорости и механизмы химических реакций. Часть 1.
Химическая кинетика. Равновесие. Химическая кинетика изучает скорости и механизмы химических реакций. Часть 1.
 Согласно химической термодинамики для реакции
Согласно химической термодинамики для реакции
 Основная задача химической кинетики Определить кинетический барьер, т. е. определить механизм химической реакции. Средняя скорость химической реакции – Это изменение коли чества вещества реагента или продукта за определенный промежуток времени «–» для реагентов; «+» для продуктов.
Основная задача химической кинетики Определить кинетический барьер, т. е. определить механизм химической реакции. Средняя скорость химической реакции – Это изменение коли чества вещества реагента или продукта за определенный промежуток времени «–» для реагентов; «+» для продуктов.
 Для гомогенной реакции количество вещества относят к единице объема реакционного пространства:
Для гомогенной реакции количество вещества относят к единице объема реакционного пространства:
 Для гетерогенных реакций количество вещества относят к единице поверхности:
Для гетерогенных реакций количество вещества относят к единице поверхности:
 Мгновенная скорость или скорость в данный момент: «+» если производная берется по возрастанию продукта, «–» если производная берется по уменьшению концентрации реагента.
Мгновенная скорость или скорость в данный момент: «+» если производная берется по возрастанию продукта, «–» если производная берется по уменьшению концентрации реагента.
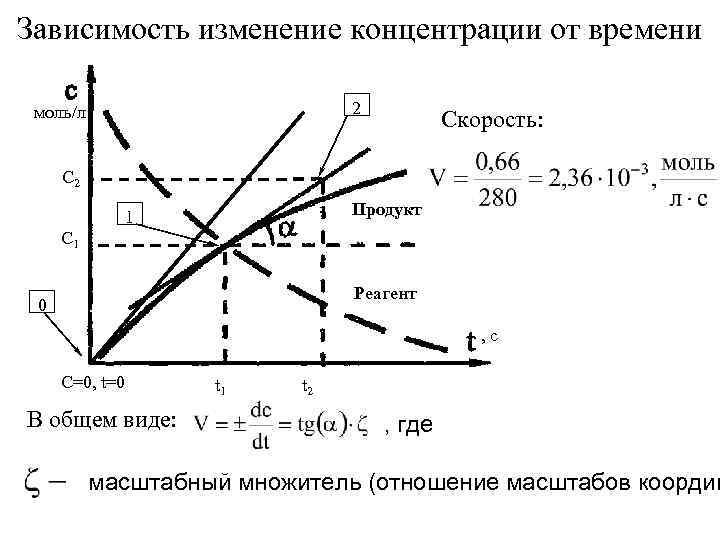 Зависимость изменение концентрации от времени 2 моль/л Скорость: С 2 Продукт 1 С 1 Реагент 0 , с С=0, t=0 В общем виде: t 1 t 2 , где масштабный множитель (отношение масштабов координ
Зависимость изменение концентрации от времени 2 моль/л Скорость: С 2 Продукт 1 С 1 Реагент 0 , с С=0, t=0 В общем виде: t 1 t 2 , где масштабный множитель (отношение масштабов координ
 Закон действующих масс. К. М. Гульдберг, Г. Вааге, 1864 -67 гг. Скорость элементарной химической реакции при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степенях с показателями, равными стехиометрическим коэффициентам в уравнении реакции. Для реакции:
Закон действующих масс. К. М. Гульдберг, Г. Вааге, 1864 -67 гг. Скорость элементарной химической реакции при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степенях с показателями, равными стехиометрическим коэффициентам в уравнении реакции. Для реакции:
 Правило Вант-Гоффа: При повышении температуры на каждые 10 градусов скорость большинства химических реакций возрастает в 2 — 4 раза. V 2 и V 1 – скорости реакций соответственно при температурах t 2 и t 1, температурный коэффициент скорости реакции –
Правило Вант-Гоффа: При повышении температуры на каждые 10 градусов скорость большинства химических реакций возрастает в 2 — 4 раза. V 2 и V 1 – скорости реакций соответственно при температурах t 2 и t 1, температурный коэффициент скорости реакции –
 Скорость химической реакции: Избыток KOH, изменяем концентрацию CH 3 Br Избыток CH 3 Br, изменяем концентрацию KOH Кинетическое уравнение, связывающее скорость реакции с концентрациями реагентов соответствует выражению:
Скорость химической реакции: Избыток KOH, изменяем концентрацию CH 3 Br Избыток CH 3 Br, изменяем концентрацию KOH Кинетическое уравнение, связывающее скорость реакции с концентрациями реагентов соответствует выражению:
 Порядок реакции определяют по сумме показателей степеней кинетического уравнения. В нашем случае порядок реакции равен: n=1+1=2. Константа скорости k коэффициент пропорциональности в кинетическом уравнении, зависит от природы реагирующих частиц. Константа скорости определяется по закону Аррейниуса.
Порядок реакции определяют по сумме показателей степеней кинетического уравнения. В нашем случае порядок реакции равен: n=1+1=2. Константа скорости k коэффициент пропорциональности в кинетическом уравнении, зависит от природы реагирующих частиц. Константа скорости определяется по закону Аррейниуса.

 Химическая кинетика. Равновесие. Химическая кинетика изучает скорости и механизмы химических реакций. Часть 2.
Химическая кинетика. Равновесие. Химическая кинетика изучает скорости и механизмы химических реакций. Часть 2.
 Простые и сложные реакции. Примеры простых реакций: Мономолекулярная реакция: Бимолекулярная реакция: Тримолекулярная реакция: .
Простые и сложные реакции. Примеры простых реакций: Мономолекулярная реакция: Бимолекулярная реакция: Тримолекулярная реакция: .
 Сложные реакции. Реакция окисления идет последовательно: Суммарная реакция:
Сложные реакции. Реакция окисления идет последовательно: Суммарная реакция:
 В лабораторном практикуме изучалась реакция:
В лабораторном практикуме изучалась реакция:

 На графике: ln. C α t константа скорости для данной температуры.
На графике: ln. C α t константа скорости для данной температуры.
 Влияние температуры на скорость химической реакции. Уравнение Аррениуса: где предэкспоненциальный множитель Z – общее число столкновений, P – стерический множитель (обычно – P=1 10– 9). Для простых реакций P=1. R – газовая постоянная, e – основание натурального логарифма, EA – энергия активации.
Влияние температуры на скорость химической реакции. Уравнение Аррениуса: где предэкспоненциальный множитель Z – общее число столкновений, P – стерический множитель (обычно – P=1 10– 9). Для простых реакций P=1. R – газовая постоянная, e – основание натурального логарифма, EA – энергия активации.
 Больцмановское распределение числа частиц по энергии при разных температурах.
Больцмановское распределение числа частиц по энергии при разных температурах.
 На примере реакции:
На примере реакции:
 Графический способ определения EA и A. или
Графический способ определения EA и A. или
 На графике представлена зависимость от lg(k) lg(A) α 1 T
На графике представлена зависимость от lg(k) lg(A) α 1 T
 Математический способ определения EA. Проводим опыт при температуре T 1 и T 2: При T 1: При T 2: далее находим отношение логарифмируем: отсюда получаем EA (k 1 и k 2 – опытные данные, T 1 и T 2 – заданы).
Математический способ определения EA. Проводим опыт при температуре T 1 и T 2: При T 1: При T 2: далее находим отношение логарифмируем: отсюда получаем EA (k 1 и k 2 – опытные данные, T 1 и T 2 – заданы).
 О кинетическом барьере. – это доля молекул с энергией EA. Допустим , тогда При EA=0 константа становится максимальной (реагируют все частицы, барьер отсутствует).
О кинетическом барьере. – это доля молекул с энергией EA. Допустим , тогда При EA=0 константа становится максимальной (реагируют все частицы, барьер отсутствует).
 О стерическом множителе. Стерический множитель A формально определяется: где Z – общее число столкновений частиц, P – доля удачно сориентированных частиц. Рассмотрим реакцию: H H С H Такая ориентация будет неудачной, т. к. одноименные заряды отталкиваются. Br δ– OH–
О стерическом множителе. Стерический множитель A формально определяется: где Z – общее число столкновений частиц, P – доля удачно сориентированных частиц. Рассмотрим реакцию: H H С H Такая ориентация будет неудачной, т. к. одноименные заряды отталкиваются. Br δ– OH–
 В итоге можно предположить из всех ориентаций более вероятные следующие: H H HO OH– H С Br δ– H Стерический множитель H С H Br– CH 3 OH+Br–
В итоге можно предположить из всех ориентаций более вероятные следующие: H H HO OH– H С Br δ– H Стерический множитель H С H Br– CH 3 OH+Br–
 Потенциальная кривая реакции E AB* EA Термодинамический путь (по этому пути реакция не идет) A+B D+K ΔH – тепловой эффект Путь процесса (направление+время)
Потенциальная кривая реакции E AB* EA Термодинамический путь (по этому пути реакция не идет) A+B D+K ΔH – тепловой эффект Путь процесса (направление+время)
 Катализ, теории катализа. Определение Борескова Г. К. (первый директор института катализа): Катализаторы — это вещества, которые изменяют скорость химической реакции, участвуя в образовании активного комплекса одной или нескольких стадий химического превращения и не входящего в состав конечного продукта.
Катализ, теории катализа. Определение Борескова Г. К. (первый директор института катализа): Катализаторы — это вещества, которые изменяют скорость химической реакции, участвуя в образовании активного комплекса одной или нескольких стадий химического превращения и не входящего в состав конечного продукта.
 Например: Эта реакция идет со взрывом. Здесь натрий является инициатором, а не катализатором. Уравнение Гиббса: работает для реакции без катализатора и для реакции с катализатором Константа равновесия равна отношению прямой и обратной константам скорости реакций: Катализатор ускоряет как прямую, так и обратную реакции.
Например: Эта реакция идет со взрывом. Здесь натрий является инициатором, а не катализатором. Уравнение Гиббса: работает для реакции без катализатора и для реакции с катализатором Константа равновесия равна отношению прямой и обратной константам скорости реакций: Катализатор ускоряет как прямую, так и обратную реакции.
 Рассмотрим влияние катализатора согласно определению Бореcкова: , где активированный промежуточный комплекс (процесс без катализатора). С катализатором: .
Рассмотрим влияние катализатора согласно определению Бореcкова: , где активированный промежуточный комплекс (процесс без катализатора). С катализатором: .
 Два пути процесса с катализатором и без катализатора E AB* ABK* A+ B EA Термодинамический путь (по этому пути EAK реакция не идет) D+K ΔH – тепловой эффект Путь процесса (направление+время)
Два пути процесса с катализатором и без катализатора E AB* ABK* A+ B EA Термодинамический путь (по этому пути EAK реакция не идет) D+K ΔH – тепловой эффект Путь процесса (направление+время)
 Уравнение Аррениуса для реакции с участием катализатора. Уравнение Аррениуса:
Уравнение Аррениуса для реакции с участием катализатора. Уравнение Аррениуса:
 Гомогенный катализ. • Гомогенный катализ – процесс, когда продукты и реагенты, и катализатор находятся в одном фазовом состоянии. Например: H C Cl Cl Fe. Cl 2 Cl Cl HCl Fe. Cl 3
Гомогенный катализ. • Гомогенный катализ – процесс, когда продукты и реагенты, и катализатор находятся в одном фазовом состоянии. Например: H C Cl Cl Fe. Cl 2 Cl Cl HCl Fe. Cl 3
 Гетерогенный катализ. Одна из основных стадий гетерогенного катализа является адсорбция. • Адсорбцией называется поглощение (удержание) вещества на поверхности раздела фаз.
Гетерогенный катализ. Одна из основных стадий гетерогенного катализа является адсорбция. • Адсорбцией называется поглощение (удержание) вещества на поверхности раздела фаз.
 Различают физическую и химическую адсорбцию. • Физическая адсорбция, обусловленная силами Ван дер Ваальса. Физическая адсорбция – обратима. • Активированная (хемосорбция) адсорбция обусловлена химическими валентными силами между адсорбированными молекулами и атомами поверхности твердого тела (катализатора). Активированная (хемосорбция) необратима, сопровождается большим тепловым эффектом.
Различают физическую и химическую адсорбцию. • Физическая адсорбция, обусловленная силами Ван дер Ваальса. Физическая адсорбция – обратима. • Активированная (хемосорбция) адсорбция обусловлена химическими валентными силами между адсорбированными молекулами и атомами поверхности твердого тела (катализатора). Активированная (хемосорбция) необратима, сопровождается большим тепловым эффектом.
 Зависимость адсорбции от температуры. n, количество адсорбированного вещества на единице поверхности Физическая адсорбция Десорбция Хемосорбция Т
Зависимость адсорбции от температуры. n, количество адсорбированного вещества на единице поверхности Физическая адсорбция Десорбция Хемосорбция Т
 Мультиплетная теория Баландина А. А. • Согласно мультиплетной теории в образовании поверхностного соединения (мультиплетного комплекса) участвуют группы активных атомов поверхности – (дуплеты, триплеты, квадруплеты …). • Мультиплетная теория основана на принципе геометрического и энергетического соответствия.
Мультиплетная теория Баландина А. А. • Согласно мультиплетной теории в образовании поверхностного соединения (мультиплетного комплекса) участвуют группы активных атомов поверхности – (дуплеты, триплеты, квадруплеты …). • Мультиплетная теория основана на принципе геометрического и энергетического соответствия.
 Принцип геометрического соответствия • Твердое тело может быть катализатором, если расположение активных мест на его поверхности находится в геометрическом соответствии с расположением атомов в молекулах реагирующих веществ.
Принцип геометрического соответствия • Твердое тело может быть катализатором, если расположение активных мест на его поверхности находится в геометрическом соответствии с расположением атомов в молекулах реагирующих веществ.
 Энергетическое соответствие • Энергия между атомами в мультиплете должна соответствовать энергии химической связи между атомами в реагирующих молекулах, образующих на поверхности катализатора мультиплетный комплекс.
Энергетическое соответствие • Энергия между атомами в мультиплете должна соответствовать энергии химической связи между атомами в реагирующих молекулах, образующих на поверхности катализатора мультиплетный комплекс.
 Разложение этилового спирта на катализаторе из Al 2 O 3. O O Al H 2 – C C – H 2 O H O C – H 2 Al O O–H H O –H
Разложение этилового спирта на катализаторе из Al 2 O 3. O O Al H 2 – C C – H 2 O H O C – H 2 Al O O–H H O –H
 На медном катализаторе этиловый спирт разлагается с образованием атецальдегида и водорода по следующей схеме: H H 3 C – C H O H H 3 – C H CH = O H
На медном катализаторе этиловый спирт разлагается с образованием атецальдегида и водорода по следующей схеме: H H 3 C – C H O H H 3 – C H CH = O H
 Все теории катализа исходят из стадийности процесса: • 1–я стадия: внешняя диффузия исходных реагентов (подвод реагентов к телу катализатора). • 2–я стадия: внутренняя диффузия реагентов в порах зерна катализатора. • 3–я стадия: активированная адсорбция (хемосорбция) реагентов на поверхности пор с образованием поверхностных химических соединений типа «реагент – катализатор» . • 4–я стадия: перегруппировка атомов с образованием поверхностных комплексов типа «продукт – катализатор» . • 5–я стадия: десорбция продуктов с поверхности пор катализатора. • 6–я стадия: диффузия (внутренняя) продуктов в объем пор. • 7–я стадия: диффузия продуктов в ядро потока.
Все теории катализа исходят из стадийности процесса: • 1–я стадия: внешняя диффузия исходных реагентов (подвод реагентов к телу катализатора). • 2–я стадия: внутренняя диффузия реагентов в порах зерна катализатора. • 3–я стадия: активированная адсорбция (хемосорбция) реагентов на поверхности пор с образованием поверхностных химических соединений типа «реагент – катализатор» . • 4–я стадия: перегруппировка атомов с образованием поверхностных комплексов типа «продукт – катализатор» . • 5–я стадия: десорбция продуктов с поверхности пор катализатора. • 6–я стадия: диффузия (внутренняя) продуктов в объем пор. • 7–я стадия: диффузия продуктов в ядро потока.
 Химические равновесия. Обратимые химические реакции протекают в обоих направлениях — прямом и обратном:
Химические равновесия. Обратимые химические реакции протекают в обоих направлениях — прямом и обратном:
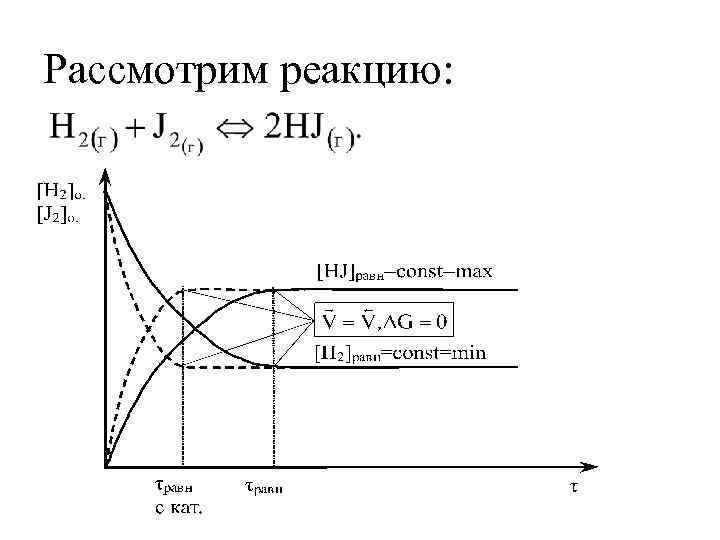 Рассмотрим реакцию:
Рассмотрим реакцию:
 • Гомогенное равновесие: реагенты находятся в одной фазе (газовой или жидкой). • Гетерогенное равновесие: реагенты находятся в разных фазах. Гомогенные Химические равновесия Гетерогенные Фазовые равновесия Равновесия
• Гомогенное равновесие: реагенты находятся в одной фазе (газовой или жидкой). • Гетерогенное равновесие: реагенты находятся в разных фазах. Гомогенные Химические равновесия Гетерогенные Фазовые равновесия Равновесия
 Константы равновесия, выраженные через равновесные концентрации: Для реакции:
Константы равновесия, выраженные через равновесные концентрации: Для реакции:
 Равновесие это: • Если реакционная система находится в состоянии равновесия, то произведение концентраций продуктов в степенях, равных соответствующим стехиометрическим коэффициентам, деленное на произведение концентраций реагентов в степенях, равных соответствующим стехиометрическим коэффициентам, является постоянной величиной при данной температуре, которую называют константой равновесия.
Равновесие это: • Если реакционная система находится в состоянии равновесия, то произведение концентраций продуктов в степенях, равных соответствующим стехиометрическим коэффициентам, деленное на произведение концентраций реагентов в степенях, равных соответствующим стехиометрическим коэффициентам, является постоянной величиной при данной температуре, которую называют константой равновесия.
![• Равновесные концентрации реагентов и продуктов - концентрации в состоянии равновесия, обозначают [С]р, • Равновесные концентрации реагентов и продуктов - концентрации в состоянии равновесия, обозначают [С]р,](https://present5.com/presentation/3/31647411_132734856.pdf-img/31647411_132734856.pdf-49.jpg) • Равновесные концентрации реагентов и продуктов - концентрации в состоянии равновесия, обозначают [С]р, они имеют размерность моль/л. В случае реакций между газами, концентрацию каждого из них можно заменить парциальным давлением:
• Равновесные концентрации реагентов и продуктов - концентрации в состоянии равновесия, обозначают [С]р, они имеют размерность моль/л. В случае реакций между газами, концентрацию каждого из них можно заменить парциальным давлением:
 • Кс — константа равновесия, выраженная через концентрации реагентов и продуктов, • Кр — константа равновесия, выраженная через парциальные давления. Значения Кс и Кр постоянны для каждой температуры. Пример: • В выражение для константы равновесия гетерогенной реакции входят только концентрации веществ, находящихся в жидкой или газовой фазе, так концентрации твердых веществ условились считать постоянными (равными 1).
• Кс — константа равновесия, выраженная через концентрации реагентов и продуктов, • Кр — константа равновесия, выраженная через парциальные давления. Значения Кс и Кр постоянны для каждой температуры. Пример: • В выражение для константы равновесия гетерогенной реакции входят только концентрации веществ, находящихся в жидкой или газовой фазе, так концентрации твердых веществ условились считать постоянными (равными 1).
 Принцип Ле-Шателье — Брауна. • Если изменить одно из условий (P, T, C), при которых система находится в состоянии равновесия, то положение равновесия сместится в направлении того процесса, протекание которого ос лабляет эффект произведенного воздействия.
Принцип Ле-Шателье — Брауна. • Если изменить одно из условий (P, T, C), при которых система находится в состоянии равновесия, то положение равновесия сместится в направлении того процесса, протекание которого ос лабляет эффект произведенного воздействия.
 • Если давление повышается, равновесие смещается в сторону уменьшения объема реагирующей системы. • Если давление понижается, равновесие смещается в сторону увеличения объема реагирующей системы. • Если температура повышается, равновесие смещается в сторону эндотермической реакции. • Если температура понижается, равновесие смещается в сторону экзотермической реакции. • Если увеличивается концентрация одного из реагентов, равновесие смещается в сторону прямой реакции. • Если уменьшается концентрация одного из реагентов, равновесие смещается в сторону обратной реакции.
• Если давление повышается, равновесие смещается в сторону уменьшения объема реагирующей системы. • Если давление понижается, равновесие смещается в сторону увеличения объема реагирующей системы. • Если температура повышается, равновесие смещается в сторону эндотермической реакции. • Если температура понижается, равновесие смещается в сторону экзотермической реакции. • Если увеличивается концентрация одного из реагентов, равновесие смещается в сторону прямой реакции. • Если уменьшается концентрация одного из реагентов, равновесие смещается в сторону обратной реакции.
 Связь константы равновесия с изменением энергии Гиббса: • Равновесие смещено вправо: • Равновесие смещено влево:
Связь константы равновесия с изменением энергии Гиббса: • Равновесие смещено вправо: • Равновесие смещено влево:


