Химическая кинетика.pptx
- Количество слайдов: 38
 Химическая кинетика
Химическая кинетика
 Основные понятия и постулаты химической кинетики
Основные понятия и постулаты химической кинетики
 Химическая кинетика — раздел физиче ской химии, изучающий скорости химиче ских реакций. Основные задачи химической кинетики: 1) расчет скоростей реакций и оп ределение кинетических кривых, т. е. зависи мости концентраций реагирующих веществ от времени {прямая задача); 2) определение, механизмов реакций по кинетическим кривым (обратная задача).
Химическая кинетика — раздел физиче ской химии, изучающий скорости химиче ских реакций. Основные задачи химической кинетики: 1) расчет скоростей реакций и оп ределение кинетических кривых, т. е. зависи мости концентраций реагирующих веществ от времени {прямая задача); 2) определение, механизмов реакций по кинетическим кривым (обратная задача).
 Основные различия между химической термодинамикой и кинетикой: 1) В химической термодинамике нет времени, она предсказывает только конечный результат процесса. Химическая кинетика изучает только изменяющиеся (динамиче ские) системы. 2) Равновесные свойства определяются состоянием как исходных веществ, так и продуктов реакции. Для термодинамики важны левая и правая части химического уравнения. Скорость реакции определяется только состоянием исходных веществ. Для кинетики важна только левая часть уравнения реакции. 3) Термодинамические свойства определяются термодинамической активностью веществ, кинетические свойства их концентрацией.
Основные различия между химической термодинамикой и кинетикой: 1) В химической термодинамике нет времени, она предсказывает только конечный результат процесса. Химическая кинетика изучает только изменяющиеся (динамиче ские) системы. 2) Равновесные свойства определяются состоянием как исходных веществ, так и продуктов реакции. Для термодинамики важны левая и правая части химического уравнения. Скорость реакции определяется только состоянием исходных веществ. Для кинетики важна только левая часть уравнения реакции. 3) Термодинамические свойства определяются термодинамической активностью веществ, кинетические свойства их концентрацией.
 Скорость химической реакции в газовой фазе или в растворе определяется изменением числа молекул( или числа молей n) вещества в единицу времени в единице объема: Знак плюс используют. Если скорость определяют по продукту, а минус по исходному веществу. Если реакция протекает при постоянном объеме, то скорость выражают через молярную концентрацию: с = n/V , которая имеет размерность моль. л 1 (молярную концентрацию часто обозначают также квадратными скобками). Для реакции а. А +b. В +. . . —> d. D + е. Е +. . скорость в момент времени t определяют следующим образом: где a, b. d, e стехиометрические коэффициенты в уравнении реакции.
Скорость химической реакции в газовой фазе или в растворе определяется изменением числа молекул( или числа молей n) вещества в единицу времени в единице объема: Знак плюс используют. Если скорость определяют по продукту, а минус по исходному веществу. Если реакция протекает при постоянном объеме, то скорость выражают через молярную концентрацию: с = n/V , которая имеет размерность моль. л 1 (молярную концентрацию часто обозначают также квадратными скобками). Для реакции а. А +b. В +. . . —> d. D + е. Е +. . скорость в момент времени t определяют следующим образом: где a, b. d, e стехиометрические коэффициенты в уравнении реакции.
 Среднюю скорость за время Δt определяют через конечные разности: Для реакций, протекающих в газовой фазе, скорость можно определять также через парциальные давления веществ. Скорость реакции выражают в различных единицах: моль. л 1. с 1, моль. см 3. с 3. , Па. с 1. Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики — законом действующих масс: Скорость химической реакции в каждый момент времени, пропорциональна текущим концентрациям реагирующих ве ществ, возведенным в некоторые тепени: с W(t)= k. [А]x. [В]y , где k — константа скорости (не зависящая от концентрации); х, у — некоторые числа, которые называют порядком реакции по веществам А и В, соответственно. Эти числа в общем случае никак не связаны с коэффициентами а и b в уравнении реакции. Сумму показателей степеней х+y называют общим порядком реакции.
Среднюю скорость за время Δt определяют через конечные разности: Для реакций, протекающих в газовой фазе, скорость можно определять также через парциальные давления веществ. Скорость реакции выражают в различных единицах: моль. л 1. с 1, моль. см 3. с 3. , Па. с 1. Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики — законом действующих масс: Скорость химической реакции в каждый момент времени, пропорциональна текущим концентрациям реагирующих ве ществ, возведенным в некоторые тепени: с W(t)= k. [А]x. [В]y , где k — константа скорости (не зависящая от концентрации); х, у — некоторые числа, которые называют порядком реакции по веществам А и В, соответственно. Эти числа в общем случае никак не связаны с коэффициентами а и b в уравнении реакции. Сумму показателей степеней х+y называют общим порядком реакции.
 Порядок реакции может быть положительным или отрицательным, целым или дробным. Размерность константы скорости зависит от порядка реакции. Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарном реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Переходный комплекс конфигурация ядер, соответствующая переходу от реагентов к продуктам. Обычно переходный комплекс соответствует максимуму на энергетической кривое химической реакции.
Порядок реакции может быть положительным или отрицательным, целым или дробным. Размерность константы скорости зависит от порядка реакции. Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарном реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Переходный комплекс конфигурация ядер, соответствующая переходу от реагентов к продуктам. Обычно переходный комплекс соответствует максимуму на энергетической кривое химической реакции.
 Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. Элементарные реакции бывают трех типов. 1)Мономолекулярные реакции элементарные реакции распада и изомеризации, в которых участвует только одна молекула: ↗ X+YZ XYZ→[X Y Z] →XY+Z ↘X+Y+Z реагент переходное продукты состояние Разрыв связей в исходной молекуле происходит под действием света или при нагревании, например hv CH 3 Br→ СН 3 + Br.
Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. Элементарные реакции бывают трех типов. 1)Мономолекулярные реакции элементарные реакции распада и изомеризации, в которых участвует только одна молекула: ↗ X+YZ XYZ→[X Y Z] →XY+Z ↘X+Y+Z реагент переходное продукты состояние Разрыв связей в исходной молекуле происходит под действием света или при нагревании, например hv CH 3 Br→ СН 3 + Br.
![2) В бимолекулярных реакциях происходит столкновение двух частиц: X+YZ→ [X Y Z]→XY+Z, реагенты 2) В бимолекулярных реакциях происходит столкновение двух частиц: X+YZ→ [X Y Z]→XY+Z, реагенты](https://present5.com/presentation/143529443_33015538/image-9.jpg) 2) В бимолекулярных реакциях происходит столкновение двух частиц: X+YZ→ [X Y Z]→XY+Z, реагенты переходное состояние продукты при этом одни связи разрываются, а другие образуются, например: H+Cl 2→HCl+Cl. Бимолекулярные реакции самый распространенный тип элементарных реакций.
2) В бимолекулярных реакциях происходит столкновение двух частиц: X+YZ→ [X Y Z]→XY+Z, реагенты переходное состояние продукты при этом одни связи разрываются, а другие образуются, например: H+Cl 2→HCl+Cl. Бимолекулярные реакции самый распространенный тип элементарных реакций.
 3)В тримолекулярных реакциях одновременно сталкиваются три молекулы, например: 2 NO+O 2→ 2 NO 2. Для элементарных реакций общий порядок равен молекулярности, а порядки по веществам равны коэффициентам в уравнении реакции. Сложная реакция состоит из нескольких элементарных реакций. Скорость сложной реакции определяется скоростью самой медленной стадии
3)В тримолекулярных реакциях одновременно сталкиваются три молекулы, например: 2 NO+O 2→ 2 NO 2. Для элементарных реакций общий порядок равен молекулярности, а порядки по веществам равны коэффициентам в уравнении реакции. Сложная реакция состоит из нескольких элементарных реакций. Скорость сложной реакции определяется скоростью самой медленной стадии
 Кинетика реакций целого порядка
Кинетика реакций целого порядка
 На основе закона действующих масс составим и решим кинетические уравнения для необратимых реакций целого порядка. Реакции 0 го порядка. Скорость этих реакций не зависит от концентрации: где [A]0 — концентрация исходного вещества. Нулевой порядок встречается в гетерогенных и фотохимических реакциях.
На основе закона действующих масс составим и решим кинетические уравнения для необратимых реакций целого порядка. Реакции 0 го порядка. Скорость этих реакций не зависит от концентрации: где [A]0 — концентрация исходного вещества. Нулевой порядок встречается в гетерогенных и фотохимических реакциях.
![Реакции 1 -го порядка. В реакциях типа А→В скорость прямо пропорциональна концентрации: (d[A]/dt)=k*[A]. При Реакции 1 -го порядка. В реакциях типа А→В скорость прямо пропорциональна концентрации: (d[A]/dt)=k*[A]. При](https://present5.com/presentation/143529443_33015538/image-13.jpg) Реакции 1 -го порядка. В реакциях типа А→В скорость прямо пропорциональна концентрации: (d[A]/dt)=k*[A]. При решении кинетических уравнений часто используют следующие обозначения: начальная концентрация [А]о = а, текущая концентрация [A]= а x(t), где x(t) — концентрация прореагировавшего вещества А. В этих обозначениях кинетическое уравнение для реакции 1 го порядка и его решение имеют вид. dx/dt=k (a-x), x(t)=a*[1 -exp(-kt)] Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции: k=(1/t)ln(a/(a-x))=(1/t)ln[A]0/[A]
Реакции 1 -го порядка. В реакциях типа А→В скорость прямо пропорциональна концентрации: (d[A]/dt)=k*[A]. При решении кинетических уравнений часто используют следующие обозначения: начальная концентрация [А]о = а, текущая концентрация [A]= а x(t), где x(t) — концентрация прореагировавшего вещества А. В этих обозначениях кинетическое уравнение для реакции 1 го порядка и его решение имеют вид. dx/dt=k (a-x), x(t)=a*[1 -exp(-kt)] Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции: k=(1/t)ln(a/(a-x))=(1/t)ln[A]0/[A]
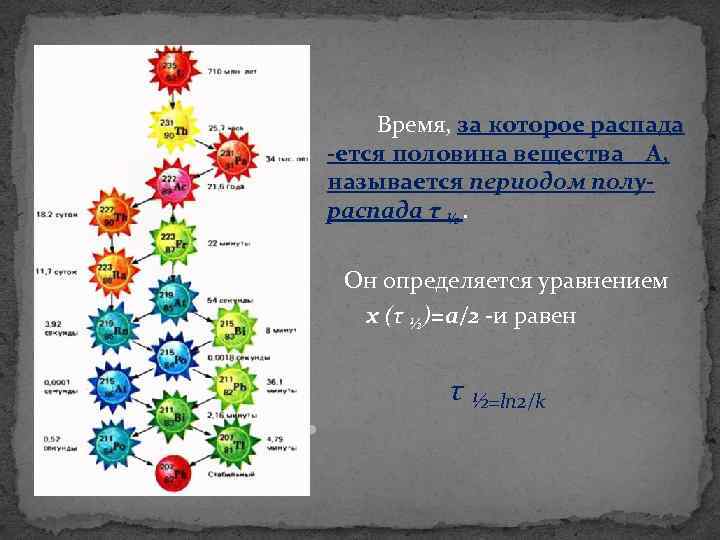 Время, за которое распада ется половина вещества А, называется периодом полураспада τ ½. Он определяется уравнением x (τ ½)=a/2 -и равен τ ½=ln 2/k
Время, за которое распада ется половина вещества А, называется периодом полураспада τ ½. Он определяется уравнением x (τ ½)=a/2 -и равен τ ½=ln 2/k
 Реакции 2 го порядка В реакциях типа А + В → D +. . . скорость прямо пропорциональна произведению концентраций: d[A]/dt= - d[B]/dt=k. [A]. [B] Начальные концентрации веществ: [А]0 = а, [В]0 = b; текущие концентрации: [А] = a-x(t), [В] =b-x(t). При решении этого уравнения различают два случая. 1) одинаковые начальные концентрации веществ А и В: а = b. Кинетическое уравнение имеет вид: dx/dt=k. (a x) 2 Решение этого уравнения записывают в различных формах: х(t) =(a 2 kt)/(1 + akt), kt=1/( а х) – 1/a=(1/ [А]) – (1/[А]0). Период полураспада веществ А и В одинаков и равен: τ ½=1/ka 2) начальные концентрации веществ А и В различны: а≠ Ь. Кинетическое уравнение имеет вид: dx/dt= к. (а х). (Ь х). Решение этого уравнения можно записать следующим образом: Периоды полураспада веществ А и В различны: τ ½ (А) ≠ τ ½ (B).
Реакции 2 го порядка В реакциях типа А + В → D +. . . скорость прямо пропорциональна произведению концентраций: d[A]/dt= - d[B]/dt=k. [A]. [B] Начальные концентрации веществ: [А]0 = а, [В]0 = b; текущие концентрации: [А] = a-x(t), [В] =b-x(t). При решении этого уравнения различают два случая. 1) одинаковые начальные концентрации веществ А и В: а = b. Кинетическое уравнение имеет вид: dx/dt=k. (a x) 2 Решение этого уравнения записывают в различных формах: х(t) =(a 2 kt)/(1 + akt), kt=1/( а х) – 1/a=(1/ [А]) – (1/[А]0). Период полураспада веществ А и В одинаков и равен: τ ½=1/ka 2) начальные концентрации веществ А и В различны: а≠ Ь. Кинетическое уравнение имеет вид: dx/dt= к. (а х). (Ь х). Решение этого уравнения можно записать следующим образом: Периоды полураспада веществ А и В различны: τ ½ (А) ≠ τ ½ (B).
 Реакции п-го порядка п. А→ D +. . . Кинетическое уравнение имеет вид: dx/dt== k. (а х)п. Решение кинетического уравнения: Период полураспада вещества А обратно пропорционален (n 1) й степени начальной концентрации:
Реакции п-го порядка п. А→ D +. . . Кинетическое уравнение имеет вид: dx/dt== k. (а х)п. Решение кинетического уравнения: Период полураспада вещества А обратно пропорционален (n 1) й степени начальной концентрации:
 Методы определения порядка реакции Общий метод определения порядка реакции основан на законе действующих масс: W(t)= k. [А]x. [В]y , Представим, что вещество В находится в большом избытке и его концентрация мало меняется в ходе реакции. Тогда порядок реакции р по веществу А можно определить, измерив скорость реакции при двух концентрациях А. Записывая уравнение W(t)= k. [А]x. [В]y для двух моментов времени в логарифмической форме и вычитая одно выражение из другого, найдем порядок х: В случае, если имеется больше двух экспериментальных точек, можно записать кинетические данные в координатах ln w — 1 n[А] представить их в линейном виде с помощью метода наименьших квадратов. Тогда порядок реакции х будет равен тангенсу угла клона прямой. Если реакция имеет целый порядок, то для определения порядка используют различные частные методы.
Методы определения порядка реакции Общий метод определения порядка реакции основан на законе действующих масс: W(t)= k. [А]x. [В]y , Представим, что вещество В находится в большом избытке и его концентрация мало меняется в ходе реакции. Тогда порядок реакции р по веществу А можно определить, измерив скорость реакции при двух концентрациях А. Записывая уравнение W(t)= k. [А]x. [В]y для двух моментов времени в логарифмической форме и вычитая одно выражение из другого, найдем порядок х: В случае, если имеется больше двух экспериментальных точек, можно записать кинетические данные в координатах ln w — 1 n[А] представить их в линейном виде с помощью метода наименьших квадратов. Тогда порядок реакции х будет равен тангенсу угла клона прямой. Если реакция имеет целый порядок, то для определения порядка используют различные частные методы.
![Метод подстановки Он заключается в том, что кинетические данные представляют в виде kt=f([A]), где Метод подстановки Он заключается в том, что кинетические данные представляют в виде kt=f([A]), где](https://present5.com/presentation/143529443_33015538/image-18.jpg) Метод подстановки Он заключается в том, что кинетические данные представляют в виде kt=f([A]), где функция f соответствует решению кинетического уравнения для одного из целых порядков. Если величина к, определенная такие образом, будет постоянной, то мы угадали, т. е. выбрали верный порядок. Если к будет изменяться со временем, то надо выбрать функцию f, соответствующую другому порядку. Другой способ определения целого порядка заключается в измерении зависимости времени протекания реакции от начальной концентрации. Из решения кинетического уравнения для реакции n го порядка следует, что время τ х„ за которое степень превращена достигнет х, обратно пропорционально (n 1) й степени начальной концентрации : τ х ~ a –(n-1) Измеряя время превращения τ х при двух начальных концентрациях, можно определить порядок п по формуле: Отметим, что разные начальные концентрации можно выбирав на одной и той же кинетической кривой.
Метод подстановки Он заключается в том, что кинетические данные представляют в виде kt=f([A]), где функция f соответствует решению кинетического уравнения для одного из целых порядков. Если величина к, определенная такие образом, будет постоянной, то мы угадали, т. е. выбрали верный порядок. Если к будет изменяться со временем, то надо выбрать функцию f, соответствующую другому порядку. Другой способ определения целого порядка заключается в измерении зависимости времени протекания реакции от начальной концентрации. Из решения кинетического уравнения для реакции n го порядка следует, что время τ х„ за которое степень превращена достигнет х, обратно пропорционально (n 1) й степени начальной концентрации : τ х ~ a –(n-1) Измеряя время превращения τ х при двух начальных концентрациях, можно определить порядок п по формуле: Отметим, что разные начальные концентрации можно выбирав на одной и той же кинетической кривой.
 Влияние температуры на скорость химических реакций Скорость большинства реакций увеличивается с ростом температуры, т. к. при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения правило Вант Гоффа и уравнение Аррениуса.
Влияние температуры на скорость химических реакций Скорость большинства реакций увеличивается с ростом температуры, т. к. при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения правило Вант Гоффа и уравнение Аррениуса.
 Правило Вант Гоффа заключается в том, что при нагревании на 100 С скорость большинства химических реакций увеличивается в 2 4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом: где γ| — температурный коэффициент скорости (γ = 2+4). Правило Вант Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур.
Правило Вант Гоффа заключается в том, что при нагревании на 100 С скорость большинства химических реакций увеличивается в 2 4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом: где γ| — температурный коэффициент скорости (γ = 2+4). Правило Вант Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур.
 Гораздо более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости: к (Т) = Аехр[ EA/RT] где R — универсальная газовая постоянная; А — предэкспоненциальный множитель, который не зависит от температуры, а определяется только природой реакции; ЕА —энергия активации, которую можно охарактеризовать как некоторую пороговую энергию: грубо говоря, если энергия сталкивающихся частиц меньше ЕА, то при столкновении реакция не произойдет, если энергия превышает ЕА, реакция произойдет. Энергия активации не зависит от температуры. Для большинства реакций между валентнонасыщенными молекулами энергия активации составляет 50 100 к. Дж. моль 1.
Гораздо более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости: к (Т) = Аехр[ EA/RT] где R — универсальная газовая постоянная; А — предэкспоненциальный множитель, который не зависит от температуры, а определяется только природой реакции; ЕА —энергия активации, которую можно охарактеризовать как некоторую пороговую энергию: грубо говоря, если энергия сталкивающихся частиц меньше ЕА, то при столкновении реакция не произойдет, если энергия превышает ЕА, реакция произойдет. Энергия активации не зависит от температуры. Для большинства реакций между валентнонасыщенными молекулами энергия активации составляет 50 100 к. Дж. моль 1.
 Экспотенциальный множитель в уравнении Аррениуса можно интерпретировать, как долю молекул, энергия которых превышает ЕА при температуре Т. В самом деле, если рассмотреть больцмановскую функцию распределения по энергии: ρ(Е) = const. exp[ Е/(/RT)], то доля молекул с Е > ЕА дается выражением:
Экспотенциальный множитель в уравнении Аррениуса можно интерпретировать, как долю молекул, энергия которых превышает ЕА при температуре Т. В самом деле, если рассмотреть больцмановскую функцию распределения по энергии: ρ(Е) = const. exp[ Е/(/RT)], то доля молекул с Е > ЕА дается выражением:
 Энергию активации можно определить, измерив константу скорости при двух температурах. Из уравнения к(Т) = Аехр[ EA/RT] следует: EA=[R. T 1. T 2/ (T 2 T 1)]. ln(k 2/k 1) Более точно энергию активации определяют по значениям константы скорости при нескольких температурах. Для этого уравнения Аррениуса (20. 2) записывают в логарифмической форме ln k= ln A ( EA/RT) и представляют экспериментальные данные в координатах In к — 1/Т. Тангенс угла наклона полученной прямой равен -EA/R. Для некоторых реакций предэкспоненциальный множитель слабо зависит от температуры. В этом случае определяют так называемую опытную энергию активации: Еоп=RT 2. (d ln k/ d. T) Если предэкспоненциальный множитель — постоянный, то опытная энергия активации равна аррениусовской энергии актива ции: оп = ЕА. Е
Энергию активации можно определить, измерив константу скорости при двух температурах. Из уравнения к(Т) = Аехр[ EA/RT] следует: EA=[R. T 1. T 2/ (T 2 T 1)]. ln(k 2/k 1) Более точно энергию активации определяют по значениям константы скорости при нескольких температурах. Для этого уравнения Аррениуса (20. 2) записывают в логарифмической форме ln k= ln A ( EA/RT) и представляют экспериментальные данные в координатах In к — 1/Т. Тангенс угла наклона полученной прямой равен -EA/R. Для некоторых реакций предэкспоненциальный множитель слабо зависит от температуры. В этом случае определяют так называемую опытную энергию активации: Еоп=RT 2. (d ln k/ d. T) Если предэкспоненциальный множитель — постоянный, то опытная энергия активации равна аррениусовской энергии актива ции: оп = ЕА. Е
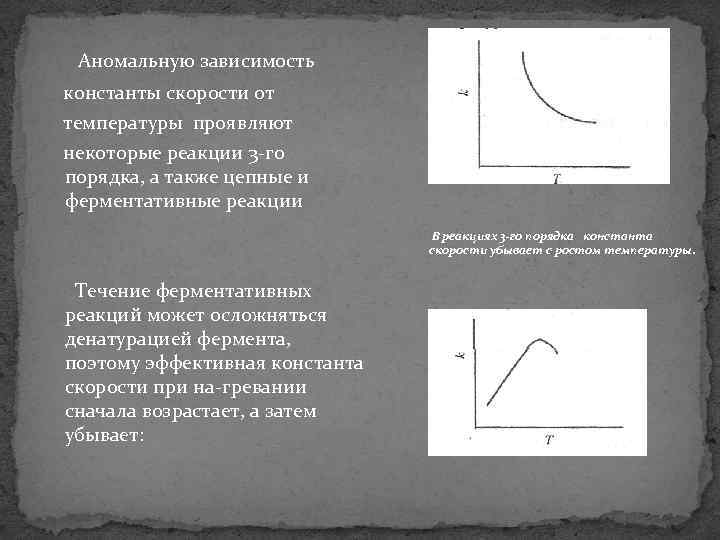 Аномальную зависимость константы скорости от температуры проявляют некоторые реакции 3 го порядка, а также цепные и ферментативные реакции В реакциях 3 -го порядка константа скорости убывает с ростом температуры. Течение ферментативных реакций может осложняться денатурацией фермента, поэтому эффективная константа скорости при на гревании сначала возрастает, а затем убывает:
Аномальную зависимость константы скорости от температуры проявляют некоторые реакции 3 го порядка, а также цепные и ферментативные реакции В реакциях 3 -го порядка константа скорости убывает с ростом температуры. Течение ферментативных реакций может осложняться денатурацией фермента, поэтому эффективная константа скорости при на гревании сначала возрастает, а затем убывает:
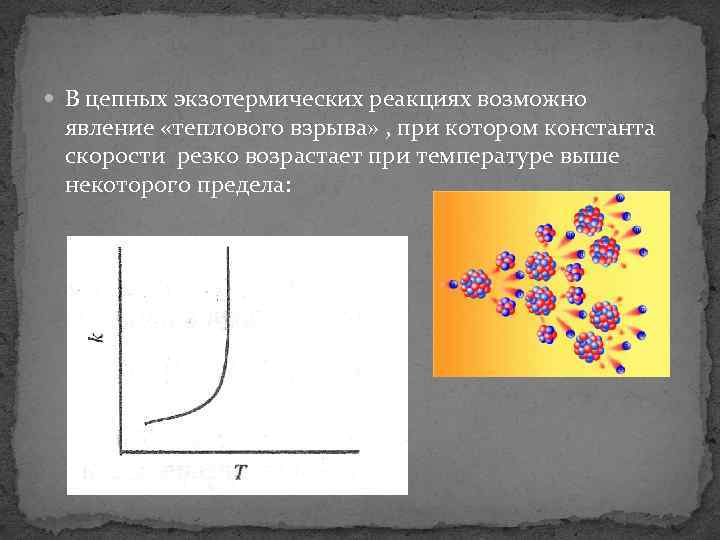 В цепных экзотермических реакциях возможно явление «теплового взрыва» , при котором константа скорости резко возрастает при температуре выше некоторого предела:
В цепных экзотермических реакциях возможно явление «теплового взрыва» , при котором константа скорости резко возрастает при температуре выше некоторого предела:
 Кинетика сложных реакций При изучении кинетики сложных реакции, включающих несколько элементарных стадий, используют принцип независимости химических реакций: Если в системе протекает несколько простых реакций, то каждая из них подчиняет ся основному постулату хими ческой кинетики независимо от других реакций.
Кинетика сложных реакций При изучении кинетики сложных реакции, включающих несколько элементарных стадий, используют принцип независимости химических реакций: Если в системе протекает несколько простых реакций, то каждая из них подчиняет ся основному постулату хими ческой кинетики независимо от других реакций.
![1. Обратимые реакции первого порядка: Закон действующих масс записывается следующим образом: - d[A]/dt= k 1. Обратимые реакции первого порядка: Закон действующих масс записывается следующим образом: - d[A]/dt= k](https://present5.com/presentation/143529443_33015538/image-27.jpg) 1. Обратимые реакции первого порядка: Закон действующих масс записывается следующим образом: - d[A]/dt= k 1[A]-k-1[B]
1. Обратимые реакции первого порядка: Закон действующих масс записывается следующим образом: - d[A]/dt= k 1[A]-k-1[B]
 Если начальные концентрации веществ А и В обозначить, соответственно, а и b и ввести степень превращения х ([А] = а — х, [B]= b + х), то кинетическое уравнение приобретает вид: dx/dt = k 1 (а — х) — k-1 (b + х). Решение этого уравнения можно выразить через степень превращения, соответствующую достижению равновесия: x = x∞(1 -exp[-(k 1+k-1)t]) или (k 1 +k-1 )t = ln(x∞ /x∞-x) , где x∞ определяется условием равенства скоростей прямой и обратной реакций:
Если начальные концентрации веществ А и В обозначить, соответственно, а и b и ввести степень превращения х ([А] = а — х, [B]= b + х), то кинетическое уравнение приобретает вид: dx/dt = k 1 (а — х) — k-1 (b + х). Решение этого уравнения можно выразить через степень превращения, соответствующую достижению равновесия: x = x∞(1 -exp[-(k 1+k-1)t]) или (k 1 +k-1 )t = ln(x∞ /x∞-x) , где x∞ определяется условием равенства скоростей прямой и обратной реакций:
 При t→∞ наступает равновесие, которое характеризуется константой: Кинетические кривые для обратимых реакций 1 го порядка на рисунке Зависимость концентраций реагента и продукта от времени для обратимой реакции первого порядка: (1)К >1; (2) K<1.
При t→∞ наступает равновесие, которое характеризуется константой: Кинетические кривые для обратимых реакций 1 го порядка на рисунке Зависимость концентраций реагента и продукта от времени для обратимой реакции первого порядка: (1)К >1; (2) K<1.
 2. Параллельные реакции первого порядка: Кинетическое уравнение записывается с учетом принципа независимости: dx/dt = к 1(а - х) + к 2(а - х). Решение этого уравнения записывается так же, как и для одной реакции первого порядка: Для параллельных реакций в любой момент времени отношение концентраций продуктов постоянно и определяется константами скорости элементарных стадий: [B]/[D]= k. L / к 2
2. Параллельные реакции первого порядка: Кинетическое уравнение записывается с учетом принципа независимости: dx/dt = к 1(а - х) + к 2(а - х). Решение этого уравнения записывается так же, как и для одной реакции первого порядка: Для параллельных реакций в любой момент времени отношение концентраций продуктов постоянно и определяется константами скорости элементарных стадий: [B]/[D]= k. L / к 2
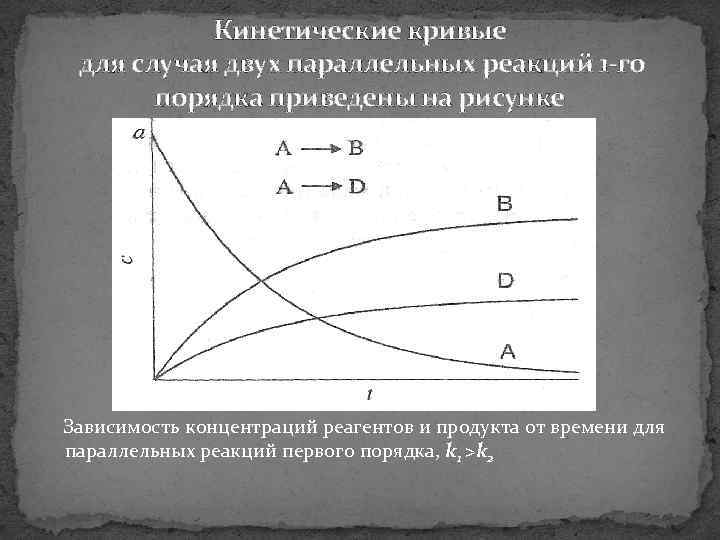 Кинетические кривые для случая двух параллельных реакций 1 го порядка приведены на рисунке Зависимость концентраций реагентов и продукта от времени для параллельных реакций первого порядка, k 1 >k 2
Кинетические кривые для случая двух параллельных реакций 1 го порядка приведены на рисунке Зависимость концентраций реагентов и продукта от времени для параллельных реакций первого порядка, k 1 >k 2
 3. Последовательные реакции первого порядка: Пусть в начальный момент времени есть только вещество А. Применим к этой системе закон действующих масс и принцип независимости химических реакций: С начальными условиями [A]0 = a, [B]0 = [D]0 = 0
3. Последовательные реакции первого порядка: Пусть в начальный момент времени есть только вещество А. Применим к этой системе закон действующих масс и принцип независимости химических реакций: С начальными условиями [A]0 = a, [B]0 = [D]0 = 0
 Решение этой системы дает концентрации веществ: Концентрация промежуточного вещества достигает максимума при tmax= ln(к 2/к 1)/(к 2 -кх ) Величина этого максимума определяется отношением констант k 2/k 1. Если оно мало, то промежуточный продукт быстро накапливается и медленно расходуется. Если же оно велико, т. е. к 2 » к 1, то промежуточный продукт не успевает накапливаться и его концентрация в любой момент времени мала (рисунок). Зависимость концентрации промежуточного продукта от времени в системе двухпоследвательных реакций при различных соотношениях констант скорости первой и второй стадий В этом случае для анализа кинетических уравнений можно использовать приближенный метод квазистационарных концентраций.
Решение этой системы дает концентрации веществ: Концентрация промежуточного вещества достигает максимума при tmax= ln(к 2/к 1)/(к 2 -кх ) Величина этого максимума определяется отношением констант k 2/k 1. Если оно мало, то промежуточный продукт быстро накапливается и медленно расходуется. Если же оно велико, т. е. к 2 » к 1, то промежуточный продукт не успевает накапливаться и его концентрация в любой момент времени мала (рисунок). Зависимость концентрации промежуточного продукта от времени в системе двухпоследвательных реакций при различных соотношениях констант скорости первой и второй стадий В этом случае для анализа кинетических уравнений можно использовать приближенный метод квазистационарных концентраций.
 Фотохимические реакции Многие химические реакции происходят только под действием светового излучения. Для возбуждения таких реакций обычно используют видимое или УФ излучение (длина волны λ = 200+700 нм). Энергия одного кванта света связана с длиной волны соотношением: Е=hυ=hc/λ , где υ частота излучения, h = 6. 626 10 Дж с — постоянная Планка, с = 3 10 s м с 1 скорость света. Один моль квантов света иногда называют эйнштейном.
Фотохимические реакции Многие химические реакции происходят только под действием светового излучения. Для возбуждения таких реакций обычно используют видимое или УФ излучение (длина волны λ = 200+700 нм). Энергия одного кванта света связана с длиной волны соотношением: Е=hυ=hc/λ , где υ частота излучения, h = 6. 626 10 Дж с — постоянная Планка, с = 3 10 s м с 1 скорость света. Один моль квантов света иногда называют эйнштейном.
 Возбужденная молекула может испытывать последующие превращения (вторичные реакции): 1) флуоресценция, т. е. быстрое испускание света и переход в ис ходное электронное состояние: А* > А + hυf. Частота испускаемого света меньше или равна частоте поглощаемого в первичном процессе света: υf < υ. 2) Фосфоресценция — испускание света с некоторой задержкой по времени, которая необходима для того, чтобы молекула за счет безызлучательных процессов перешла в другое возбужденное сoстояние. 3) Дезактивация при соударении: А* + А → А + А. 4) Диссоциация: А*→В + С. 5) Реакция с другими молекулами: А* + В →С.
Возбужденная молекула может испытывать последующие превращения (вторичные реакции): 1) флуоресценция, т. е. быстрое испускание света и переход в ис ходное электронное состояние: А* > А + hυf. Частота испускаемого света меньше или равна частоте поглощаемого в первичном процессе света: υf < υ. 2) Фосфоресценция — испускание света с некоторой задержкой по времени, которая необходима для того, чтобы молекула за счет безызлучательных процессов перешла в другое возбужденное сoстояние. 3) Дезактивация при соударении: А* + А → А + А. 4) Диссоциация: А*→В + С. 5) Реакция с другими молекулами: А* + В →С.
 Квантовый выход φ фотохимической реакции равен отношению числа прореагировавших молекул к числу поглощенных фотонов По закону эквивалентности Эйнштейна Штарка, каждый поглощенный фотон вызывает фотохимическое возбуждение одной молекулы. Это означает, что теоретически первичный квантовый выход всегда равен 1. Экспериментальные значения квантового выхода могут 3 значи тельно отклоняться от 1 (10 < φ < 106) за счет вторичных процессов. Высокие значения квантового выхода (φ> 1) свидетельствуют о протекании цепной реакции. Низкие значения φ (φ < 1) характерны для реакций, включающих процессы релаксации, т. е. потери энер гии возбуждения.
Квантовый выход φ фотохимической реакции равен отношению числа прореагировавших молекул к числу поглощенных фотонов По закону эквивалентности Эйнштейна Штарка, каждый поглощенный фотон вызывает фотохимическое возбуждение одной молекулы. Это означает, что теоретически первичный квантовый выход всегда равен 1. Экспериментальные значения квантового выхода могут 3 значи тельно отклоняться от 1 (10 < φ < 106) за счет вторичных процессов. Высокие значения квантового выхода (φ> 1) свидетельствуют о протекании цепной реакции. Низкие значения φ (φ < 1) характерны для реакций, включающих процессы релаксации, т. е. потери энер гии возбуждения.
 Согласно закону Вант Гоффа, количество вещества, которое вступило в фотохимическую реакцию, пропорционально поглощенной энергии света. Из законов Ламберта Бера и Вант Гоффа следует выражение для скорости первичной фотохимической реакции: w =dc/dt= const. I 0 • (1 e εcl ). Если толщина поглощающего слоя мала, εcl<<1, то фотохимическая реакция имеет первый порядок по реагенту: w= (const. I 0 • εl). c Если же толщина поглощающего света велика, εcl >>1, то весь свет поглощается и скорость реакции определяется только величиной I 0, т. е. реакция имеет нулевой порядок по реагенту: w= const. I 0
Согласно закону Вант Гоффа, количество вещества, которое вступило в фотохимическую реакцию, пропорционально поглощенной энергии света. Из законов Ламберта Бера и Вант Гоффа следует выражение для скорости первичной фотохимической реакции: w =dc/dt= const. I 0 • (1 e εcl ). Если толщина поглощающего слоя мала, εcl<<1, то фотохимическая реакция имеет первый порядок по реагенту: w= (const. I 0 • εl). c Если же толщина поглощающего света велика, εcl >>1, то весь свет поглощается и скорость реакции определяется только величиной I 0, т. е. реакция имеет нулевой порядок по реагенту: w= const. I 0
 Кинетика фотохимических реакций описывается обычными дифференциальными уравнениями, выражающими закон действующих масс. Единственное отличие от обычных реакций с термическим возбуждением состоит в том, что скорость первичных фотохимических процессов не зависит от концентрации исходного вещества, а определяется только интенсивностью света.
Кинетика фотохимических реакций описывается обычными дифференциальными уравнениями, выражающими закон действующих масс. Единственное отличие от обычных реакций с термическим возбуждением состоит в том, что скорость первичных фотохимических процессов не зависит от концентрации исходного вещества, а определяется только интенсивностью света.


