Лек.7. Химическая кинетика.pptx
- Количество слайдов: 61
 ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
 Реакция взаимодействия оксида азота (II) с кислородом 2 N 0(г) + 02(г) = 2 N 02(г) G 0298 = - 150 к. Дж/моль проходит очень быстро при комнатной температуре. А реакция 2 H 2(г) + О 2(г) = 2 Н 2 О(г) G 0298 = - 476 к. Дж/моль характеризуется значительно большим уменьшением энергии Гиббса, в обычных условиях не протекает, но в присутствии катализатора при t =7000 С практически протекает мгновенно (со взрывом).
Реакция взаимодействия оксида азота (II) с кислородом 2 N 0(г) + 02(г) = 2 N 02(г) G 0298 = - 150 к. Дж/моль проходит очень быстро при комнатной температуре. А реакция 2 H 2(г) + О 2(г) = 2 Н 2 О(г) G 0298 = - 476 к. Дж/моль характеризуется значительно большим уменьшением энергии Гиббса, в обычных условиях не протекает, но в присутствии катализатора при t =7000 С практически протекает мгновенно (со взрывом).
 Таким образом, для полного описания химической реакции необходимо знать также закономерность ее протекания во времени, т. е. ее скорость и механизм.
Таким образом, для полного описания химической реакции необходимо знать также закономерность ее протекания во времени, т. е. ее скорость и механизм.
 Кинетика – наука о скоростях химических реакций. Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице поверхности (гетерогенные).
Кинетика – наука о скоростях химических реакций. Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице поверхности (гетерогенные).
 Реакции, в которых вещества соединяются в различных фазах гетерогенные, а реакции, в которых взаимодействующие вещества находятся в одной фазе, называются гомогенными. Скорость гомогенной химической реакции по мере израсходования исходных веществ уменьшается.
Реакции, в которых вещества соединяются в различных фазах гетерогенные, а реакции, в которых взаимодействующие вещества находятся в одной фазе, называются гомогенными. Скорость гомогенной химической реакции по мере израсходования исходных веществ уменьшается.
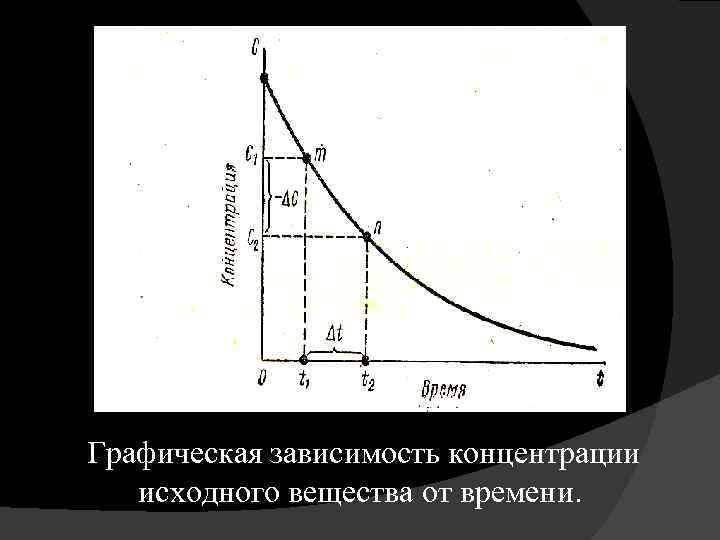 Графическая зависимость концентрации исходного вещества от времени.
Графическая зависимость концентрации исходного вещества от времени.
 Выражение для определения средней скорости химической реакции имеет вид: υ = (С 1 – C 2) / τ С 1 – начальная концентрация вещества, моль/л; C 2 – конечная концентрация вещества, моль/л; τ – время реакции, сек; υ – средняя скорость химической реакции в этом промежутке времени, моль/л. с.
Выражение для определения средней скорости химической реакции имеет вид: υ = (С 1 – C 2) / τ С 1 – начальная концентрация вещества, моль/л; C 2 – конечная концентрация вещества, моль/л; τ – время реакции, сек; υ – средняя скорость химической реакции в этом промежутке времени, моль/л. с.
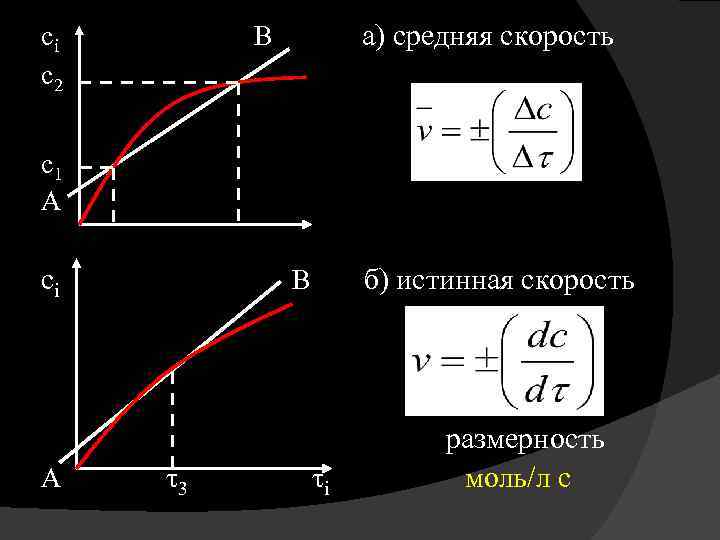
 Истинная скорость реакции в конкретный момент времени определяется как первая производная от концентрации С по времени τ. υ = - (d. С 1 / dτ)
Истинная скорость реакции в конкретный момент времени определяется как первая производная от концентрации С по времени τ. υ = - (d. С 1 / dτ)
 Если концентрация С убывает со временем, то значение производной d. С 1 / dτ отрицательно. Для того чтобы мгновенная скорость реакции была всегда положительной, перед значением производной необходимо поставить знак минус, т. е. – (d. С 1 / dτ).
Если концентрация С убывает со временем, то значение производной d. С 1 / dτ отрицательно. Для того чтобы мгновенная скорость реакции была всегда положительной, перед значением производной необходимо поставить знак минус, т. е. – (d. С 1 / dτ).
 сi с2 а) средняя скорость В с1 А сi А б) истинная скорость В τ3 τi размерность моль/л с
сi с2 а) средняя скорость В с1 А сi А б) истинная скорость В τ3 τi размерность моль/л с
 Факторы, влияющие на скорость химической реакции природа реагирующих веществ концентрация реагентов температура катализаторы дисперсность (для твердых веществ) кислотность среды (для реакции в растворах)
Факторы, влияющие на скорость химической реакции природа реагирующих веществ концентрация реагентов температура катализаторы дисперсность (для твердых веществ) кислотность среды (для реакции в растворах)
 Природа реагирующих веществ 2 NO + O 2 = 2 NO 2 идет при стандартных условиях. 2 CO + O 2 = 2 CO 2 не реагирует при стандартных условиях, хотя чисто внешне уравнения данных реакций похожи, но природа веществ различна.
Природа реагирующих веществ 2 NO + O 2 = 2 NO 2 идет при стандартных условиях. 2 CO + O 2 = 2 CO 2 не реагирует при стандартных условиях, хотя чисто внешне уравнения данных реакций похожи, но природа веществ различна.
 Концентрация реагентов Необходимой предпосылкой взаимодействия веществ является столкновение молекул. Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Концентрация реагентов Необходимой предпосылкой взаимодействия веществ является столкновение молекул. Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
 Для реакции a. А + b. В с АВ скорость прямой реакции определяется уравнением k – константа скорости химической реакции Физический смысл константы скорости: она равна скорости химической реакции, когда СА=1 моль/л и СВ=1 моль/л.
Для реакции a. А + b. В с АВ скорость прямой реакции определяется уравнением k – константа скорости химической реакции Физический смысл константы скорости: она равна скорости химической реакции, когда СА=1 моль/л и СВ=1 моль/л.
 Константа скорости зависит только от природы реагирующих веществ, температуры и присутствия катализаторов, но не зависит от концентраций реагирующих веществ. Для реакций, в которых участвуют несколько молекул, концентрации берутся с соответствующим показателем степени (при условии, что реакция не происходит в две и более стадии).
Константа скорости зависит только от природы реагирующих веществ, температуры и присутствия катализаторов, но не зависит от концентраций реагирующих веществ. Для реакций, в которых участвуют несколько молекул, концентрации берутся с соответствующим показателем степени (при условии, что реакция не происходит в две и более стадии).
 Закон действующих масс справедлив только для взаимодействий, протекающих в газах или в разбавленных растворах (гомогенные системы). 2 NO(г) + O 2(г) = 2 NO 2(г) υ = k [NO]2·[O 2] В реакциях с участием твердых веществ (гетерогенные системы) скорость зависит от поверхности соприкосновения между реагирующими веществами и не зависит от массы твердого вещества: С(тв. ) + О 2 (г. ) = СО 2 (г. ) υ = k [O 2]
Закон действующих масс справедлив только для взаимодействий, протекающих в газах или в разбавленных растворах (гомогенные системы). 2 NO(г) + O 2(г) = 2 NO 2(г) υ = k [NO]2·[O 2] В реакциях с участием твердых веществ (гетерогенные системы) скорость зависит от поверхности соприкосновения между реагирующими веществами и не зависит от массы твердого вещества: С(тв. ) + О 2 (г. ) = СО 2 (г. ) υ = k [O 2]
 Молекулярность и порядок реакций В элементарном акте реакции могут принимать участие одна, две или три молекулы. По этому признаку различают реакции: мономолекулярные - бимолекулярные - тримолекулярные. - Молекулярность реакции - число молекул, одновременно вступающих во взаимодействие.
Молекулярность и порядок реакций В элементарном акте реакции могут принимать участие одна, две или три молекулы. По этому признаку различают реакции: мономолекулярные - бимолекулярные - тримолекулярные. - Молекулярность реакции - число молекул, одновременно вступающих во взаимодействие.
 Мономолекулярная реакция –в элементарном акте участвует одна молекула: например, диссоциация молекулярного иода на атомы I 2 = 2 I Кинетическое уравнение имеет вид:
Мономолекулярная реакция –в элементарном акте участвует одна молекула: например, диссоциация молекулярного иода на атомы I 2 = 2 I Кинетическое уравнение имеет вид:
 Бимолекулярные реакции –в элементарном акте участвуют 2 молекулы одного или различного вида. Например: I 2 + H 2 = 2 H I Кинетическое уравнение имеет вид:
Бимолекулярные реакции –в элементарном акте участвуют 2 молекулы одного или различного вида. Например: I 2 + H 2 = 2 H I Кинетическое уравнение имеет вид:
 Тримолекулярные реакции – в элементарном акте участвуют 3 молекулы одного или различных видов; такие реакции редки, так как вероятность одновременного соударения многих частиц очень мала. Например: 2 NO + H 2 = N 2 O + H 2 O Кинетическое уравнение имеет вид:
Тримолекулярные реакции – в элементарном акте участвуют 3 молекулы одного или различных видов; такие реакции редки, так как вероятность одновременного соударения многих частиц очень мала. Например: 2 NO + H 2 = N 2 O + H 2 O Кинетическое уравнение имеет вид:
 Характер зависимости скорости реакции от концентрации реагирующих веществ определяется ее порядком, равным сумме показателей степеней в уравнении закона действующих масс. Порядок реакции 2 NO(г) + O 2(г) = 2 NO 2(г) равен 2 + 1 =3. Часто порядка реакции не совпадает с суммой коэффициентов. Это обусловлено тем, что рассматриваемая реакция протекает в несколько стадий.
Характер зависимости скорости реакции от концентрации реагирующих веществ определяется ее порядком, равным сумме показателей степеней в уравнении закона действующих масс. Порядок реакции 2 NO(г) + O 2(г) = 2 NO 2(г) равен 2 + 1 =3. Часто порядка реакции не совпадает с суммой коэффициентов. Это обусловлено тем, что рассматриваемая реакция протекает в несколько стадий.
 Пример: 2 N 2 O 5(г) = 4 NO 2(г) + O 2(г) Порядок этой реакции равен единице и выражение скорости реакции записывается как υ = k [N 2 O 5 ], а не υ = k [N 2 O 5 ]2 , т. к. реакция идет по стадиям: I стадия - N 2 O 5(г) = N 2 O 3(г) + O 2(г) II стадия - N 2 O 5(г) + N 2 O 3(г) = 4 NO 2(г) Общая скорость таких реакций определяется скоростью более медленной стадии. В этом примере – скоростью первой стадии.
Пример: 2 N 2 O 5(г) = 4 NO 2(г) + O 2(г) Порядок этой реакции равен единице и выражение скорости реакции записывается как υ = k [N 2 O 5 ], а не υ = k [N 2 O 5 ]2 , т. к. реакция идет по стадиям: I стадия - N 2 O 5(г) = N 2 O 3(г) + O 2(г) II стадия - N 2 O 5(г) + N 2 O 3(г) = 4 NO 2(г) Общая скорость таких реакций определяется скоростью более медленной стадии. В этом примере – скоростью первой стадии.
 Зависимость скорости реакции от температуры. Энергия активации В большинстве случаев нагревание резко повышает скорость химической реакции. При повышении температуры увеличивается скорость движения молекул, возрастает число столкновений между ними и, соответственно этому доля активных молекул. Зависимость скорости реакции от температуры определяется правилом Вант. Гоффа (1884 г):
Зависимость скорости реакции от температуры. Энергия активации В большинстве случаев нагревание резко повышает скорость химической реакции. При повышении температуры увеличивается скорость движения молекул, возрастает число столкновений между ними и, соответственно этому доля активных молекул. Зависимость скорости реакции от температуры определяется правилом Вант. Гоффа (1884 г):
 где: υt 1 - первоначальная скорость химической реакции при температуре t 1; υt 2 - скорость химической реакции при температуре t 2;
где: υt 1 - первоначальная скорость химической реакции при температуре t 1; υt 2 - скорость химической реакции при температуре t 2;
 γ – температурный коэффициент скорости реакции (от 2 до 4 ) – это число, показывающее во сколько именно раз увеличивается скорость химической реакции при повышении температуры на 100 С ( это отношение константы скорости при температуре t + 10 к константе при температуре t). γ = k t+10 / k t
γ – температурный коэффициент скорости реакции (от 2 до 4 ) – это число, показывающее во сколько именно раз увеличивается скорость химической реакции при повышении температуры на 100 С ( это отношение константы скорости при температуре t + 10 к константе при температуре t). γ = k t+10 / k t
 Химическое взаимодействие молекул происходит лишь в том случае, если молекулы приближаются на расстояние, при котором происходит перераспределение электронной плотности и возникновение новых химических связей. Cталкивающиеся молекулы должны обладать энергией, необходимой для преодоления сил отталкивания (энергии барьера) между их электронными оболочками. Частицы, обладающие такой энергией, называют активными.
Химическое взаимодействие молекул происходит лишь в том случае, если молекулы приближаются на расстояние, при котором происходит перераспределение электронной плотности и возникновение новых химических связей. Cталкивающиеся молекулы должны обладать энергией, необходимой для преодоления сил отталкивания (энергии барьера) между их электронными оболочками. Частицы, обладающие такой энергией, называют активными.
 Избыточная (по сравнению со средней) энергия, которой должна обладать молекула для того, чтобы она могла вступить в химическое взаимодействие, называется энергией активации (Еа). Зависимость скорости реакции от температуры и энергии активации определяется уравнением Аррениуса для вычисления константы скорости химической реакции:
Избыточная (по сравнению со средней) энергия, которой должна обладать молекула для того, чтобы она могла вступить в химическое взаимодействие, называется энергией активации (Еа). Зависимость скорости реакции от температуры и энергии активации определяется уравнением Аррениуса для вычисления константы скорости химической реакции:
 где А –множитель, связанный с вероятностью и числом столкновений молекул; еxp – основание натурального логарифма; Еа – энергия активации; R – универсальная газовая постоянная; Т – абсолютная температура.
где А –множитель, связанный с вероятностью и числом столкновений молекул; еxp – основание натурального логарифма; Еа – энергия активации; R – универсальная газовая постоянная; Т – абсолютная температура.
 Общее число соударений молекул в единицу времени обозначается параметром Z. Вероятность надлежащей ориентации молекул при соударении характеризуется энтропией активации ΔSa. Зависимость скорости реакции от температуры, энергии активации и энтропии активации определяется следующим выражением:
Общее число соударений молекул в единицу времени обозначается параметром Z. Вероятность надлежащей ориентации молекул при соударении характеризуется энтропией активации ΔSa. Зависимость скорости реакции от температуры, энергии активации и энтропии активации определяется следующим выражением:
 где еxp – основание натурального логарифма; Еа – энергия активации; R – универсальная газовая постоянная; Т – абсолютная температура; ΔSa – энтропия активации; Z - число соударений молекул в единицу времени.
где еxp – основание натурального логарифма; Еа – энергия активации; R – универсальная газовая постоянная; Т – абсолютная температура; ΔSa – энтропия активации; Z - число соударений молекул в единицу времени.
 Из уравнения Аррениуса видно, что чем больше энергия активации, тем меньше константа скорости реакции, т. е. тем меньше скорость реакции. В логарифмической форме ln К = ln A – Eа/RT
Из уравнения Аррениуса видно, что чем больше энергия активации, тем меньше константа скорости реакции, т. е. тем меньше скорость реакции. В логарифмической форме ln К = ln A – Eа/RT
 Если известны константы скорости КT 1 и КT 2 при двух температурах Т 1 и Т 2 можно найти значение Еа из уравнения Аррениуса в логарифмической форме: ln КT 1 = ln. A – Eа/RT 1 ln КT 2 = ln. A - Eа/RT 2 (1) (2)
Если известны константы скорости КT 1 и КT 2 при двух температурах Т 1 и Т 2 можно найти значение Еа из уравнения Аррениуса в логарифмической форме: ln КT 1 = ln. A – Eа/RT 1 ln КT 2 = ln. A - Eа/RT 2 (1) (2)
 Из уравнения 2 вычитаем уравнение 1: ln КT 2 – ln КT 1 = -Eа / RT 2 + Eа / RT 1 ln КT 2 / КT 1 = Eа / R (1/T 1 - 1/T 2) Из уравнения Аррениуса видно, что поскольку Т входит в показатель степени, скорость химической реакции очень чувствительна к изменению температуры.
Из уравнения 2 вычитаем уравнение 1: ln КT 2 – ln КT 1 = -Eа / RT 2 + Eа / RT 1 ln КT 2 / КT 1 = Eа / R (1/T 1 - 1/T 2) Из уравнения Аррениуса видно, что поскольку Т входит в показатель степени, скорость химической реакции очень чувствительна к изменению температуры.
 Энергия активации – наименьшая избыточная энергия молекул, по сравнению со средней величиной при данной Т, достаточная для совершения реакции:
Энергия активации – наименьшая избыточная энергия молекул, по сравнению со средней величиной при данной Т, достаточная для совершения реакции:
 Ea < 40 (к. Дж/моль) - «быстрые» реакции (ионные реакции в растворах) 40 < Ea > 100 (к. Дж/моль) - реакции с измеряемой скоростью 100 < Ea> 150 (к. Дж/моль) - «медленные» реакции (синтез NH 3 при обычных температурах) Ea > 150 (к. Дж/моль) - реакции в обычных условиях не идут
Ea < 40 (к. Дж/моль) - «быстрые» реакции (ионные реакции в растворах) 40 < Ea > 100 (к. Дж/моль) - реакции с измеряемой скоростью 100 < Ea> 150 (к. Дж/моль) - «медленные» реакции (синтез NH 3 при обычных температурах) Ea > 150 (к. Дж/моль) - реакции в обычных условиях не идут
 Зависимость скорости реакции от катализатора Катализаторы – вещества, изменяющие скорость химической реакции, но сами остающиеся в конце реакции химически неизменными. Изменение скорости химической реакции под действием катализатора называется катализом. Катализаторы, увеличивающие скорость химической реакции, называются положительными, а катализаторы, уменьшающие скорость реакции – отрицательными, или ингибиторами.
Зависимость скорости реакции от катализатора Катализаторы – вещества, изменяющие скорость химической реакции, но сами остающиеся в конце реакции химически неизменными. Изменение скорости химической реакции под действием катализатора называется катализом. Катализаторы, увеличивающие скорость химической реакции, называются положительными, а катализаторы, уменьшающие скорость реакции – отрицательными, или ингибиторами.
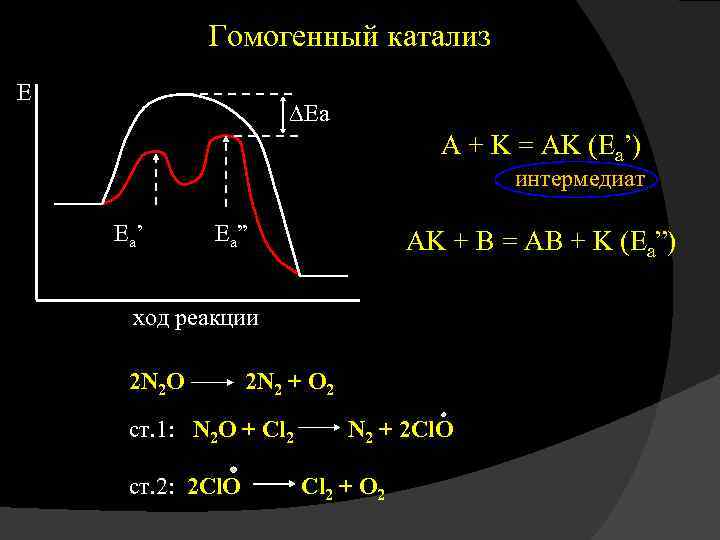
 Существует два вида катализа: гомогенный и гетерогенный. Гомогенный катализ – процесс, при котором катализатор и реагирующие вещества находятся в одной фазе. Гетерогенный катализ – процесс, при котором катализатор и реагирующие вещества находятся в разных фазах. Сущность механизма действия катализатора при гомогенном катализе заключается в образовании промежуточного реакционноспособного соединения.
Существует два вида катализа: гомогенный и гетерогенный. Гомогенный катализ – процесс, при котором катализатор и реагирующие вещества находятся в одной фазе. Гетерогенный катализ – процесс, при котором катализатор и реагирующие вещества находятся в разных фазах. Сущность механизма действия катализатора при гомогенном катализе заключается в образовании промежуточного реакционноспособного соединения.
 Гомогенный катализ E Ea A + K = AK (Ea’) интермедиат E a’ E a” AK + B = AB + K (Ea”) ход реакции 2 N 2 O 2 N 2 + O 2 ст. 1: N 2 O + Cl 2 N 2 + 2 Cl. O ст. 2: 2 Cl. O Cl 2 + O 2
Гомогенный катализ E Ea A + K = AK (Ea’) интермедиат E a’ E a” AK + B = AB + K (Ea”) ход реакции 2 N 2 O 2 N 2 + O 2 ст. 1: N 2 O + Cl 2 N 2 + 2 Cl. O ст. 2: 2 Cl. O Cl 2 + O 2
 В присутствии катализатора реакция протекает в две стадии: I стадия: А + К = АК II стадия: АК + В = АВ + К АК – промежуточное соединение. Еa’ – энергия активации без участия катализатора; Еa” – энергия активации при образовании промежуточного соединения; При участии катализатора в химической реакции энергия активации уменьшается. Вследствие того, что энергия активации одной стадии заменяется меньшими энергиями Еa’ и Еa” двух последних стадий, скорость химической реакции возрастает.
В присутствии катализатора реакция протекает в две стадии: I стадия: А + К = АК II стадия: АК + В = АВ + К АК – промежуточное соединение. Еa’ – энергия активации без участия катализатора; Еa” – энергия активации при образовании промежуточного соединения; При участии катализатора в химической реакции энергия активации уменьшается. Вследствие того, что энергия активации одной стадии заменяется меньшими энергиями Еa’ и Еa” двух последних стадий, скорость химической реакции возрастает.
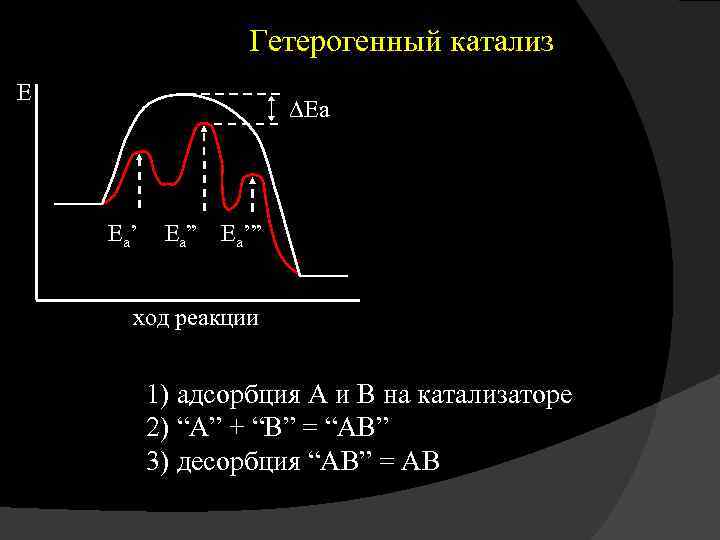 Гетерогенный катализ E Ea E a’ Ea” Ea’” ход реакции 1) адсорбция А и В на катализаторе 2) “A” + “B” = “AB” 3) десорбция “AB” = AB
Гетерогенный катализ E Ea E a’ Ea” Ea’” ход реакции 1) адсорбция А и В на катализаторе 2) “A” + “B” = “AB” 3) десорбция “AB” = AB
 Механизм гетерогенного катализа объясняется теорией активированной адсорбции. Адсорбция – свойство вещества поглощать на своей поверхности другие вещества. На поверхности катализатора адсорбируются реагирующие вещества (за счет того, что поверхность катализатора неоднородна и на ней имеются так называемые активные центры).
Механизм гетерогенного катализа объясняется теорией активированной адсорбции. Адсорбция – свойство вещества поглощать на своей поверхности другие вещества. На поверхности катализатора адсорбируются реагирующие вещества (за счет того, что поверхность катализатора неоднородна и на ней имеются так называемые активные центры).
 Процесс протекает в несколько стадий, и промежуточными являются поверхностные соединения. Это приводит к снижению энергии активации. В общем случае катализатор ведет реакцию по другому пути, чем тот, по которому реакция протекает без катализатора. Катализатор всегда измельчают и наносят на инертный носитель с развитой поверхностью (пемза, асбест). Например, синтез аммиака на железном катализаторе.
Процесс протекает в несколько стадий, и промежуточными являются поверхностные соединения. Это приводит к снижению энергии активации. В общем случае катализатор ведет реакцию по другому пути, чем тот, по которому реакция протекает без катализатора. Катализатор всегда измельчают и наносят на инертный носитель с развитой поверхностью (пемза, асбест). Например, синтез аммиака на железном катализаторе.
 Автокатализ 2 Mn. O 4 - + 5 H 2 C 2 O 4 +6 H+ 2 Mn 2+ + 10 CO 2 + 8 H 2 O I Mn. O 4 - + 4 Mn 2+ + 8 H+ 5 Mn 3+ + 4 H 2 O II H 2 C 2 O 4 + 2 Mn 3+ 2 CO 2 + 2 Mn 2+ + H 2 O υ1 < υ2
Автокатализ 2 Mn. O 4 - + 5 H 2 C 2 O 4 +6 H+ 2 Mn 2+ + 10 CO 2 + 8 H 2 O I Mn. O 4 - + 4 Mn 2+ + 8 H+ 5 Mn 3+ + 4 H 2 O II H 2 C 2 O 4 + 2 Mn 3+ 2 CO 2 + 2 Mn 2+ + H 2 O υ1 < υ2
 ОБРАТИМОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. ПОНЯТИЕ О ХИМИЧЕСКОМ РАВНОВЕСИИ Химически необратимые реакции идут до полного расхода одного из реагирующих веществ: NH 4 NO 3 → 2 H 2 O + N 2 O Химически обратимые реакции протекают одновременно как в прямом, так и в обратном направлении. Примером обратимой реакции служит взаимодействие водорода с иодом:
ОБРАТИМОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. ПОНЯТИЕ О ХИМИЧЕСКОМ РАВНОВЕСИИ Химически необратимые реакции идут до полного расхода одного из реагирующих веществ: NH 4 NO 3 → 2 H 2 O + N 2 O Химически обратимые реакции протекают одновременно как в прямом, так и в обратном направлении. Примером обратимой реакции служит взаимодействие водорода с иодом:
 H 2 + I 2 = HI При температуре около 500 o. С прямая и обратная реакции идут со значительными скоростями. υ1 = k 1 · [H 2]· [I 2] υ2 = k 1 · [HI]2 Если υ1 = υ2, то в системе устанавливается химическое равновесие. Химическое равновесие – такое динамическое состояние системы, при котором скорости прямой и обратной реакций равны, поэтому концентрации всех веществ остаются неизменными.
H 2 + I 2 = HI При температуре около 500 o. С прямая и обратная реакции идут со значительными скоростями. υ1 = k 1 · [H 2]· [I 2] υ2 = k 1 · [HI]2 Если υ1 = υ2, то в системе устанавливается химическое равновесие. Химическое равновесие – такое динамическое состояние системы, при котором скорости прямой и обратной реакций равны, поэтому концентрации всех веществ остаются неизменными.
 Признаки химического равновесия: - состояние системы остается неизменным во времени при отсутствии внешних воздействий; - состояние системы изменяется под влиянием внешних воздействий, сколь малы бы они ни были; - состояние системы не зависит от того, с какой стороны она подходит к равновесию.
Признаки химического равновесия: - состояние системы остается неизменным во времени при отсутствии внешних воздействий; - состояние системы изменяется под влиянием внешних воздействий, сколь малы бы они ни были; - состояние системы не зависит от того, с какой стороны она подходит к равновесию.
![k 1 · [H 2]· [I 2] = k 1 · [HI]2 К - k 1 · [H 2]· [I 2] = k 1 · [HI]2 К -](https://present5.com/presentation/-76516864_340768758/image-47.jpg) k 1 · [H 2]· [I 2] = k 1 · [HI]2 К - константа равновесия (отношение констант скоростей прямой и обратной реакций). В общем случае для обратимой реакции, выражаемой уравнением: n. A + m. B ↔ p. C + q. D выражение константы равновесия можно записать:
k 1 · [H 2]· [I 2] = k 1 · [HI]2 К - константа равновесия (отношение констант скоростей прямой и обратной реакций). В общем случае для обратимой реакции, выражаемой уравнением: n. A + m. B ↔ p. C + q. D выражение константы равновесия можно записать:
 Константа равновесия изменяется с изменением температуры. При постоянной температуре константа равновесия не зависит ни от концентраций веществ, ни от объема. Если реакция протекает в гетерогенной системе, то концентрации веществ, образующих твердую фазу, в уравнение не вводятся, т. е. скорость реакции в этом случае зависит только от величины поверхности соприкосновения фаз, но не зависит от массы твердой фазы.
Константа равновесия изменяется с изменением температуры. При постоянной температуре константа равновесия не зависит ни от концентраций веществ, ни от объема. Если реакция протекает в гетерогенной системе, то концентрации веществ, образующих твердую фазу, в уравнение не вводятся, т. е. скорость реакции в этом случае зависит только от величины поверхности соприкосновения фаз, но не зависит от массы твердой фазы.
 Когда реакция происходит в газовой среде, концентрации газов можно заменить парциальными давлениями. Константа равновесия, выраженная через давление – Кр. В общем случае для обратимой реакции, выражаемой уравнением: a. A + b. B ↔ c. C + d. D выражение константы равновесия можно записать:
Когда реакция происходит в газовой среде, концентрации газов можно заменить парциальными давлениями. Константа равновесия, выраженная через давление – Кр. В общем случае для обратимой реакции, выражаемой уравнением: a. A + b. B ↔ c. C + d. D выражение константы равновесия можно записать:
 Взаимосвязь между Кс и Кр определяется уравнением: Kp = Kc · (RT)∆n где Δn – происходящее в данной реакции изменение числа молекул газообразных веществ.
Взаимосвязь между Кс и Кр определяется уравнением: Kp = Kc · (RT)∆n где Δn – происходящее в данной реакции изменение числа молекул газообразных веществ.
 Смещение химического равновесия. Принцип Ле-Шателье Изменение температуры реакции, концентраций реагентов, давления в системе (только для газов) приводят к нарушению равенства , а значит, к нарушению состояния равновесия в системе. Через некоторое время равенство скоростей прямой и обратной реакций снова восстанавливается. Однако, равновесные концентрации в новых условиях реакции принимают новые значения.
Смещение химического равновесия. Принцип Ле-Шателье Изменение температуры реакции, концентраций реагентов, давления в системе (только для газов) приводят к нарушению равенства , а значит, к нарушению состояния равновесия в системе. Через некоторое время равенство скоростей прямой и обратной реакций снова восстанавливается. Однако, равновесные концентрации в новых условиях реакции принимают новые значения.
 Переход системы из одного равновесного состояния в другое называется смещением равновесия. Смещение равновесия определяется принципом Ле-Шателье: - если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то равновесие смещается в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия.
Переход системы из одного равновесного состояния в другое называется смещением равновесия. Смещение равновесия определяется принципом Ле-Шателье: - если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то равновесие смещается в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия.
 Влияние концентраций реагирующих веществ на состояние равновесия 2 SO 2 +O 2 ↔ 2 SO 3 Увеличение концентрации [SO 2], или [O 2] вызывает сдвиг равновесия вправо, а [SO 2] – влево.
Влияние концентраций реагирующих веществ на состояние равновесия 2 SO 2 +O 2 ↔ 2 SO 3 Увеличение концентрации [SO 2], или [O 2] вызывает сдвиг равновесия вправо, а [SO 2] – влево.
 Влияние давления на состояние химического равновесия Давление оказывает существенное влияние только на газообразные системы. При увеличении давления повышаются концентрации реагирующих веществ, а значит, и скорость химической реакции. При взаимодействии газообразных веществ можно представить три случая.
Влияние давления на состояние химического равновесия Давление оказывает существенное влияние только на газообразные системы. При увеличении давления повышаются концентрации реагирующих веществ, а значит, и скорость химической реакции. При взаимодействии газообразных веществ можно представить три случая.
 1. Суммарное число молей исходных веществ равняется суммарному числу молей продуктов реакции. N 2 + O 2 ↔ 2 NO 2 моля → 2=2 Если увеличить давление в системе в два раза, то, соответственно, объем уменьшится в два раза, а концентрации газов увеличатся в два раза. Следовательно, если объемы исходных и конечных продуктов реакции равны, то изменение давления не нарушает состояние химического равновесия в системе.
1. Суммарное число молей исходных веществ равняется суммарному числу молей продуктов реакции. N 2 + O 2 ↔ 2 NO 2 моля → 2=2 Если увеличить давление в системе в два раза, то, соответственно, объем уменьшится в два раза, а концентрации газов увеличатся в два раза. Следовательно, если объемы исходных и конечных продуктов реакции равны, то изменение давления не нарушает состояние химического равновесия в системе.
 2. Суммарное число молей исходных веществ больше, чем суммарное число молей продуктов реакции. N 2 + 3 Н 2 ↔ 2 NН 3 4 моля 2 моля → 4>2 В этом случае суммарные объемы газов, вступающих в реакцию, больше суммарных объемов газообразных продуктов реакции. Таким образом, эта реакция протекает с уменьшением объема. При повышении давления в системе равновесие смещается в сторону меньшего числа молей, т. е. в сторону образования аммиака.
2. Суммарное число молей исходных веществ больше, чем суммарное число молей продуктов реакции. N 2 + 3 Н 2 ↔ 2 NН 3 4 моля 2 моля → 4>2 В этом случае суммарные объемы газов, вступающих в реакцию, больше суммарных объемов газообразных продуктов реакции. Таким образом, эта реакция протекает с уменьшением объема. При повышении давления в системе равновесие смещается в сторону меньшего числа молей, т. е. в сторону образования аммиака.
 3. Суммарное число молей исходных веществ меньше, чем суммарное число молей продуктов реакции. N 2 О 4 ↔ 2 NО 2 1 моль 2 моля → 1<2 Если при равновесии повысить давление в системе, то равновесие сместится в сторону обратной реакции, сопровождающейся понижением давления (понижение давления – равновесие сместится в сторону прямой реакции). Таким образом, повышение давления сдвигает равновесие в сторону меньших объемов, а понижение давления – в сторону больших объемов.
3. Суммарное число молей исходных веществ меньше, чем суммарное число молей продуктов реакции. N 2 О 4 ↔ 2 NО 2 1 моль 2 моля → 1<2 Если при равновесии повысить давление в системе, то равновесие сместится в сторону обратной реакции, сопровождающейся понижением давления (понижение давления – равновесие сместится в сторону прямой реакции). Таким образом, повышение давления сдвигает равновесие в сторону меньших объемов, а понижение давления – в сторону больших объемов.
 Влияние температуры на состояние равновесия В соответствии с принципом Ле-Шателье, повышение температуры в системе вызывает смещение химического равновесия в сторону эндотермического процесса, а уменьшение температуры – в сторону экзотермического процесса. Значит, необходимо знать тепловой эффект реакции. Чем больше ΔН, тем сильнее влияние температуры.
Влияние температуры на состояние равновесия В соответствии с принципом Ле-Шателье, повышение температуры в системе вызывает смещение химического равновесия в сторону эндотермического процесса, а уменьшение температуры – в сторону экзотермического процесса. Значит, необходимо знать тепловой эффект реакции. Чем больше ΔН, тем сильнее влияние температуры.
 СО(г) + 3 Н 2 О(г) ↔ Н 2(г) + СО 2(г) ΔН = - 98 к. Дж/моль Т. к. прямая реакция – экзотермическая, то при нагревании системы химическое равновесие будет смещаться влево, а при охлаждении – вправо. При величине ΔН, близкой к нулевому значению, температура практически не влияет на состояние химического равновесия.
СО(г) + 3 Н 2 О(г) ↔ Н 2(г) + СО 2(г) ΔН = - 98 к. Дж/моль Т. к. прямая реакция – экзотермическая, то при нагревании системы химическое равновесие будет смещаться влево, а при охлаждении – вправо. При величине ΔН, близкой к нулевому значению, температура практически не влияет на состояние химического равновесия.
 Пример: N 2 + 3 Н 2 ↔ 2 NН 3 ΔН = - 46 к. Дж/моль Образование аммиака сопровождается уменьшением числа молей, поэтому сместить равновесие вправо можно путем увеличения давления. Реакция экзотермическая – ее следует проводить при низких температурах.
Пример: N 2 + 3 Н 2 ↔ 2 NН 3 ΔН = - 46 к. Дж/моль Образование аммиака сопровождается уменьшением числа молей, поэтому сместить равновесие вправо можно путем увеличения давления. Реакция экзотермическая – ее следует проводить при низких температурах.
 Синтез аммиака проводят при повышенном давлении (примерно 30– 50 МПа) и при температуре 400 -500 о. С. Катализатор - губчатое железо или никель (катализатор не влияет на состояние химического равновесия в системе). Экономически выгоднее проводить технологический процесс с меньшим выходом продукта, но за более короткий срок.
Синтез аммиака проводят при повышенном давлении (примерно 30– 50 МПа) и при температуре 400 -500 о. С. Катализатор - губчатое железо или никель (катализатор не влияет на состояние химического равновесия в системе). Экономически выгоднее проводить технологический процесс с меньшим выходом продукта, но за более короткий срок.


