кинетика рмп,гиг,мгп.ppt
- Количество слайдов: 38
 Химическая кинетика и равновесие
Химическая кинетика и равновесие
 химическая кинетика • – наука о химическом процессе, его механизме и закономерностях протекания во времени.
химическая кинетика • – наука о химическом процессе, его механизме и закономерностях протекания во времени.
 Зачем изучают химическую кинетику? 3 Fe + 2 O 2 → Fe 3 O 4(к), ΔН = -1117 к. Дж/моль К счастью, в обычных условиях эта реакция идет очень медленно… N 2 + 3 H 2 → 2 NH 3 Скорость этой реакции нужно увеличивать. 2 KNO 3 + S + 3 C → K 2 S + 3 CO 2 + N 2 Кинетику этой и подобных реакций исследуют особенно тщательно! Демонстрация ролика 1
Зачем изучают химическую кинетику? 3 Fe + 2 O 2 → Fe 3 O 4(к), ΔН = -1117 к. Дж/моль К счастью, в обычных условиях эта реакция идет очень медленно… N 2 + 3 H 2 → 2 NH 3 Скорость этой реакции нужно увеличивать. 2 KNO 3 + S + 3 C → K 2 S + 3 CO 2 + N 2 Кинетику этой и подобных реакций исследуют особенно тщательно! Демонстрация ролика 1
 Основные понятия § Механизм реакции - последовательность всех элементарных стадий химической реакции § Элементарные стадии- ряд промежуточных стадий , через которые происходит превращение реагентов в продукты в большинстве химических реакций. § Молекулярность - число частиц, участвующих в элементарном химическом 4 акте (или элементарной стадии).
Основные понятия § Механизм реакции - последовательность всех элементарных стадий химической реакции § Элементарные стадии- ряд промежуточных стадий , через которые происходит превращение реагентов в продукты в большинстве химических реакций. § Молекулярность - число частиц, участвующих в элементарном химическом 4 акте (или элементарной стадии).
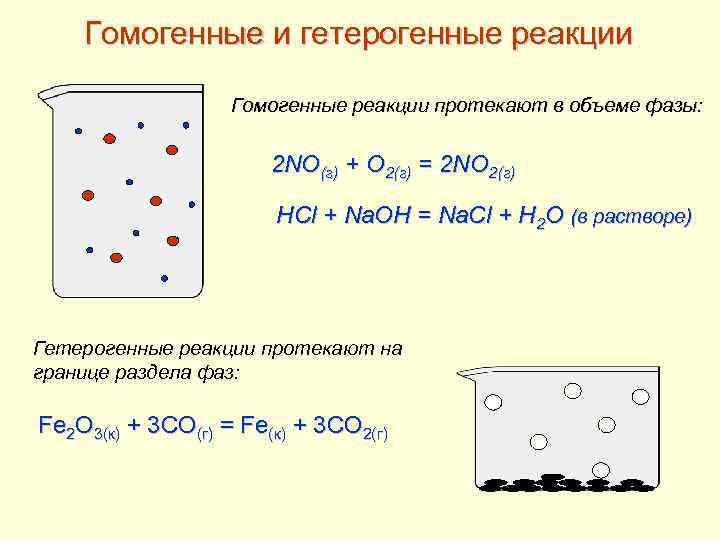 Гомогенные и гетерогенные реакции Гомогенные реакции протекают в объеме фазы: 2 NO(г) + O 2(г) = 2 NO 2(г) HCl + Na. OH = Na. Cl + H 2 O (в растворе) Гетерогенные реакции протекают на границе раздела фаз: Fe 2 O 3(к) + 3 CO(г) = Fe(к) + 3 CO 2(г)
Гомогенные и гетерогенные реакции Гомогенные реакции протекают в объеме фазы: 2 NO(г) + O 2(г) = 2 NO 2(г) HCl + Na. OH = Na. Cl + H 2 O (в растворе) Гетерогенные реакции протекают на границе раздела фаз: Fe 2 O 3(к) + 3 CO(г) = Fe(к) + 3 CO 2(г)
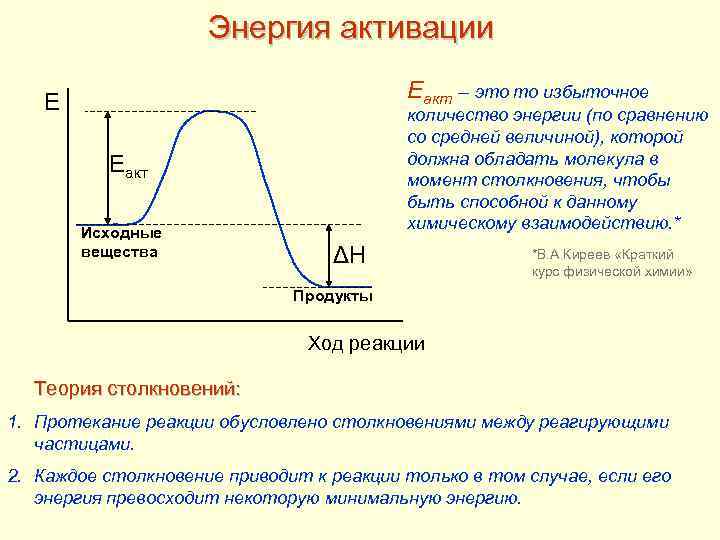 Энергия активации Еакт – это то избыточное E количество энергии (по сравнению со средней величиной), которой должна обладать молекула в момент столкновения, чтобы быть способной к данному химическому взаимодействию. * Еакт Исходные вещества ΔН *В. А. Киреев «Краткий курс физической химии» Продукты Ход реакции Теория столкновений: 1. Протекание реакции обусловлено столкновениями между реагирующими частицами. 2. Каждое столкновение приводит к реакции только в том случае, если его энергия превосходит некоторую минимальную энергию.
Энергия активации Еакт – это то избыточное E количество энергии (по сравнению со средней величиной), которой должна обладать молекула в момент столкновения, чтобы быть способной к данному химическому взаимодействию. * Еакт Исходные вещества ΔН *В. А. Киреев «Краткий курс физической химии» Продукты Ход реакции Теория столкновений: 1. Протекание реакции обусловлено столкновениями между реагирующими частицами. 2. Каждое столкновение приводит к реакции только в том случае, если его энергия превосходит некоторую минимальную энергию.
 Основные понятия o Скорость химической реакции – o изменение концентрации реагирующих веществ в единицу времени в единице реакционного пространства. Vср = (С 2 -С 1)/ (t 2 -t 1) = ΔС/Δt, V = d. С/dt, где С 1 и С 2 – концентрации вещества в момент времени t 1 и t 2. Знак используется для того, чтобы скорость реакции всегда была положительной. 7
Основные понятия o Скорость химической реакции – o изменение концентрации реагирующих веществ в единицу времени в единице реакционного пространства. Vср = (С 2 -С 1)/ (t 2 -t 1) = ΔС/Δt, V = d. С/dt, где С 1 и С 2 – концентрации вещества в момент времени t 1 и t 2. Знак используется для того, чтобы скорость реакции всегда была положительной. 7
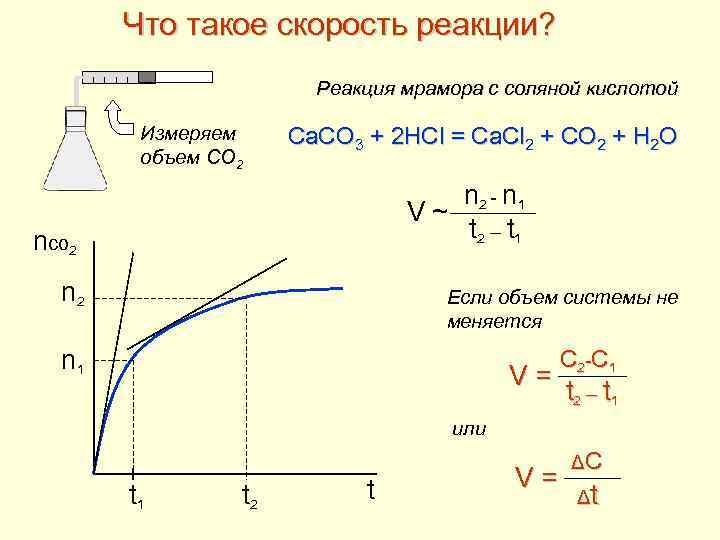 Что такое скорость реакции? Реакция мрамора с соляной кислотой Измеряем объем СО 2 Ca. CO 3 + 2 HCl = Ca. Cl 2 + CO 2 + H 2 O n 2 - n 1 V ~ t 2 – t 1 nco 2 n 2 Если объем системы не меняется n 1 V = C 2 -C 1 t 2 – t 1 или t 1 t 2 t V = ΔC Δt
Что такое скорость реакции? Реакция мрамора с соляной кислотой Измеряем объем СО 2 Ca. CO 3 + 2 HCl = Ca. Cl 2 + CO 2 + H 2 O n 2 - n 1 V ~ t 2 – t 1 nco 2 n 2 Если объем системы не меняется n 1 V = C 2 -C 1 t 2 – t 1 или t 1 t 2 t V = ΔC Δt
 Факторы, влияющие на скорость химических реакций Для гомогенных реакций • Природа реагентов • Их концентрация • Температура Для гетерогенных реакций + • Катализатор • Величина поверхности раздела между фазами • Скорость доставки реагентов к межфазной поверхности
Факторы, влияющие на скорость химических реакций Для гомогенных реакций • Природа реагентов • Их концентрация • Температура Для гетерогенных реакций + • Катализатор • Величина поверхности раздела между фазами • Скорость доставки реагентов к межфазной поверхности
 ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ ВЕЩЕСТВ (Закон действующих масс Гульдберга и Вааге) 1867 Скорость элементарной химической реакции пропорциональна концентрации реагирующих веществ в степени их стехиометрических коэффициентов. a. A + b. B = c. C + d. D v = k • Ca. A • Cb. B k – константа скорости химической реакции
ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ ВЕЩЕСТВ (Закон действующих масс Гульдберга и Вааге) 1867 Скорость элементарной химической реакции пропорциональна концентрации реагирующих веществ в степени их стехиометрических коэффициентов. a. A + b. B = c. C + d. D v = k • Ca. A • Cb. B k – константа скорости химической реакции
 Кинетическое уравнение v = k C(A)m. C(B)n • степенные показатели m и n обычно не совпадают со стехиометрическими коэффициентами • Порядок реакции - сумма всех показателей степеней m и n. (Порядок реакции по реагенту A равен m)
Кинетическое уравнение v = k C(A)m. C(B)n • степенные показатели m и n обычно не совпадают со стехиометрическими коэффициентами • Порядок реакции - сумма всех показателей степеней m и n. (Порядок реакции по реагенту A равен m)
 Физический смысл константы скорости Если С(А) = 1 моль/л С(В) = 1 моль/л, то v = k k - зависит от тех же факторов, что и скорость реакции ( кроме концентрации) Для сложной реакции, протекающей в несколько стадий, закон действующих масс применим к каждой стадии, но не применим к реакции в целом !!!
Физический смысл константы скорости Если С(А) = 1 моль/л С(В) = 1 моль/л, то v = k k - зависит от тех же факторов, что и скорость реакции ( кроме концентрации) Для сложной реакции, протекающей в несколько стадий, закон действующих масс применим к каждой стадии, но не применим к реакции в целом !!!
 С Закон действующих масс а. А + b. В = … Для многих реакций Например, для v = k (CA)a (CB)b 2 NO + O 2 = 2 NO 2 v = k (CNO)2 ∙ CO 2 Для гетерогенных реакций Cu. O(к) + H 2(г) = Cu(к) + H 2 O(г) v = k ∙CН 2
С Закон действующих масс а. А + b. В = … Для многих реакций Например, для v = k (CA)a (CB)b 2 NO + O 2 = 2 NO 2 v = k (CNO)2 ∙ CO 2 Для гетерогенных реакций Cu. O(к) + H 2(г) = Cu(к) + H 2 O(г) v = k ∙CН 2
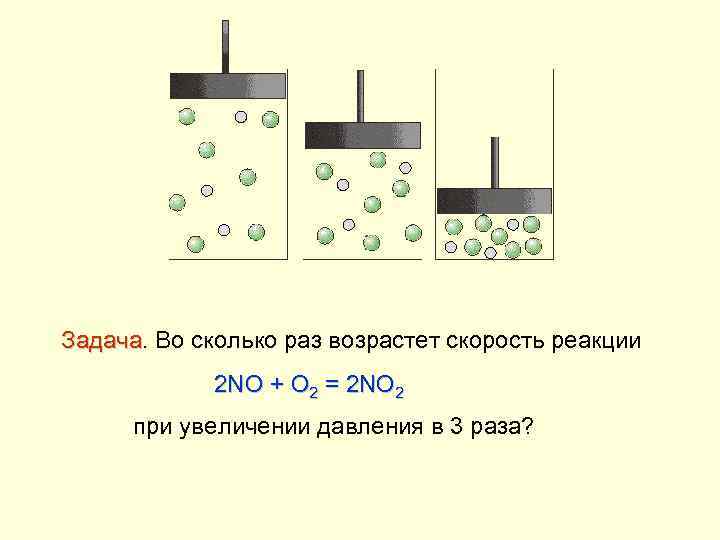 Задача. Во сколько раз возрастет скорость реакции Задача 2 NO + O 2 = 2 NO 2 при увеличении давления в 3 раза?
Задача. Во сколько раз возрастет скорость реакции Задача 2 NO + O 2 = 2 NO 2 при увеличении давления в 3 раза?
 T Правило Вант-Гоффа γ = 2 ÷ 4 γ- температурный коэффициент. При повышении Т доля активных молекул с Е > Еакт значительно возрастает
T Правило Вант-Гоффа γ = 2 ÷ 4 γ- температурный коэффициент. При повышении Т доля активных молекул с Е > Еакт значительно возрастает
 ПРИМЕР • γ = 2 • ΔТ = 100 о v. T 2 /v. T 1= 2100/10 = 210 = 1024
ПРИМЕР • γ = 2 • ΔТ = 100 о v. T 2 /v. T 1= 2100/10 = 210 = 1024
 ЭНЕРГИЯ АКТИВАЦИИ – это та избыточная энергия , которой должны обладать частицы, чтобы столкновение привело к химической реакции. ЕА к. Дж/моль – теплота образования 1 моль активных частиц ПРИМЕР. H + I → H…. I → H I H…. I H I переходное состояние активированный комплекс
ЭНЕРГИЯ АКТИВАЦИИ – это та избыточная энергия , которой должны обладать частицы, чтобы столкновение привело к химической реакции. ЕА к. Дж/моль – теплота образования 1 моль активных частиц ПРИМЕР. H + I → H…. I → H I H…. I H I переходное состояние активированный комплекс
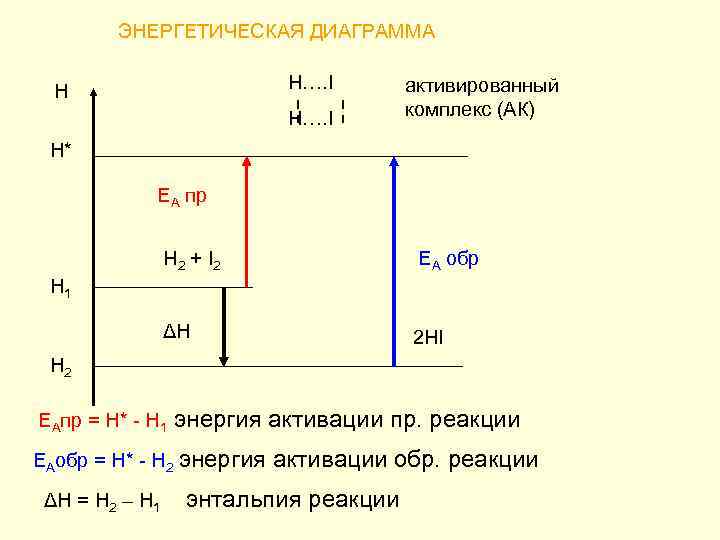 ЭНЕРГЕТИЧЕСКАЯ ДИАГРАММА H…. I Н H…. I активированный комплекс (АК) Н* ЕА пр H 2 + I 2 ЕА обр ΔН 2 HI Н 1 Н 2 EAпр = Н* - Н 1 энергия активации пр. реакции ЕАобр = Н* - Н 2 энергия активации обр. реакции ΔН = Н 2 – Н 1 энтальпия реакции
ЭНЕРГЕТИЧЕСКАЯ ДИАГРАММА H…. I Н H…. I активированный комплекс (АК) Н* ЕА пр H 2 + I 2 ЕА обр ΔН 2 HI Н 1 Н 2 EAпр = Н* - Н 1 энергия активации пр. реакции ЕАобр = Н* - Н 2 энергия активации обр. реакции ΔН = Н 2 – Н 1 энтальпия реакции
 УРАВНЕНИЕ АРРЕНИУСА k = ko • e - EA RT ko = Z • p предэкспоненциальный множитель Z – вероятностный фактор столкновений р – стерический фактор R = 8, 31 д. Ж/моль∙К е = lnk = - EA/RT + const EA < 40 к. Дж/моль – быстрые реакции 40 < ЕА < 120 к. Дж/моль – средние ЕА > 120 к. Дж/моль –очень медленные
УРАВНЕНИЕ АРРЕНИУСА k = ko • e - EA RT ko = Z • p предэкспоненциальный множитель Z – вероятностный фактор столкновений р – стерический фактор R = 8, 31 д. Ж/моль∙К е = lnk = - EA/RT + const EA < 40 к. Дж/моль – быстрые реакции 40 < ЕА < 120 к. Дж/моль – средние ЕА > 120 к. Дж/моль –очень медленные
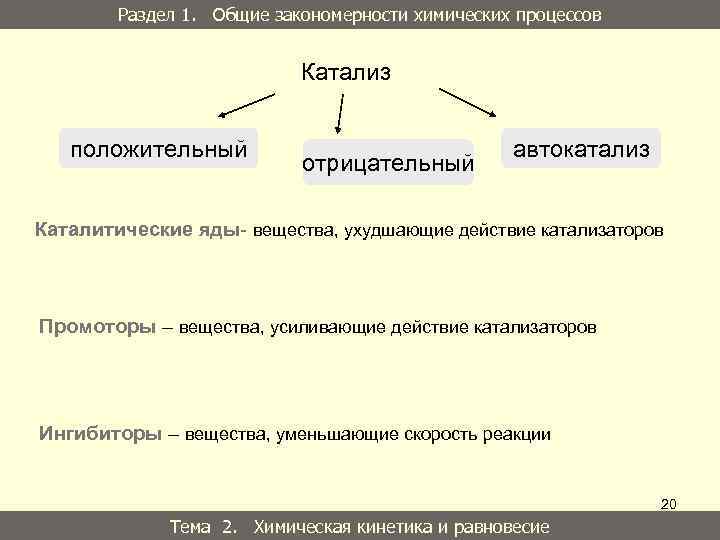 Раздел 1. Общие закономерности химических процессов Катализ положительный отрицательный автокатализ Каталитические яды- вещества, ухудшающие действие катализаторов Промоторы – вещества, усиливающие действие катализаторов Ингибиторы – вещества, уменьшающие скорость реакции 20 Тема 2. Химическая кинетика и равновесие
Раздел 1. Общие закономерности химических процессов Катализ положительный отрицательный автокатализ Каталитические яды- вещества, ухудшающие действие катализаторов Промоторы – вещества, усиливающие действие катализаторов Ингибиторы – вещества, уменьшающие скорость реакции 20 Тема 2. Химическая кинетика и равновесие
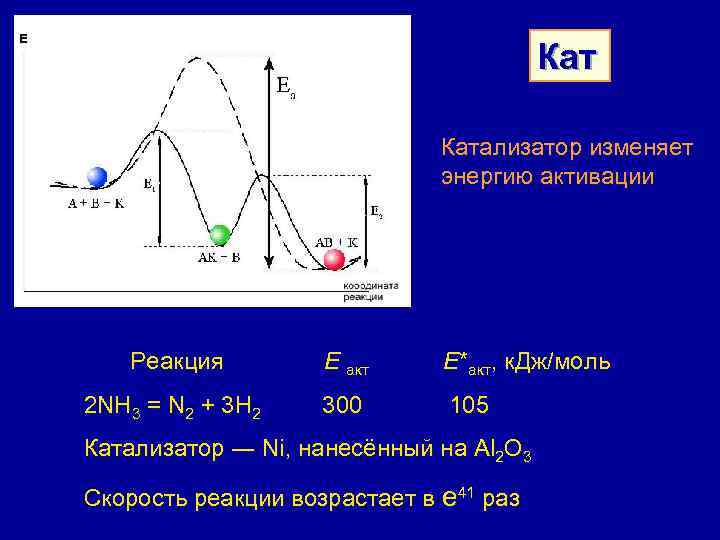 Кат Катализатор изменяет энергию активации Реакция Е акт Е*акт, к. Дж/моль 2 NH 3 = N 2 + 3 H 2 300 105 Катализатор ― Ni, нанесённый на Al 2 O 3 Скорость реакции возрастает в е 41 раз
Кат Катализатор изменяет энергию активации Реакция Е акт Е*акт, к. Дж/моль 2 NH 3 = N 2 + 3 H 2 300 105 Катализатор ― Ni, нанесённый на Al 2 O 3 Скорость реакции возрастает в е 41 раз
![Механизм гомогенного катализа А + К А…К (активированный комплекс) АК В +АК [В…АК]# (активированный Механизм гомогенного катализа А + К А…К (активированный комплекс) АК В +АК [В…АК]# (активированный](https://present5.com/presentation/3/87260991_327049586.pdf-img/87260991_327049586.pdf-22.jpg) Механизм гомогенного катализа А + К А…К (активированный комплекс) АК В +АК [В…АК]# (активированный комплекс) АВ + К А + В + К АВ + К. 22
Механизм гомогенного катализа А + К А…К (активированный комплекс) АК В +АК [В…АК]# (активированный комплекс) АВ + К А + В + К АВ + К. 22
 Стадии гетерогенного катализа • диффузия реагирующих веществ к • • поверхности катализатора адсорбция реагентов на поверхности катализатора реакция на поверхности катализатора десорбция продуктов реакции с поверхности катализатора диффузия продуктов от поверхности катализатора. 23
Стадии гетерогенного катализа • диффузия реагирующих веществ к • • поверхности катализатора адсорбция реагентов на поверхности катализатора реакция на поверхности катализатора десорбция продуктов реакции с поверхности катализатора диффузия продуктов от поверхности катализатора. 23
 Катализатор нейтрализации выхлопных газов автомобиля Керамический монолит, пронизанный множеством каналов, покрыт слоем Al 2 O 3, на который нанесены Rh Pd Pt
Катализатор нейтрализации выхлопных газов автомобиля Керамический монолит, пронизанный множеством каналов, покрыт слоем Al 2 O 3, на который нанесены Rh Pd Pt
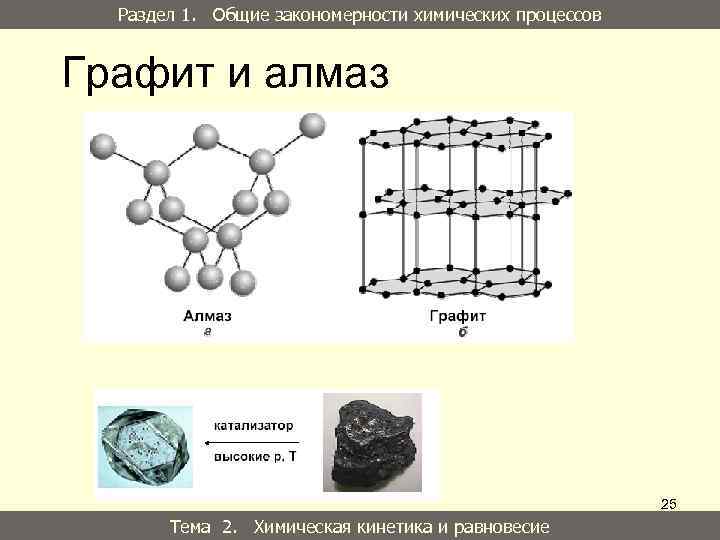 Раздел 1. Общие закономерности химических процессов Графит и алмаз 25 Тема 2. Химическая кинетика и равновесие
Раздел 1. Общие закономерности химических процессов Графит и алмаз 25 Тема 2. Химическая кинетика и равновесие
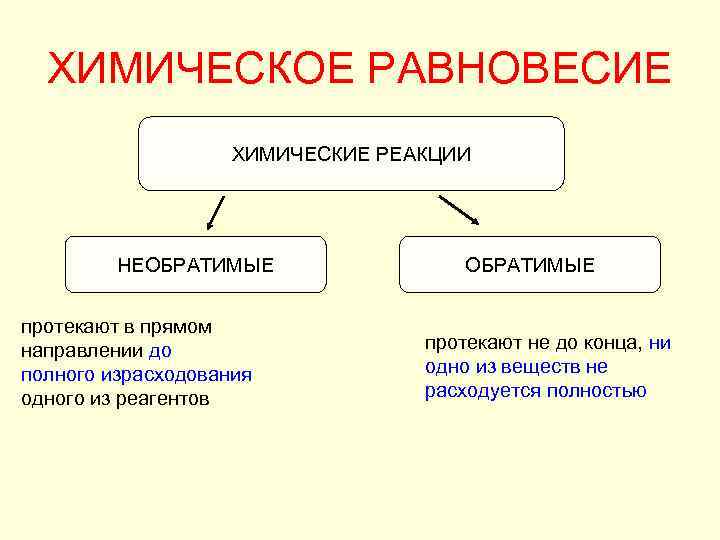 ХИМИЧЕСКОЕ РАВНОВЕСИЕ ХИМИЧЕСКИЕ РЕАКЦИИ НЕОБРАТИМЫЕ протекают в прямом направлении до полного израсходования одного из реагентов ОБРАТИМЫЕ протекают не до конца, ни одно из веществ не расходуется полностью
ХИМИЧЕСКОЕ РАВНОВЕСИЕ ХИМИЧЕСКИЕ РЕАКЦИИ НЕОБРАТИМЫЕ протекают в прямом направлении до полного израсходования одного из реагентов ОБРАТИМЫЕ протекают не до конца, ни одно из веществ не расходуется полностью
 Химическое равновесие T = const H 2 + Cl 2 = 2 HCl В состоянии равновесия H 2 + I 2(г) ⇄ 2 HI → ← v = v Три признака химического равновесия Динамический характер равновесия
Химическое равновесие T = const H 2 + Cl 2 = 2 HCl В состоянии равновесия H 2 + I 2(г) ⇄ 2 HI → ← v = v Три признака химического равновесия Динамический характер равновесия
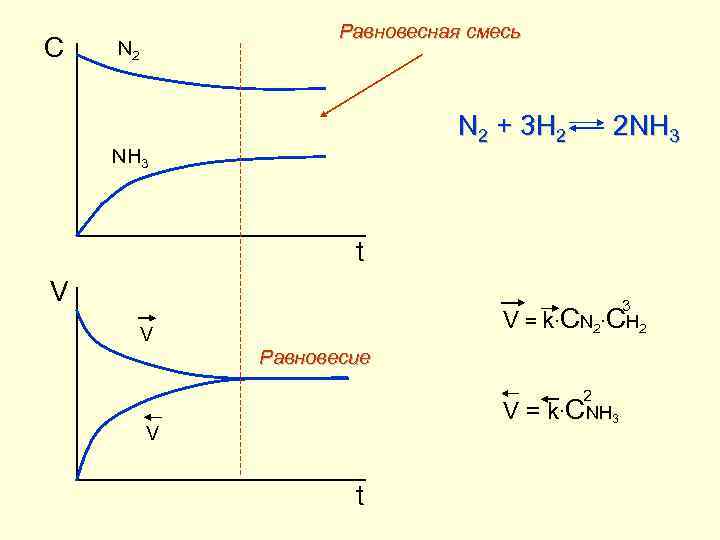 C Равновесная смесь N 2 + 3 H 2 2 NH 3 t V 3 V = k∙CN 2∙CH 2 V Равновесие 2 V = k∙CNH 3 V t
C Равновесная смесь N 2 + 3 H 2 2 NH 3 t V 3 V = k∙CN 2∙CH 2 V Равновесие 2 V = k∙CNH 3 V t
![Задача. Определите [N 2], [H 2] и [NH 3], если исходные Задача. концентрации N Задача. Определите [N 2], [H 2] и [NH 3], если исходные Задача. концентрации N](https://present5.com/presentation/3/87260991_327049586.pdf-img/87260991_327049586.pdf-29.jpg) Задача. Определите [N 2], [H 2] и [NH 3], если исходные Задача. концентрации N 2 и H 2 равны 10 и 30 моль/л соответственно, а выход реакции составляет 25%. N 2 + 3 H 2 2 NH 3 N 2 H 2 NH 3 10 30 0 Прореагировало/ образовалось 2, 5 7, 5 5 Равновесные конц. [ ] 7, 5 22, 5 5 Исходные конц. Сисх, моль/л
Задача. Определите [N 2], [H 2] и [NH 3], если исходные Задача. концентрации N 2 и H 2 равны 10 и 30 моль/л соответственно, а выход реакции составляет 25%. N 2 + 3 H 2 2 NH 3 N 2 H 2 NH 3 10 30 0 Прореагировало/ образовалось 2, 5 7, 5 5 Равновесные конц. [ ] 7, 5 22, 5 5 Исходные конц. Сисх, моль/л
 Константа равновесия Н 2 + I 2 ⇄ 2 HI (T = const) 2 HI → v = k [H 2] [I 2] ← v = k [HI]2 k K = k
Константа равновесия Н 2 + I 2 ⇄ 2 HI (T = const) 2 HI → v = k [H 2] [I 2] ← v = k [HI]2 k K = k
![а. А + b. В ⇄ с. С + d. D [C]c [D]d K а. А + b. В ⇄ с. С + d. D [C]c [D]d K](https://present5.com/presentation/3/87260991_327049586.pdf-img/87260991_327049586.pdf-31.jpg) а. А + b. В ⇄ с. С + d. D [C]c [D]d K = ————— [A]a [B]b K не зависит от С, но зависит от Т К >> 1 ― выход реакции высок, К < 1 ― низок
а. А + b. В ⇄ с. С + d. D [C]c [D]d K = ————— [A]a [B]b K не зависит от С, но зависит от Т К >> 1 ― выход реакции высок, К < 1 ― низок
 КС и КР m n PV = — RT P = — RT = const ∙ C M V 2(HI) P KP = —————— P(H 2) ∙ P(I 2) Fe 2 O 3(к) + 3 СО(г) ⇄ 2 Fe(к) + 3 СО 2(г) Р 3(СО 2) KP = ———— Р 3(СО) В гетерогенных системах константа равновесия учитывает Р или С только летучих веществ
КС и КР m n PV = — RT P = — RT = const ∙ C M V 2(HI) P KP = —————— P(H 2) ∙ P(I 2) Fe 2 O 3(к) + 3 СО(г) ⇄ 2 Fe(к) + 3 СО 2(г) Р 3(СО 2) KP = ———— Р 3(СО) В гетерогенных системах константа равновесия учитывает Р или С только летучих веществ
 СМЕЩЕНИЕ РАВНОВЕСИЯ. ПРИНЦИП ЛЕ-ШАТЕЛЬЕ Если на систему, находящуюся в равновесии, оказать какое-либо воздействие (изменить Т, С, Р ), то равновесие сместится в сторону процесса, ослабляющего это воздействие.
СМЕЩЕНИЕ РАВНОВЕСИЯ. ПРИНЦИП ЛЕ-ШАТЕЛЬЕ Если на систему, находящуюся в равновесии, оказать какое-либо воздействие (изменить Т, С, Р ), то равновесие сместится в сторону процесса, ослабляющего это воздействие.
 СМЕЩЕНИЕ РАВНОВЕСИЯ. ПРИНЦИП ЛЕ-ШАТЕЛЬЕ ПРИМЕР 1 H 2 + I 2 ↔ 2 HI vпр = vобр Введем в систему HI. vобр увеличится. voбр > vпр Равновесие сместится влево ←.
СМЕЩЕНИЕ РАВНОВЕСИЯ. ПРИНЦИП ЛЕ-ШАТЕЛЬЕ ПРИМЕР 1 H 2 + I 2 ↔ 2 HI vпр = vобр Введем в систему HI. vобр увеличится. voбр > vпр Равновесие сместится влево ←.
 ПРИМЕР 2. N 2 + 3 H 2 ↔ 2 NH 3 , T = const v 1 пр = kпр • p(N 2) • p 3(H 2) v 1 обр= k обр • p 2(NH 3) Пусть давление в системе увеличится в 2 раза. 2 p(N 2) 2 p(H 2) 2 p(NH 3) v 2 пр = kпр {2 p(N 2)} • {2 p(H 2)}3 = 16 v 1 пр v 2 обр = kобр{2 p(NH 3)}2 = 4 v 1 обр Равновесие сместится вправо →
ПРИМЕР 2. N 2 + 3 H 2 ↔ 2 NH 3 , T = const v 1 пр = kпр • p(N 2) • p 3(H 2) v 1 обр= k обр • p 2(NH 3) Пусть давление в системе увеличится в 2 раза. 2 p(N 2) 2 p(H 2) 2 p(NH 3) v 2 пр = kпр {2 p(N 2)} • {2 p(H 2)}3 = 16 v 1 пр v 2 обр = kобр{2 p(NH 3)}2 = 4 v 1 обр Равновесие сместится вправо →
 ПРИМЕР 3. N 2 + 3 H 2 ↔ 2 NH 3 , ΔHреакц = - 92 к. ДЖ прямая реакция ЭКЗОтермическая При ↑ Т равновесие сместится в сторону ЭНДОтермической реакции (влево←)
ПРИМЕР 3. N 2 + 3 H 2 ↔ 2 NH 3 , ΔHреакц = - 92 к. ДЖ прямая реакция ЭКЗОтермическая При ↑ Т равновесие сместится в сторону ЭНДОтермической реакции (влево←)
 ПРИМЕР 4 • 2 NO 2 ↔ N 2 O 4 , ΔH реакц = - 84 к. Дж • бурый бесцветный • ↑Т ← интенсивность окраски растет • ↓Т → интенсивность окраски уменьшается
ПРИМЕР 4 • 2 NO 2 ↔ N 2 O 4 , ΔH реакц = - 84 к. Дж • бурый бесцветный • ↑Т ← интенсивность окраски растет • ↓Т → интенсивность окраски уменьшается
 ПРИМЕР 5. Чистейший Si – элементарный полупроводник Используется в микроэлектронике. Получение Si. O 2 + 2 C = Si (технич) + 2 CO 750 -850 о. С Si (техн) + 2 I 2 Si. I 4, ΔHo 298 = -113 к. Дж/моль 1000 -1200 о. С
ПРИМЕР 5. Чистейший Si – элементарный полупроводник Используется в микроэлектронике. Получение Si. O 2 + 2 C = Si (технич) + 2 CO 750 -850 о. С Si (техн) + 2 I 2 Si. I 4, ΔHo 298 = -113 к. Дж/моль 1000 -1200 о. С


