Химическая кинетика и катализ.ppt
- Количество слайдов: 23
 Химическая кинетика и катализ
Химическая кинетика и катализ
 План лекции 1. Химическая кинетика 2. Скорость химических реакций 3. Влияние концентрации на скорость химических реакций 4. Влияние температуры на скорость химических реакций 5. Влияние природы реагирующих веществ на скорость химических реакций 6. Влияние площади соприкосновения на скорость гетерогенных реакций 7. Влияние катализатора на скорость и путь химических реакций 8. Катализаторы в химическом производстве и в биологических объектах
План лекции 1. Химическая кинетика 2. Скорость химических реакций 3. Влияние концентрации на скорость химических реакций 4. Влияние температуры на скорость химических реакций 5. Влияние природы реагирующих веществ на скорость химических реакций 6. Влияние площади соприкосновения на скорость гетерогенных реакций 7. Влияние катализатора на скорость и путь химических реакций 8. Катализаторы в химическом производстве и в биологических объектах
 Условия протекания химических реакций 1) Соприкосновение реагирующих веществ. 2) Нагревание. 3) Использование катализатора.
Условия протекания химических реакций 1) Соприкосновение реагирующих веществ. 2) Нагревание. 3) Использование катализатора.
 Сущность химических реакций 1) Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакции. 2) Общее число атомов каждого химического элемента до и после реакции остаётся постоянным. 3) Образование связей происходит с выделением энергии, а разрыв связей – с поглощением энергии.
Сущность химических реакций 1) Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакции. 2) Общее число атомов каждого химического элемента до и после реакции остаётся постоянным. 3) Образование связей происходит с выделением энергии, а разрыв связей – с поглощением энергии.
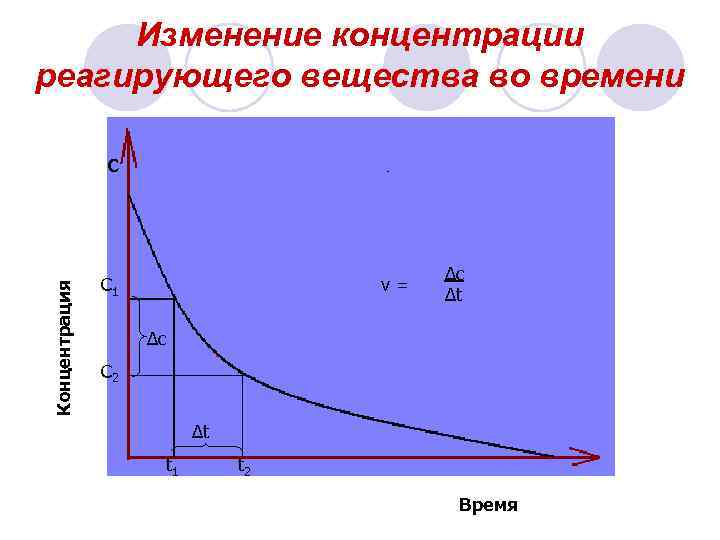 Изменение концентрации реагирующего вещества во времени Концентрация С С 1 v= ∆c ∆t ∆c С 2 ∆t t 1 t 2 Время
Изменение концентрации реагирующего вещества во времени Концентрация С С 1 v= ∆c ∆t ∆c С 2 ∆t t 1 t 2 Время
 Для гомогенных реакций Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объёме. c 2 – c 1 ∆c МОЛЬ v== t 2 – t 1 ∆t Л* С ∆с - изменение концентрации , моль/л ∆ t – изменение времени, с
Для гомогенных реакций Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объёме. c 2 – c 1 ∆c МОЛЬ v== t 2 – t 1 ∆t Л* С ∆с - изменение концентрации , моль/л ∆ t – изменение времени, с
 Факторы, влияющие на скорость реакции 1) 2) 3) 4) Концентрация реагирующих веществ. Температура. Природа реагирующих веществ. Площадь соприкосновения реагирующих веществ. 5) Катализатор.
Факторы, влияющие на скорость реакции 1) 2) 3) 4) Концентрация реагирующих веществ. Температура. Природа реагирующих веществ. Площадь соприкосновения реагирующих веществ. 5) Катализатор.
 Концентрация реагирующих веществ l Закон действующих масс (ЗДМ) : скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. l Для реакции: m. А + n. B = Am. Bn ЗДМ: v = k٠САm٠CBn k – константа скорости реакции: k = v, при с. А = св = 1 моль/л или при с. А ٠ св = 1 моль/л l k – зависит от природы реагирующих веществ и от t l
Концентрация реагирующих веществ l Закон действующих масс (ЗДМ) : скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. l Для реакции: m. А + n. B = Am. Bn ЗДМ: v = k٠САm٠CBn k – константа скорости реакции: k = v, при с. А = св = 1 моль/л или при с. А ٠ св = 1 моль/л l k – зависит от природы реагирующих веществ и от t l
 Cкорость и концентрация l Чем больше концентрация реагирующих веществ, тем чаще сталкиваются частицы веществ, а значит скорость реакции увеличивается.
Cкорость и концентрация l Чем больше концентрация реагирующих веществ, тем чаще сталкиваются частицы веществ, а значит скорость реакции увеличивается.
 Температура Правило Вант-Гоффа: при изменении температуры на каждые 100 С скорость большинства реакций изменяется в 2 – 4 раза. v 2 = v 1 ٠ t 2 – t 1 10 – температурный коэффициент, который показывает, во сколько раз изменяется скорость реакции при изменении t на 100 С
Температура Правило Вант-Гоффа: при изменении температуры на каждые 100 С скорость большинства реакций изменяется в 2 – 4 раза. v 2 = v 1 ٠ t 2 – t 1 10 – температурный коэффициент, который показывает, во сколько раз изменяется скорость реакции при изменении t на 100 С
 Физический смысл температурного коэффициента l Если температурный коэффициент равен 3, это значит, что скорость реакции возрастает в 3 раза, при повышении температуры на 100 С. l При увеличении температуры ещё на 100 С, скорость реакции возрастёт в 32=9 раз.
Физический смысл температурного коэффициента l Если температурный коэффициент равен 3, это значит, что скорость реакции возрастает в 3 раза, при повышении температуры на 100 С. l При увеличении температуры ещё на 100 С, скорость реакции возрастёт в 32=9 раз.
 Скорость и температура l При повышении температуры, увеличивается скорость движения частиц, поэтому они чаще сталкиваются, а значит скорость реакции возрастает.
Скорость и температура l При повышении температуры, увеличивается скорость движения частиц, поэтому они чаще сталкиваются, а значит скорость реакции возрастает.
 Взаимодействие магния с водой l Запишите уравнение реакции взаимодействия магния с водой. Mg+H 2 O=Mg. O+H 2↑
Взаимодействие магния с водой l Запишите уравнение реакции взаимодействия магния с водой. Mg+H 2 O=Mg. O+H 2↑
 Природа реагирующих веществ Металлы I и II групп главных подгрупп взаимодействуют с водой с образованием щёлочи и выделением водорода. Например: 2 Na + 2 H 2 O = 2 Na. OH + H 2↑ 2 K + 2 H 2 O = 2 KOH + H 2↑ Ca + 2 H 2 O = Ca(OH)2 +H 2↑
Природа реагирующих веществ Металлы I и II групп главных подгрупп взаимодействуют с водой с образованием щёлочи и выделением водорода. Например: 2 Na + 2 H 2 O = 2 Na. OH + H 2↑ 2 K + 2 H 2 O = 2 KOH + H 2↑ Ca + 2 H 2 O = Ca(OH)2 +H 2↑
 Взаимодействие калия с водой
Взаимодействие калия с водой
 Взаимодействие кальция с водой
Взаимодействие кальция с водой
 Природа реагирующих веществ l Чем активнее вещество, тем скорость реакции с его участием больше.
Природа реагирующих веществ l Чем активнее вещество, тем скорость реакции с его участием больше.
 Площадь соприкосновения реагирующих веществ Скорость гетерогенных реакций зависит от площади соприкосновения веществ. l Гетерогенные реакции идут только на поверхности раздела реагирующих веществ. l Скорость гетерогенной реакции выражается формулой: l ∆ Vгетерог. = ∆t*S [ ] МОЛЬ м 2 * С
Площадь соприкосновения реагирующих веществ Скорость гетерогенных реакций зависит от площади соприкосновения веществ. l Гетерогенные реакции идут только на поверхности раздела реагирующих веществ. l Скорость гетерогенной реакции выражается формулой: l ∆ Vгетерог. = ∆t*S [ ] МОЛЬ м 2 * С
 Скорость гетерогенных реакций l Чем больше поверхность соприкосновения веществ, тем выше скорость реакции.
Скорость гетерогенных реакций l Чем больше поверхность соприкосновения веществ, тем выше скорость реакции.
 Катализаторами называются вещества, изменяющие скорость химических реакций. Сам катализатор в реакциях не расходуется и в конечные продукты не входит. Химические реакции, протекающие при участии катализаторов, называют каталитическими.
Катализаторами называются вещества, изменяющие скорость химических реакций. Сам катализатор в реакциях не расходуется и в конечные продукты не входит. Химические реакции, протекающие при участии катализаторов, называют каталитическими.
 Скорость и катализатор l Катализатор увеличивает скорость химической реакции. t С 12 Н 22 О 11=12 СО 2+11 Н 2 О
Скорость и катализатор l Катализатор увеличивает скорость химической реакции. t С 12 Н 22 О 11=12 СО 2+11 Н 2 О
 Механизм каталитических реакций Для реакции: А + В = АВ Механизм: 1) Катализатор взаимодействует с исходным веществом: А + К = АК 2) Промежуточное соединение взаимодействует с другим исходным веществом: АК + В = АВ + К 3) Суммарное уравнение: А + В = АВ
Механизм каталитических реакций Для реакции: А + В = АВ Механизм: 1) Катализатор взаимодействует с исходным веществом: А + К = АК 2) Промежуточное соединение взаимодействует с другим исходным веществом: АК + В = АВ + К 3) Суммарное уравнение: А + В = АВ
 Влияние катализатора на путь химической реакции 1. диэтиловый эфир 2. этилен 3. ацетальдегид 4. этилацетат 5. бутадиен-1, 3
Влияние катализатора на путь химической реакции 1. диэтиловый эфир 2. этилен 3. ацетальдегид 4. этилацетат 5. бутадиен-1, 3


