Химическая кинетика — это
















 Химическая кинетика - это учение о скорости и механизме процесса и его зависимости от различных факторов, позволяющих ускорить или замедлить ход реакции. • Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций). • Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени. Средняя скорость в промежутке времени Δt В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени: Истинная (мгновенная) скорость реакции
Химическая кинетика - это учение о скорости и механизме процесса и его зависимости от различных факторов, позволяющих ускорить или замедлить ход реакции. • Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций). • Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени. Средняя скорость в промежутке времени Δt В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени: Истинная (мгновенная) скорость реакции
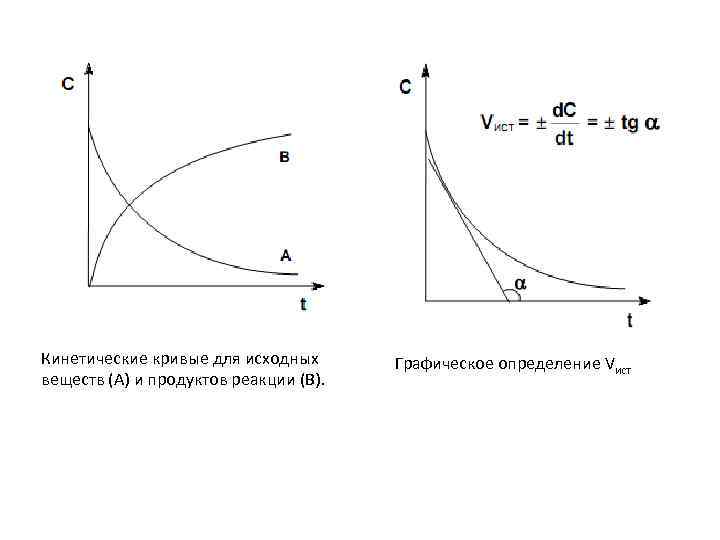
 Кинетические кривые для исходных Графическое определение Vист веществ (А) и продуктов реакции (В).
Кинетические кривые для исходных Графическое определение Vист веществ (А) и продуктов реакции (В).
 Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях. Т. е. для реакции можно записать: Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции ( соответственно х, у и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (х + у + z) представляет собой общий порядок реакции. Порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях. Т. е. для реакции можно записать: Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции ( соответственно х, у и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (х + у + z) представляет собой общий порядок реакции. Порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
 Молекулярность реакции Молекулярность химической реакции определяется числом молекул, в общем случае частиц (молекул, атомов, радикалов, ионов, т. е. любых формульных единиц), одновременно участвующих в элементарном химическом акте. В мономолекулярных реакциях участвует одна частица (молекула). К числу мономолекулярных относятся реакции, связанные с внутримолекулярным превращением - изомеризацией и распадом одной частицы на несколько других. Примером бимолекулярной реакции является щелочной гидролиз метилиодида, протекающий по уравнению Вероятность одновременного столкновения и взаимодействия трех молекул крайне мала - такие столкновения следует рассматривать скорее как исключения, чем правила. Поэтому тримолекулярные реакции встречаются сравнительно редко. Примером такой реакции может служить реакция восстановления оксида азота (II) водородом
Молекулярность реакции Молекулярность химической реакции определяется числом молекул, в общем случае частиц (молекул, атомов, радикалов, ионов, т. е. любых формульных единиц), одновременно участвующих в элементарном химическом акте. В мономолекулярных реакциях участвует одна частица (молекула). К числу мономолекулярных относятся реакции, связанные с внутримолекулярным превращением - изомеризацией и распадом одной частицы на несколько других. Примером бимолекулярной реакции является щелочной гидролиз метилиодида, протекающий по уравнению Вероятность одновременного столкновения и взаимодействия трех молекул крайне мала - такие столкновения следует рассматривать скорее как исключения, чем правила. Поэтому тримолекулярные реакции встречаются сравнительно редко. Примером такой реакции может служить реакция восстановления оксида азота (II) водородом
 Реакции нулевого порядка Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
Реакции нулевого порядка Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
 Реакции первого порядка Зависимость логарифма концентрации от времени для реакций первого порядка.
Реакции первого порядка Зависимость логарифма концентрации от времени для реакций первого порядка.
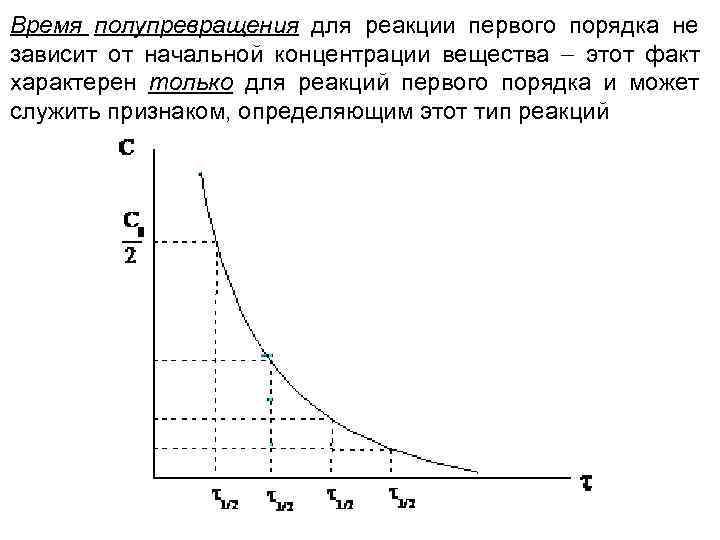
 Время полупревращения для реакции первого порядка не зависит от начальной концентрации вещества этот факт характерен только для реакций первого порядка и может служить признаком, определяющим этот тип реакций
Время полупревращения для реакции первого порядка не зависит от начальной концентрации вещества этот факт характерен только для реакций первого порядка и может служить признаком, определяющим этот тип реакций
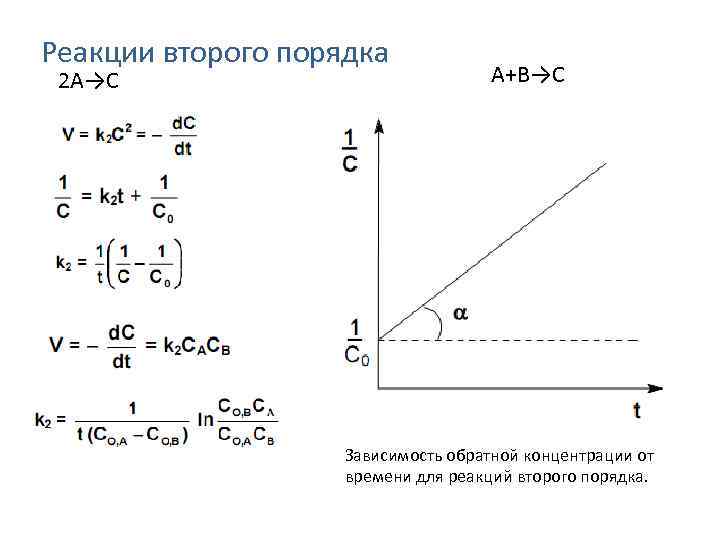
 Реакции второго порядка 2 A→C A+B→C Зависимость обратной концентрации от времени для реакций второго порядка.
Реакции второго порядка 2 A→C A+B→C Зависимость обратной концентрации от времени для реакций второго порядка.
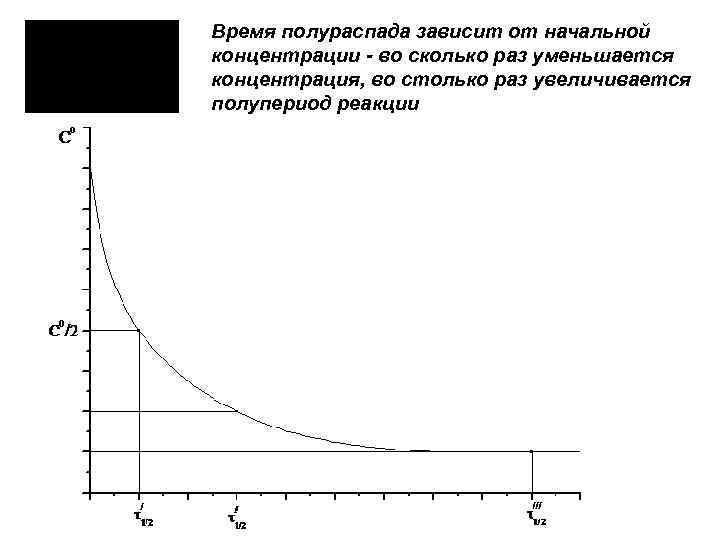
 Время полураспада зависит от начальной концентрации - во сколько раз уменьшается концентрация, во столько раз увеличивается полупериод реакции
Время полураспада зависит от начальной концентрации - во сколько раз уменьшается концентрация, во столько раз увеличивается полупериод реакции
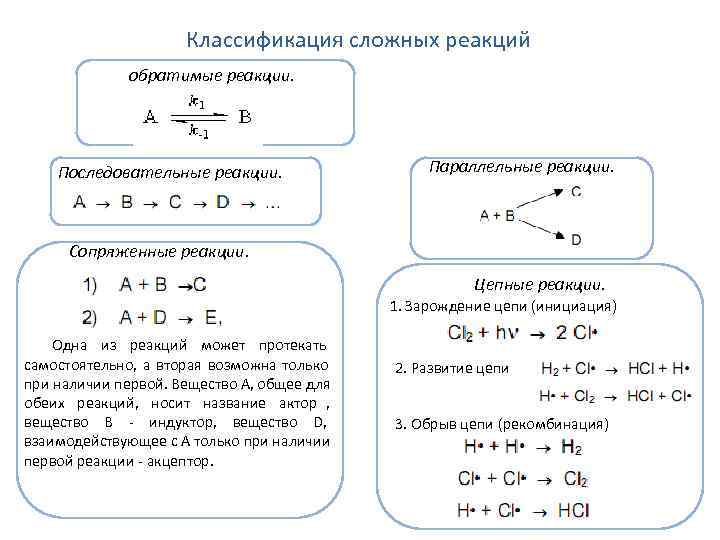
 Классификация сложных реакций обратимые реакции. Последовательные реакции. Параллельные реакции. Сопряженные реакции. Цепные реакции. 1. Зарождение цепи (инициация) Одна из реакций может протекать самостоятельно, а вторая возможна только 2. Развитие цепи при наличии первой. Вещество А, общее для обеих реакций, носит название актор , вещество В - индуктор, вещество D, 3. Обрыв цепи (рекомбинация) взаимодействующее с А только при наличии первой реакции - акцептор.
Классификация сложных реакций обратимые реакции. Последовательные реакции. Параллельные реакции. Сопряженные реакции. Цепные реакции. 1. Зарождение цепи (инициация) Одна из реакций может протекать самостоятельно, а вторая возможна только 2. Развитие цепи при наличии первой. Вещество А, общее для обеих реакций, носит название актор , вещество В - индуктор, вещество D, 3. Обрыв цепи (рекомбинация) взаимодействующее с А только при наличии первой реакции - акцептор.
 Фотохимические реакции Передача энергии для активации вступающих во взаимодействие молекул может осуществляться либо в форме теплоты (т. н. темновые реакции), либо в виде квантов электромагнитного излучения. Реакции, в которых активация частиц является результатом их взаимодействия с квантами электромагнитного излучения видимой области спектра, называют фотохимическими реакциями. При всех фотохимических процессах выполняется закон Гротгуса: Химическое превращение вещества может вызвать только то излучение, которое поглощается этим веществом. Взаимодействие света с веществом может идти по трем возможным направлениям: 1. Возбуждение частиц (переход электронов на вышележащие орбитали): 2. Ионизация частиц за счет отрыва электронов: 3. Диссоциация молекул с образованием свободных радикалов (гомолитическая) либо ионов (гетеролитическая):
Фотохимические реакции Передача энергии для активации вступающих во взаимодействие молекул может осуществляться либо в форме теплоты (т. н. темновые реакции), либо в виде квантов электромагнитного излучения. Реакции, в которых активация частиц является результатом их взаимодействия с квантами электромагнитного излучения видимой области спектра, называют фотохимическими реакциями. При всех фотохимических процессах выполняется закон Гротгуса: Химическое превращение вещества может вызвать только то излучение, которое поглощается этим веществом. Взаимодействие света с веществом может идти по трем возможным направлениям: 1. Возбуждение частиц (переход электронов на вышележащие орбитали): 2. Ионизация частиц за счет отрыва электронов: 3. Диссоциация молекул с образованием свободных радикалов (гомолитическая) либо ионов (гетеролитическая):
 Между количеством лучистой энергии, поглощенной молекулами вещества, и количеством фотохимически прореагировавших молекул существует соотношение, выражаемое законом фотохимической эквивалентности Штарка- Эйнштейна: Число молекул. подвергшихся первичному фотохимическому превращению, равно числу поглощенных веществом квантов электромагнитного излучения. Квантовый выход фотохимической реакции γ есть отношение числа частиц, претерпевших превращение, к числу поглощенных веществом квантов света. Важнейшими фотохимическими реакциями являются реакции фотосинтеза, протекающие в растениях с участием хлорофилла. Процесс фотосинтеза составляют две стадии: световая, связанная с поглощением фотонов, и значительно более медленная - темновая , представляющая собой ряд химических превращений, осуществляемых в отсутствие света. Суммарный процесс фотосинтеза заключается в окислении воды до кислорода и восстановлении диоксида углерода до углеводов:
Между количеством лучистой энергии, поглощенной молекулами вещества, и количеством фотохимически прореагировавших молекул существует соотношение, выражаемое законом фотохимической эквивалентности Штарка- Эйнштейна: Число молекул. подвергшихся первичному фотохимическому превращению, равно числу поглощенных веществом квантов электромагнитного излучения. Квантовый выход фотохимической реакции γ есть отношение числа частиц, претерпевших превращение, к числу поглощенных веществом квантов света. Важнейшими фотохимическими реакциями являются реакции фотосинтеза, протекающие в растениях с участием хлорофилла. Процесс фотосинтеза составляют две стадии: световая, связанная с поглощением фотонов, и значительно более медленная - темновая , представляющая собой ряд химических превращений, осуществляемых в отсутствие света. Суммарный процесс фотосинтеза заключается в окислении воды до кислорода и восстановлении диоксида углерода до углеводов:
 Влияние температуры на скорость химических реакций • температурный коэффициент - равен отношению константы скорости при температуре ( Т + 10 0 ) к константе скорости при температуре Т ( т. е. показывает, во сколько раз изменяется константа скорости при увеличении температуры на 10 градусов): • • Экспериментально установлено, что повышение температуры на 10 К в области обычных температур (≈ 300 К) увеличивает скорость большинства гомогенных реакций в 2 ÷ 4 раза. Это правило называется правилом Вант–Гоффа. • В общем случае отношение констант скорости реакции k 2 и k 1, определенных при двух различных температурах Т 2 и Т 1, равно •
Влияние температуры на скорость химических реакций • температурный коэффициент - равен отношению константы скорости при температуре ( Т + 10 0 ) к константе скорости при температуре Т ( т. е. показывает, во сколько раз изменяется константа скорости при увеличении температуры на 10 градусов): • • Экспериментально установлено, что повышение температуры на 10 К в области обычных температур (≈ 300 К) увеличивает скорость большинства гомогенных реакций в 2 ÷ 4 раза. Это правило называется правилом Вант–Гоффа. • В общем случае отношение констант скорости реакции k 2 и k 1, определенных при двух различных температурах Т 2 и Т 1, равно •
 • уравнение Аррениуса • ЕА - энергия активации химической реакции
• уравнение Аррениуса • ЕА - энергия активации химической реакции
 Изменение энергии реагирующей системы Элементарный акт реакции
Изменение энергии реагирующей системы Элементарный акт реакции
 • I - энергетический уровень до реакции • II - более низкий энергетический уровень после реакции • ΔН - выделившиеся энергия в ходе реакции • К – уровень наименьшего запаса энергии, для взаимодействия молекул • Еакт 1 - энергия активации прямой реакции • Еакт 2 - энергия активации обратной реакции Реакция в направлении I → II экзотермическая, протекает с выделением энергии. На рисунке показано, что по пути из исходного состояния в конечное система должна перейти через своего рода энергетический барьер.
• I - энергетический уровень до реакции • II - более низкий энергетический уровень после реакции • ΔН - выделившиеся энергия в ходе реакции • К – уровень наименьшего запаса энергии, для взаимодействия молекул • Еакт 1 - энергия активации прямой реакции • Еакт 2 - энергия активации обратной реакции Реакция в направлении I → II экзотермическая, протекает с выделением энергии. На рисунке показано, что по пути из исходного состояния в конечное система должна перейти через своего рода энергетический барьер.
 Катализом называется изменение скорости химических реакций или их возбуждение в результате воздействия веществ - катализаторов , которые, участвуя в процессе, остаются по окончании его химически неизменными. ферменты Гомогенные Катализаторы Гетерогенные Гетерогенизированные (Иммобилизованные)
Катализом называется изменение скорости химических реакций или их возбуждение в результате воздействия веществ - катализаторов , которые, участвуя в процессе, остаются по окончании его химически неизменными. ферменты Гомогенные Катализаторы Гетерогенные Гетерогенизированные (Иммобилизованные)
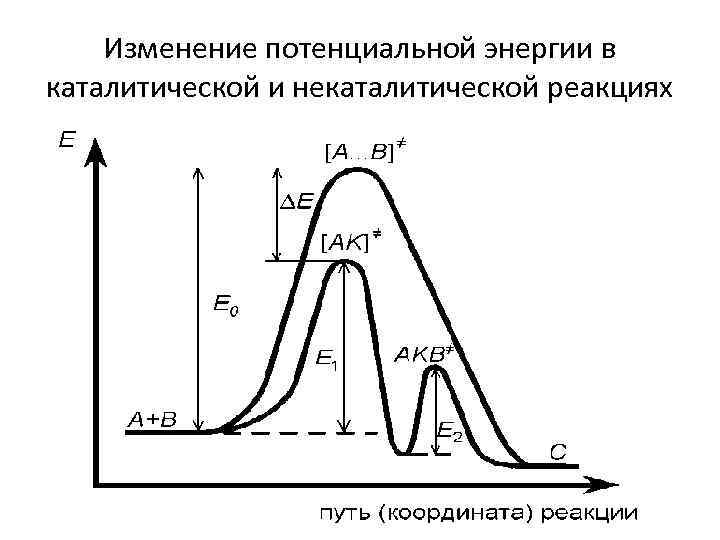
 Изменение потенциальной энергии в каталитической и некаталитической реакциях
Изменение потенциальной энергии в каталитической и некаталитической реакциях
 • Гомогенные катализаторы При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе- газовой или в растворе. Плюсы: ь Высокая активность ь Однородные активные частицы Минусы: ь Сложность отделения от реакционной смеси ь Часто неустойчивы и не подлежат регенерации.
• Гомогенные катализаторы При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе- газовой или в растворе. Плюсы: ь Высокая активность ь Однородные активные частицы Минусы: ь Сложность отделения от реакционной смеси ь Часто неустойчивы и не подлежат регенерации.
 • Гетерогенные катализаторы При гетерогенном катализе реагент и катализатор находятся в разных фазах. Плюсы: ь Стабильность ь Легко отделяемые от реакционной смеси ь Возможность использования в проточных установках ь Регенерация Минусы: ь Меньшая активность по сравнению с гомогенными катализаторами ь Требуют жестких условий процесса ь Неоднородность активных центров
• Гетерогенные катализаторы При гетерогенном катализе реагент и катализатор находятся в разных фазах. Плюсы: ь Стабильность ь Легко отделяемые от реакционной смеси ь Возможность использования в проточных установках ь Регенерация Минусы: ь Меньшая активность по сравнению с гомогенными катализаторами ь Требуют жестких условий процесса ь Неоднородность активных центров
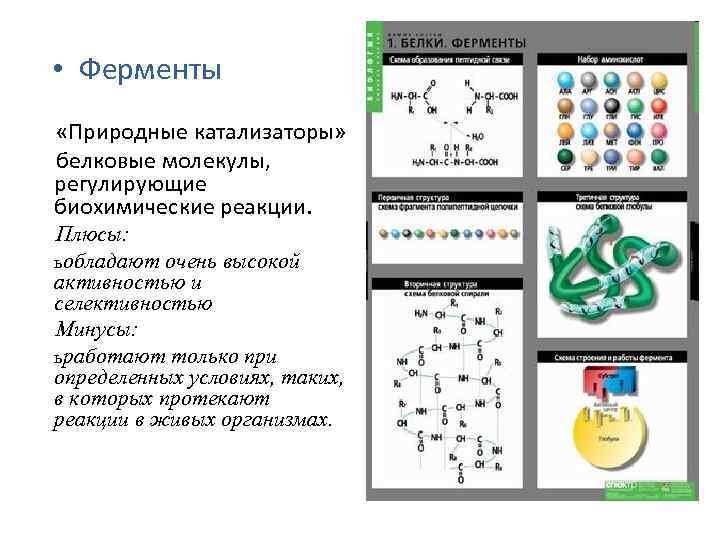
 • Ферменты «Природные катализаторы» белковые молекулы, регулирующие биохимические реакции. Плюсы: ь обладают очень высокой активностью и селективностью Минусы: ь работают только при определенных условиях, таких, в которых протекают реакции в живых организмах.
• Ферменты «Природные катализаторы» белковые молекулы, регулирующие биохимические реакции. Плюсы: ь обладают очень высокой активностью и селективностью Минусы: ь работают только при определенных условиях, таких, в которых протекают реакции в живых организмах.
 F + S F + P
F + S F + P

