ХИМИЯ.pptx
- Количество слайдов: 26
 Химическая картина мира Химия наука о веществе и его превращениях
Химическая картина мира Химия наука о веществе и его превращениях
 • Происхождение самого слова «химия» до сих пор точно не известно. – По одной версии слово «хеми» означает «Египет» , – а также «черный» или «египетское искусство» – т. е. искусство производить необходимые вещества. По другой версии – в основе греческое слово «химос» , которое переводится как «сок растений» или как «расплавленный металл» Химия – это искусство получения соков, или же искусство металлургии.
• Происхождение самого слова «химия» до сих пор точно не известно. – По одной версии слово «хеми» означает «Египет» , – а также «черный» или «египетское искусство» – т. е. искусство производить необходимые вещества. По другой версии – в основе греческое слово «химос» , которое переводится как «сок растений» или как «расплавленный металл» Химия – это искусство получения соков, или же искусство металлургии.
 Современная химия – это: 1. Наука о химических элементах и их соединениях; 2. Наука о веществах и их превращениях; 3. Наука о процессах качественного превращения веществ; 4. Наука, изучающая свойства и превращения веществ, сопровождающиеся изменением их состава и строения; 5. Система знаний о химических элементах и их соединениях, энергетике химических процессов, реакционной способности веществ, катализаторах и т. д.
Современная химия – это: 1. Наука о химических элементах и их соединениях; 2. Наука о веществах и их превращениях; 3. Наука о процессах качественного превращения веществ; 4. Наука, изучающая свойства и превращения веществ, сопровождающиеся изменением их состава и строения; 5. Система знаний о химических элементах и их соединениях, энергетике химических процессов, реакционной способности веществ, катализаторах и т. д.
 История становления и развития химии включает в себя следующие периоды: • 2. Период зарождения научной химии 1. Период алхимии (14 – 18 века). (с древности до 14 века • Создание первых по-настоящему нашей эры). • Ведутся активные поиски философского камня, эликсира долголетия, универсального растворителя. Попытки «превращения» неблагородных металлов в золото или серебро. • • научных химических теорий: Теория газов Р. Бойля; Теория флогистона Г. Шталя (флогистон – это горючее в-во, которое должны содержать все вещества, способные к горению); Теория химических элементов А. Лавуазье. Совершенствуется прикладная химия: металлургия, производство стекла и фарфора, искусство перегонки жидкостей и т. д.
История становления и развития химии включает в себя следующие периоды: • 2. Период зарождения научной химии 1. Период алхимии (14 – 18 века). (с древности до 14 века • Создание первых по-настоящему нашей эры). • Ведутся активные поиски философского камня, эликсира долголетия, универсального растворителя. Попытки «превращения» неблагородных металлов в золото или серебро. • • научных химических теорий: Теория газов Р. Бойля; Теория флогистона Г. Шталя (флогистон – это горючее в-во, которое должны содержать все вещества, способные к горению); Теория химических элементов А. Лавуазье. Совершенствуется прикладная химия: металлургия, производство стекла и фарфора, искусство перегонки жидкостей и т. д.
 3. Период открытия основных законов химии (первые 60 лет 19 -го века). • 4. Современный период (с 60 -х гг. 19 века до наших дней). Атомная теория Д. Дальтона; Атомно-молекулярная теория Авогадро; Установление Берцелиусом атомных весов химических элементов. В этот период сформировались и основные понятия химии: атом, молекула и др. • Периодический закон Д. И. Менделеева и периодическая классификация элементов; • Теория валентности; • Теория ароматических соединений и стереохимия; • Теория электролитической диссоциации Аррениуса; • Электронная теория материи и т. д.
3. Период открытия основных законов химии (первые 60 лет 19 -го века). • 4. Современный период (с 60 -х гг. 19 века до наших дней). Атомная теория Д. Дальтона; Атомно-молекулярная теория Авогадро; Установление Берцелиусом атомных весов химических элементов. В этот период сформировались и основные понятия химии: атом, молекула и др. • Периодический закон Д. И. Менделеева и периодическая классификация элементов; • Теория валентности; • Теория ароматических соединений и стереохимия; • Теория электролитической диссоциации Аррениуса; • Электронная теория материи и т. д.

 Проблемы современной химии • 1. Проблемы химического элемента • Более двух тысяч лет химическая наука пыталась обнаружить так называемый первоэлемент природы – то, из чего все возникло. • Но только в 17 веке Р. Бойль положил начало современному представлению о химическом элементе: • Химический элемент (Бойль) – это простое тело, предел химического разложения вещества, переходящий без изменения из состава одного сложного тела в другое. • Но в то время химики еще не знали ни одного чистого химического элемента. При попытках их получить возникали ошибки. • Например, получавшиеся при прокаливании оксиды принимали за чистые элементы, а металлы – медь, железо, свинец – считали сложными телами, в состав которых входит флогистон (горючий элемент).
Проблемы современной химии • 1. Проблемы химического элемента • Более двух тысяч лет химическая наука пыталась обнаружить так называемый первоэлемент природы – то, из чего все возникло. • Но только в 17 веке Р. Бойль положил начало современному представлению о химическом элементе: • Химический элемент (Бойль) – это простое тело, предел химического разложения вещества, переходящий без изменения из состава одного сложного тела в другое. • Но в то время химики еще не знали ни одного чистого химического элемента. При попытках их получить возникали ошибки. • Например, получавшиеся при прокаливании оксиды принимали за чистые элементы, а металлы – медь, железо, свинец – считали сложными телами, в состав которых входит флогистон (горючий элемент).
 • Только в конце 19 века Д. И. Менделееву удалось доказать, что свойства химического элемента зависят от величины заряда его атома и → от места данного элемента в периодической системе (т. к. заряд атома элемента – это его порядковый номер в периодической системе. Например, H – 1, Na – 11, Au – 79). • В 20 -м веке была изучена сложная структура атомов химических элементов. • Атом= + ядро и – электроны. Электроны расположены на орбиталях вокруг ядра атома. Способность элемента к химическим реакциям зависит от того, сколько электронов находится на его внешней орбитали. Наиболее активны: – Элементы, имеющие минимальную атомную массу и 6 – 7 электронов на внешнем электронном уровне (F, Cl, ) – они стремятся достроить свою эл. оболочку – присоединить недостающие электроны; – Элементы, обладающие большой атомной массой и имеющие 1 – 2 электрона на внешнем уровне (Ba, Cs) – они стремятся отдать эти лишние электроны. • На этом основано понятие валентности – способности атома к образованию химической связи. • Во времена Менделеева было известно 62 химических элемента, сейчас – 110 элементов. Содержание всех этих элементов в природе крайне неравномерно.
• Только в конце 19 века Д. И. Менделееву удалось доказать, что свойства химического элемента зависят от величины заряда его атома и → от места данного элемента в периодической системе (т. к. заряд атома элемента – это его порядковый номер в периодической системе. Например, H – 1, Na – 11, Au – 79). • В 20 -м веке была изучена сложная структура атомов химических элементов. • Атом= + ядро и – электроны. Электроны расположены на орбиталях вокруг ядра атома. Способность элемента к химическим реакциям зависит от того, сколько электронов находится на его внешней орбитали. Наиболее активны: – Элементы, имеющие минимальную атомную массу и 6 – 7 электронов на внешнем электронном уровне (F, Cl, ) – они стремятся достроить свою эл. оболочку – присоединить недостающие электроны; – Элементы, обладающие большой атомной массой и имеющие 1 – 2 электрона на внешнем уровне (Ba, Cs) – они стремятся отдать эти лишние электроны. • На этом основано понятие валентности – способности атома к образованию химической связи. • Во времена Менделеева было известно 62 химических элемента, сейчас – 110 элементов. Содержание всех этих элементов в природе крайне неравномерно.
 • 98, 6 % массы Земли • Возникает проблема составляют только 8 рационального элеменитов: О (47 %), Si использования (27, 5 %), Al (8, 8 %), химических элементов. • Fe (4, 6 %), Ca (3, 6 %), Na • Основное направление (2, 6 %), K (2, 5 %), Mg (2, 1 – использование %). Человек использует силикатов – они по эти элементы своим свойствам не непропорционально их хуже металлов и содержанию. • Например, железа в • Поэтому должны стать земле в 2 раза меньше, основным сырьем для чем алюминия. Но производства более 95 % всех строительных металлических изделий материалов и керамики. производится из железа.
• 98, 6 % массы Земли • Возникает проблема составляют только 8 рационального элеменитов: О (47 %), Si использования (27, 5 %), Al (8, 8 %), химических элементов. • Fe (4, 6 %), Ca (3, 6 %), Na • Основное направление (2, 6 %), K (2, 5 %), Mg (2, 1 – использование %). Человек использует силикатов – они по эти элементы своим свойствам не непропорционально их хуже металлов и содержанию. • Например, железа в • Поэтому должны стать земле в 2 раза меньше, основным сырьем для чем алюминия. Но производства более 95 % всех строительных металлических изделий материалов и керамики. производится из железа.
 2. Проблемы химического соединения Эта проблема состоит в следующем – какие вещества относить к чистым химическим соединениям, а какие – к смесям. В начале 19 века Ж. Пруст сформулировал закон постоянства состава – любое индивидуальное химическое соединение обладает строго определенным неизменным составом и этим отличается от смесей. Д. Дальтон показал, что даже если соединения состоят из атомов двух или нескольких элементов, то эти атомы тесно взаимодействуют (связаны) друг с другом. В смесях такие тесные связи отсутствуют. С конца 19 века, когда была изучена природа химических связей, определение химического соединения стало более точным – это качественно определенное вещество, состоящее из одного или нескольких химических элементов, атомы которых за счет химической связи объединены в частицы – молекулы.
2. Проблемы химического соединения Эта проблема состоит в следующем – какие вещества относить к чистым химическим соединениям, а какие – к смесям. В начале 19 века Ж. Пруст сформулировал закон постоянства состава – любое индивидуальное химическое соединение обладает строго определенным неизменным составом и этим отличается от смесей. Д. Дальтон показал, что даже если соединения состоят из атомов двух или нескольких элементов, то эти атомы тесно взаимодействуют (связаны) друг с другом. В смесях такие тесные связи отсутствуют. С конца 19 века, когда была изучена природа химических связей, определение химического соединения стало более точным – это качественно определенное вещество, состоящее из одного или нескольких химических элементов, атомы которых за счет химической связи объединены в частицы – молекулы.
 Современная классификация веществ
Современная классификация веществ
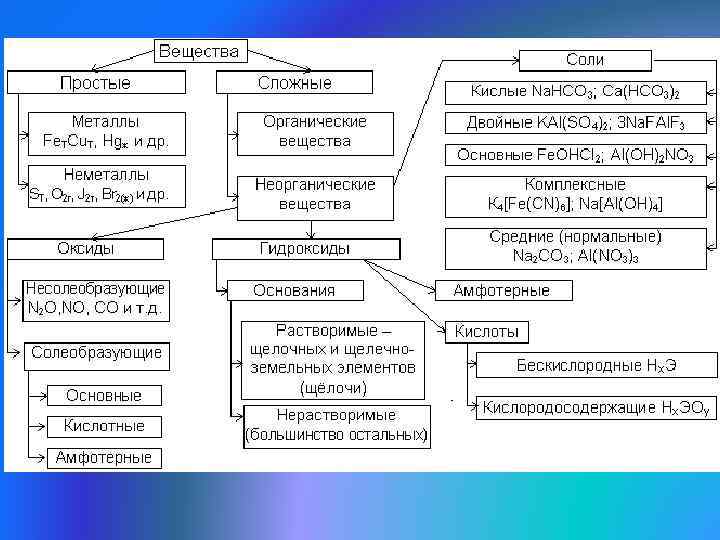
 3. Проблемы структуры химического соединения • Сейчас существует особое направление – структурная химия. • В её задачи входит создание структурных формул любых химических соединений и разработка возможностей для целенаправленного качественного преобразования веществ, для создания схемы синтеза любого химического соединения. •
3. Проблемы структуры химического соединения • Сейчас существует особое направление – структурная химия. • В её задачи входит создание структурных формул любых химических соединений и разработка возможностей для целенаправленного качественного преобразования веществ, для создания схемы синтеза любого химического соединения. •
 Развитие этого направления в химии тесно связано с именем русского химика Александра Михайловича Бутлерова. Его теория позволяла строить структурные формулы любого химического соединения, т. к. показывала взаимное влияние атомов в составе молекулы. Эта теория стала для химиков практическим руководством по синтезу органических веществ. Химия из аналитической науки (изучала состав готовых веществ) стала наукой синтетической (способной создавать новые вещества). Эта теория наглядно показала валентность химических элементов, как число единиц сродства, присущих атому → можно комбинировать атомы ХЭ, учитывая их единицы сродства → появилась возможность создавать структурные формулы любых химических соединений: Н Н Н Н – С – С – О – Н (С 3 Н 7 ОН – пропанол) Н Н Н Появилось понятие изомерии – т. е. существование веществ, имеющих один и тот же качественный и количественный состав, одинаковую молекулярную массу, но отличающихся друг от друга строением, а следовательно и свойствами. С 5 Н 12 (пентан): СН 3 – СН 2 – СН 3 , или СН 3 – СН 2 – СН 3
Развитие этого направления в химии тесно связано с именем русского химика Александра Михайловича Бутлерова. Его теория позволяла строить структурные формулы любого химического соединения, т. к. показывала взаимное влияние атомов в составе молекулы. Эта теория стала для химиков практическим руководством по синтезу органических веществ. Химия из аналитической науки (изучала состав готовых веществ) стала наукой синтетической (способной создавать новые вещества). Эта теория наглядно показала валентность химических элементов, как число единиц сродства, присущих атому → можно комбинировать атомы ХЭ, учитывая их единицы сродства → появилась возможность создавать структурные формулы любых химических соединений: Н Н Н Н – С – С – О – Н (С 3 Н 7 ОН – пропанол) Н Н Н Появилось понятие изомерии – т. е. существование веществ, имеющих один и тот же качественный и количественный состав, одинаковую молекулярную массу, но отличающихся друг от друга строением, а следовательно и свойствами. С 5 Н 12 (пентан): СН 3 – СН 2 – СН 3 , или СН 3 – СН 2 – СН 3
 • Как результат возникновения структурной химии – возник органический синтез (60 -е – 80 -е гг. 19 века). Сейчас – большая часть лекарственных препаратов – это продукты органического синтеза. • Исследования в области современной структурной химии идут по двум направлениям: – Синтез кристаллов с максимальным приближением к идеальной решетке → получение материалов с высокими техническими показателями (прочностью, устойчивостью, долговечностью). • Сложность – для выращивания таких кристаллов необходимо исключить воздействие всех внешних факторов (даже земного притяжения) → такие кристаллы выращивают на орбитальных станциях в космосе; – Создание кристаллов с заранее запрограммированными дефектами → производство материалов с заданными электрическими, магнитными и другими свойствами, которые основываются на этих дефектах. • Сложность – вместе с запрограммированными дефектами обычно появляются и нежелательные.
• Как результат возникновения структурной химии – возник органический синтез (60 -е – 80 -е гг. 19 века). Сейчас – большая часть лекарственных препаратов – это продукты органического синтеза. • Исследования в области современной структурной химии идут по двум направлениям: – Синтез кристаллов с максимальным приближением к идеальной решетке → получение материалов с высокими техническими показателями (прочностью, устойчивостью, долговечностью). • Сложность – для выращивания таких кристаллов необходимо исключить воздействие всех внешних факторов (даже земного притяжения) → такие кристаллы выращивают на орбитальных станциях в космосе; – Создание кристаллов с заранее запрограммированными дефектами → производство материалов с заданными электрическими, магнитными и другими свойствами, которые основываются на этих дефектах. • Сложность – вместе с запрограммированными дефектами обычно появляются и нежелательные.

 4. Проблемы химического процесса. • Эта проблема встала перед учеными - химиками после того как было доказано, что на способность химических веществ к взаимодействию могут влиять и условия протекания химических реакций. • Изучением химических процессов и условий их протекания занимались такие великие химики как Г. И. Гесс, Я. Вант-Гофф, Ле-Шателье и др. • Одним из основоположников учения о химических процессах стал и русский химик Николай Николаевич Семенов – лауреат Нобелевской премии 1965 г.
4. Проблемы химического процесса. • Эта проблема встала перед учеными - химиками после того как было доказано, что на способность химических веществ к взаимодействию могут влиять и условия протекания химических реакций. • Изучением химических процессов и условий их протекания занимались такие великие химики как Г. И. Гесс, Я. Вант-Гофф, Ле-Шателье и др. • Одним из основоположников учения о химических процессах стал и русский химик Николай Николаевич Семенов – лауреат Нобелевской премии 1965 г.
 Условия, влияющие на ход химических реакций: Термодинамические условия (температура, давление и т. п. ) – влияют на направленность химических процессов. • Каждая химическая реакция в принципе обратима, но на практике равновесие может смещаться в ту или иную сторону. • Есть реакции, которые не требуют особых средств управления (реакции нейтрализации, реакции с образованием газообразного вещества или твердого осадка). В них протекают как прямые и необратимые реакции: • Ba. Cl 2 + H 2 SO 4 = Ba. SO 4 + 2 HCl, или Na 2 S + H 2 SO 3 = Na 2 SO 3 + H 2 S • Но существуют реакции, равновесие которых смещено влево, к исходным веществам. И чтобы их осуществить, требуются особые термодинамические условия – увеличение температуры, давления и концентрации реагируемых веществ: • t t • H 2 CO 3 + Mg. O = Mg. CO 3 + H 2 O, или Ba(OH)2 = Ba. O + H 2 O • • Термодинамическое воздействие влияет только на направление химического процесса, а не на его скорость.
Условия, влияющие на ход химических реакций: Термодинамические условия (температура, давление и т. п. ) – влияют на направленность химических процессов. • Каждая химическая реакция в принципе обратима, но на практике равновесие может смещаться в ту или иную сторону. • Есть реакции, которые не требуют особых средств управления (реакции нейтрализации, реакции с образованием газообразного вещества или твердого осадка). В них протекают как прямые и необратимые реакции: • Ba. Cl 2 + H 2 SO 4 = Ba. SO 4 + 2 HCl, или Na 2 S + H 2 SO 3 = Na 2 SO 3 + H 2 S • Но существуют реакции, равновесие которых смещено влево, к исходным веществам. И чтобы их осуществить, требуются особые термодинамические условия – увеличение температуры, давления и концентрации реагируемых веществ: • t t • H 2 CO 3 + Mg. O = Mg. CO 3 + H 2 O, или Ba(OH)2 = Ba. O + H 2 O • • Термодинамическое воздействие влияет только на направление химического процесса, а не на его скорость.

 Кинетические условия (строение исходных реагентов, их концентрация, наличие катализаторов или ингибиторов и т. п. ) - влияют на скорость химических процессов. • • В большинстве случаев на скорость химических реакций влияют катализаторы (ускоряют процесс) или ингибиторы (замедляют процесс). Сами эти вещества хотя и участвуют в реакции, но в конце ее выделяются в неизменном виде. Например, реакция разложения бертолетовой соли, или взаимодействие аммиака с кислородом: Mn. O 2 Pt 2 KCl. O 3 = 2 KCl + 3 O 2, или 4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O Суть катализа в том, что сначала: • Реагирующие вещества вступают в контакт с катализатором, взаимодействуют с ним, в результате чего происходит ослабление химических связей; • Затем происходит перераспределение ослабленных химических связей в результате чего получаются новые вещества, а катализатор выходит из реакции в таком же состояние, как и до неё; • Следствием взаимодействия реагентов с катализатором является увеличение скорости реакции, так как на поверхности катализатора молекулы реагирующих веществ чаще встречаются.
Кинетические условия (строение исходных реагентов, их концентрация, наличие катализаторов или ингибиторов и т. п. ) - влияют на скорость химических процессов. • • В большинстве случаев на скорость химических реакций влияют катализаторы (ускоряют процесс) или ингибиторы (замедляют процесс). Сами эти вещества хотя и участвуют в реакции, но в конце ее выделяются в неизменном виде. Например, реакция разложения бертолетовой соли, или взаимодействие аммиака с кислородом: Mn. O 2 Pt 2 KCl. O 3 = 2 KCl + 3 O 2, или 4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O Суть катализа в том, что сначала: • Реагирующие вещества вступают в контакт с катализатором, взаимодействуют с ним, в результате чего происходит ослабление химических связей; • Затем происходит перераспределение ослабленных химических связей в результате чего получаются новые вещества, а катализатор выходит из реакции в таком же состояние, как и до неё; • Следствием взаимодействия реагентов с катализатором является увеличение скорости реакции, так как на поверхности катализатора молекулы реагирующих веществ чаще встречаются.
 • • • Химия плазмы. Изучает химические процессы в низкотемпературной плазме (плазма – это ионизированный газ). Радиационная химия. • Такие реакции происходят с огромной скоростью (10 -13 сек) при температуре от 1000 до 10 000 0 С. Производительность плазмохимических процессов очень высока. • Сейчас химия плазмы внедряется и в промышленное производство – уже созданы плазменные сталеплавильные печи, позволяющие получать самые высококачественные металлы. Плазмохимия позволяет синтезировать новые ранее неизвестные материалы Изучает превращения самых разных веществ под воздействием ионизирующих излучений. Источниками этих излучений служат рентгеновские установки, ускорители заряженных частиц и ядерные реакторы. В результате радиационнохимических реакций вещества получают повышенную термостойкость и твердость. Наиболее важными направлениями радиационно-химической технологии являются полимеризация, вулканизация, производство композиционных материалов (полимербетон – в 4 раза более прочный, водонепроницаемый, устойчив к коррозии). Химия высоких давлений и температур. Основная цель этого направления – высокотемпературный синтез тугоплавких и керамических материалов. Это производство основано на реакциях горения одного металла в другом, или металла в азоте, углероде и т. п. Горение – это реакция окисления. Горение возможно не только в кислороде, но и в других окислителях. Таким образом, происходит горение порошка титана в порошке бора, или порошка циркония в порошке кремния. В результате таких реакций получают тугоплавкие соединения самого высокого качества.
• • • Химия плазмы. Изучает химические процессы в низкотемпературной плазме (плазма – это ионизированный газ). Радиационная химия. • Такие реакции происходят с огромной скоростью (10 -13 сек) при температуре от 1000 до 10 000 0 С. Производительность плазмохимических процессов очень высока. • Сейчас химия плазмы внедряется и в промышленное производство – уже созданы плазменные сталеплавильные печи, позволяющие получать самые высококачественные металлы. Плазмохимия позволяет синтезировать новые ранее неизвестные материалы Изучает превращения самых разных веществ под воздействием ионизирующих излучений. Источниками этих излучений служат рентгеновские установки, ускорители заряженных частиц и ядерные реакторы. В результате радиационнохимических реакций вещества получают повышенную термостойкость и твердость. Наиболее важными направлениями радиационно-химической технологии являются полимеризация, вулканизация, производство композиционных материалов (полимербетон – в 4 раза более прочный, водонепроницаемый, устойчив к коррозии). Химия высоких давлений и температур. Основная цель этого направления – высокотемпературный синтез тугоплавких и керамических материалов. Это производство основано на реакциях горения одного металла в другом, или металла в азоте, углероде и т. п. Горение – это реакция окисления. Горение возможно не только в кислороде, но и в других окислителях. Таким образом, происходит горение порошка титана в порошке бора, или порошка циркония в порошке кремния. В результате таких реакций получают тугоплавкие соединения самого высокого качества.
 5. Проблемы эволюционной химии. До 50 – 60 -х годов ХХ века об эволюционной химии еще ничего не было известно. Химиков вопрос о происхождении вещества не волновал, т. к. получение любого нового химического соединения было делом рук и разума человека. Молекулу нового вещества можно построить по законам структурной химии из атомов, как здание из кирпичей. • Возникновению эволюционной химии способствовали исследования в области биокатализаторов (химия ферментов). В этом случае искусственный выбор катализаторов ориентировался на естественную, происходящую в природе эволюцию от неорганических веществ к живым системам. • Сейчас эволюционная химия решает проблемы самопроизвольного (без участия человека) синтеза новых химических соединений, являющихся более высокоорганизованными продуктами по сравнению с исходными веществами.
5. Проблемы эволюционной химии. До 50 – 60 -х годов ХХ века об эволюционной химии еще ничего не было известно. Химиков вопрос о происхождении вещества не волновал, т. к. получение любого нового химического соединения было делом рук и разума человека. Молекулу нового вещества можно построить по законам структурной химии из атомов, как здание из кирпичей. • Возникновению эволюционной химии способствовали исследования в области биокатализаторов (химия ферментов). В этом случае искусственный выбор катализаторов ориентировался на естественную, происходящую в природе эволюцию от неорганических веществ к живым системам. • Сейчас эволюционная химия решает проблемы самопроизвольного (без участия человека) синтеза новых химических соединений, являющихся более высокоорганизованными продуктами по сравнению с исходными веществами.
 ЭВОЛЮЦИОННАЯ ХИМИЯ – это наука о самоорганизации и саморазвитии химических систем. В процессе самоорганизации живых систем происходил определенный отбор химических элементов: • • Из всех химических элементов на Земле наиболее распространены О и Н, а в космосе Н и Не. В настоящее время насчитывается около 8 млн. химических соединений. Из них 96% - органические. Они состоят из 6 - 18 элементов. Из остальных 95 элементов природа создала только 300 тыс. неорганических соединений. Основу всех органических соединений, а следовательно, и всех живых систем составляют 6 элементов (органогенов). Это C, H, O, N, P и S. Их общая доля в организме – более 97%. За ними следуют 11 элементов, которые принимают участие в построении многих физиологически важных компонентов биосистем. Это Na, K, Ca, Mg, Fe, Si, Al, Cu, Zn и Co. Их общая доля в организме – 1, 6%. Еще 20 элементов участвуют в построении и функционировании отдельных узкоспециализированных биосистем. Их суммарная доля – 1%. Все остальные элементы в построении биосистем практически не участвуют.
ЭВОЛЮЦИОННАЯ ХИМИЯ – это наука о самоорганизации и саморазвитии химических систем. В процессе самоорганизации живых систем происходил определенный отбор химических элементов: • • Из всех химических элементов на Земле наиболее распространены О и Н, а в космосе Н и Не. В настоящее время насчитывается около 8 млн. химических соединений. Из них 96% - органические. Они состоят из 6 - 18 элементов. Из остальных 95 элементов природа создала только 300 тыс. неорганических соединений. Основу всех органических соединений, а следовательно, и всех живых систем составляют 6 элементов (органогенов). Это C, H, O, N, P и S. Их общая доля в организме – более 97%. За ними следуют 11 элементов, которые принимают участие в построении многих физиологически важных компонентов биосистем. Это Na, K, Ca, Mg, Fe, Si, Al, Cu, Zn и Co. Их общая доля в организме – 1, 6%. Еще 20 элементов участвуют в построении и функционировании отдельных узкоспециализированных биосистем. Их суммарная доля – 1%. Все остальные элементы в построении биосистем практически не участвуют.
 • Определяющими критериями в отборе химических элементов при формировании биологических систем являются: – Способность образовывать прочные и энергоёмкие химические связи; – Эти химические связи должны быть лабильны (т. е. способны к образованию новых разнообразных связей). • Элемент № 1 – это углерод (С). Он лучше других элементов соответствует этим критериям. • В настоящее время все процессы, происходящие в живом организме можно изложить на языке химии, в виде конкретных химических процессов.
• Определяющими критериями в отборе химических элементов при формировании биологических систем являются: – Способность образовывать прочные и энергоёмкие химические связи; – Эти химические связи должны быть лабильны (т. е. способны к образованию новых разнообразных связей). • Элемент № 1 – это углерод (С). Он лучше других элементов соответствует этим критериям. • В настоящее время все процессы, происходящие в живом организме можно изложить на языке химии, в виде конкретных химических процессов.
 Значение эволюционной химии • 1. Позволила создать безотходные производства. • 2. Снизить энергозатраты на химических предприятиях. • 3. Понять природу химического процесса в природе и т. д.
Значение эволюционной химии • 1. Позволила создать безотходные производства. • 2. Снизить энергозатраты на химических предприятиях. • 3. Понять природу химического процесса в природе и т. д.



