лекция_растворы..ppt
- Количество слайдов: 31
 Характеристики и свойства истинных растворов Рассматриваемые вопросы: 1. Растворы и растворимость. 2. Способы выражения состава растворов. Закон Рауля. Осмос. 3. Электролиты. 4. Ионное произведение воды. 5. Гидролиз солей.
Характеристики и свойства истинных растворов Рассматриваемые вопросы: 1. Растворы и растворимость. 2. Способы выражения состава растворов. Закон Рауля. Осмос. 3. Электролиты. 4. Ионное произведение воды. 5. Гидролиз солей.
 Раствор - гомогенная система, состоящая из двух или более независимых компонентов, соотношение между которыми может изменяться. Растворитель Растворенные вещества Азот (78%) - растворитель Воздух Кислород, пары воды, углекислый газ и благородные газы (22%) - растворенные вещества
Раствор - гомогенная система, состоящая из двух или более независимых компонентов, соотношение между которыми может изменяться. Растворитель Растворенные вещества Азот (78%) - растворитель Воздух Кислород, пары воды, углекислый газ и благородные газы (22%) - растворенные вещества
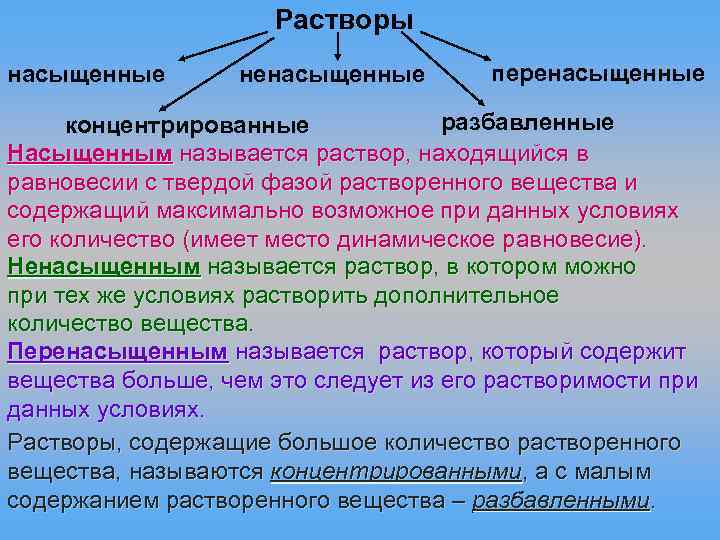 Растворы насыщенные ненасыщенные перенасыщенные разбавленные концентрированные Насыщенным называется раствор, находящийся в равновесии с твердой фазой растворенного вещества и содержащий максимально возможное при данных условиях его количество (имеет место динамическое равновесие). Ненасыщенным называется раствор, в котором можно при тех же условиях растворить дополнительное количество вещества. Перенасыщенным называется раствор, который содержит вещества больше, чем это следует из его растворимости при данных условиях. Растворы, содержащие большое количество растворенного вещества, называются концентрированными, а с малым содержанием растворенного вещества – разбавленными.
Растворы насыщенные ненасыщенные перенасыщенные разбавленные концентрированные Насыщенным называется раствор, находящийся в равновесии с твердой фазой растворенного вещества и содержащий максимально возможное при данных условиях его количество (имеет место динамическое равновесие). Ненасыщенным называется раствор, в котором можно при тех же условиях растворить дополнительное количество вещества. Перенасыщенным называется раствор, который содержит вещества больше, чем это следует из его растворимости при данных условиях. Растворы, содержащие большое количество растворенного вещества, называются концентрированными, а с малым содержанием растворенного вещества – разбавленными.
 Способы выражения состава растворов Массовая доля – отношение (обычно процентное) массы растворенного вещества к массе раствора. выражается в долях Х выражается в 100% процентах (%) Например, 15% (масс. ) водный раствор Na. Cl на 100 единиц массы содержит 15 единиц массы Na. Cl и 85 единиц массы Н 2 О. Молярная концентрация (молярность) – отношение количества растворенного вещества к объему раствора. Выражается в моль/л. Обозначается См или (после численного значения молярности) М.
Способы выражения состава растворов Массовая доля – отношение (обычно процентное) массы растворенного вещества к массе раствора. выражается в долях Х выражается в 100% процентах (%) Например, 15% (масс. ) водный раствор Na. Cl на 100 единиц массы содержит 15 единиц массы Na. Cl и 85 единиц массы Н 2 О. Молярная концентрация (молярность) – отношение количества растворенного вещества к объему раствора. Выражается в моль/л. Обозначается См или (после численного значения молярности) М.
 Так, 2 М Н 2 SO 4 означает раствор, в каждом литре которого содержится два моля серной кислоты, то есть См = 2 моль/л. Моляльность (моляльная концентрация) – отношение количества растворенного вещества к массе растворителя. Обычно моляльность обозначается буквой m. Так, для раствора H 2 SO 4 запись m=2 моль/кг (Н 2 О) означает, что в этом растворе на каждый килограмм растворителя (воды) приходится два моль Н 2 SO 4.
Так, 2 М Н 2 SO 4 означает раствор, в каждом литре которого содержится два моля серной кислоты, то есть См = 2 моль/л. Моляльность (моляльная концентрация) – отношение количества растворенного вещества к массе растворителя. Обычно моляльность обозначается буквой m. Так, для раствора H 2 SO 4 запись m=2 моль/кг (Н 2 О) означает, что в этом растворе на каждый килограмм растворителя (воды) приходится два моль Н 2 SO 4.
 Нормальность (нормальная или эквивалентная концентрация) – отношение числа эквивалентов растворенного вещества к объему раствора. Концентрация, выраженная этим способом, обозначается Сn или (после численного значения нормальности) буквой н, выражается в грамм/эквивалент/л Так, 2 н Н 2 SO 4 означает раствор, в каждом литре которого содержится 2 эквивалента Н 2 SO 4 , то есть 98 г Н 2 SO 4.
Нормальность (нормальная или эквивалентная концентрация) – отношение числа эквивалентов растворенного вещества к объему раствора. Концентрация, выраженная этим способом, обозначается Сn или (после численного значения нормальности) буквой н, выражается в грамм/эквивалент/л Так, 2 н Н 2 SO 4 означает раствор, в каждом литре которого содержится 2 эквивалента Н 2 SO 4 , то есть 98 г Н 2 SO 4.
 для оснований X= число замещаемых в реакции гидроксильных групп для кислот X= число замещаемых в реакции атомов водорода для соли X =n x B, т. е. произведение числа катионов на его валентность
для оснований X= число замещаемых в реакции гидроксильных групп для кислот X= число замещаемых в реакции атомов водорода для соли X =n x B, т. е. произведение числа катионов на его валентность
 Эквивалент кислоты – это её количество, содержащее один эквивалент водорода, способного замещаться металлом. Эквивалент основания – это его количество, которые реагирует с эквивалентами кислот. Эквивалент соли может быть вычислен как частное от деления ее молярной массы на произведение числа ионов металла и его валентности:
Эквивалент кислоты – это её количество, содержащее один эквивалент водорода, способного замещаться металлом. Эквивалент основания – это его количество, которые реагирует с эквивалентами кислот. Эквивалент соли может быть вычислен как частное от деления ее молярной массы на произведение числа ионов металла и его валентности:
 Объемы растворов реагирующих веществ обратно пропорциональны их нормальностям. Пусть V 1 раствора вещества 1 с нормальностью N 1 реагирует с V 2 раствора вещества 2 с нормальностью N 2. Это означает, что в реакцию вступило N 1 V 1 эквивалентов вещества 1 и N 2 V 2 эквивалентов вещества 2. Но вещества реагируют в эквивалентных количествах, следовательно N 1 V 1 = N 2 V 2
Объемы растворов реагирующих веществ обратно пропорциональны их нормальностям. Пусть V 1 раствора вещества 1 с нормальностью N 1 реагирует с V 2 раствора вещества 2 с нормальностью N 2. Это означает, что в реакцию вступило N 1 V 1 эквивалентов вещества 1 и N 2 V 2 эквивалентов вещества 2. Но вещества реагируют в эквивалентных количествах, следовательно N 1 V 1 = N 2 V 2
 Растворение – процесс обратимый: в зависимости от условий происходит или растворение, или выделение из раствора растворенного вещества. Вследствие обратимости процесса растворения к нему применим принцип Ле Шателье: 1. Если растворение вещества происходит с поглощением теплоты, то повышение температуры приводит к увеличению растворимости. 2. Наоборот, если при растворении вещества теплота выделяется, то повышение температуры приведет к уменьшению растворимости.
Растворение – процесс обратимый: в зависимости от условий происходит или растворение, или выделение из раствора растворенного вещества. Вследствие обратимости процесса растворения к нему применим принцип Ле Шателье: 1. Если растворение вещества происходит с поглощением теплоты, то повышение температуры приводит к увеличению растворимости. 2. Наоборот, если при растворении вещества теплота выделяется, то повышение температуры приведет к уменьшению растворимости.
 Закон Рауля. Давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем. Отсюда вытекает два следствия: - температура кипения Ткип раствора выше температуры кипения чистого растворителя. - температура замерзания раствора Тзам ниже температуры замерзания растворителя. Повышение температура кипения ∆Ткип и понижение температура замерзания ∆Тзам раствора зависят от его концентрации tкип = Екип · m, tзам = Езам · m; Екип и Езам – коэффициенты пропорциональности, соответственно эмбулиоскопическая и криоскопическая константы, зависящие только от природы растворителя. Для воды Езам = 1, 86; Екип = 0, 516; m – моляльность раствора.
Закон Рауля. Давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем. Отсюда вытекает два следствия: - температура кипения Ткип раствора выше температуры кипения чистого растворителя. - температура замерзания раствора Тзам ниже температуры замерзания растворителя. Повышение температура кипения ∆Ткип и понижение температура замерзания ∆Тзам раствора зависят от его концентрации tкип = Екип · m, tзам = Езам · m; Екип и Езам – коэффициенты пропорциональности, соответственно эмбулиоскопическая и криоскопическая константы, зависящие только от природы растворителя. Для воды Езам = 1, 86; Екип = 0, 516; m – моляльность раствора.
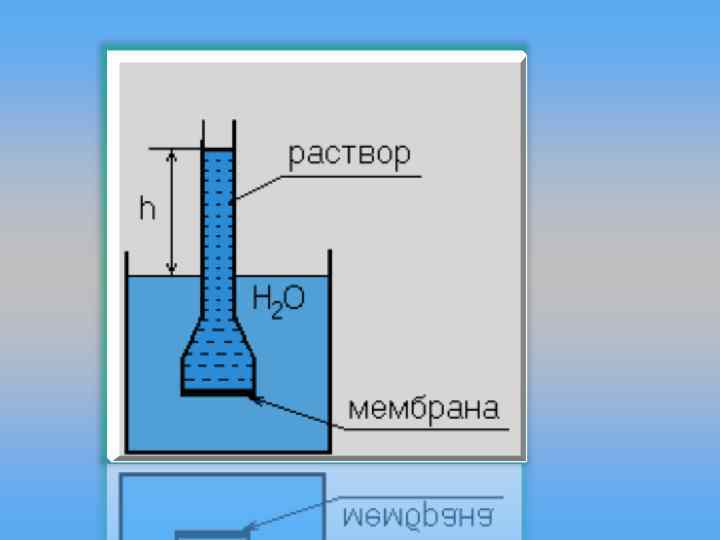
 Осмотическое давление Если растворитель разделены полупроницаемой (т. е. проницаемой только для растворителя) мембраной, то растворитель проникает в раствор, преодолевая избыточное давление, до достижения равновесного его значения – осмотического давления. Росм = СМ R T, СМ=n/V, где n – количество растворенного вещества, моль; V – объем раствора, л. Росм V = n R T Закон Вант-Гоффа: осмотическое давление численно равно тому давлению, которое оказывало бы растворенное – осмотическое давление в атмосферах, См – молярная вещество, если бы оно при данной температуре находилось концентрация раствора, Т – абсолютная температура, R – в состоянии идеального газа и занимало объем равный универсальная газовая постоянная (0, 082 Дж/моль К ) объему раствора. = См RT, – осмотическое давление в к. Па, См – молярная концентрация раствора, Т – абсолютная температура, R – универсальная газовая постоянная (8, 31 Дж/моль К )
Осмотическое давление Если растворитель разделены полупроницаемой (т. е. проницаемой только для растворителя) мембраной, то растворитель проникает в раствор, преодолевая избыточное давление, до достижения равновесного его значения – осмотического давления. Росм = СМ R T, СМ=n/V, где n – количество растворенного вещества, моль; V – объем раствора, л. Росм V = n R T Закон Вант-Гоффа: осмотическое давление численно равно тому давлению, которое оказывало бы растворенное – осмотическое давление в атмосферах, См – молярная вещество, если бы оно при данной температуре находилось концентрация раствора, Т – абсолютная температура, R – в состоянии идеального газа и занимало объем равный универсальная газовая постоянная (0, 082 Дж/моль К ) объему раствора. = См RT, – осмотическое давление в к. Па, См – молярная концентрация раствора, Т – абсолютная температура, R – универсальная газовая постоянная (8, 31 Дж/моль К )
 Для случая, когда g – г. неэлектролита, молярная масса которого М, растворены в А г растворителя можно записать: / Мв- молярная масса вещества, m В – масса вещества растворенного в одном литре раствора, – масса вещества растворенного в одном кг. растворителя,
Для случая, когда g – г. неэлектролита, молярная масса которого М, растворены в А г растворителя можно записать: / Мв- молярная масса вещества, m В – масса вещества растворенного в одном литре раствора, – масса вещества растворенного в одном кг. растворителя,
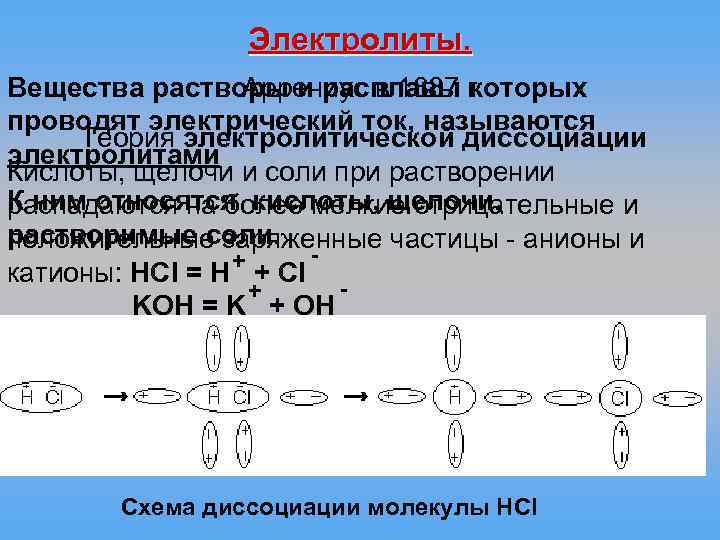 Электролиты. Аррениус в 1887 г Вещества растворы и расплавы которых проводят электрический ток, называются Теория электролитической диссоциации электролитами Кислоты, щелочи и соли при растворении К ним относятся кислоты, щелочи, распадаются на более мелкие отрицательные и растворимые соли. положительные заряженные частицы - анионы и + катионы: HCl = H + Cl + KOH = K + OH Схема диссоциации молекулы НCl
Электролиты. Аррениус в 1887 г Вещества растворы и расплавы которых проводят электрический ток, называются Теория электролитической диссоциации электролитами Кислоты, щелочи и соли при растворении К ним относятся кислоты, щелочи, распадаются на более мелкие отрицательные и растворимые соли. положительные заряженные частицы - анионы и + катионы: HCl = H + Cl + KOH = K + OH Схема диссоциации молекулы НCl
 Сильные и слабые электролиты степень диссоциации Сильные электролиты - 1 • все растворимые соли; • сильные кислоты: HCl, HBr, HI, H 2 SO 4, HNO 3, HCl. O 4; • сильные основания (щелочи): Li. OH, Na. OH, KOH, Ca(OH)2, Ba(OH)2. + - Na. Cl = Na + Cl , i ≈ 2 ; 2+ Ca. Cl 2 = Ca + 2 Cl , i ≈ 3 ; Тзам ≈ i. КСm ; Ткип≈ i. ЕСm ; ≈ i. RTCM
Сильные и слабые электролиты степень диссоциации Сильные электролиты - 1 • все растворимые соли; • сильные кислоты: HCl, HBr, HI, H 2 SO 4, HNO 3, HCl. O 4; • сильные основания (щелочи): Li. OH, Na. OH, KOH, Ca(OH)2, Ba(OH)2. + - Na. Cl = Na + Cl , i ≈ 2 ; 2+ Ca. Cl 2 = Ca + 2 Cl , i ≈ 3 ; Тзам ≈ i. КСm ; Ткип≈ i. ЕСm ; ≈ i. RTCM
 Слабые электролиты - < 0. 03 Слабые кислоты: H 2 CO 3, H 2 SO 3, HNO 2, H 3 PO 4, H 2 S и другие, а так же большинство органических кислот. Слабые основания NH 4 OH , Cu(OH)2, Fe(OH)3, Pb(OH)2, Al(OH)3 и др. + - HNO 2 = H + NO 2 - Константа диссоциации название формула Кд Ортофосфорная H 3 PO 4=Н+ + Н 2 РO 4 H 2 PO 4 – =Н+ + НРO 4 2 =Н+ + РO 43 – 7, 1∙ 10− 3 6, 2∙ 10− 8 5, 0∙ 10− 13
Слабые электролиты - < 0. 03 Слабые кислоты: H 2 CO 3, H 2 SO 3, HNO 2, H 3 PO 4, H 2 S и другие, а так же большинство органических кислот. Слабые основания NH 4 OH , Cu(OH)2, Fe(OH)3, Pb(OH)2, Al(OH)3 и др. + - HNO 2 = H + NO 2 - Константа диссоциации название формула Кд Ортофосфорная H 3 PO 4=Н+ + Н 2 РO 4 H 2 PO 4 – =Н+ + НРO 4 2 =Н+ + РO 43 – 7, 1∙ 10− 3 6, 2∙ 10− 8 5, 0∙ 10− 13
 С точки зрения электролитической диссоциации Кислоты - это электролиты, которые диссоциируют в + растворе с образованием ионов водорода Н. Эти ионы являясь носителем кислотных свойств, определяют их кислый вкус и изменяют цвет индикатора. -4 3 КД(НNO 2)=4 х 10 , КД(Н 2 SO 4)=10 Основания - это электролиты, диссоциирующие в растворах с образованием ионов ОН , которые являются носителями -7 щелочных свойств. КД(Na. OH)=2, 3 , КД 1(Fe(OH)3)=3, 5 х 10 Соли – электролиты, которые диссоциируют в растворе образуя ионы металлов (или NH 4+ ) и анионов кислотных остатков.
С точки зрения электролитической диссоциации Кислоты - это электролиты, которые диссоциируют в + растворе с образованием ионов водорода Н. Эти ионы являясь носителем кислотных свойств, определяют их кислый вкус и изменяют цвет индикатора. -4 3 КД(НNO 2)=4 х 10 , КД(Н 2 SO 4)=10 Основания - это электролиты, диссоциирующие в растворах с образованием ионов ОН , которые являются носителями -7 щелочных свойств. КД(Na. OH)=2, 3 , КД 1(Fe(OH)3)=3, 5 х 10 Соли – электролиты, которые диссоциируют в растворе образуя ионы металлов (или NH 4+ ) и анионов кислотных остатков.
 Ионно-молекулярными уравнениями называются уравнения химических реакций, в которых сильные электролиты записываются в ионной форме, а слабые электролиты и нерастворимые соли в молекулярной форме. Например: HCl + Na. OH = Na. Cl + H 2 O + + + H + Cl + Na + OH = Na + Cl + H 2 O + H + OH = H 2 O
Ионно-молекулярными уравнениями называются уравнения химических реакций, в которых сильные электролиты записываются в ионной форме, а слабые электролиты и нерастворимые соли в молекулярной форме. Например: HCl + Na. OH = Na. Cl + H 2 O + + + H + Cl + Na + OH = Na + Cl + H 2 O + H + OH = H 2 O
 Произведение растворимости Произведение концентраций ионов электролита содержащихся в его насыщенном растворе при данной температуре называют произведением растворимости обозначается - ПР Ag. Cl(кр) = Ag + Cl - + Кр= [Ag ][Cl ]=ПРAg. Cl - 10 для Ag. Cl ПР=2 х 10 [Ag+] = [Cl-]= -5 =1, 4 10 моль/л -5 -5 m. Ag. Cl = MAg [Ag+] + MCl [Cl-] = 107 • 1, 4 х10 + 35, 5 • 1, 4 х10 -3 = 2 х10 г
Произведение растворимости Произведение концентраций ионов электролита содержащихся в его насыщенном растворе при данной температуре называют произведением растворимости обозначается - ПР Ag. Cl(кр) = Ag + Cl - + Кр= [Ag ][Cl ]=ПРAg. Cl - 10 для Ag. Cl ПР=2 х 10 [Ag+] = [Cl-]= -5 =1, 4 10 моль/л -5 -5 m. Ag. Cl = MAg [Ag+] + MCl [Cl-] = 107 • 1, 4 х10 + 35, 5 • 1, 4 х10 -3 = 2 х10 г
 Ионное произведение воды. Водородный показатель + H 2 O H + OH - =1, 8 х10 Кд х 55, 5 моль/л =КН 2 О - ионное произведение воды. - 14 При температуре 298 К КН 2 О=10 , и следовательно -7 - 14 [Н+]=[ОН ]= 10 =10 моль/л. Водородным показателем называется взятый с обратным знаком десятичный логарифм концентрации ионов водорода в растворе р. Н= lg [H+] р. Н =7 - реакция (среда) нейтральная р. Н < 7 - реакция (среда) кислая р. Н > 7 - реакция (среда) щелочная. -16
Ионное произведение воды. Водородный показатель + H 2 O H + OH - =1, 8 х10 Кд х 55, 5 моль/л =КН 2 О - ионное произведение воды. - 14 При температуре 298 К КН 2 О=10 , и следовательно -7 - 14 [Н+]=[ОН ]= 10 =10 моль/л. Водородным показателем называется взятый с обратным знаком десятичный логарифм концентрации ионов водорода в растворе р. Н= lg [H+] р. Н =7 - реакция (среда) нейтральная р. Н < 7 - реакция (среда) кислая р. Н > 7 - реакция (среда) щелочная. -16
 Гидролиз солей Гидролизом солей называется реакции обмена между водой и растворяемыми в ней солями. а) Соли образованные сильной кислотой и сильным основанием (Na. NO 3, K 2 SO 4, Ca. Cl 2 и т. д. ) гидролизу не подвергаются, их растворы имеют нейтральную реакцию (р. Н = 7). KCl + H 2 O = KOH + HCl б) Соли образованные сильной кислотой и слабым основанием (Fe. Cl 3, Cu(NO 3)2, Al 2 SO 4 и т. д. ) гидролизуются по катиону с появлением в растворе + избыточных ионов Н . Их растворы приобретают кислую реакцию(7> р. Н). Fe. Cl 3 + 6 H 2 O = Fe(OH)3 + 3 HCl + 3+ Fe + 3 Cl + 6 H 2 O = Fe(OH)3 + 3 H + 3 Cl + 3+ Или в итоге Fe + 6 H 2 O = Fe(OH)3 + 3 H
Гидролиз солей Гидролизом солей называется реакции обмена между водой и растворяемыми в ней солями. а) Соли образованные сильной кислотой и сильным основанием (Na. NO 3, K 2 SO 4, Ca. Cl 2 и т. д. ) гидролизу не подвергаются, их растворы имеют нейтральную реакцию (р. Н = 7). KCl + H 2 O = KOH + HCl б) Соли образованные сильной кислотой и слабым основанием (Fe. Cl 3, Cu(NO 3)2, Al 2 SO 4 и т. д. ) гидролизуются по катиону с появлением в растворе + избыточных ионов Н . Их растворы приобретают кислую реакцию(7> р. Н). Fe. Cl 3 + 6 H 2 O = Fe(OH)3 + 3 HCl + 3+ Fe + 3 Cl + 6 H 2 O = Fe(OH)3 + 3 H + 3 Cl + 3+ Или в итоге Fe + 6 H 2 O = Fe(OH)3 + 3 H
 в) Соли образованные слабой кислотой и сильным основанием (Na 2 S, KNO 2, Na 2 CO 3 и др. ) гидролизуется по аниону с накоплением в растворе избыточных ионов ОН и их растворы имеют щелочную среду. K 2 S + 2 H 2 O = 2 KOH + H 2 S + 2+ 2 K + S + 2 H 2 O = 2 K + 2 OH +H 2 S 2 или в итоге S + 2 H 2 O = H 2 S +2 OH
в) Соли образованные слабой кислотой и сильным основанием (Na 2 S, KNO 2, Na 2 CO 3 и др. ) гидролизуется по аниону с накоплением в растворе избыточных ионов ОН и их растворы имеют щелочную среду. K 2 S + 2 H 2 O = 2 KOH + H 2 S + 2+ 2 K + S + 2 H 2 O = 2 K + 2 OH +H 2 S 2 или в итоге S + 2 H 2 O = H 2 S +2 OH
 дисперсные системы – системы, где одно вещество в виде частиц различной величины распределено в другом. Грубодисперсные системы – системы, размер -7 частиц дисперсной фазы в которых превышает 10 м. Коллоидные системы – системы, размер частиц -7 -9 дисперсной фазы в которых составляет 10 – 10 м. К лиофобным коллоидам относятся системы, в которых частицы дисперсной фазы слабо взаимодействуют с дисперсионной средой. Эти системы могут быть получены только с затратой энергии и устойчивы лишь в присутствии стабилизаторов.
дисперсные системы – системы, где одно вещество в виде частиц различной величины распределено в другом. Грубодисперсные системы – системы, размер -7 частиц дисперсной фазы в которых превышает 10 м. Коллоидные системы – системы, размер частиц -7 -9 дисперсной фазы в которых составляет 10 – 10 м. К лиофобным коллоидам относятся системы, в которых частицы дисперсной фазы слабо взаимодействуют с дисперсионной средой. Эти системы могут быть получены только с затратой энергии и устойчивы лишь в присутствии стабилизаторов.
 Растворы высокомолекулярных соединений (ВМС) образуются самопроизвольно благодаря сильному взаимодействию частиц дисперсной фазы с дисперсионной средой и способны сохранять устойчивость без стабилизаторов. Для лиофобных коллоидов единицей структуры является сложный многокомпонентный агрегат переменного состава – мицелла, для растворов ВМС – макромолекула.
Растворы высокомолекулярных соединений (ВМС) образуются самопроизвольно благодаря сильному взаимодействию частиц дисперсной фазы с дисперсионной средой и способны сохранять устойчивость без стабилизаторов. Для лиофобных коллоидов единицей структуры является сложный многокомпонентный агрегат переменного состава – мицелла, для растворов ВМС – макромолекула.
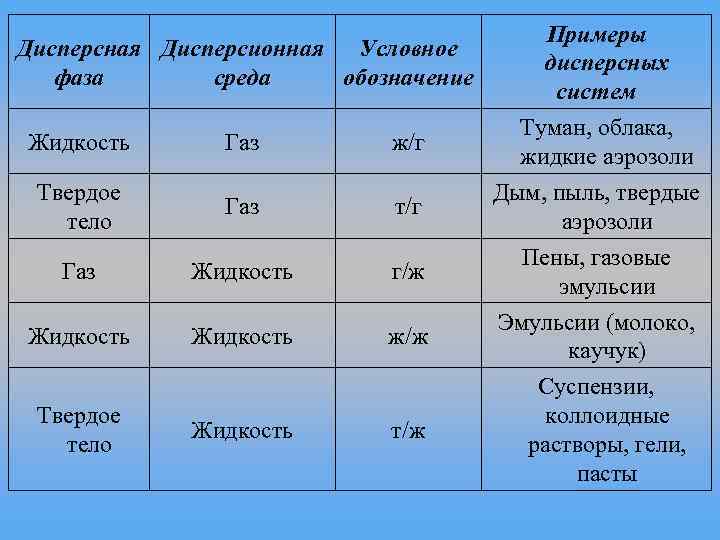 Дисперсная Дисперсионная Условное фаза среда обозначение Жидкость Газ ж/г Твердое тело Газ т/г Газ Жидкость г/ж Жидкость ж/ж Твердое тело Жидкость т/ж Примеры дисперсных систем Туман, облака, жидкие аэрозоли Дым, пыль, твердые аэрозоли Пены, газовые эмульсии Эмульсии (молоко, каучук) Суспензии, коллоидные растворы, гели, пасты
Дисперсная Дисперсионная Условное фаза среда обозначение Жидкость Газ ж/г Твердое тело Газ т/г Газ Жидкость г/ж Жидкость ж/ж Твердое тело Жидкость т/ж Примеры дисперсных систем Туман, облака, жидкие аэрозоли Дым, пыль, твердые аэрозоли Пены, газовые эмульсии Эмульсии (молоко, каучук) Суспензии, коллоидные растворы, гели, пасты
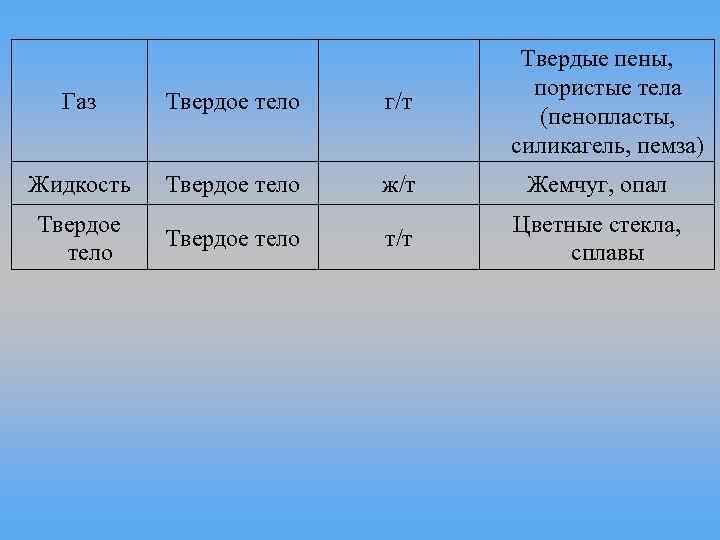 Твердые пены, пористые тела (пенопласты, силикагель, пемза) Газ Твердое тело г/т Жидкость Твердое тело ж/т Жемчуг, опал т/т Цветные стекла, сплавы Твердое тело
Твердые пены, пористые тела (пенопласты, силикагель, пемза) Газ Твердое тело г/т Жидкость Твердое тело ж/т Жемчуг, опал т/т Цветные стекла, сплавы Твердое тело
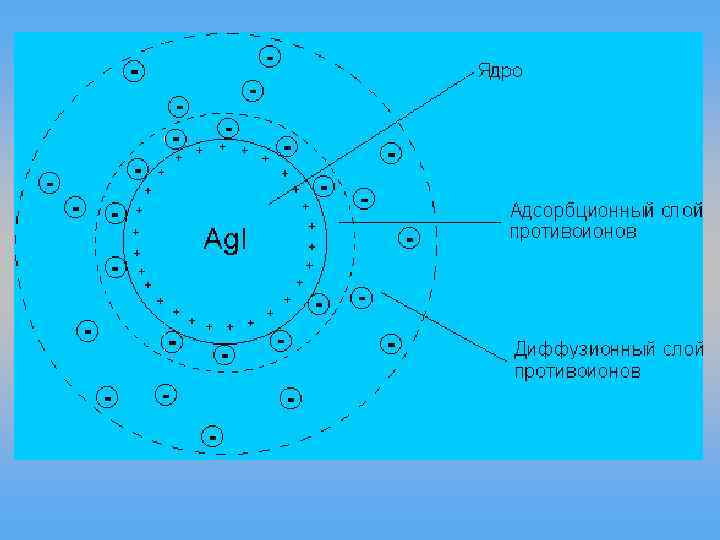
 Ag. NO 3 + KI ––> Ag. I + KNO 3 Схематически мицелла золя иодида серебра, полученного в избытке иодида калия (потенциалопределяющие ионы – анионы I–, противоионы – ионы К+) может быть изображена следующим образом: -· (n-x)K+ }xх- · x K+ {[Ag. I]m · n. I При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд: - х+ {[Ag. I]m · n. Ag+· (n-x)NO 3 }x · x NO 3
Ag. NO 3 + KI ––> Ag. I + KNO 3 Схематически мицелла золя иодида серебра, полученного в избытке иодида калия (потенциалопределяющие ионы – анионы I–, противоионы – ионы К+) может быть изображена следующим образом: -· (n-x)K+ }xх- · x K+ {[Ag. I]m · n. I При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд: - х+ {[Ag. I]m · n. Ag+· (n-x)NO 3 }x · x NO 3
 Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов. Методы конденсации Вещество, находящееся в молекулярнодисперсном состоянии, можно перевести в коллоидное состояние при замене одного растворителя другим – методом замены растворителя.
Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов. Методы конденсации Вещество, находящееся в молекулярнодисперсном состоянии, можно перевести в коллоидное состояние при замене одного растворителя другим – методом замены растворителя.



