хим.сист..pptx
- Количество слайдов: 23
 Характеристика химических систем Химическая система – это совокупность микро- и макроколичеств веществ, способных под воздействием факторов к превращениям с образованием новых химических соединений. хим. превращения Σ Bi Σ Bj реагенты продуты (исходные вещества) (конечные вещества) факторы (условия)
Характеристика химических систем Химическая система – это совокупность микро- и макроколичеств веществ, способных под воздействием факторов к превращениям с образованием новых химических соединений. хим. превращения Σ Bi Σ Bj реагенты продуты (исходные вещества) (конечные вещества) факторы (условия)
 Характеристика химических систем Вещество – устойчивая совокупность атомов (вид материи, обладающий массой покоя). Структурные единицы вещества: атомы, молекулы, ионы. Атом – наименьшая частица химического элемента, носитель его свойств. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем. Число электронов в нейтральном атоме равно числу протонов. Порядковый номер элементов в таблице Д. И. Менделеева (Z) равен заряду ядра (т. е. количеству протонов). Говоря о конкретном атомном ядре, обычно употребляют термин нуклид, а протоны и нейтроны в совокупности называются нуклонами.
Характеристика химических систем Вещество – устойчивая совокупность атомов (вид материи, обладающий массой покоя). Структурные единицы вещества: атомы, молекулы, ионы. Атом – наименьшая частица химического элемента, носитель его свойств. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем. Число электронов в нейтральном атоме равно числу протонов. Порядковый номер элементов в таблице Д. И. Менделеева (Z) равен заряду ядра (т. е. количеству протонов). Говоря о конкретном атомном ядре, обычно употребляют термин нуклид, а протоны и нейтроны в совокупности называются нуклонами.
 Двойственный характер электрона Распределение по энергетическим уровням и количество электронов будут влиять на свойства атома. При этом положение электронов в атоме нельзя однозначно определить из-за двойственной природы электрона. Как было предложено в 1924 г. Луи де Бролем, что электрон характеризуется корпускулярно – волновым дуализмом, иными словами - одновременно проявляет свойства малой частицы и электромагнитной волны. Поэтому движение электрона в атоме может быть представлено в форме 3 -х мерного облака вокруг ядра. Электронное облако характеризуется вероятностью нахождения электрона в каждый момент времени в данном микрообъёме атома.
Двойственный характер электрона Распределение по энергетическим уровням и количество электронов будут влиять на свойства атома. При этом положение электронов в атоме нельзя однозначно определить из-за двойственной природы электрона. Как было предложено в 1924 г. Луи де Бролем, что электрон характеризуется корпускулярно – волновым дуализмом, иными словами - одновременно проявляет свойства малой частицы и электромагнитной волны. Поэтому движение электрона в атоме может быть представлено в форме 3 -х мерного облака вокруг ядра. Электронное облако характеризуется вероятностью нахождения электрона в каждый момент времени в данном микрообъёме атома.
 Электронная орбиталь Область электронного облака, в котором электрон проводит более 95% времени, называется электронной орбиталью. Чем больше радиус орбитали, тем больше энергия у электрона (E 2>E 1) и тем слабее он связан с ядром. Так получается, что электроны движущиеся на орбиталях близких размеров образуют энергетические уровни. Энергетические уровни, кроме первого, состоят из подуровней. А отсюда следует, что энергия и активность атома зависит от количества уровней и распределения электронов на подуровнях.
Электронная орбиталь Область электронного облака, в котором электрон проводит более 95% времени, называется электронной орбиталью. Чем больше радиус орбитали, тем больше энергия у электрона (E 2>E 1) и тем слабее он связан с ядром. Так получается, что электроны движущиеся на орбиталях близких размеров образуют энергетические уровни. Энергетические уровни, кроме первого, состоят из подуровней. А отсюда следует, что энергия и активность атома зависит от количества уровней и распределения электронов на подуровнях.
 Характеристика химических систем Разновидность атомов одного элемента, обладающих одинаковыми зарядами ядер, но разными массовыми числами (суммой протонов и нейтронов), называются изотопами. Изотопы аргона: Ar, Ar. Изотопы калия: K, K, K. Химический элемент – совокупность атомов, имеющих одинаковый заряд ядра (с одинаковым порядком или атомным номером в периодической системе Д. И. Менделеева) Молекулой называют наименьшую частицу индивидуального вещества, способную к самостоятельному существованию, обладающую его основными химическими свойствами и состоящую из одинаковых или различных атомов. Молекулы могут быть одно-, двух- и многоатомными. Они являются составными частицами вещества.
Характеристика химических систем Разновидность атомов одного элемента, обладающих одинаковыми зарядами ядер, но разными массовыми числами (суммой протонов и нейтронов), называются изотопами. Изотопы аргона: Ar, Ar. Изотопы калия: K, K, K. Химический элемент – совокупность атомов, имеющих одинаковый заряд ядра (с одинаковым порядком или атомным номером в периодической системе Д. И. Менделеева) Молекулой называют наименьшую частицу индивидуального вещества, способную к самостоятельному существованию, обладающую его основными химическими свойствами и состоящую из одинаковых или различных атомов. Молекулы могут быть одно-, двух- и многоатомными. Они являются составными частицами вещества.
 Характеристика химических систем Металлы. Металлами является большинство химических элементов (примерно 90 %). Пример: Na, K, Mg, Ca, Ba. Неметаллы. Элементы с типично неметаллическими свойствами занимают правый верхний угол периодической системы. Основное различие между металлами и неметаллами заключается в том, что металлы проводят ток, а неметаллы не проводят Ионы – частицы реального вещества, одноатомные или многоатомные, несущие на себе электрический заряд (Na+, Cl. SO 42 -, Cr 2 O 72 - и т. д. )
Характеристика химических систем Металлы. Металлами является большинство химических элементов (примерно 90 %). Пример: Na, K, Mg, Ca, Ba. Неметаллы. Элементы с типично неметаллическими свойствами занимают правый верхний угол периодической системы. Основное различие между металлами и неметаллами заключается в том, что металлы проводят ток, а неметаллы не проводят Ионы – частицы реального вещества, одноатомные или многоатомные, несущие на себе электрический заряд (Na+, Cl. SO 42 -, Cr 2 O 72 - и т. д. )
 p. H-среды Водородным показателем, или p. H, называется взятый с обратным знаком десятичный логарифм активности ионов водорода в растворе: p. H = - lg a. H+ • a. OH- = Кв =10 -14 ; p. H + p. OH = 14 Среду можно охарактеризовать следующим образом: Кислая: a. H+> a. OH- => a. H+> 10 -7 => p. H < p. OH => p. H<7; Нейтральная: a. H+ = a. OH- = 10 -7 => p. H = p. OH = 7; Щелочная: a. H+ < a. OH- => a. H+ < 10 -7 => p. H > p. OH => p. H>7;
p. H-среды Водородным показателем, или p. H, называется взятый с обратным знаком десятичный логарифм активности ионов водорода в растворе: p. H = - lg a. H+ • a. OH- = Кв =10 -14 ; p. H + p. OH = 14 Среду можно охарактеризовать следующим образом: Кислая: a. H+> a. OH- => a. H+> 10 -7 => p. H < p. OH => p. H<7; Нейтральная: a. H+ = a. OH- = 10 -7 => p. H = p. OH = 7; Щелочная: a. H+ < a. OH- => a. H+ < 10 -7 => p. H > p. OH => p. H>7;
 Двойственность химических свойств гидроксида алюминия Амфотерность алюминия: (p. H < 7) Al(OH)3 + 3 HCl Al. Cl 3 + 3 H 2 O гидроксид алюминия, проявляя основные свойства, взаимодействует с кислотой и образует соль. (Al 3+ выступает в роли катиона) (p. H >7) Al(OH)3 + 3 Na. OH Na 3 Al. O 3 + 3 H 2 O гидроксид алюминия, выступая как кислота, реагирует со щёлочью, образуя соль. (Al. O 33 - выступает в роли аниона)
Двойственность химических свойств гидроксида алюминия Амфотерность алюминия: (p. H < 7) Al(OH)3 + 3 HCl Al. Cl 3 + 3 H 2 O гидроксид алюминия, проявляя основные свойства, взаимодействует с кислотой и образует соль. (Al 3+ выступает в роли катиона) (p. H >7) Al(OH)3 + 3 Na. OH Na 3 Al. O 3 + 3 H 2 O гидроксид алюминия, выступая как кислота, реагирует со щёлочью, образуя соль. (Al. O 33 - выступает в роли аниона)
 Двойственность химических свойств пероксида водорода Проявление свойств восстановителя или окислителя пероксида: (p. H < 7) 5 H 2 O 2 + 2 KMn. O 4 + 3 H 2 SO 4 Mn+7 2 O- + 5 e– 2 e- Mn+2 O 2 5 O 2 + K 2 SO 4 + 2 Mn. SO 4 + 8 H 2 O 2 5 В данной реакции кислород в пероксиде отдаёт электроны и является восстановителем; (p. H > 7) H 2 O 2 + 2 KI + H 2 SO 4 2 I- – 2 e 2 O-+ 2 e- I 2 2 O 2 - I 2 + K 2 SO 4 + 2 H 2 O 1 1 В данной реакции кислород в пероксиде принимает электроны и является окислителем.
Двойственность химических свойств пероксида водорода Проявление свойств восстановителя или окислителя пероксида: (p. H < 7) 5 H 2 O 2 + 2 KMn. O 4 + 3 H 2 SO 4 Mn+7 2 O- + 5 e– 2 e- Mn+2 O 2 5 O 2 + K 2 SO 4 + 2 Mn. SO 4 + 8 H 2 O 2 5 В данной реакции кислород в пероксиде отдаёт электроны и является восстановителем; (p. H > 7) H 2 O 2 + 2 KI + H 2 SO 4 2 I- – 2 e 2 O-+ 2 e- I 2 2 O 2 - I 2 + K 2 SO 4 + 2 H 2 O 1 1 В данной реакции кислород в пероксиде принимает электроны и является окислителем.
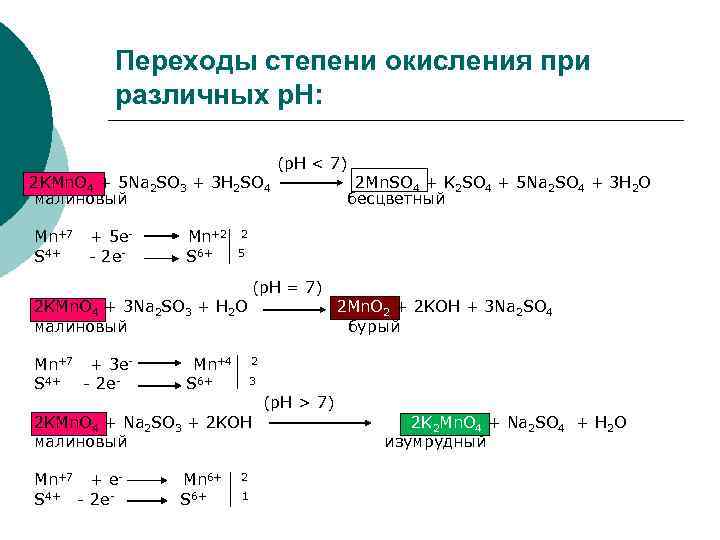 Переходы степени окисления при различных p. H: (p. H < 7) 2 KMn. O 4 + 5 Na 2 SO 3 + 3 H 2 SO 4 2 Mn. SO 4 + K 2 SO 4 + 5 Na 2 SO 4 + 3 H 2 O малиновый бесцветный Mn+7 + 5 e- Mn+2 2 S 4+ - 2 e- S 6+ 5 (p. H = 7) 2 KMn. O 4 + 3 Na 2 SO 3 + H 2 O 2 Mn. O 2 + 2 KOH + 3 Na 2 SO 4 малиновый бурый Mn+7 + 3 e- Mn+4 2 S 4+ - 2 e- S 6+ 3 (p. H > 7) 2 KMn. O 4 + Na 2 SO 3 + 2 KOH малиновый Mn+7 + e- Mn 6+ 2 S 4+ - 2 e- S 6+ 1 2 K 2 Mn. O 4 + Na 2 SO 4 + H 2 O изумрудный
Переходы степени окисления при различных p. H: (p. H < 7) 2 KMn. O 4 + 5 Na 2 SO 3 + 3 H 2 SO 4 2 Mn. SO 4 + K 2 SO 4 + 5 Na 2 SO 4 + 3 H 2 O малиновый бесцветный Mn+7 + 5 e- Mn+2 2 S 4+ - 2 e- S 6+ 5 (p. H = 7) 2 KMn. O 4 + 3 Na 2 SO 3 + H 2 O 2 Mn. O 2 + 2 KOH + 3 Na 2 SO 4 малиновый бурый Mn+7 + 3 e- Mn+4 2 S 4+ - 2 e- S 6+ 3 (p. H > 7) 2 KMn. O 4 + Na 2 SO 3 + 2 KOH малиновый Mn+7 + e- Mn 6+ 2 S 4+ - 2 e- S 6+ 1 2 K 2 Mn. O 4 + Na 2 SO 4 + H 2 O изумрудный
 Переходы степени окисления при различных p. H: Получаем такую схему:
Переходы степени окисления при различных p. H: Получаем такую схему:
 Химические превращения – это такие превращения, при которых происходят изменения только во внешних электронных слоях атомов, не затрагивая внутренних электронных слоёв и ядра. Основные признаки химических превращений: 1). Выделение газа ( ↑ ) 2). Выпадение осадка ( ↓ ) 3). Выделение или поглощение тепла ( ±Q ) 4). Изменение цвета как результат изменения степеней окисления.
Химические превращения – это такие превращения, при которых происходят изменения только во внешних электронных слоях атомов, не затрагивая внутренних электронных слоёв и ядра. Основные признаки химических превращений: 1). Выделение газа ( ↑ ) 2). Выпадение осадка ( ↓ ) 3). Выделение или поглощение тепла ( ±Q ) 4). Изменение цвета как результат изменения степеней окисления.
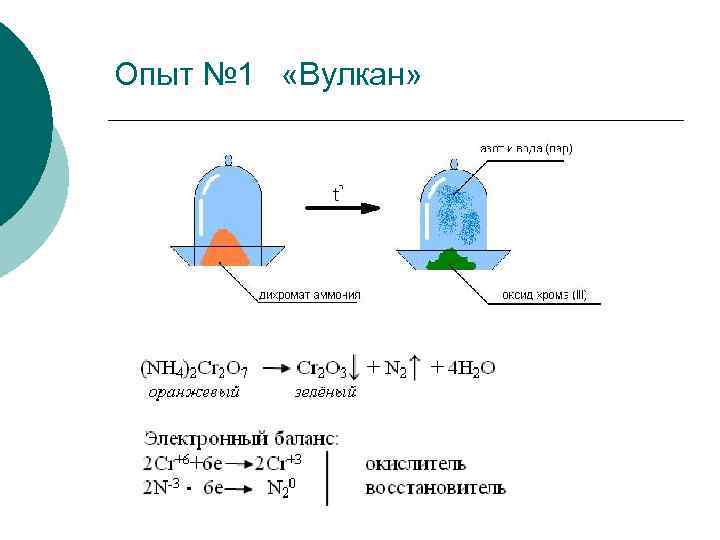 Опыт № 1 «Вулкан»
Опыт № 1 «Вулкан»
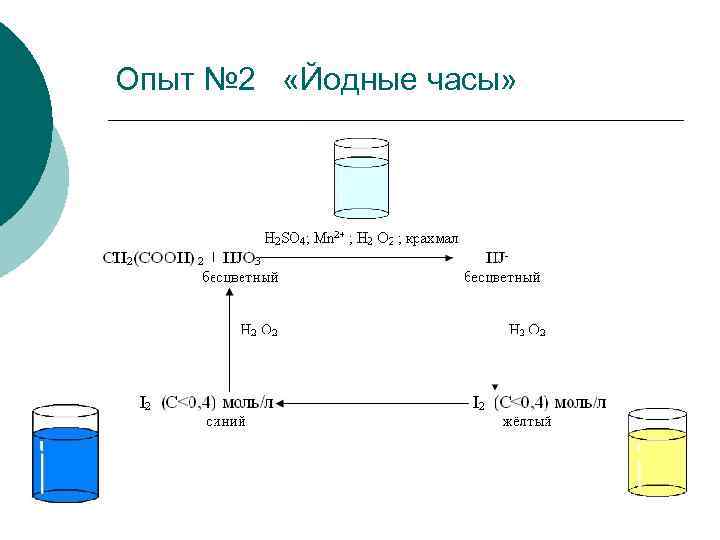 Опыт № 2 «Йодные часы»
Опыт № 2 «Йодные часы»
 Степень окисления и структурные формулы Степень окисления – это условный электрический заряд атомов в молекуле, возникающий из-за смещения электронов в сторону более электроотрицательного атома. Структурные формулы: Оксиды и пероксиды: + -2 + H 2 O H – O – H +2 -2 +2 -2 Ba. O Ba = O +3 -2 -2 +3 -2 +3 -2 Al 2 O 3 O = Al – O – Al = O
Степень окисления и структурные формулы Степень окисления – это условный электрический заряд атомов в молекуле, возникающий из-за смещения электронов в сторону более электроотрицательного атома. Структурные формулы: Оксиды и пероксиды: + -2 + H 2 O H – O – H +2 -2 +2 -2 Ba. O Ba = O +3 -2 -2 +3 -2 +3 -2 Al 2 O 3 O = Al – O – Al = O
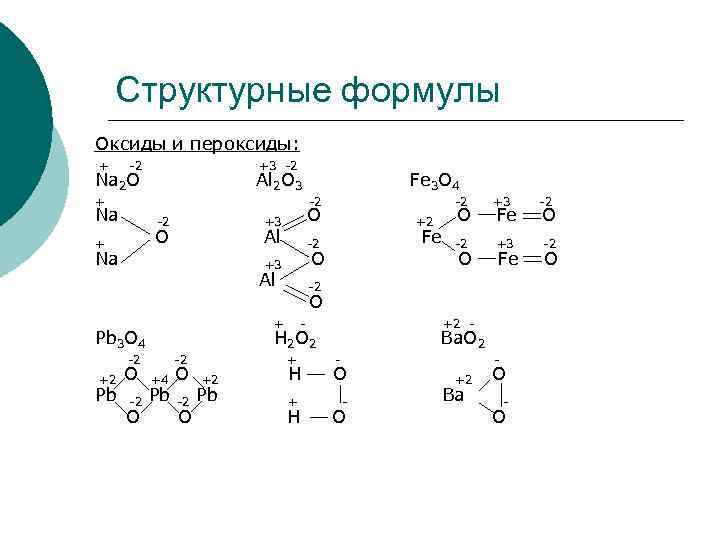 Структурные формулы Оксиды и пероксиды: + -2 +3 -2 Na 2 O Al 2 O 3 Fe 3 O 4 + -2 +3 -2 Na -2 +3 O +2 O Fe O + O Al -2 Fe -2 +3 -2 Na +3 O O Fe O Al -2 O + - +2 - Pb 3 O 4 H 2 O 2 Ba. O 2 -2 + - - +2 O +4 O +2 H O +2 O Pb -2 Pb + - Ba O O H O
Структурные формулы Оксиды и пероксиды: + -2 +3 -2 Na 2 O Al 2 O 3 Fe 3 O 4 + -2 +3 -2 Na -2 +3 O +2 O Fe O + O Al -2 Fe -2 +3 -2 Na +3 O O Fe O Al -2 O + - +2 - Pb 3 O 4 H 2 O 2 Ba. O 2 -2 + - - +2 O +4 O +2 H O +2 O Pb -2 Pb + - Ba O O H O
 Структурные формулы Основания: + -2 + + -2 + Na. OH Na – O – H +2 -2 + + -2 +2 -2 + Ba(OH)2 H – O – Ba – O – H + H -2 O +3 -2 + + -2 +3 -2 + Al(OH)3 H – O – Al – O – H
Структурные формулы Основания: + -2 + + -2 + Na. OH Na – O – H +2 -2 + + -2 +2 -2 + Ba(OH)2 H – O – Ba – O – H + H -2 O +3 -2 + + -2 +3 -2 + Al(OH)3 H – O – Al – O – H
 Структурные формулы Кислоты: ++5 -2 + +6 -2 + +5 -2 HNO 3 H 2 SO 4 H 3 PO 4 -2 + -2 + -2 +5 O H – O +6 O H – O – N -2 + -2 S -2 + -2 +5 -2 O H – O O H – O – P = O + -2 H – O + +3 -2 + +4 -2 H 2 C 2 O 4 H 2 CO 3 + -2 +3 -2 + -2 H – O – C = O H – O +4 -2 +3 -2 + -2 C = O H – O – C = O H – O
Структурные формулы Кислоты: ++5 -2 + +6 -2 + +5 -2 HNO 3 H 2 SO 4 H 3 PO 4 -2 + -2 + -2 +5 O H – O +6 O H – O – N -2 + -2 S -2 + -2 +5 -2 O H – O O H – O – P = O + -2 H – O + +3 -2 + +4 -2 H 2 C 2 O 4 H 2 CO 3 + -2 +3 -2 + -2 H – O – C = O H – O +4 -2 +3 -2 + -2 C = O H – O – C = O H – O
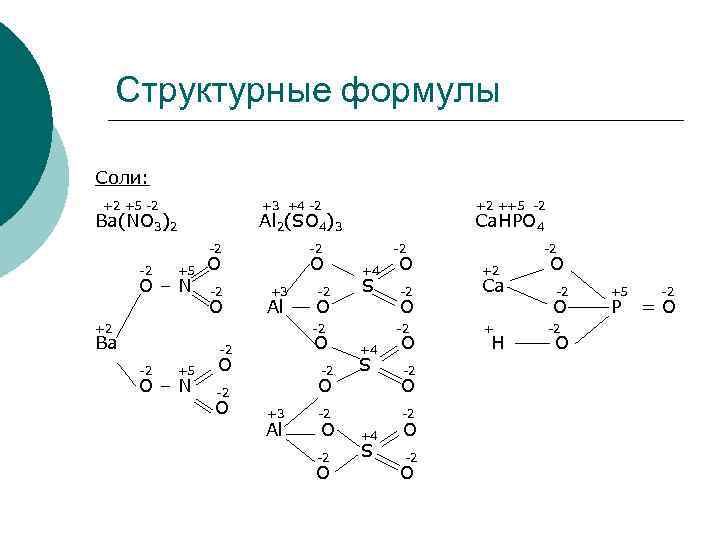 Структурные формулы Соли: +3 +4 -2 +2 ++5 -2 Ba(NO 3)2 Al 2(SO 4)3 Ca. HPO 4 -2 -2 +5 O O +4 O +2 O O – N -2 +3 -2 S -2 Ca -2 +5 -2 O Al O O P = O +2 +5 -2 +2 -2 + -2 Ba -2 O +4 O H O -2 +5 O -2 S -2 O – N -2 O O +3 -2 Al O +4 O -2 S -2 O O
Структурные формулы Соли: +3 +4 -2 +2 ++5 -2 Ba(NO 3)2 Al 2(SO 4)3 Ca. HPO 4 -2 -2 +5 O O +4 O +2 O O – N -2 +3 -2 S -2 Ca -2 +5 -2 O Al O O P = O +2 +5 -2 +2 -2 + -2 Ba -2 O +4 O H O -2 +5 O -2 S -2 O – N -2 O O +3 -2 Al O +4 O -2 S -2 O O
 Составление ионных уравнений Многие молекулы в воде диссоциируют на ионы. Химические соединения, которые хорошо растворяются в воде, делятся на сильные электролиты (т. е. полностью распадаются на ионы) и слабые электролиты (т. е частично распадаются на ионы). При написании ионного уравнения разбиваем на ионы: 1. Растворимые соли (Na. Cl, Na 3 PO 4 и др. ) 2. Сильные кислоты ( часто встречаемые в учебном курсе : H 2 SO 4, HNO 3, HCl , HBr , HI , HCl. O 4 ) 3. Сильные основания (Li. OH , Na. OH , KOH, Rb. OH , Cs. OH , Fr. OH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2 )
Составление ионных уравнений Многие молекулы в воде диссоциируют на ионы. Химические соединения, которые хорошо растворяются в воде, делятся на сильные электролиты (т. е. полностью распадаются на ионы) и слабые электролиты (т. е частично распадаются на ионы). При написании ионного уравнения разбиваем на ионы: 1. Растворимые соли (Na. Cl, Na 3 PO 4 и др. ) 2. Сильные кислоты ( часто встречаемые в учебном курсе : H 2 SO 4, HNO 3, HCl , HBr , HI , HCl. O 4 ) 3. Сильные основания (Li. OH , Na. OH , KOH, Rb. OH , Cs. OH , Fr. OH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2 )
 Примеры диссоциации молекул на ионы Ba(NO 3)2 Ba 2+ + 2 NO 3– K 2 Cr 2 O 7 2 K+ + Cr 2 O 72 KMn. O 4 K+ + Mn. O 4– Na. H 2 PO 4 Na+ + H 2 PO 4– Al. OHSO 4 Al. OH 2+ + SO 42 H 2 SO 4 2 H+ + SO 42 Ca(OH)2 Ca 2+ + 2 OH-
Примеры диссоциации молекул на ионы Ba(NO 3)2 Ba 2+ + 2 NO 3– K 2 Cr 2 O 7 2 K+ + Cr 2 O 72 KMn. O 4 K+ + Mn. O 4– Na. H 2 PO 4 Na+ + H 2 PO 4– Al. OHSO 4 Al. OH 2+ + SO 42 H 2 SO 4 2 H+ + SO 42 Ca(OH)2 Ca 2+ + 2 OH-
 Составление ионных уравнений При написании ионного уравнения не разбиваем на ионы: 1. Оксиды (CO, Na 2 O и др. ) 2. Газы (Cl 2, CO 2 и др. ) 3. Осадки (Ag. Cl, Ba. SO 4 и др. ) 4. Слабые электролиты (H 2 O, H 2 O 2), ü слабые кислоты (H 2 SO 3, H 3 PO 4 и др. ), ü слабые основания (NH 4 OH, Fe(OH)3 и др. )
Составление ионных уравнений При написании ионного уравнения не разбиваем на ионы: 1. Оксиды (CO, Na 2 O и др. ) 2. Газы (Cl 2, CO 2 и др. ) 3. Осадки (Ag. Cl, Ba. SO 4 и др. ) 4. Слабые электролиты (H 2 O, H 2 O 2), ü слабые кислоты (H 2 SO 3, H 3 PO 4 и др. ), ü слабые основания (NH 4 OH, Fe(OH)3 и др. )
 Примеры составления ионных уравнений 5 H 2 O 2 + 2 KMn. O 4 + 3 H 2 SO 4 5 O 2 + K 2 SO 4 + 2 Mn SO 4 + 8 H 2 O 5 H 2 O 2 + 2 Mn. O 4 - + 6 H+ 5 O 2 + 2 Mn 2+ + 8 H 2 O Проверка: слева суммарный заряд = + 4 и справа суммарный заряд = +4 H 2 O 2 + 2 K I + H 2 SO 4 I 2 + K 2 SO 4 + 2 H 2 O H 2 O 2 + 2 I- + 2 H+ I 2 + 2 H 2 O Проверка: слева суммарный заряд = 0 и справа суммарный заряд = 0
Примеры составления ионных уравнений 5 H 2 O 2 + 2 KMn. O 4 + 3 H 2 SO 4 5 O 2 + K 2 SO 4 + 2 Mn SO 4 + 8 H 2 O 5 H 2 O 2 + 2 Mn. O 4 - + 6 H+ 5 O 2 + 2 Mn 2+ + 8 H 2 O Проверка: слева суммарный заряд = + 4 и справа суммарный заряд = +4 H 2 O 2 + 2 K I + H 2 SO 4 I 2 + K 2 SO 4 + 2 H 2 O H 2 O 2 + 2 I- + 2 H+ I 2 + 2 H 2 O Проверка: слева суммарный заряд = 0 и справа суммарный заряд = 0


