cc8796c43d8b797409abe22909dca544.ppt
- Количество слайдов: 34
 www. verum. de 05. 10. 2012 Facts are facts perception is reality Albert Einstein Реформирование требований к проведению клинических испытаний в Европейском Союзе Михеев А. Г. , к. мед. н. , доцент
www. verum. de 05. 10. 2012 Facts are facts perception is reality Albert Einstein Реформирование требований к проведению клинических испытаний в Европейском Союзе Михеев А. Г. , к. мед. н. , доцент
 Содержание: • • • Значение Директивы по клиническим исследованиям 2001/20/EC: мнения экспертов Предпосылки и причины изменений в регулировании клинических исследований в странах ЕС Какие изменения ожидаются в законодательстве ЕС относительно клинических исследований? Как повлияют предстоящие изменения европейского законодательства на рынок клинических испытаний в «третьих странах» ? Когда ожидать изменений регулирования КИ в странах ЕС? Стоит ли опасаться уменьшения количества размещаемых проектов КИ в странах, не входящих в Европейский Союз?
Содержание: • • • Значение Директивы по клиническим исследованиям 2001/20/EC: мнения экспертов Предпосылки и причины изменений в регулировании клинических исследований в странах ЕС Какие изменения ожидаются в законодательстве ЕС относительно клинических исследований? Как повлияют предстоящие изменения европейского законодательства на рынок клинических испытаний в «третьих странах» ? Когда ожидать изменений регулирования КИ в странах ЕС? Стоит ли опасаться уменьшения количества размещаемых проектов КИ в странах, не входящих в Европейский Союз?
 Директива по клиническим испытаниям 2001/20/ЕС: достигнута ли цель? Принятие директивы было продиктовано необходимостью сближения законов, правил и административных положений государств-членов ЕС в области регулирования клинических испытаний новых медицинских продуктов.
Директива по клиническим испытаниям 2001/20/ЕС: достигнута ли цель? Принятие директивы было продиктовано необходимостью сближения законов, правил и административных положений государств-членов ЕС в области регулирования клинических испытаний новых медицинских продуктов.
 Директива по клиническим испытаниям 2001/20/ЕС: достигнута ли цель? • Директива сыграла значительную роль в унификации национальных законодательств • Директива привела к повышению уровня безопасности КИ • Обеспечила этическую обоснованность КИ • Обеспечила высокую надежность получаемых данных.
Директива по клиническим испытаниям 2001/20/ЕС: достигнута ли цель? • Директива сыграла значительную роль в унификации национальных законодательств • Директива привела к повышению уровня безопасности КИ • Обеспечила этическую обоснованность КИ • Обеспечила высокую надежность получаемых данных.
 Директива по клиническим испытаниям 2001/20/ЕС: достигнута ли цель? • Однако, Директива не обеспечила полное однообразие требований к разрешению и проведению КИ во всех государствах-членах и, возможно, является наиболее критикуемой частью европейского законодательства в области фармации.
Директива по клиническим испытаниям 2001/20/ЕС: достигнута ли цель? • Однако, Директива не обеспечила полное однообразие требований к разрешению и проведению КИ во всех государствах-членах и, возможно, является наиболее критикуемой частью европейского законодательства в области фармации.
 Директива по клиническим испытаниям 2001/20/ЕС: факты в поддержку критики • Количество заявлений на проведение КИ в • государствах-участниках снизилось на 25% в период с 2007 по 2011 год; • Существенно увеличились затраты на проведение КИ (2001 -2011).
Директива по клиническим испытаниям 2001/20/ЕС: факты в поддержку критики • Количество заявлений на проведение КИ в • государствах-участниках снизилось на 25% в период с 2007 по 2011 год; • Существенно увеличились затраты на проведение КИ (2001 -2011).
 Внедрение положений Директивы по клиническим испытаниям 2001/20/ЕС привели к значительному увеличению затрат • Нуждаемость фармацевтических компаний в персонале, задействованном в области КИ, увеличилась вдвое (на 107%); • Административные расходы некоммерческих спонсоров возросли на 98%; • Затраты на страховые взносы увеличились на 800%; • Период задержки запуска исследования увеличился в среднем на 152 дней (на 90%).
Внедрение положений Директивы по клиническим испытаниям 2001/20/ЕС привели к значительному увеличению затрат • Нуждаемость фармацевтических компаний в персонале, задействованном в области КИ, увеличилась вдвое (на 107%); • Административные расходы некоммерческих спонсоров возросли на 98%; • Затраты на страховые взносы увеличились на 800%; • Период задержки запуска исследования увеличился в среднем на 152 дней (на 90%).
 Влияние Директивы 2001/20/ЕС на размещение клинических исследований в государствах-членах ЕС По материалам работы Маркуса Хартмана «Оценка влияния Директивы по клиническим испытаниям: Продольное, проспективное, наблюдательное исследование анализа структуры и тенденций клинических испытаний поданных с 2001 года в регуляторные органы шести стран ЕС» [Trials, 2012]
Влияние Директивы 2001/20/ЕС на размещение клинических исследований в государствах-членах ЕС По материалам работы Маркуса Хартмана «Оценка влияния Директивы по клиническим испытаниям: Продольное, проспективное, наблюдательное исследование анализа структуры и тенденций клинических испытаний поданных с 2001 года в регуляторные органы шести стран ЕС» [Trials, 2012]
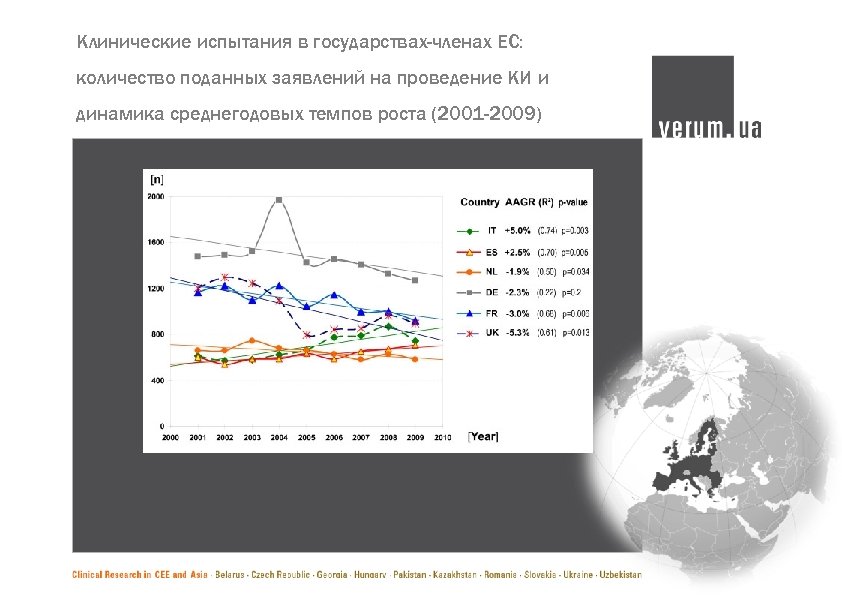 Клинические испытания в государствах-членах ЕС: количество поданных заявлений на проведение КИ и динамика среднегодовых темпов роста (2001 -2009)
Клинические испытания в государствах-членах ЕС: количество поданных заявлений на проведение КИ и динамика среднегодовых темпов роста (2001 -2009)
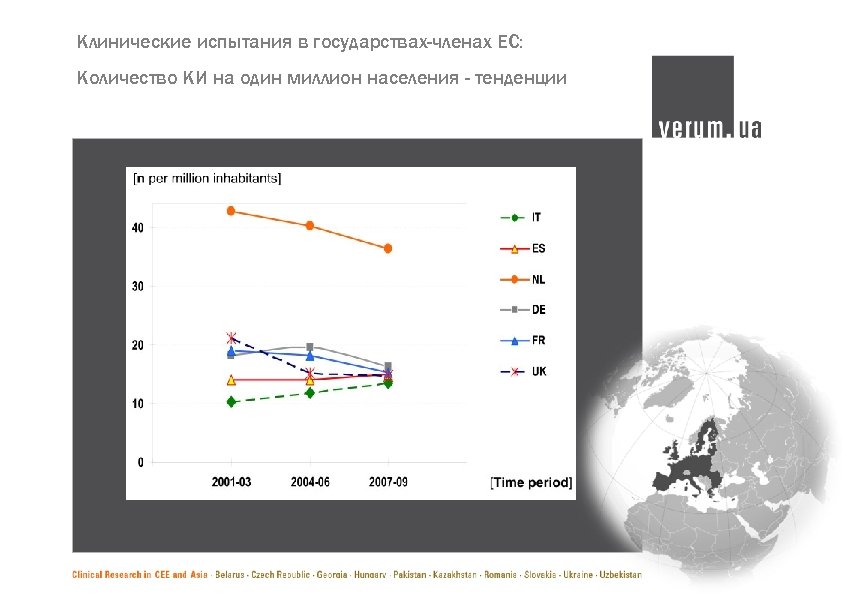 Клинические испытания в государствах-членах ЕС: Количество КИ на один миллион населения - тенденции
Клинические испытания в государствах-членах ЕС: Количество КИ на один миллион населения - тенденции
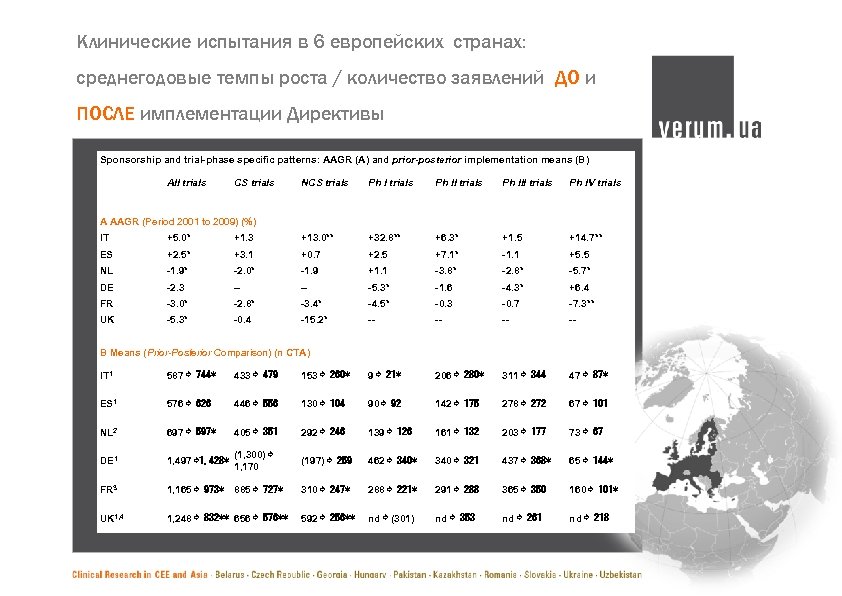 Клинические испытания в 6 европейских странах: среднегодовые темпы роста / количество заявлений ДО и ПОСЛЕ имплементации Директивы Sponsorship and trial-phase specific patterns: AAGR (A) and prior-posterior implementation means (B) All trials CS trials NCS trials Ph III trials Ph IV trials A AAGR (Period 2001 to 2009) (%) IT +5. 0* +1. 3 +13. 0** +32. 8** +6. 3* +1. 5 +14. 7** ES +2. 5* +3. 1 +0. 7 +2. 5 +7. 1* -1. 1 +5. 5 NL -1. 9* -2. 0* -1. 9 +1. 1 -3. 8* -2. 8* -5. 7* DE -2. 3 -- -- -5. 3* -1. 6 -4. 3* +6. 4 FR -3. 0* -2. 8* -3. 4* -4. 5* -0. 3 -0. 7 -7. 3** UK -5. 3* -0. 4 -15. 2* -- -- B Means (Prior-Posterior Comparison) (n CTA) IT 1 587 ⇨ 744* 433 ⇨ 479 153 ⇨ 260* 9 ⇨ 21* 206 ⇨ 280* 311 ⇨ 344 47 ⇨ 87* ES 1 576 ⇨ 626 446 ⇨ 556 130 ⇨ 104 90 ⇨ 92 142 ⇨ 175 278 ⇨ 272 67 ⇨ 101 NL 2 697 ⇨ 597* 405 ⇨ 351 292 ⇨ 246 139 ⇨ 126 161 ⇨ 132 203 ⇨ 177 73 ⇨ 67 DE 1 1, 497 ⇨ 1, 428* (1, 300) ⇨ 1, 170 (197) ⇨ 259 462 ⇨ 340* 340 ⇨ 321 437 ⇨ 368* 65 ⇨ 144* FR 3 1, 165 ⇨ 973* 885 ⇨ 727* 310 ⇨ 247* 288 ⇨ 221* 291 ⇨ 288 365 ⇨ 350 160 ⇨ 101* UK 1, 4 1, 248 ⇨ 832** 656 ⇨ 576** 592 ⇨ 256** nd ⇨ (301) nd ⇨ 353 nd ⇨ 261 nd ⇨ 218
Клинические испытания в 6 европейских странах: среднегодовые темпы роста / количество заявлений ДО и ПОСЛЕ имплементации Директивы Sponsorship and trial-phase specific patterns: AAGR (A) and prior-posterior implementation means (B) All trials CS trials NCS trials Ph III trials Ph IV trials A AAGR (Period 2001 to 2009) (%) IT +5. 0* +1. 3 +13. 0** +32. 8** +6. 3* +1. 5 +14. 7** ES +2. 5* +3. 1 +0. 7 +2. 5 +7. 1* -1. 1 +5. 5 NL -1. 9* -2. 0* -1. 9 +1. 1 -3. 8* -2. 8* -5. 7* DE -2. 3 -- -- -5. 3* -1. 6 -4. 3* +6. 4 FR -3. 0* -2. 8* -3. 4* -4. 5* -0. 3 -0. 7 -7. 3** UK -5. 3* -0. 4 -15. 2* -- -- B Means (Prior-Posterior Comparison) (n CTA) IT 1 587 ⇨ 744* 433 ⇨ 479 153 ⇨ 260* 9 ⇨ 21* 206 ⇨ 280* 311 ⇨ 344 47 ⇨ 87* ES 1 576 ⇨ 626 446 ⇨ 556 130 ⇨ 104 90 ⇨ 92 142 ⇨ 175 278 ⇨ 272 67 ⇨ 101 NL 2 697 ⇨ 597* 405 ⇨ 351 292 ⇨ 246 139 ⇨ 126 161 ⇨ 132 203 ⇨ 177 73 ⇨ 67 DE 1 1, 497 ⇨ 1, 428* (1, 300) ⇨ 1, 170 (197) ⇨ 259 462 ⇨ 340* 340 ⇨ 321 437 ⇨ 368* 65 ⇨ 144* FR 3 1, 165 ⇨ 973* 885 ⇨ 727* 310 ⇨ 247* 288 ⇨ 221* 291 ⇨ 288 365 ⇨ 350 160 ⇨ 101* UK 1, 4 1, 248 ⇨ 832** 656 ⇨ 576** 592 ⇨ 256** nd ⇨ (301) nd ⇨ 353 nd ⇨ 261 nd ⇨ 218
 Среднегодовые темпы роста клинических испытаний в других регионах «Безусловным и общеизвестным фактом является непрекращающаяся тенденция перемещения КИ в такназываемые развивающиеся регионы… в Азию, Латинскую Америку и восточно-европейские страны, не входящие в Европейский Союз…» [Markus Hartmann, Trials, 2012]
Среднегодовые темпы роста клинических испытаний в других регионах «Безусловным и общеизвестным фактом является непрекращающаяся тенденция перемещения КИ в такназываемые развивающиеся регионы… в Азию, Латинскую Америку и восточно-европейские страны, не входящие в Европейский Союз…» [Markus Hartmann, Trials, 2012]
 Среднегодовые темпы роста абсолютного количества заявлений на проведение клинических испытаний в других регионах (2001 -2009) Европейский Союз (4) -1. 9 -5. 3% Северная Америка Азия 5% 5% Тайвань Сингапур Китай Южная Корея Япония 6% 7% 30% 4%
Среднегодовые темпы роста абсолютного количества заявлений на проведение клинических испытаний в других регионах (2001 -2009) Европейский Союз (4) -1. 9 -5. 3% Северная Америка Азия 5% 5% Тайвань Сингапур Китай Южная Корея Япония 6% 7% 30% 4%
 Влияние Директивы 2001/20/ЕС на размещение проектов КИ в странах ЕС «Было бы неправильным объяснять уменьшение количества клинических испытаний только внедрением Директивы 2001/20/ЕС. Тем не менее, ее положения напрямую повлияли на стоимость и возможность проведения клинических испытаний в ЕС… Таким образом, существующие положения Директивы 2001/20/ЕС, по видимому, препятствуют проведению клинических испытаний в Европе и это обстоятельство заставило Комиссию действовать. » [Предложения для Постановления Европейского Парламента и Совета «О клинических испытаниях медицинских продуктов…» , Европейская Комиссия, июль 2012 ]
Влияние Директивы 2001/20/ЕС на размещение проектов КИ в странах ЕС «Было бы неправильным объяснять уменьшение количества клинических испытаний только внедрением Директивы 2001/20/ЕС. Тем не менее, ее положения напрямую повлияли на стоимость и возможность проведения клинических испытаний в ЕС… Таким образом, существующие положения Директивы 2001/20/ЕС, по видимому, препятствуют проведению клинических испытаний в Европе и это обстоятельство заставило Комиссию действовать. » [Предложения для Постановления Европейского Парламента и Совета «О клинических испытаниях медицинских продуктов…» , Европейская Комиссия, июль 2012 ]
 Какие изменения ожидаются в законодательстве ЕС относительно клинических исследований?
Какие изменения ожидаются в законодательстве ЕС относительно клинических исследований?
 Регулирующие компоненты системы международных клинических исследований • Региональное законодательное регулирование (планируется Постановление Европейского парламента и Совета) • Региональное рекомендательное регулирование (Директивы ЕС) • Национальные законодательства • Межгосударственные решения / Руководства (IСH-GCP, Хельсинская декларация) • Региональное рекомендательное регулирование (Директивы ЕС)
Регулирующие компоненты системы международных клинических исследований • Региональное законодательное регулирование (планируется Постановление Европейского парламента и Совета) • Региональное рекомендательное регулирование (Директивы ЕС) • Национальные законодательства • Межгосударственные решения / Руководства (IСH-GCP, Хельсинская декларация) • Региональное рекомендательное регулирование (Директивы ЕС)
 Ожидаемые изменения в законодательстве ЕС относительно клинических испытаний • Предполагается отмена Директивы 2001/20/ЕС (являющейся рекомендательным документом) • и замещение ее Постановлением Европейского Парламента и Совета «О клинических испытаниях медицинских продуктов» (Постановление, в отличие от Директивы, является законодательным актом, обязательным для выполнения всеми государствами-участниками ЕС).
Ожидаемые изменения в законодательстве ЕС относительно клинических испытаний • Предполагается отмена Директивы 2001/20/ЕС (являющейся рекомендательным документом) • и замещение ее Постановлением Европейского Парламента и Совета «О клинических испытаниях медицинских продуктов» (Постановление, в отличие от Директивы, является законодательным актом, обязательным для выполнения всеми государствами-участниками ЕС).
 Ожидаемые изменения в законодательстве ЕС относительно клинических испытаний Сфера применения предлагаемого Регулирования клинические испытания медицинских продуктов, не предусматривающие «интервенций» т. е. идентична сфере применения Директивы 2001/20/ЕС
Ожидаемые изменения в законодательстве ЕС относительно клинических испытаний Сфера применения предлагаемого Регулирования клинические испытания медицинских продуктов, не предусматривающие «интервенций» т. е. идентична сфере применения Директивы 2001/20/ЕС
 Разделы регулирования клинических исследований, в которых ожидаются изменения (1) • Процедура авторизации (разрешения) исследования; • Внедрение возможной практики «научного консультирования» регуляторными органами; • Защита субъектов исследования и информированное согласие (при неотложных состояниях); • Этические комиссии;
Разделы регулирования клинических исследований, в которых ожидаются изменения (1) • Процедура авторизации (разрешения) исследования; • Внедрение возможной практики «научного консультирования» регуляторными органами; • Защита субъектов исследования и информированное согласие (при неотложных состояниях); • Этические комиссии;
 Разделы регулирования клинических исследований, в которых ожидаются изменения (2) • Исследуемый продукт и «вспомогательные медицинские продукты» ; • Страхование и компенсации; • Упрощение правил для испытаний авторизированных (зарегистрированных) медицинских продуктов; • Юридическая форма регулирования.
Разделы регулирования клинических исследований, в которых ожидаются изменения (2) • Исследуемый продукт и «вспомогательные медицинские продукты» ; • Страхование и компенсации; • Упрощение правил для испытаний авторизированных (зарегистрированных) медицинских продуктов; • Юридическая форма регулирования.
 Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: ПРОЦЕДУРА РАЗРЕШЕНИЯ (1) • Внедрение единого электронного портала ЕС для подачи заявления на проведение КИ и рассмотрения документов; • Введение институции и понятия «отчетного государства-члена» и «заинтересованного государства-члена» ; • Установление четкого механизма назначения «отчетного государства-члена» и Рассмотрение заявления одним и только одним государством-членом в кооперации с другими странами, в которых планируется проведение исследования;
Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: ПРОЦЕДУРА РАЗРЕШЕНИЯ (1) • Внедрение единого электронного портала ЕС для подачи заявления на проведение КИ и рассмотрения документов; • Введение институции и понятия «отчетного государства-члена» и «заинтересованного государства-члена» ; • Установление четкого механизма назначения «отчетного государства-члена» и Рассмотрение заявления одним и только одним государством-членом в кооперации с другими странами, в которых планируется проведение исследования;
 Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: ПРОЦЕДУРА РАЗРЕШЕНИЯ (2) • Определение сроков рассмотрения заявления и их сокращение; • Облегченная процедура авторизации исследования для дополнительно вовлекаемых стран (членов ЕС); • Усиление кооперации регуляторных органов стран-членов при авторизации КИ; • Введение понятия «низко-интервенционных исследований» и его определение. «Наднациональный» разрешительный / регулирующий орган ожидаемым Регулированием не предусмотрен
Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: ПРОЦЕДУРА РАЗРЕШЕНИЯ (2) • Определение сроков рассмотрения заявления и их сокращение; • Облегченная процедура авторизации исследования для дополнительно вовлекаемых стран (членов ЕС); • Усиление кооперации регуляторных органов стран-членов при авторизации КИ; • Введение понятия «низко-интервенционных исследований» и его определение. «Наднациональный» разрешительный / регулирующий орган ожидаемым Регулированием не предусмотрен
 Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: ПОДАЧА ЗАЯВЛЕНИЯ (1) • Спонсор, на свое усмотрение, предлагает регуляторному органу одного из государствчленов принять заявительное досье (“reporting Member State”); • На протяжении 6 дней (срок валидации заявления) предложение принимается или отклоняется с предложением другому «заинтересованному государству-члену» быть “reporting Member State”; При подаче заявительного досье и его рассмотрении используется принцип «решения по умолчанию при соблюдении установленных сроков»
Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: ПОДАЧА ЗАЯВЛЕНИЯ (1) • Спонсор, на свое усмотрение, предлагает регуляторному органу одного из государствчленов принять заявительное досье (“reporting Member State”); • На протяжении 6 дней (срок валидации заявления) предложение принимается или отклоняется с предложением другому «заинтересованному государству-члену» быть “reporting Member State”; При подаче заявительного досье и его рассмотрении используется принцип «решения по умолчанию при соблюдении установленных сроков»
 Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: ПОДАЧА ЗАЯВЛЕНИЯ (2) • В эти же сроки происходит оценка комплектности и правильности оформления заявительного досье; • При наличии замечаний спонсору дается максимально 6 дней для уточнений; • Экспертиза (оценка) заявительного досье продолжается от 10 -30 дней (зависит от типа исследования) и заканчивается «датой оценки» ; • Только и только “reporting Member State” может запрашивать дополнительную информацию между днем валидации и датой заключения по оценке.
Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: ПОДАЧА ЗАЯВЛЕНИЯ (2) • В эти же сроки происходит оценка комплектности и правильности оформления заявительного досье; • При наличии замечаний спонсору дается максимально 6 дней для уточнений; • Экспертиза (оценка) заявительного досье продолжается от 10 -30 дней (зависит от типа исследования) и заканчивается «датой оценки» ; • Только и только “reporting Member State” может запрашивать дополнительную информацию между днем валидации и датой заключения по оценке.
 Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: ПОДАЧА ЗАЯВЛЕНИЯ (3) • Только и только “reporting Member State” может запрашивать у Спонсора дополнительную информацию между датой валидации и датой окончательной оценки; • «Заинтересованное государство-член» должно провести собственную оценку заявленного досье, но в пределах 10 дней с даты валидации; • Сроки направления и ожидания ответов на дополнительные запросы “reporting Mamber State” и “Member State concerned” очень короткие. При подаче заявительного досье и его рассмотрении используется принцип «решения по умолчанию при соблюдении установленных сроков»
Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: ПОДАЧА ЗАЯВЛЕНИЯ (3) • Только и только “reporting Member State” может запрашивать у Спонсора дополнительную информацию между датой валидации и датой окончательной оценки; • «Заинтересованное государство-член» должно провести собственную оценку заявленного досье, но в пределах 10 дней с даты валидации; • Сроки направления и ожидания ответов на дополнительные запросы “reporting Mamber State” и “Member State concerned” очень короткие. При подаче заявительного досье и его рассмотрении используется принцип «решения по умолчанию при соблюдении установленных сроков»
 Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: ПОДАЧА ЗАЯВЛЕНИЯ (4) • Спонсор уведомляется о решении регуляторного органа «reporting Member State” в пределах 10 дней после даты оценки (посредством размещения решения на едином портале). Таким образом, общая продолжительность рассмотрения заявления составит минимум 40 дней (при отсутствии дополнительных запросов от регуляторного органа reporting Member State)
Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: ПОДАЧА ЗАЯВЛЕНИЯ (4) • Спонсор уведомляется о решении регуляторного органа «reporting Member State” в пределах 10 дней после даты оценки (посредством размещения решения на едином портале). Таким образом, общая продолжительность рассмотрения заявления составит минимум 40 дней (при отсутствии дополнительных запросов от регуляторного органа reporting Member State)
 Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: Информированное согласие Уточнения в части получения информированного согласия у пациентов с неотложными состояниями «… Информированное согласие может быть получено после включения [пациента] в клиническое испытание с последующим его подписанием… при соблюдении следующих условий… - неотложность ситуации , связанная с внезапно возникшей угрожающей жизни ситуацией… - Отсутствие законного представителя…»
Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: Информированное согласие Уточнения в части получения информированного согласия у пациентов с неотложными состояниями «… Информированное согласие может быть получено после включения [пациента] в клиническое испытание с последующим его подписанием… при соблюдении следующих условий… - неотложность ситуации , связанная с внезапно возникшей угрожающей жизни ситуацией… - Отсутствие законного представителя…»
 Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: Этические комиссии Этическая оценка по-прежнему будет осуществляться на национальной основе в каждой заинтересованной стране и/или месте проведения КИ Предлагаемое Регулирование , в отличие от Директивы, не устанавливает какой орган или органы проводит этическую оценку и выдает разрешение. Каждое государство самостоятельно решает иметь ли одну центральную и/или локальные этические комиссии.
Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: Этические комиссии Этическая оценка по-прежнему будет осуществляться на национальной основе в каждой заинтересованной стране и/или месте проведения КИ Предлагаемое Регулирование , в отличие от Директивы, не устанавливает какой орган или органы проводит этическую оценку и выдает разрешение. Каждое государство самостоятельно решает иметь ли одну центральную и/или локальные этические комиссии.
 Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: Отчеты по безопасности • Необязательность рапортирования исследователем неблагоприятных явлений спонсору (если это предусмотрено протоколом); • Спонсор напрямую сообщает о SUSAR в Европейскую EUDRAVigilance базу данных • Упрощенная подача годового отчета по безопасности; • Годовой отчет по безопасности не подается для зарегистрированных ЛС (используемых в рамках утвержденных показаний)
Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: Отчеты по безопасности • Необязательность рапортирования исследователем неблагоприятных явлений спонсору (если это предусмотрено протоколом); • Спонсор напрямую сообщает о SUSAR в Европейскую EUDRAVigilance базу данных • Упрощенная подача годового отчета по безопасности; • Годовой отчет по безопасности не подается для зарегистрированных ЛС (используемых в рамках утвержденных показаний)
 Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: страхование и компенсации • Необязательность страхования распространяется только на малоинвазивные некоммерческие исследования, которые не представляют дополнительных рисков для субъектов.
Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения: страхование и компенсации • Необязательность страхования распространяется только на малоинвазивные некоммерческие исследования, которые не представляют дополнительных рисков для субъектов.
 Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения • Введение нового Регулирования планируется в 2014 году • Переходный период займет 2 года (одновременно будут действовать положения Директивы и нового Регулирования)
Регулирование клинических испытаний в Европейском Союзе: ожидаемые изменения • Введение нового Регулирования планируется в 2014 году • Переходный период займет 2 года (одновременно будут действовать положения Директивы и нового Регулирования)
 Влияние предстоящих изменений на рынок клинических исследований в «развивающихся регионах» • Введение «Постановления Европейского Парламента и Совета по клиническим исследованиям» уменьшит темпы и количество размещаемых проектов клинических испытаний на 10 -15% в странах с более жестким регулированием, непредсказуемыми изменениями и более длительным периодом получения разрешения.
Влияние предстоящих изменений на рынок клинических исследований в «развивающихся регионах» • Введение «Постановления Европейского Парламента и Совета по клиническим исследованиям» уменьшит темпы и количество размещаемых проектов клинических испытаний на 10 -15% в странах с более жестким регулированием, непредсказуемыми изменениями и более длительным периодом получения разрешения.
 Влияние предстоящих изменений на рынок клинических исследований в «развивающихся регионах» • Введение «Постановления Европейского Парламента и Совета по клиническим исследованиям» будет способствовать «возвращению» клинических исследований в страны, являющиеся разработчиками инновационных медицинских продуктов.
Влияние предстоящих изменений на рынок клинических исследований в «развивающихся регионах» • Введение «Постановления Европейского Парламента и Совета по клиническим исследованиям» будет способствовать «возвращению» клинических исследований в страны, являющиеся разработчиками инновационных медицинских продуктов.
![The end [конец] The end [конец]](https://present5.com/presentation/cc8796c43d8b797409abe22909dca544/image-34.jpg) The end [конец]
The end [конец]


