49a522d134adb43825e9af511b34be5c.ppt
- Количество слайдов: 42

Web Hépato Session 60ème congrès AASLD Boston du 30 octobre au 3 novembre 2009 Post-AASLD : les messages pour la pratique

Web Hépato Session Comment optimiser le traitement des hépatites chroniques virales ? Denis Ouzan Nouvelles molécules Autres hépatopathies Patrick Delasalle Conclusion Bertrand Hanslik (Saint-Laurent du Var) (Grasse) (Montpellier) Président de la Commission Hépatologie du CREGG

60 e congrès AASLD Boston du 30 oct au 3 nov 2009 Introduction Bertrand Hanslik Président de la Commission Hépatologie du CREGG (Montpellier)

60 e congrès AASLD Boston du 30 oct au 3 nov 2009 Denis Ouzan (Saint-Laurent du Var) Comment optimiser le traitement des hépatites chroniques virales ?
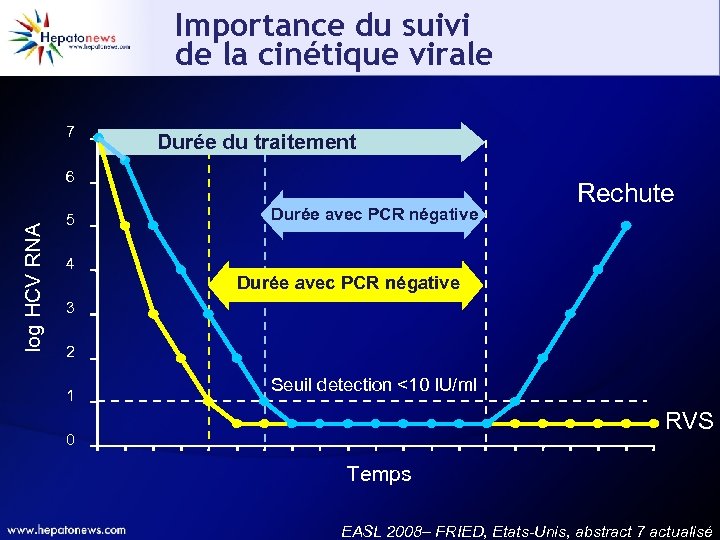
Importance du suivi de la cinétique virale 7 Durée du traitement log HCV RNA 6 5 4 Durée avec PCR négative Rechute Durée avec PCR négative 3 2 1 Seuil detection <10 IU/ml RVS 0 Temps EASL 2008– FRIED, Etats-Unis, abstract 7 actualisé
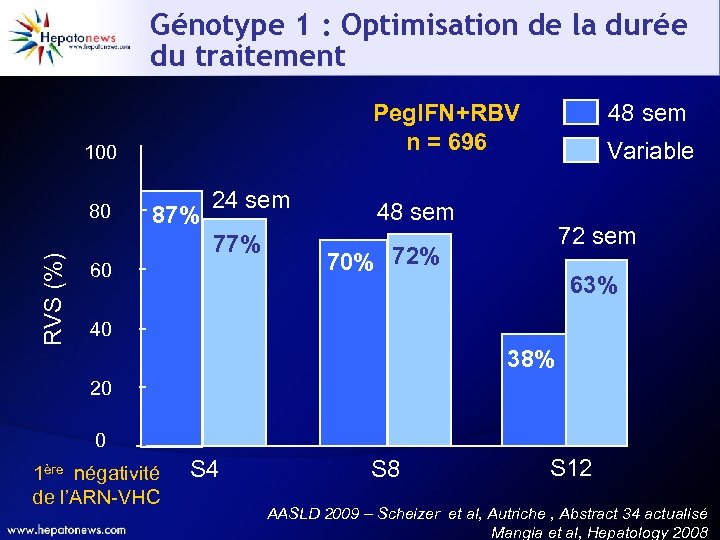
Génotype 1 : Optimisation de la durée du traitement Peg. IFN+RBV n = 696 100 RVS (%) 80 87% 24 sem 77% 60 48 sem Variable 48 sem 72 sem 70% 72% 63% 40 38% 20 0 1ère négativité de l’ARN-VHC S 4 S 8 S 12 AASLD 2009 – Scheizer et al, Autriche , Abstract 34 actualisé Mangia et al, Hepatology 2008

Génotype 3 : quelle durée de traitement ? (1) • Étude prospective multicentrique italienne (13 centres) STANDARD Traitement 24 sem. PEGα-2 b 1, 5 µg/kg/sem + RBV 1 -1. 2 g/j 24 sem. (n = 190) 374 malades G 3 naïfs n = 116 ARN VHC S 4 négatif VARIABLE PEGα-2 b 1, 5µg/kg/sem + RBV 1 -1. 2 mg/j 12 ou 36 sem. (n = 184) Traitement 12 sem. ARN VHC S 4 positif Traitement 36 sem. n = 68 AASLD 2009 – Mangia A. , Italie, Abstract 1584 actualisé
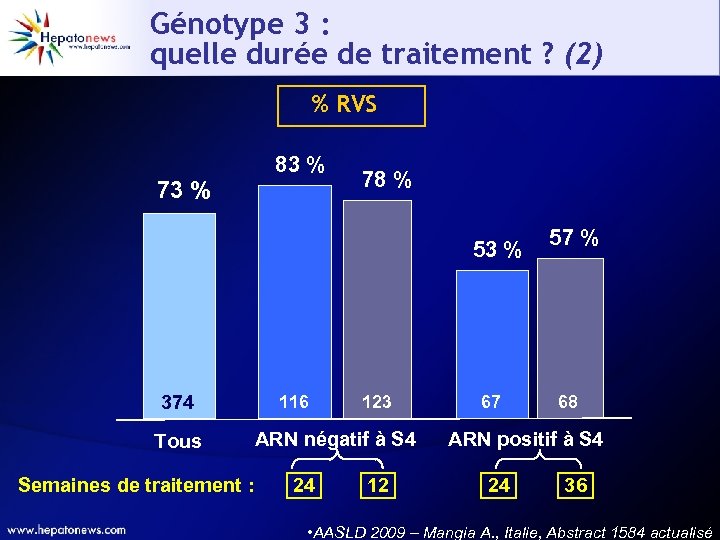
Génotype 3 : quelle durée de traitement ? (2) % RVS 73 % 83 % 78 % 53 % 374 Tous Semaines de traitement : 116 123 ARN négatif à S 4 24 12 67 57 % 68 ARN positif à S 4 24 36 • AASLD 2009 – Mangia A. , Italie, Abstract 1584 actualisé

Après traitement, prédiction dès S 12 de la RVS • • 573 patients traités par PEG-IFN + RBV Evaluation ARN-VHC à S 12 et S 24 post-traitement (Seuil d’indétectabilité : ARN-VHC ≤ 10 UI (TMA)) Prédire la guérison dès S 12 post-traitement • S 12 post-traitement 71% (408/573) VPP : 99, 7% • S 24 post-traitement 71% (409/573) AASLD 2009 – Martinot-Peignoux et al, France, Abstract 118 actualisé
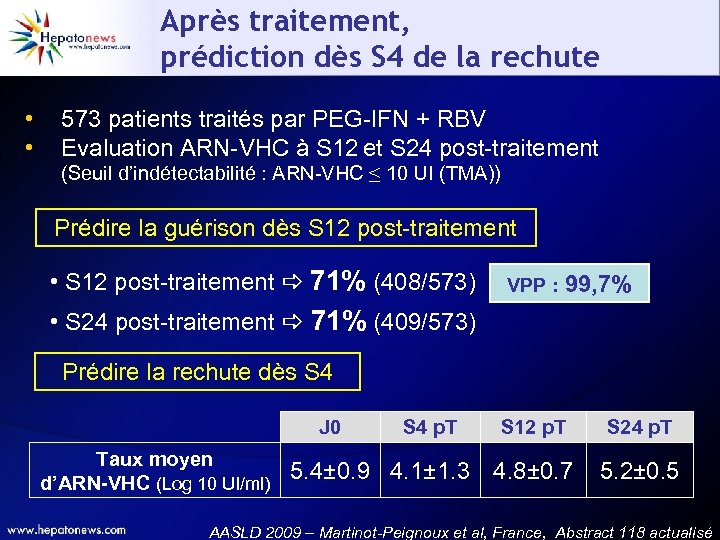
Après traitement, prédiction dès S 4 de la rechute • • 573 patients traités par PEG-IFN + RBV Evaluation ARN-VHC à S 12 et S 24 post-traitement (Seuil d’indétectabilité : ARN-VHC ≤ 10 UI (TMA)) Prédire la guérison dès S 12 post-traitement • S 12 post-traitement 71% (408/573) VPP : 99, 7% • S 24 post-traitement 71% (409/573) Prédire la rechute dès S 4 J 0 Taux moyen d’ARN-VHC (Log 10 UI/ml) S 4 p. T S 12 p. T 5. 4± 0. 9 4. 1± 1. 3 4. 8± 0. 7 S 24 p. T 5. 2± 0. 5 AASLD 2009 – Martinot-Peignoux et al, France, Abstract 118 actualisé
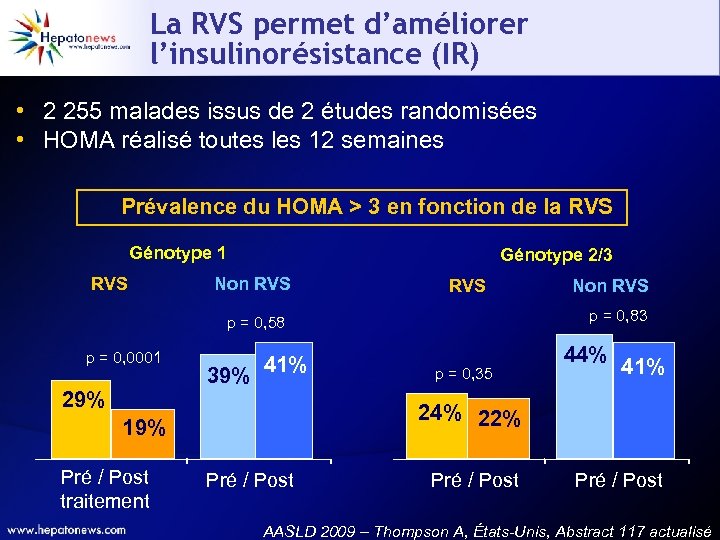
La RVS permet d’améliorer l’insulinorésistance (IR) • 2 255 malades issus de 2 études randomisées • HOMA réalisé toutes les 12 semaines Prévalence du HOMA > 3 en fonction de la RVS Génotype 1 RVS Génotype 2/3 Non RVS p = 0, 83 p = 0, 58 p = 0, 0001 29% 39% 41% p = 0, 35 44% 41% 24% 22% 19% Pré / Post traitement Non RVS Pré / Post AASLD 2009 – Thompson A, États-Unis, Abstract 117 actualisé
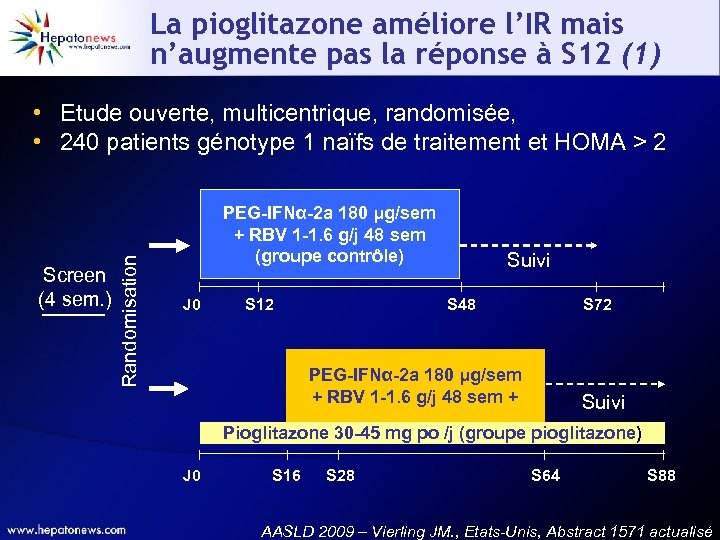
La pioglitazone améliore l’IR mais n’augmente pas la réponse à S 12 (1) Screen (4 sem. ) Randomisation • Etude ouverte, multicentrique, randomisée, • 240 patients génotype 1 naïfs de traitement et HOMA > 2 PEG-IFNα-2 a 180 μg/sem + RBV 1 -1. 6 g/j 48 sem (groupe contrôle) J 0 S 12 Suivi S 48 S 72 PEG-IFNα-2 a 180 μg/sem + RBV 1 -1. 6 g/j 48 sem + Suivi Pioglitazone 30 -45 mg po /j (groupe pioglitazone) J 0 S 16 S 28 S 64 S 88 AASLD 2009 – Vierling JM. , Etats-Unis, Abstract 1571 actualisé
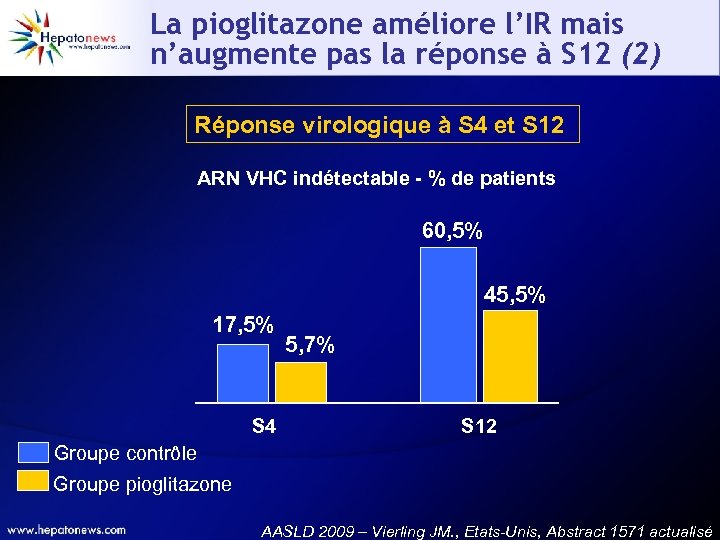
La pioglitazone améliore l’IR mais n’augmente pas la réponse à S 12 (2) Réponse virologique à S 4 et S 12 ARN VHC indétectable - % de patients 60, 5% 45, 5% 17, 5% S 4 5, 7% S 12 Groupe contrôle Groupe pioglitazone AASLD 2009 – Vierling JM. , Etats-Unis, Abstract 1571 actualisé
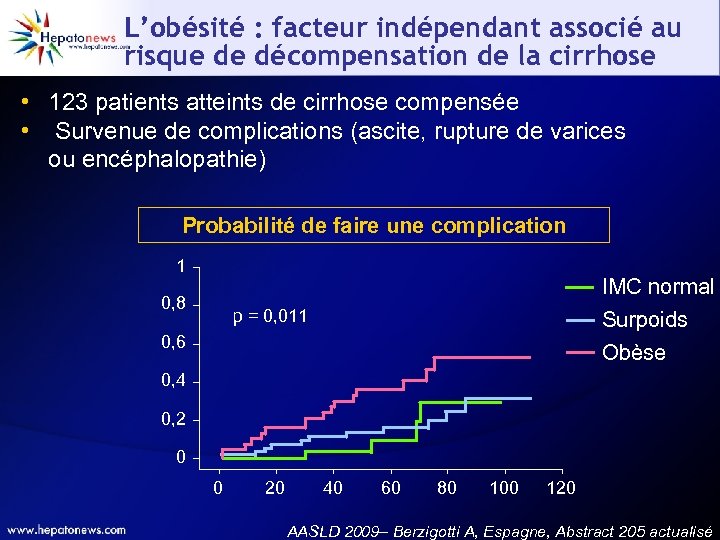
L’obésité : facteur indépendant associé au risque de décompensation de la cirrhose • 123 patients atteints de cirrhose compensée • Survenue de complications (ascite, rupture de varices ou encéphalopathie) Probabilité de faire une complication 1 0, 8 IMC normal Surpoids p = 0, 011 0, 6 Obèse 0, 4 0, 2 0 0 20 40 60 80 100 120 AASLD 2009– Berzigotti A, Espagne, Abstract 205 actualisé
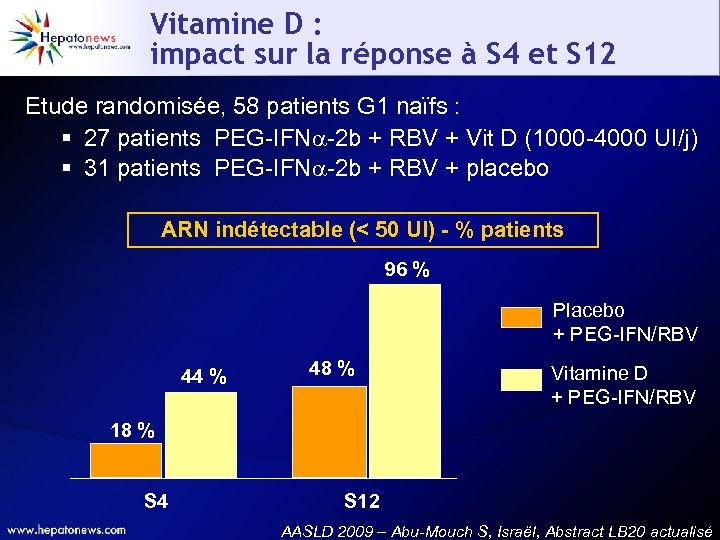
Vitamine D : impact sur la réponse à S 4 et S 12 Etude randomisée, 58 patients G 1 naïfs : § 27 patients PEG-IFN -2 b + RBV + Vit D (1000 -4000 UI/j) § 31 patients PEG-IFN -2 b + RBV + placebo ARN indétectable (< 50 UI) - % patients 96 % Placebo + PEG-IFN/RBV 44 % 48 % Vitamine D + PEG-IFN/RBV 18 % S 4 S 12 AASLD 2009 – Abu-Mouch S, Israël, Abstract LB 20 actualisé
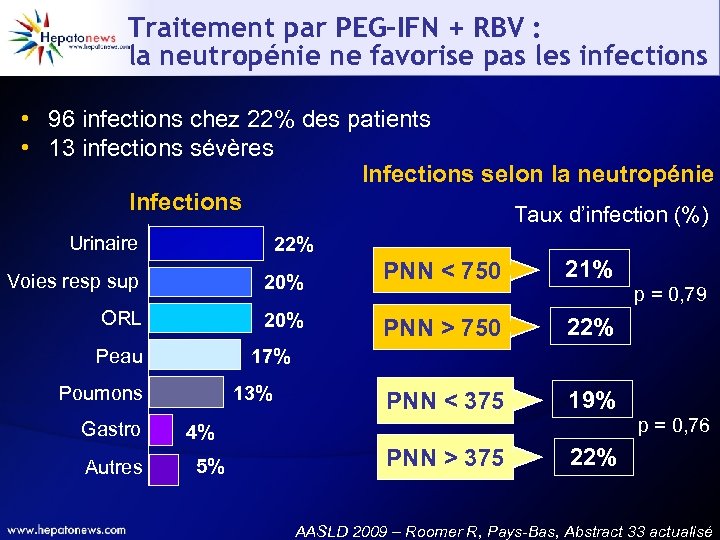
Traitement par PEG-IFN + RBV : la neutropénie ne favorise pas les infections • 96 infections chez 22% des patients • 13 infections sévères Infections selon la neutropénie Infections Taux d’infection (%) Urinaire 22% ORL 20% Peau Autres PNN > 750 22% 19% 22% p = 0, 79 17% 13% Poumons Gastro 21% PNN > 375 20% PNN < 750 PNN < 375 Voies resp sup 4% 5% p = 0, 76 AASLD 2009 – Roomer R, Pays-Bas, Abstract 33 actualisé

Prédiction génétique de la réponse à la bithérapie pégylée chez les patients G 1 • 1 628 malades (essais de bithérapie pégylée) • Origine ethnique déclarée • Réponse virologique définie • 1 polymorphisme : § situé sur le chromosome 19 § situé pres du gène de l’IL 28 B (IFN λ-3) : 2 allèles (C et T) § fortement lié à la RVS Ge D et al, Nature 2009 46 : 399 AASLD 2009 – Thompson AJ, Etats-Unis, Abstract LB 5 actualisé
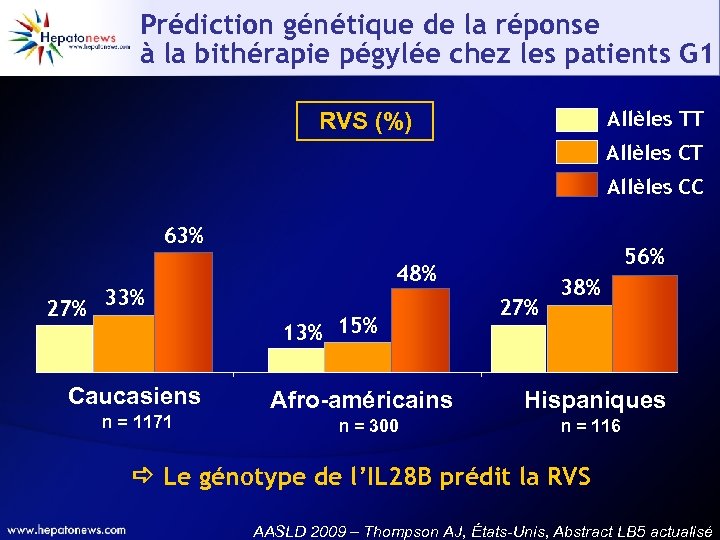
Prédiction génétique de la réponse à la bithérapie pégylée chez les patients G 1 Allèles TT RVS (%) Allèles CT Allèles CC 63% 27% 33% 48% 69 Caucasiens n = 1171 56% 13% 15% Afro-américains n = 300 27% 38% Hispaniques n = 116 Le génotype de l’IL 28 B prédit la RVS AASLD 2009 – Thompson AJ, États-Unis, Abstract LB 5 actualisé
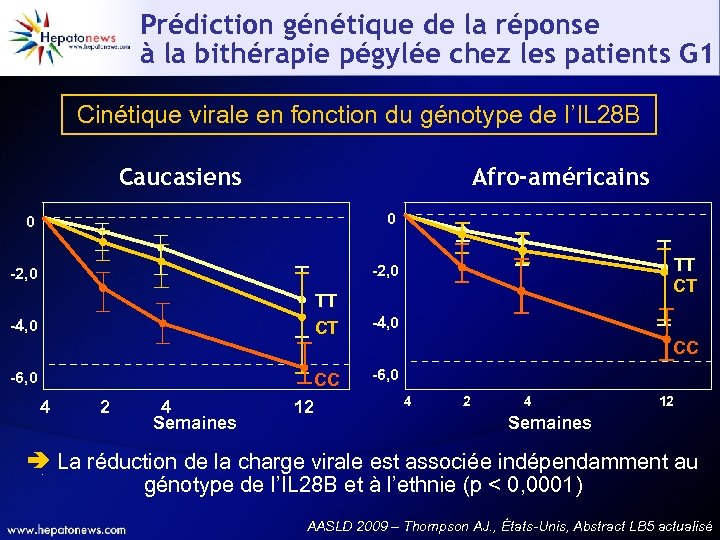
Prédiction génétique de la réponse à la bithérapie pégylée chez les patients G 1 Cinétique virale en fonction du génotype de l’IL 28 B Caucasiens Afro-américains 0 0 -2, 0 TT CT -4, 0 CC -6, 0 CC 4 2 4 Semaines 12 -6, 0 4 2 4 12 Semaines La réduction de la charge virale est associée indépendamment au génotype de l’IL 28 B et à l’ethnie (p < 0, 0001) AASLD 2009 – Thompson AJ. , États-Unis, Abstract LB 5 actualisé
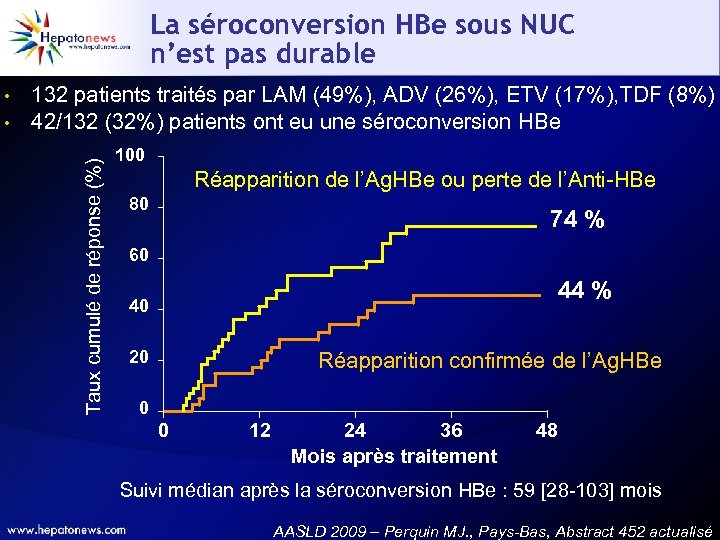
La séroconversion HBe sous NUC n’est pas durable • 132 patients traités par LAM (49%), ADV (26%), ETV (17%), TDF (8%) 42/132 (32%) patients ont eu une séroconversion HBe Taux cumulé de réponse (%) • 100 Réapparition de l’Ag. HBe ou perte de l’Anti-HBe 80 74 % 60 44 % 40 20 Réapparition confirmée de l’Ag. HBe 0 0 12 24 36 Mois après traitement 48 Suivi médian après la séroconversion HBe : 59 [28 -103] mois AASLD 2009 – Perquin MJ. , Pays-Bas, Abstract 452 actualisé
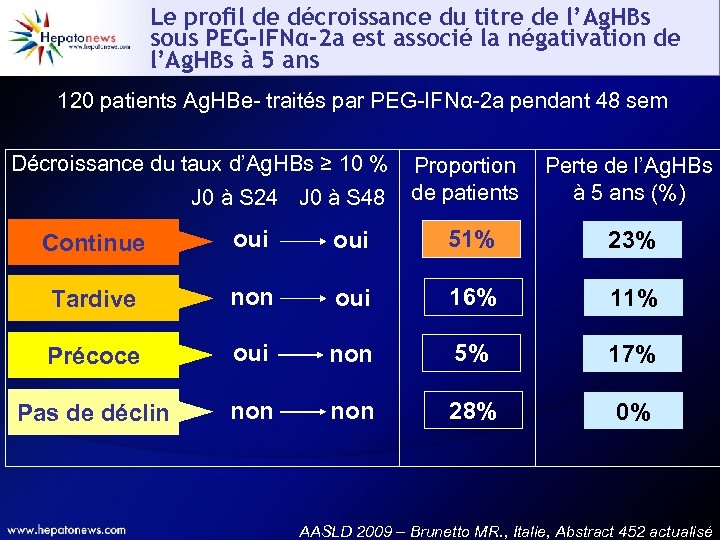
Le profil de décroissance du titre de l’Ag. HBs sous PEG-IFNα-2 a est associé la négativation de l’Ag. HBs à 5 ans 120 patients Ag. HBe- traités par PEG-IFNα-2 a pendant 48 sem Décroissance du taux d’Ag. HBs ≥ 10 % J 0 à S 24 J 0 à S 48 Proportion de patients Perte de l’Ag. HBs à 5 ans (%) Continue oui 51% 23% Tardive non oui 16% 11% Précoce oui non 5% 17% Pas de déclin non 28% 0% AASLD 2009 – Brunetto MR. , Italie, Abstract 452 actualisé
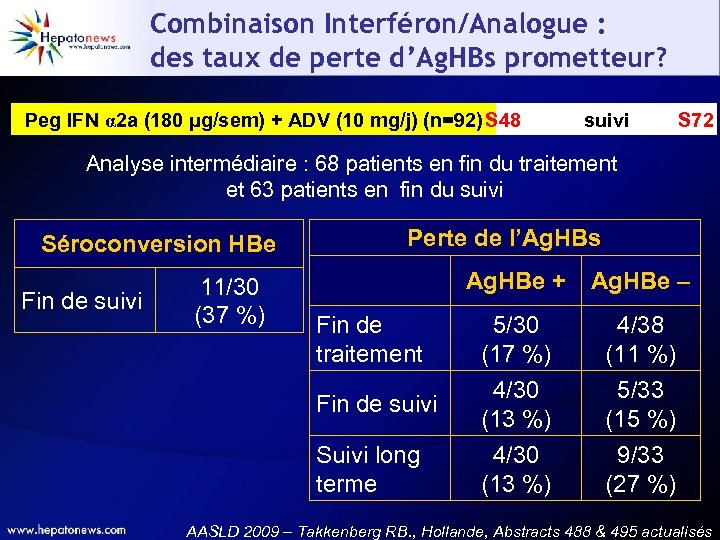
Combinaison Interféron/Analogue : des taux de perte d’Ag. HBs prometteur? Peg IFN α 2 a (180 µg/sem) + ADV (10 mg/j) (n=92) S 48 suivi S 72 Analyse intermédiaire : 68 patients en fin du traitement et 63 patients en fin du suivi Séroconversion HBe Fin de suivi Perte de l’Ag. HBs Ag. HBe + Ag. HBe – Fin de traitement 5/30 (17 %) 4/38 (11 %) Fin de suivi 4/30 (13 %) 5/33 (15 %) Suivi long terme 11/30 (37 %) 4/30 (13 %) 9/33 (27 %) AASLD 2009 – Takkenberg RB. , Hollande, Abstracts 488 & 495 actualisés

Le titrage de l’Ag. HBs en pratique • Prescription : – Titre d’Ag. HBs quantitatif – Mesure par le kit Architect quantitatif Abbott (qui nécessite une dilution pour les valeurs >250 UI/m. L) • Laboratoires spécialisés réalisant le test (Biomnis Ivry , Pasteur Cerba, Alphabio)

60 e congrès AASLD Boston du 30 oct au 3 nov 2009 Patrick Delasalle (Grasse) Nouvelles molécules dans le traitement du VHC Autres hépatopathies

Nouvelles molécules : Phases de développement Préclinique AVL-181 (Avila) Phase I IDX-184 (Idenix) ABT-333 (Abbott) PSI-7851 (Pharmasset) ABT- 072 (Abbott)* Phase II SCH 900518 Telaprevir (Janssen-Cilag) (Schering Plough) GS 9190 (Gilead) Boceprevir (Schering Plough) HCV-796 (Wyeth) ITMN-191 R 7227 * BI 207127 (Boehringer ) VCH-916 (Viro. Chem Pharma) MK-3281 (Merck) G 1 b > G 1 a > G 3 VCH-222 (Viro. Chem Pharma) Inhibiteur protéase Inhibiteur polymérase Phase III (Intermune, Roche) TMC 435350* (Tibotec Medivir) BI 201335 (Boehringer) * MK 7009 (Merck)* R 7128 (Roche, Pharmasset)* PF-00868554 (Pfizer) ANA 598 (Anadys)* * Phase pas encore débutée
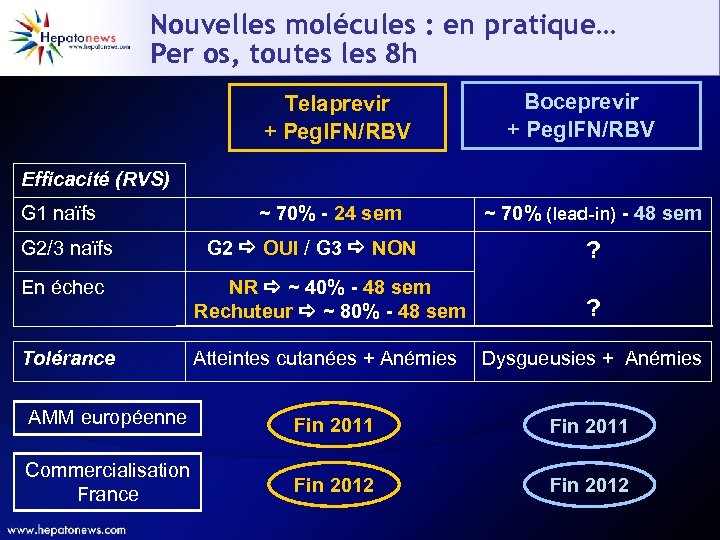
Nouvelles molécules : en pratique… Per os, toutes les 8 h Telaprevir + Peg. IFN/RBV Boceprevir + Peg. IFN/RBV Efficacité (RVS) G 1 naïfs G 2/3 naïfs ~ 70% - 24 sem G 2 OUI / G 3 NON ~ 70% (lead-in) - 48 sem ? En échec NR ~ 40% - 48 sem Rechuteur ~ 80% - 48 sem ? Tolérance Atteintes cutanées + Anémies Dysgueusies + Anémies AMM européenne Fin 2011 Commercialisation France Fin 2012
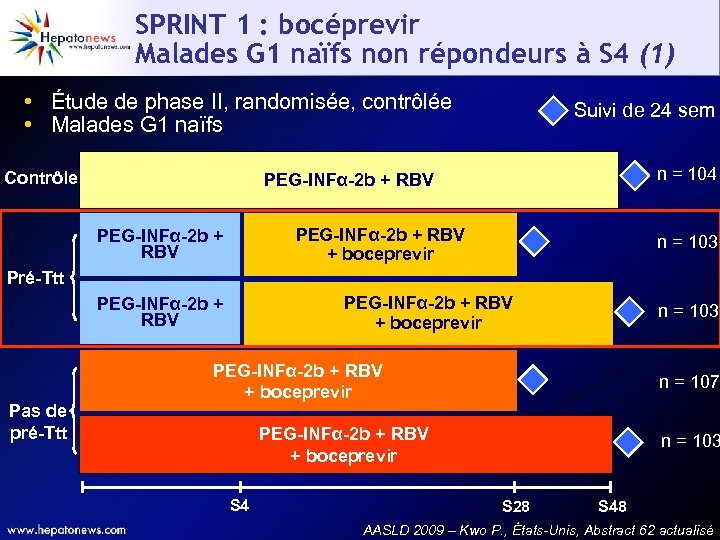
SPRINT 1 : bocéprevir Malades G 1 naïfs non répondeurs à S 4 (1) • Étude de phase II, randomisée, contrôlée • Malades G 1 naïfs Contrôle Suivi de 24 sem n = 104 PEG-INFα-2 b + RBV + boceprevir PEG-INFα-2 b + RBV n = 103 Pré-Ttt PEG-INFα-2 b + RBV + boceprevir PEG-INFα-2 b + RBV Pas de pré-Ttt n = 103 PEG-INFα-2 b + RBV + boceprevir n = 107 PEG-INFα-2 b + RBV + boceprevir S 4 n = 103 S 28 S 48 AASLD 2009 – Kwo P. , États-Unis, Abstract 62 actualisé
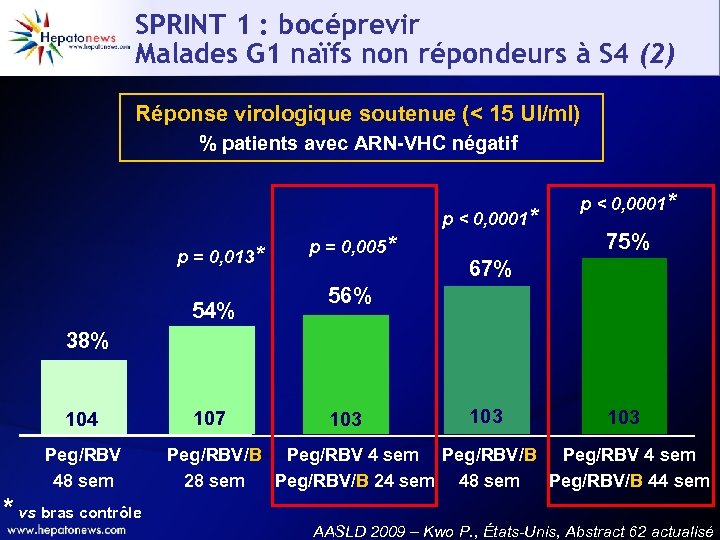
SPRINT 1 : bocéprevir Malades G 1 naïfs non répondeurs à S 4 (2) Réponse virologique soutenue (< 15 UI/ml) % patients avec ARN-VHC négatif p < 0, 0001* p = 0, 013* 54% p = 0, 005* p < 0, 0001* 75% 67% 56% 38% 104 Peg/RBV 48 sem * vs bras contrôle 107 103 103 Peg/RBV/B Peg/RBV 4 sem 28 sem Peg/RBV/B 24 sem 48 sem Peg/RBV/B 44 sem AASLD 2009 – Kwo P. , États-Unis, Abstract 62 actualisé
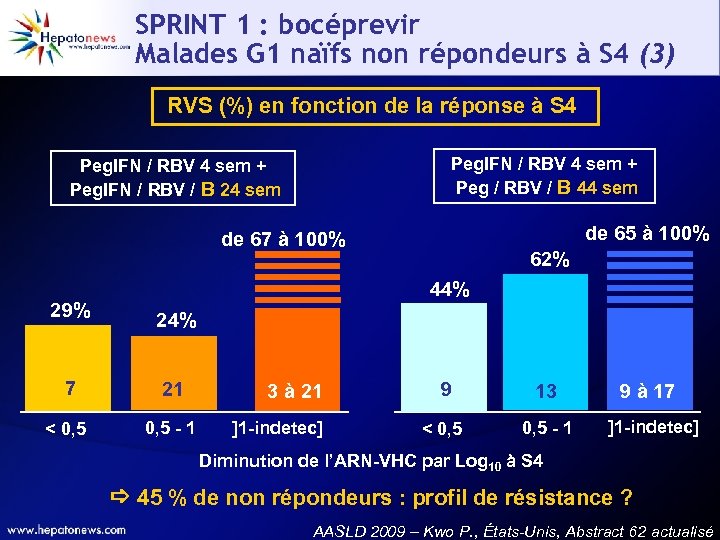
SPRINT 1 : bocéprevir Malades G 1 naïfs non répondeurs à S 4 (3) RVS (%) en fonction de la réponse à S 4 Peg. IFN / RBV 4 sem + Peg / RBV / B 44 sem Peg. IFN / RBV 4 sem + Peg. IFN / RBV / B 24 sem de 65 à 100% de 67 à 100% 29% 62% 44% 24% 7 21 < 0, 5 - 1 3 à 21 ]1 -indetec] 9 13 < 0, 5 - 1 9 à 17 ]1 -indetec] Diminution de l’ARN-VHC par Log 10 à S 4 45 % de non répondeurs : profil de résistance ? AASLD 2009 – Kwo P. , États-Unis, Abstract 62 actualisé

PROVE-2 : Télaprevir Malades G 1 naïfs – Etude européenne (1) • Étude de phase IIb, randomisée, contrôlée, multicentrique • n = 323 PR 48 Placebo + PEG-IFNα-2 a/RBV (n = 82) PEG-IFNα-2 a / RBV TVR + (n = 81) PEG-IFNα-2 a/RBV T 12/PR 24 T 12/PR 12 (n = 82) TVR + PEG-IFNα-2 a/RBV TVR + PEG-IFNα-2 a T 12/P 12 (n = 78) 0 S 12 S 24 S 48 S 72 AASLD 2008 – Zeuzem S, Allemagne, Abstract 243 actualisé
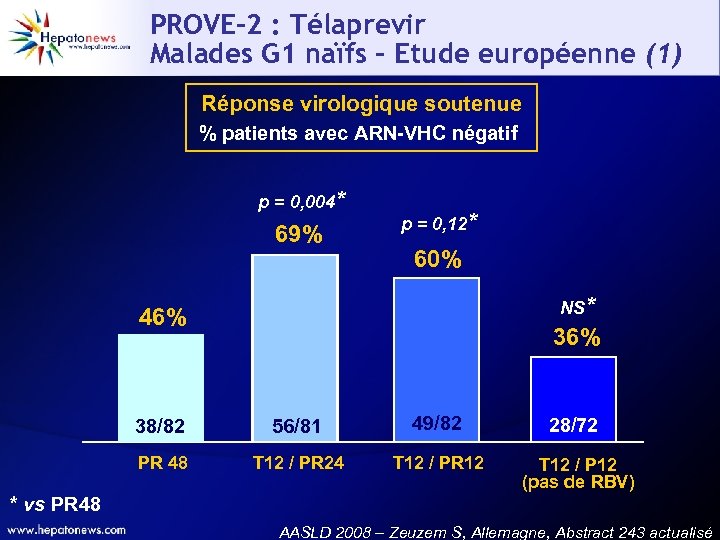
PROVE-2 : Télaprevir Malades G 1 naïfs – Etude européenne (1) Réponse virologique soutenue % patients avec ARN-VHC négatif p = 0, 004* 69% p = 0, 12* 60% NS* 46% 38/82 56/81 49/82 28/72 PR 48 T 12 / PR 24 T 12 / PR 12 T 12 / P 12 (pas de RBV) * vs PR 48 AASLD 2008 – Zeuzem S, Allemagne, Abstract 243 actualisé

INFORM-1 : 1ère étude d’association orale antiprotéase + inhibiteur de polymérase (1) • Étude randomisée, en double aveugle • Patients naïfs et non répondeurs génotype 1 NR partiels ou 1000 mg/12 h RG 7128 rechuteurs 600 mg/12 h RG 7227 n = 8/2 NR complets n = 8/2 Naïfs n = 8/2 PEGa-2 a-IFN + RBV 900 mg/12 h RG 7227 1000 mg/12 h RG 7128 900 mg/12 h RG 7227 Cohorte B PEGa-2 a-IFN + RBV 1000 mg/12 h RG 7128 Cohorte A Cohorte C Active/placebo J 1 J 4 J 14 S 48 NR complets = réduction ARN VHC < 1 log 10 UI/ml à S 4 ou < 2 log 10 UI/ml à S 12 AASLD 2009 – Gane EJ. , Nouvelle-Zélande, Abstract 193 actualisé
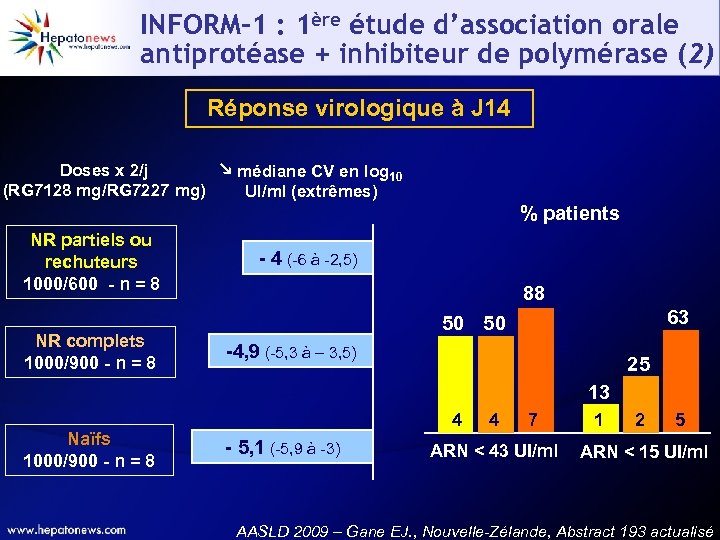
INFORM-1 : 1ère étude d’association orale antiprotéase + inhibiteur de polymérase (2) Réponse virologique à J 14 Doses x 2/j médiane CV en log 10 (RG 7128 mg/RG 7227 mg) UI/ml (extrêmes) % patients NR complets 1000/900 - n = 8 - 4 (-6 à -2, 5) 88 50 50 63 Naïfs NR partiels ou rechuteurs 1000/600 - n = 8 -4, 9 (-5, 3 à – 3, 5) 25 13 Naïfs 1000/900 - n = 8 4 - 5, 1 (-5, 9 à -3) 4 7 ARN < 43 UI/ml 1 2 5 ARN < 15 UI/ml AASLD 2009 – Gane EJ. , Nouvelle-Zélande, Abstract 193 actualisé
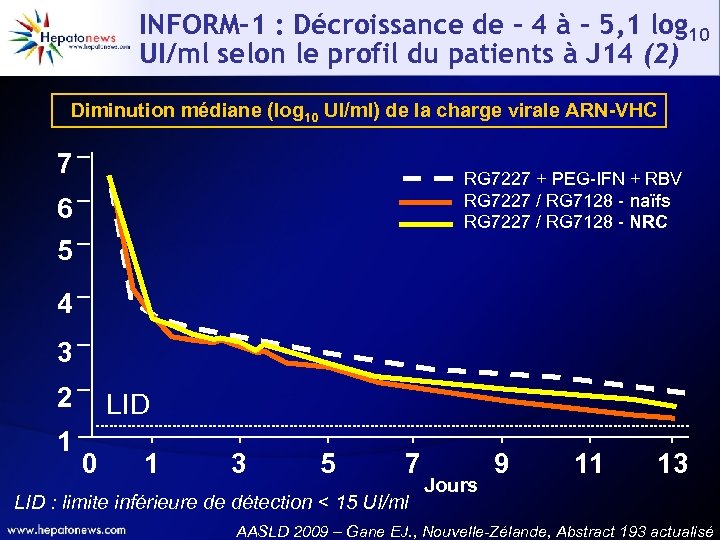
INFORM-1 : Décroissance de - 4 à - 5, 1 log 10 UI/ml selon le profil du patients à J 14 (2) Diminution médiane (log 10 UI/ml) de la charge virale ARN-VHC 7 RG 7227 + PEG-IFN + RBV RG 7227 / RG 7128 - naïfs RG 7227 / RG 7128 - NRC 6 5 4 3 2 1 LID 0 1 3 5 7 LID : limite inférieure de détection < 15 UI/ml Jours 9 11 13 AASLD 2009 – Gane EJ. , Nouvelle-Zélande, Abstract 193 actualisé
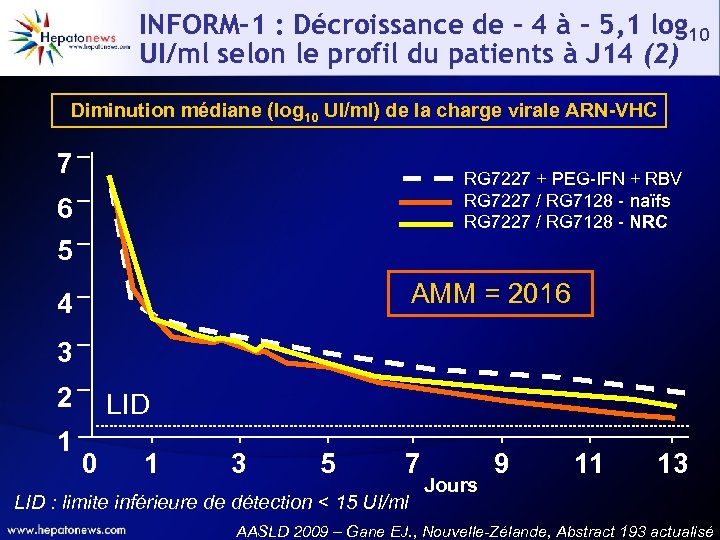
INFORM-1 : Décroissance de - 4 à - 5, 1 log 10 UI/ml selon le profil du patients à J 14 (2) Diminution médiane (log 10 UI/ml) de la charge virale ARN-VHC 7 RG 7227 + PEG-IFN + RBV RG 7227 / RG 7128 - naïfs RG 7227 / RG 7128 - NRC 6 5 AMM = 2016 4 3 2 1 LID 0 1 3 5 7 LID : limite inférieure de détection < 15 UI/ml Jours 9 11 13 AASLD 2009 – Gane EJ. , Nouvelle-Zélande, Abstract 193 actualisé
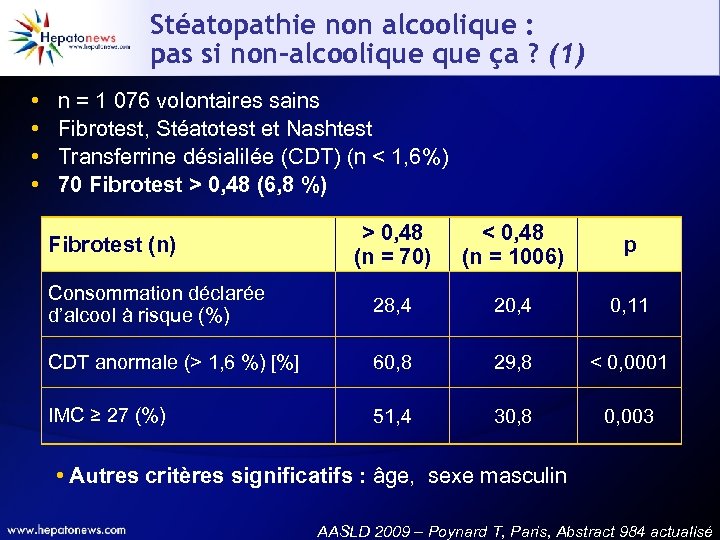
Stéatopathie non alcoolique : pas si non-alcoolique ça ? (1) • • n = 1 076 volontaires sains Fibrotest, Stéatotest et Nashtest Transferrine désialilée (CDT) (n < 1, 6%) 70 Fibrotest > 0, 48 (6, 8 %) > 0, 48 (n = 70) < 0, 48 (n = 1006) p Consommation déclarée d’alcool à risque (%) 28, 4 20, 4 0, 11 CDT anormale (> 1, 6 %) [%] 60, 8 29, 8 < 0, 0001 IMC ≥ 27 (%) 51, 4 30, 8 0, 003 Fibrotest (n) • Autres critères significatifs : âge, sexe masculin AASLD 2009 – Poynard T, Paris, Abstract 984 actualisé
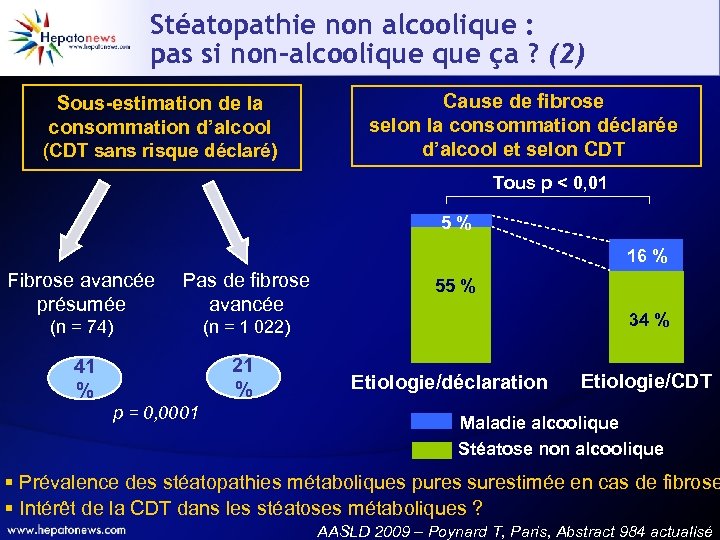
Stéatopathie non alcoolique : pas si non-alcoolique ça ? (2) Sous-estimation de la consommation d’alcool (CDT sans risque déclaré) Cause de fibrose selon la consommation déclarée d’alcool et selon CDT Tous p < 0, 01 5% 16 % Fibrose avancée présumée Pas de fibrose avancée (n = 74) (n = 1 022) 41 % 21 % p = 0, 0001 55 % 34 % Etiologie/déclaration Etiologie/CDT Maladie alcoolique Stéatose non alcoolique § Prévalence des stéatopathies métaboliques pures surestimée en cas de fibrose § Intérêt de la CDT dans les stéatoses métaboliques ? AASLD 2009 – Poynard T, Paris, Abstract 984 actualisé
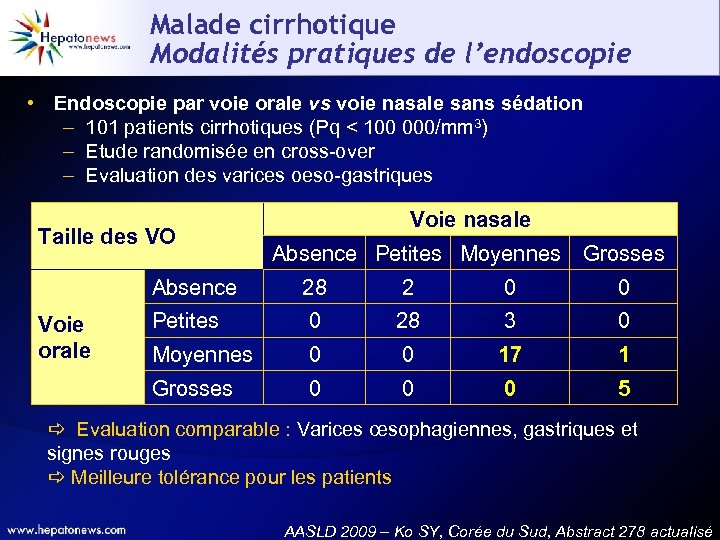
Malade cirrhotique Modalités pratiques de l’endoscopie • Endoscopie par voie orale vs voie nasale sans sédation – 101 patients cirrhotiques (Pq < 100 000/mm 3) – Etude randomisée en cross-over – Evaluation des varices oeso-gastriques Taille des VO Voie nasale Absence Petites Moyennes Grosses Absence 2 0 0 Petites 0 28 3 0 Moyennes 0 0 17 1 Grosses Voie orale 28 0 0 0 5 Evaluation comparable : Varices œsophagiennes, gastriques et signes rouges Meilleure tolérance pour les patients AASLD 2009 – Ko SY, Corée du Sud, Abstract 278 actualisé

Erythromycine en pré-endoscopie Efficacité confirmée • Patients cirrhotiques, hospitalisés pour suspicion d’hémorragie digestive par rupture de VO • Prise en charge – Transfusions à la demande 9 ≤ Hb ≤ 10 g/dl – Octréotide, IPP IV, antibiotiques IV • Randomisation : Placebo IV vs Erythromycine IV (125 mg / 50 ml sérum physiologique - 10 min) 30 min avant endoscopie Facteurs prédictifs de rupture de VO Erythromycine Placebo Patients (n) 47 43 47 % Œsophage et estomac clairs 23 % p 0, 02 Durée moyenne de l’endoscopie (min) 19 + 10 26 + 13 0, 005 Durée moyenne d’hospitalisation (jour) 3, 5 + 2, 5 5, 2 + 2, 9 0, 003 • Autres facteurs NS : 2ème endoscopie dans les 24 h, moyenne des unités sanguines transfusées, pneumopathies d’inhalation, mortalité hospitalière AASLD 2009– Altraïf I, Arabie Saoudite, Abstract 207
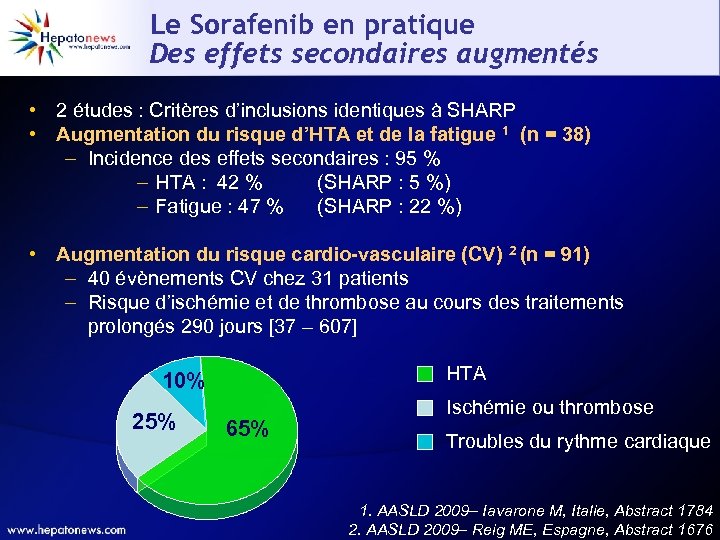
Le Sorafenib en pratique Des effets secondaires augmentés • 2 études : Critères d’inclusions identiques à SHARP • Augmentation du risque d’HTA et de la fatigue 1 (n = 38) – Incidence des effets secondaires : 95 % – HTA : 42 % (SHARP : 5 %) – Fatigue : 47 % (SHARP : 22 %) • Augmentation du risque cardio-vasculaire (CV) 2 (n = 91) – 40 évènements CV chez 31 patients – Risque d’ischémie et de thrombose au cours des traitements prolongés 290 jours [37 – 607] HTA 10% 25% 65% Ischémie ou thrombose Troubles du rythme cardiaque 1. AASLD 2009– Iavarone M, Italie, Abstract 1784 2. AASLD 2009– Reig ME, Espagne, Abstract 1676

Penser à l’hépatite E … une histoire de bêtes Hollande • Prélèvement de sang, de foie et de muscle, cerf, sanglier, chevreuil • PCR «conventionnelle » et temps réel « maison » • Sérologie (ELISA) PACA • 3 familles, 17 malades • Les malades avaient mangé du figatellu • PCR et microscopie électronique dans 12 figatelli ARN VHE : 8 /106 Anti VHE : 25 - 38 % ARN VHE : 6/39 Anti VHE : 0 -18 % ARN VHE : 7/12 103 à 106 copies/tranche Attention à la viande crue ou peu cuite ! Reesink HW, Hollande, Abstract 907 actualisé ; Colson P , France, Abstract 912 actualisé

Vaccin anti VHB : Pas de risque accru de maladies auto-immunes (MAI) Base de données médecine générale britannique (> 7 millions de patients) • Critères d’inclusion : > 1 injection vaccin anti-VHB avant 60 ans • Critères d’exclusion – vaccin dans l’année qui précède – antécédent de MAI – antécédent de cancer, traitement immunosuppresseur – infection à VHC, VIH, – insuffisance rénale chronique • Appariement : âge, sexe, année de vaccination, cabinet médical Vaccinés Non-vaccinés (44628) (130715) Risque de MAI à 1 an 0, 051 % 0, 054 % Rapport de risque 0, 94 (IC 95 % : 0, 59 -1, 50) AASLD 2009 – Egbring M. , Suisse, Abstract 411 actualisé
49a522d134adb43825e9af511b34be5c.ppt