Взаимозамняемость ЛП от Мелика-Гусейна для Школы.pptx
- Количество слайдов: 31
 Взаимозаменяемость лекарственных препаратов. Рынок, медицина, государство, пациент. Апрель 2013
Взаимозаменяемость лекарственных препаратов. Рынок, медицина, государство, пациент. Апрель 2013
 Источники информации: ЦЕНТР СОЦИАЛЬНОЙ ЭКОНОМИКИ – исследования в области здравоохранения и рынков его обслуживающих Минздрав РФ, ФАС РФ– нормативно-правовые документы Данные компаний, СМИ, экспертов отрасли 2
Источники информации: ЦЕНТР СОЦИАЛЬНОЙ ЭКОНОМИКИ – исследования в области здравоохранения и рынков его обслуживающих Минздрав РФ, ФАС РФ– нормативно-правовые документы Данные компаний, СМИ, экспертов отрасли 2
 Взаимозаменяемость яблок очевидна 3
Взаимозаменяемость яблок очевидна 3
 Взаимозаменяемость фруктов - менее очевидна 4
Взаимозаменяемость фруктов - менее очевидна 4
 Взаимозаменяемость лекарств – актуальный диспут 5
Взаимозаменяемость лекарств – актуальный диспут 5
 ФАС РФ vs Минздрав РФ МИНЗДРАВ РФ Взаимозаменяемый лекарственный препарат – лекарственный препарат, не являющийся биологическим лекарственным препаратом, с доказанной терапевтической эквивалентностью в отношении оригинального лекарственного препарата или, в случае его отсутствия в обращении, в отношении препарата сравнения, применяемый по одним и тем же показаниям, имеющий одинаковый качественный и количественный состав действующих веществ, а также лекарственную форму, дозировку и способ введения; ФАС РФ Взаимозаменяемое лекарственное средство – это лекарственное средство, которое терапевтически эквивалентно оригинальному лекарственному средству; Взаимозаменяемое биологическое лекарственное средство (биоаналог) – биологическое лекарственное средство, сопоставимое по параметрам качества, безопасности и эффективности, c оригинальным лекарственным средством, и поступившее в обращение после поступления в обращение оригинального лекарственного средства; 6
ФАС РФ vs Минздрав РФ МИНЗДРАВ РФ Взаимозаменяемый лекарственный препарат – лекарственный препарат, не являющийся биологическим лекарственным препаратом, с доказанной терапевтической эквивалентностью в отношении оригинального лекарственного препарата или, в случае его отсутствия в обращении, в отношении препарата сравнения, применяемый по одним и тем же показаниям, имеющий одинаковый качественный и количественный состав действующих веществ, а также лекарственную форму, дозировку и способ введения; ФАС РФ Взаимозаменяемое лекарственное средство – это лекарственное средство, которое терапевтически эквивалентно оригинальному лекарственному средству; Взаимозаменяемое биологическое лекарственное средство (биоаналог) – биологическое лекарственное средство, сопоставимое по параметрам качества, безопасности и эффективности, c оригинальным лекарственным средством, и поступившее в обращение после поступления в обращение оригинального лекарственного средства; 6
 Позицию согласовали Взаимозаменяемый лекарственный препарат – лекарственный препарат с доказанной терапевтической эквивалентностью в отношении оригинального лекарственного препарата или, в случае его отсутствия в обращении, в отношении препарата сравнения, применяемый по одним и тем же показаниям, имеющий одинаковый качественный и количественный состав действующих веществ, а также лекарственную форму, дозировку и способ введения Проект поправок в ФЗ№ 61 (внесено в Правительство РФ) 7
Позицию согласовали Взаимозаменяемый лекарственный препарат – лекарственный препарат с доказанной терапевтической эквивалентностью в отношении оригинального лекарственного препарата или, в случае его отсутствия в обращении, в отношении препарата сравнения, применяемый по одним и тем же показаниям, имеющий одинаковый качественный и количественный состав действующих веществ, а также лекарственную форму, дозировку и способ введения Проект поправок в ФЗ№ 61 (внесено в Правительство РФ) 7
 Взаимозаменяемость лекарственных средств в России – это не то, что Вы думаете Федеральный закон от 12. 04. 2010 № 61 -ФЗ «Об обращении лекарственных средств» ввел понятие «воспроизведенного лекарственного средства» , содержащего такую же фармацевтическую субстанцию (или комбинацию таких же фармацевтических субстанций) в такой же лекарственной форме, что и оригинальное лекарственное средство В то время, как во всем мире лекарственные препараты, имеющие одинаковое МНН, считаются взаимозаменяемыми, в Российской Федерации назначение таких препаратов, выписка и закупка для государственных нужд определяется лечащими врачами по своему усмотрению. 8
Взаимозаменяемость лекарственных средств в России – это не то, что Вы думаете Федеральный закон от 12. 04. 2010 № 61 -ФЗ «Об обращении лекарственных средств» ввел понятие «воспроизведенного лекарственного средства» , содержащего такую же фармацевтическую субстанцию (или комбинацию таких же фармацевтических субстанций) в такой же лекарственной форме, что и оригинальное лекарственное средство В то время, как во всем мире лекарственные препараты, имеющие одинаковое МНН, считаются взаимозаменяемыми, в Российской Федерации назначение таких препаратов, выписка и закупка для государственных нужд определяется лечащими врачами по своему усмотрению. 8
 В России в инструкциях по применению дженериков – разные показания и побочные эффекты В России при регистрации взаимозаменяемых лекарственных средств и дженериков в их инструкции по применению вносятся несущественные различия в показаниях к применению, которые позже используются госзаказчиками при формировании требований к предлагаемым к поставке лекарственным средствам 9
В России в инструкциях по применению дженериков – разные показания и побочные эффекты В России при регистрации взаимозаменяемых лекарственных средств и дженериков в их инструкции по применению вносятся несущественные различия в показаниях к применению, которые позже используются госзаказчиками при формировании требований к предлагаемым к поставке лекарственным средствам 9
 Взаимозаменяемость – требования ФАС 2011 • приведение всех зарегистрированных в Российской Федерации инструкций по медицинскому применению оригинальных лекарственных препаратов в соответствие с оригинальными инструкциями на оригинальных языках, зарегистрированных Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA) и Европейским агентством по лекарственным средствам (EMEA); • приведение инструкций по медицинскому применению воспроизведенных лекарственных препаратов (дженериков) в соответствие с инструкциями оригинальных лекарственных препаратов; • усиление административной и введение уголовной ответственности за введение потребителей, государственных и муниципальных заказчиков в заблуждение относительно технических свойств и характеристик препаратов. 10
Взаимозаменяемость – требования ФАС 2011 • приведение всех зарегистрированных в Российской Федерации инструкций по медицинскому применению оригинальных лекарственных препаратов в соответствие с оригинальными инструкциями на оригинальных языках, зарегистрированных Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA) и Европейским агентством по лекарственным средствам (EMEA); • приведение инструкций по медицинскому применению воспроизведенных лекарственных препаратов (дженериков) в соответствие с инструкциями оригинальных лекарственных препаратов; • усиление административной и введение уголовной ответственности за введение потребителей, государственных и муниципальных заказчиков в заблуждение относительно технических свойств и характеристик препаратов. 10
 Взаимозаменяемость – опубликованные ФАСом разъяснения • • • все лекарственные средства, имеющие МНН «Соматропин» , в рамках высокой или низкой концентрации; препараты «Селлсепт» и «Майсепт» (МНН «Микофенолата мофетил» ); лекарственные средства, имеющие МНН «Фактор свертывания крови VIII» , с «плавающей» и «фиксированной» дозировкой; лекарственные средства «Эпрекс» и «Эральфон» (МНН «Эпоэтин альфа» ); формы выпуска «концентрат для приготовления раствора для инфузий» и «лиофилизат для приготовления раствора для инфузий» для препаратов с МНН Октреотид и Золедроновая кислота; лекарственные препараты «Пенкрофтон» , таблетки, 200 мг и «Мифепристон» , таблетки 200 мг (МНН «Мифепристон» ); лекарственные препараты «Миролют» , таблетки, 0, 2 мг и «Мизопростол» , таблетки, 0, 2 мг (МНН «Мизопростол» ); антивирусные комбинированные и монопрепараты в той же комбинации в виде 2 -х или 3 -х таблеток, предназначенные для лечения лиц, инфицированных вирусом иммунодефицита человека; все зарегистрированные в Российской Федерации лекарственные препараты, имеющие МНН «Меропенем» ; формы выпуска «лиофилизат для приготовления раствора для подкожного введения 9, 6 млн МЕ» и «раствор для подкожного введения 8 млн МЕ/05 мл, 8 млн МЕ/мл» для лекарственных средств, имеющих МНН «Интерферон бета-1 b&» ; 11
Взаимозаменяемость – опубликованные ФАСом разъяснения • • • все лекарственные средства, имеющие МНН «Соматропин» , в рамках высокой или низкой концентрации; препараты «Селлсепт» и «Майсепт» (МНН «Микофенолата мофетил» ); лекарственные средства, имеющие МНН «Фактор свертывания крови VIII» , с «плавающей» и «фиксированной» дозировкой; лекарственные средства «Эпрекс» и «Эральфон» (МНН «Эпоэтин альфа» ); формы выпуска «концентрат для приготовления раствора для инфузий» и «лиофилизат для приготовления раствора для инфузий» для препаратов с МНН Октреотид и Золедроновая кислота; лекарственные препараты «Пенкрофтон» , таблетки, 200 мг и «Мифепристон» , таблетки 200 мг (МНН «Мифепристон» ); лекарственные препараты «Миролют» , таблетки, 0, 2 мг и «Мизопростол» , таблетки, 0, 2 мг (МНН «Мизопростол» ); антивирусные комбинированные и монопрепараты в той же комбинации в виде 2 -х или 3 -х таблеток, предназначенные для лечения лиц, инфицированных вирусом иммунодефицита человека; все зарегистрированные в Российской Федерации лекарственные препараты, имеющие МНН «Меропенем» ; формы выпуска «лиофилизат для приготовления раствора для подкожного введения 9, 6 млн МЕ» и «раствор для подкожного введения 8 млн МЕ/05 мл, 8 млн МЕ/мл» для лекарственных средств, имеющих МНН «Интерферон бета-1 b&» ; 11
 Виды взаимозаменяемости • Фармацевтическая эквивалентность (аналогичность действующего и сопутствующих веществ) • Биоэквивалентность (аналогичность фармакокинетических параметров) • Терапевтическая эквивалентность (аналогичные эффективность и безопасность, доказанные в ходе клинических исследований) The rules governing medicinal products in the European Union. Investigation of Bioavailability and Bioequivalence, v. 3 C, 1998, pp. 231– 244 12
Виды взаимозаменяемости • Фармацевтическая эквивалентность (аналогичность действующего и сопутствующих веществ) • Биоэквивалентность (аналогичность фармакокинетических параметров) • Терапевтическая эквивалентность (аналогичные эффективность и безопасность, доказанные в ходе клинических исследований) The rules governing medicinal products in the European Union. Investigation of Bioavailability and Bioequivalence, v. 3 C, 1998, pp. 231– 244 12
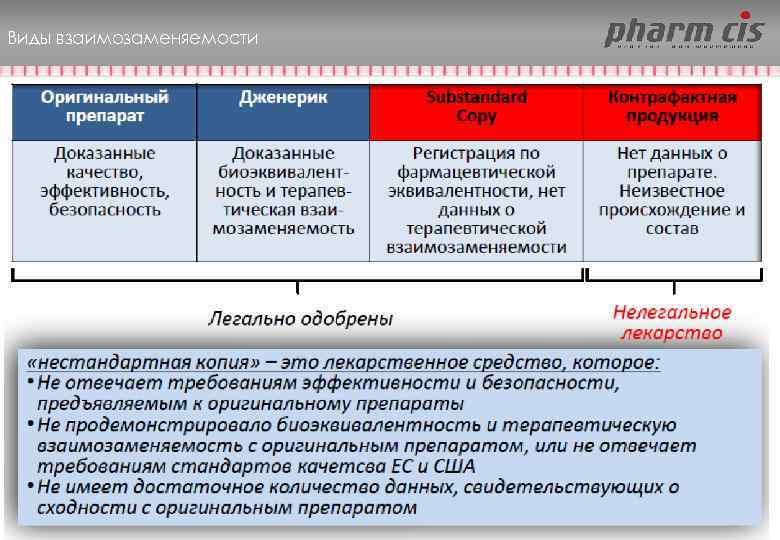 Виды взаимозаменяемости
Виды взаимозаменяемости
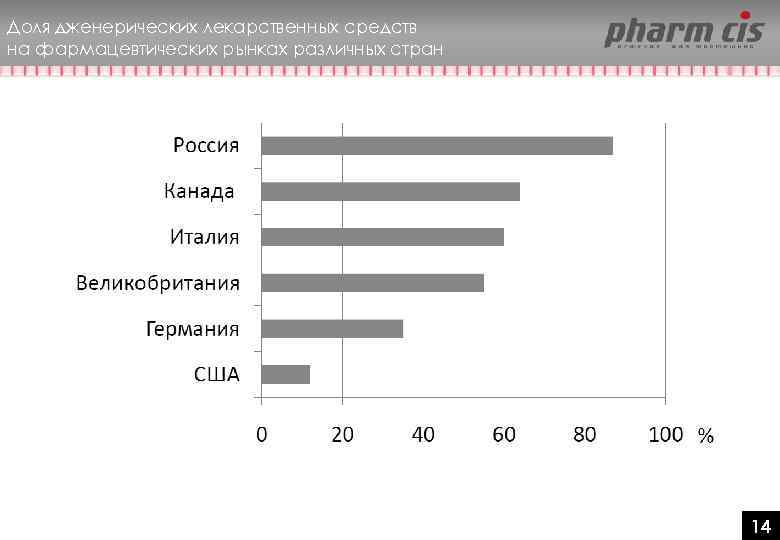 Доля дженерических лекарственных средств на фармацевтических рынках различных стран 14
Доля дженерических лекарственных средств на фармацевтических рынках различных стран 14
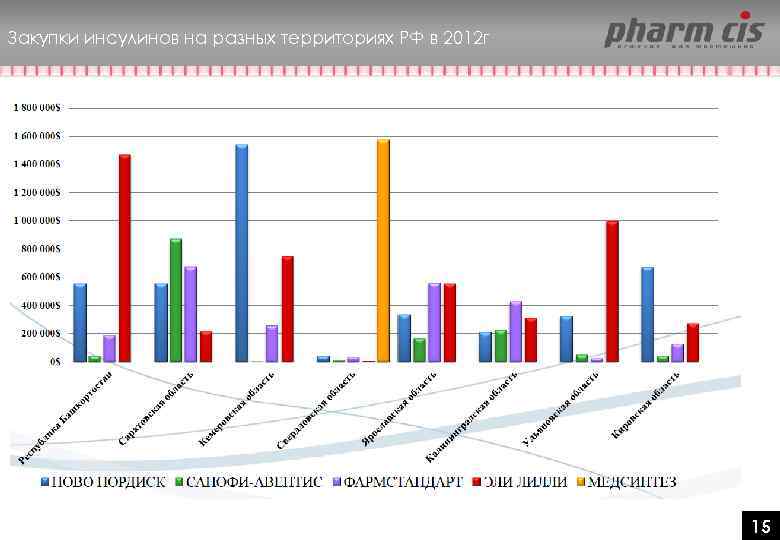 Закупки инсулинов на разных территориях РФ в 2012 г 15
Закупки инсулинов на разных территориях РФ в 2012 г 15
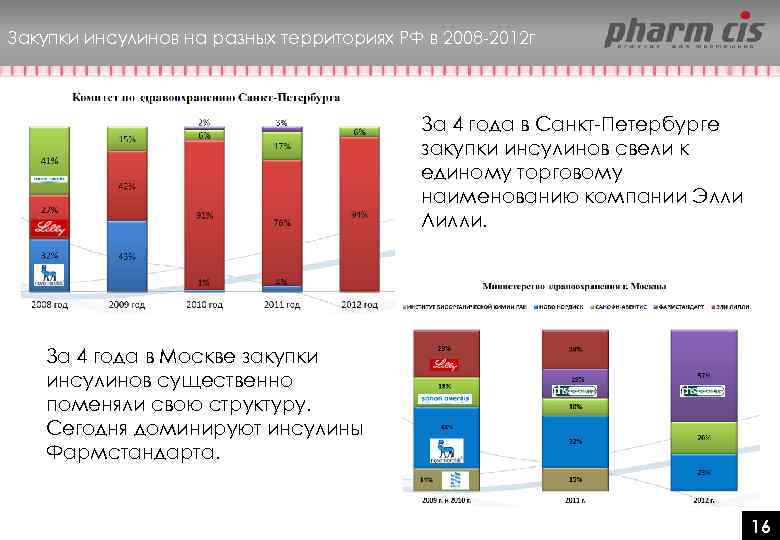 Закупки инсулинов на разных территориях РФ в 2008 -2012 г За 4 года в Санкт-Петербурге закупки инсулинов свели к единому торговому наименованию компании Элли Лилли. За 4 года в Москве закупки инсулинов существенно поменяли свою структуру. Сегодня доминируют инсулины Фармстандарта. 16
Закупки инсулинов на разных территориях РФ в 2008 -2012 г За 4 года в Санкт-Петербурге закупки инсулинов свели к единому торговому наименованию компании Элли Лилли. За 4 года в Москве закупки инсулинов существенно поменяли свою структуру. Сегодня доминируют инсулины Фармстандарта. 16
 Проблема взаимозаменяемости звучит не только в регуляторном, но и в медицинском аспекте 17
Проблема взаимозаменяемости звучит не только в регуляторном, но и в медицинском аспекте 17
 Примеры отзывов биоаналогов с рынка 1996 г, рекомбинантный человеческий интерферон альфа (Lemery, Куба). 1997 г, эпоэтин альфа (Cryopharma) 1998 г, интерферон альфа (Fustery) Причина – большое количество побочных реакций, т. к. безопасность препарата не была изучена на момент регистрации Мексика. HIS Global lnsight Article, 06 March 2009, http: //www. ibclifesciences. com/upload/wysiwyg/biopharma_series/B 9194/Biosimilars. US_IHSGlobal. Insight. pdf 18
Примеры отзывов биоаналогов с рынка 1996 г, рекомбинантный человеческий интерферон альфа (Lemery, Куба). 1997 г, эпоэтин альфа (Cryopharma) 1998 г, интерферон альфа (Fustery) Причина – большое количество побочных реакций, т. к. безопасность препарата не была изучена на момент регистрации Мексика. HIS Global lnsight Article, 06 March 2009, http: //www. ibclifesciences. com/upload/wysiwyg/biopharma_series/B 9194/Biosimilars. US_IHSGlobal. Insight. pdf 18
 Обзор взаимозаменяемости биологических лекарственных средств в различных странах Страны, в которых запрещена замена биологических лекарственных средств на аналоги • Франция • Испания • Германия (запрещена замена при отпуске из аптеки без четкого указания врача) Страны, в которых не рекомендуется замена биологических лекарственных средств на аналоги • Швеция • Италия • Бельгия (на рассмотрении находится законопроект, запрещающий выписку биологических ЛС по МНН) 19
Обзор взаимозаменяемости биологических лекарственных средств в различных странах Страны, в которых запрещена замена биологических лекарственных средств на аналоги • Франция • Испания • Германия (запрещена замена при отпуске из аптеки без четкого указания врача) Страны, в которых не рекомендуется замена биологических лекарственных средств на аналоги • Швеция • Италия • Бельгия (на рассмотрении находится законопроект, запрещающий выписку биологических ЛС по МНН) 19
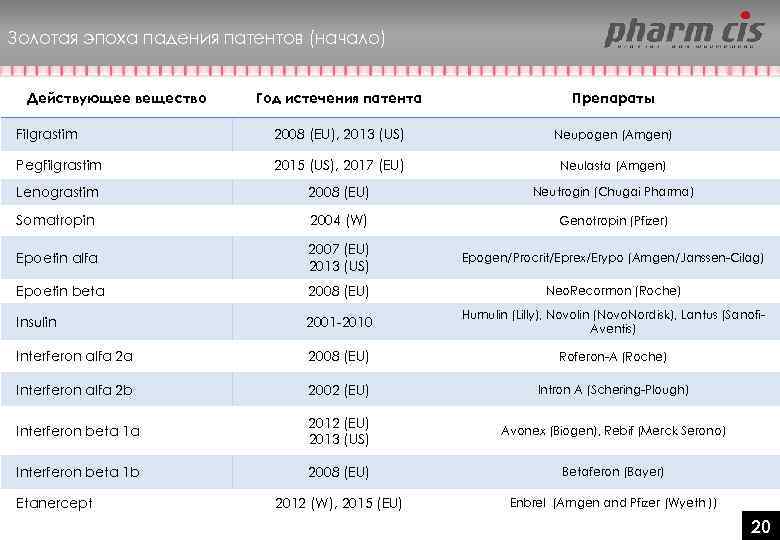 Золотая эпоха падения патентов (начало) Действующее вещество Год истечения патента Препараты Filgrastim 2008 (EU), 2013 (US) Neupogen (Amgen) Pegfilgrastim 2015 (US), 2017 (EU) Neulasta (Amgen) Lenograstim 2008 (EU) Neutrogin (Chugai Pharma) Somatropin 2004 (W) Genotropin (Pfizer) Epoetin alfa 2007 (EU) 2013 (US) Epogen/Procrit/Eprex/Erypo (Amgen/Janssen-Cilag) Epoetin beta 2008 (EU) Neo. Recormon (Roche) Insulin 2001 -2010 Humulin (Lilly), Novolin (Novo. Nordisk), Lantus (Sanofi. Aventis) Interferon alfa 2 a 2008 (EU) Roferon-A (Roche) Interferon alfa 2 b 2002 (EU) Intron A (Schering-Plough) Interferon beta 1 a 2012 (EU) 2013 (US) Avonex (Biogen), Rebif (Merck Serono) Interferon beta 1 b 2008 (EU) Betaferon (Bayer) 2012 (W), 2015 (EU) Enbrel (Amgen and Pfizer (Wyeth )) Etanercept 2020
Золотая эпоха падения патентов (начало) Действующее вещество Год истечения патента Препараты Filgrastim 2008 (EU), 2013 (US) Neupogen (Amgen) Pegfilgrastim 2015 (US), 2017 (EU) Neulasta (Amgen) Lenograstim 2008 (EU) Neutrogin (Chugai Pharma) Somatropin 2004 (W) Genotropin (Pfizer) Epoetin alfa 2007 (EU) 2013 (US) Epogen/Procrit/Eprex/Erypo (Amgen/Janssen-Cilag) Epoetin beta 2008 (EU) Neo. Recormon (Roche) Insulin 2001 -2010 Humulin (Lilly), Novolin (Novo. Nordisk), Lantus (Sanofi. Aventis) Interferon alfa 2 a 2008 (EU) Roferon-A (Roche) Interferon alfa 2 b 2002 (EU) Intron A (Schering-Plough) Interferon beta 1 a 2012 (EU) 2013 (US) Avonex (Biogen), Rebif (Merck Serono) Interferon beta 1 b 2008 (EU) Betaferon (Bayer) 2012 (W), 2015 (EU) Enbrel (Amgen and Pfizer (Wyeth )) Etanercept 2020
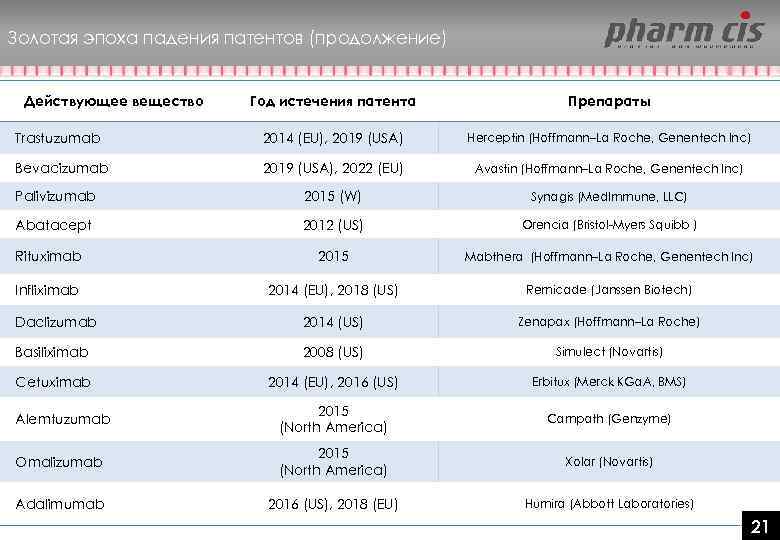 Золотая эпоха падения патентов (продолжение) Действующее вещество Год истечения патента Препараты Trastuzumab 2014 (EU), 2019 (USA) Herceptin (Hoffmann–La Roche, Genentech Inc) Bevacizumab 2019 (USA), 2022 (EU) Avastin (Hoffmann–La Roche, Genentech Inc) Palivizumab 2015 (W) Synagis (Med. Immune, LLC) Abatacept 2012 (US) Orencia (Bristol-Myers Squibb ) Rituximab 2015 Mabthera (Hoffmann–La Roche, Genentech Inc) Infliximab 2014 (EU), 2018 (US) Remicade (Janssen Biotech) Daclizumab 2014 (US) Zenapax (Hoffmann–La Roche) Basiliximab 2008 (US) Simulect (Novartis) Cetuximab 2014 (EU), 2016 (US) Erbitux (Merck KGa. A, BMS) Alemtuzumab 2015 (North America) Campath (Genzyme) Omalizumab 2015 (North America) Xolar (Novartis) Adalimumab 2016 (US), 2018 (EU) Humira (Abbott Laboratories) 2121
Золотая эпоха падения патентов (продолжение) Действующее вещество Год истечения патента Препараты Trastuzumab 2014 (EU), 2019 (USA) Herceptin (Hoffmann–La Roche, Genentech Inc) Bevacizumab 2019 (USA), 2022 (EU) Avastin (Hoffmann–La Roche, Genentech Inc) Palivizumab 2015 (W) Synagis (Med. Immune, LLC) Abatacept 2012 (US) Orencia (Bristol-Myers Squibb ) Rituximab 2015 Mabthera (Hoffmann–La Roche, Genentech Inc) Infliximab 2014 (EU), 2018 (US) Remicade (Janssen Biotech) Daclizumab 2014 (US) Zenapax (Hoffmann–La Roche) Basiliximab 2008 (US) Simulect (Novartis) Cetuximab 2014 (EU), 2016 (US) Erbitux (Merck KGa. A, BMS) Alemtuzumab 2015 (North America) Campath (Genzyme) Omalizumab 2015 (North America) Xolar (Novartis) Adalimumab 2016 (US), 2018 (EU) Humira (Abbott Laboratories) 2121
 Мировые тренды Европейский союз • Мировой лидер по числу зарегистрированных биосимиляров (14 наименований с 2004 года); EMA при регулировании рынка биосимиляров обращает главное внимание на безопасность препаратов, при этом не ограничивая их доступность для населения. США • • Основные принципы научно обоснованного подхода FDA к развитию рынка биосимиляров: поэтапный подход к разработке молекулы (физико-химические и биологические данные), сравнительные данные для оценки эффективности, экстраполяция признаков, возможность использования для сравнения препарата-аналога, оценка возможности заменяемости; Консультации по вопросу универсальных наименований биосимиляров с целью избегания введения в заблуждение врачей и пациентов. Япония • • Рынок биосимиляров начал развиваться в 2009 году. Жестко требуется выполнение принципа подобия путем доказательства сходства с оригинальным продуктом, однако указывается на необходимость проведения испытаний в сравнении с аналогичным продуктом, произведенным в Японии, а также первой фазы испытаний среди японского населения; Всего 2 биосимиляра в настоящий момент зарегистрировано в Японии. Индия • Полурегулируемый рынок, отсутствуют фазы испытаний 1 и 2; для регистрации необходимо проведение фазы 3 при минимуме 100 пациентов. 2222
Мировые тренды Европейский союз • Мировой лидер по числу зарегистрированных биосимиляров (14 наименований с 2004 года); EMA при регулировании рынка биосимиляров обращает главное внимание на безопасность препаратов, при этом не ограничивая их доступность для населения. США • • Основные принципы научно обоснованного подхода FDA к развитию рынка биосимиляров: поэтапный подход к разработке молекулы (физико-химические и биологические данные), сравнительные данные для оценки эффективности, экстраполяция признаков, возможность использования для сравнения препарата-аналога, оценка возможности заменяемости; Консультации по вопросу универсальных наименований биосимиляров с целью избегания введения в заблуждение врачей и пациентов. Япония • • Рынок биосимиляров начал развиваться в 2009 году. Жестко требуется выполнение принципа подобия путем доказательства сходства с оригинальным продуктом, однако указывается на необходимость проведения испытаний в сравнении с аналогичным продуктом, произведенным в Японии, а также первой фазы испытаний среди японского населения; Всего 2 биосимиляра в настоящий момент зарегистрировано в Японии. Индия • Полурегулируемый рынок, отсутствуют фазы испытаний 1 и 2; для регистрации необходимо проведение фазы 3 при минимуме 100 пациентов. 2222
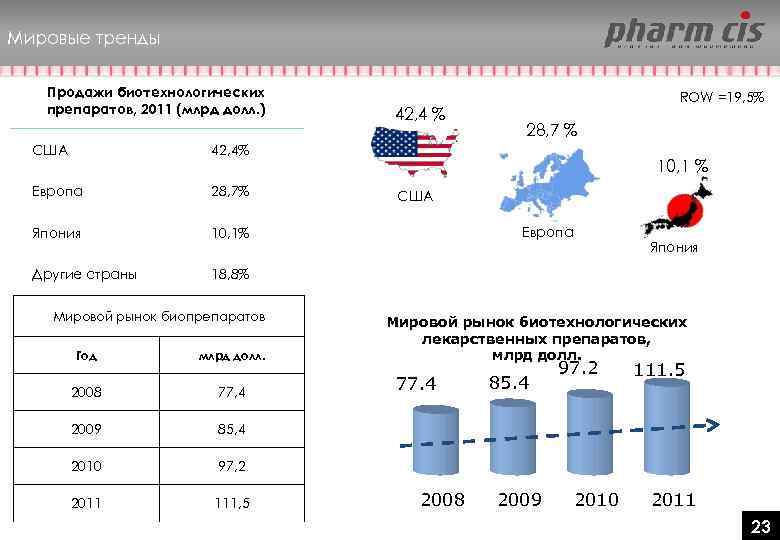 Мировые тренды Продажи биотехнологических препаратов, 2011 (млрд долл. ) США 28, 7% Япония 10, 1% Другие страны 28, 7 % 42, 4% Европа 42, 4 % ROW =19, 5% 18, 8% Мировой рынок биопрепаратов Год млрд долл. 2008 77, 4 2009 111, 5 Европа Япония Мировой рынок биотехнологических лекарственных препаратов, млрд долл. 97, 2 2011 США 85, 4 2010 10, 1 % 77. 4 2008 85. 4 2009 97. 2 2010 111. 5 2011 23 23
Мировые тренды Продажи биотехнологических препаратов, 2011 (млрд долл. ) США 28, 7% Япония 10, 1% Другие страны 28, 7 % 42, 4% Европа 42, 4 % ROW =19, 5% 18, 8% Мировой рынок биопрепаратов Год млрд долл. 2008 77, 4 2009 111, 5 Европа Япония Мировой рынок биотехнологических лекарственных препаратов, млрд долл. 97, 2 2011 США 85, 4 2010 10, 1 % 77. 4 2008 85. 4 2009 97. 2 2010 111. 5 2011 23 23
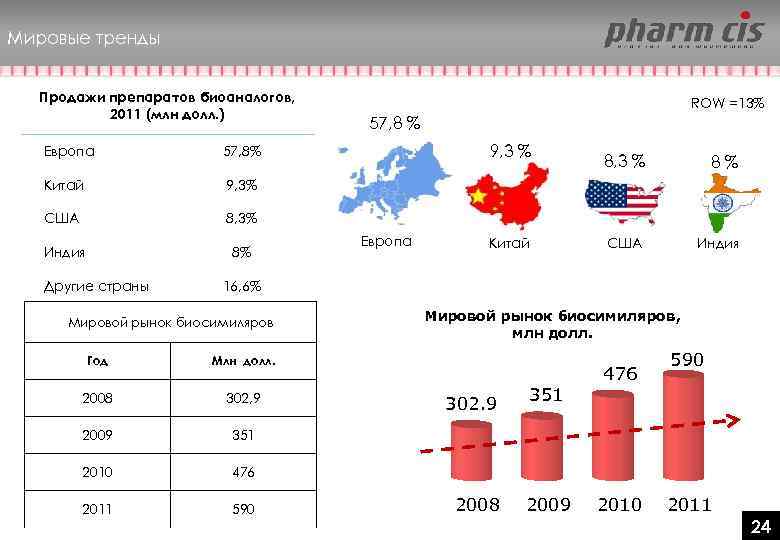 Мировые тренды Продажи препаратов биоаналогов, 2011 (млн долл. ) Европа 8, 3% Индия 8% 9, 3% США 57, 8 % 57, 8% Китай ROW =13% Другие страны Европа Китай 8, 3 % 8% США Индия 16, 6% Мировой рынок биосимиляров Год Млн долл. 2008 302, 9 2009 476 2011 590 351 2010 Мировой рынок биосимиляров, млн долл. 302. 9 2008 351 2009 476 2010 2011 24
Мировые тренды Продажи препаратов биоаналогов, 2011 (млн долл. ) Европа 8, 3% Индия 8% 9, 3% США 57, 8 % 57, 8% Китай ROW =13% Другие страны Европа Китай 8, 3 % 8% США Индия 16, 6% Мировой рынок биосимиляров Год Млн долл. 2008 302, 9 2009 476 2011 590 351 2010 Мировой рынок биосимиляров, млн долл. 302. 9 2008 351 2009 476 2010 2011 24
 Ключевые тенденции макросреды для рынка биосимиляров Лоббирование компаниями-оригинаторами инициатив, ограничивающих развитие рынка биосимиляров; Политические факторы Изменение развитие законодательства регулирования обращения биосимиояров срок и патентной защиты) в области (регистрация, Макроэкономическая стагнация и нулевой рост рынков в развитых странах; Экономические факторы Усиление конкурентоспособности компанийпроизводителей из развивающихся стран и их выход на глобальный уровень; Удешевление стоимости производства биосимиляров Снижение доходов населения и низкая эффективность государственных систем здравоохранения; Социальные факторы Технологические факторы Увеличение заболеваемости социально-значимыми болезнями (что связано со старением и неблагоприятными факторами окружающей среды) Новые технологии (пэгилирование). производства биопрепаратов Выход на рынок препаратов на основе моноклональных антител в среднесрочной перспективе 25
Ключевые тенденции макросреды для рынка биосимиляров Лоббирование компаниями-оригинаторами инициатив, ограничивающих развитие рынка биосимиляров; Политические факторы Изменение развитие законодательства регулирования обращения биосимиояров срок и патентной защиты) в области (регистрация, Макроэкономическая стагнация и нулевой рост рынков в развитых странах; Экономические факторы Усиление конкурентоспособности компанийпроизводителей из развивающихся стран и их выход на глобальный уровень; Удешевление стоимости производства биосимиляров Снижение доходов населения и низкая эффективность государственных систем здравоохранения; Социальные факторы Технологические факторы Увеличение заболеваемости социально-значимыми болезнями (что связано со старением и неблагоприятными факторами окружающей среды) Новые технологии (пэгилирование). производства биопрепаратов Выход на рынок препаратов на основе моноклональных антител в среднесрочной перспективе 25
 Состав: периндоприла эрбумин 4 мг Фармакотерапевтическая группа: ингибитор ангиотензинпревращающего фермента (АПФ) Форма выпуска: таблетки 4 мг № 30 Показания к применению и дозы: артериальная гипертензия – доза 4 – 8 мг в сутки, хроническая сердечная недостаточность – начальная доза 2 мг в сутки Производство: ОЗОН, Самарская обл-ть, г. Жигулевск
Состав: периндоприла эрбумин 4 мг Фармакотерапевтическая группа: ингибитор ангиотензинпревращающего фермента (АПФ) Форма выпуска: таблетки 4 мг № 30 Показания к применению и дозы: артериальная гипертензия – доза 4 – 8 мг в сутки, хроническая сердечная недостаточность – начальная доза 2 мг в сутки Производство: ОЗОН, Самарская обл-ть, г. Жигулевск
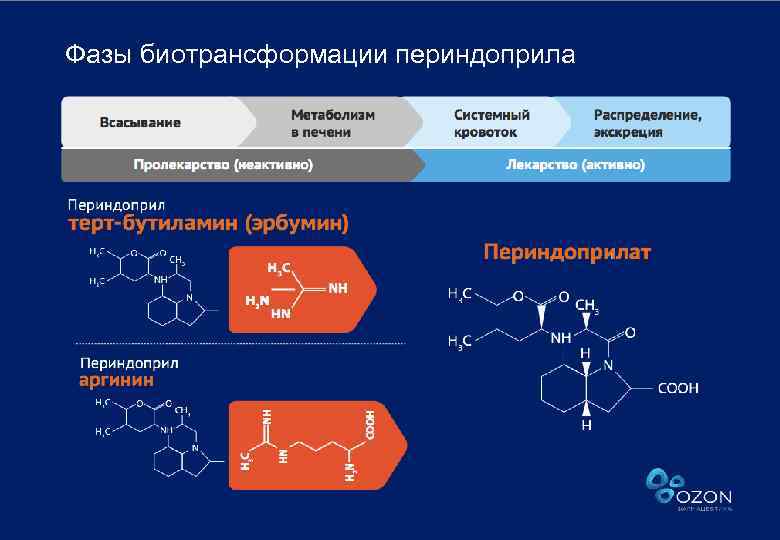 Фазы биотрансформации периндоприла
Фазы биотрансформации периндоприла
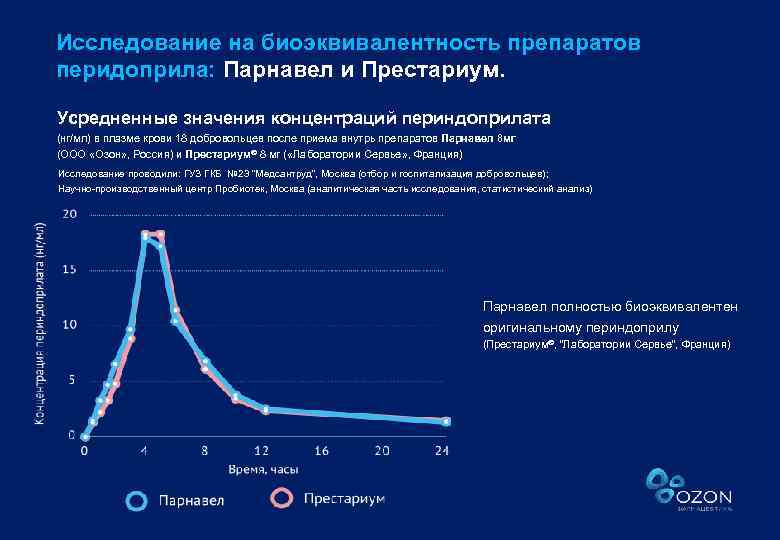 Исследование на биоэквивалентность препаратов перидоприла: Парнавел и Престариум. Усредненные значения концентраций периндоприлата (нг/мл) в плазме крови 18 добровольцев после приема внутрь препаратов Парнавел 8 мг (ООО «Озон» , Россия) и Престариум® 8 мг ( «Лаборатории Сервье» , Франция) Исследование проводили: ГУЗ ГКБ № 23 “Медсантруд”, Москва (отбор и госпитализация добровольцев); Научно-производственный центр Пробиотек, Москва (аналитическая часть исследования, статистический анализ) Парнавел полностью биоэквивалентен оригинальному периндоприлу (Престариум®, “Лаборатории Сервье”, Франция)
Исследование на биоэквивалентность препаратов перидоприла: Парнавел и Престариум. Усредненные значения концентраций периндоприлата (нг/мл) в плазме крови 18 добровольцев после приема внутрь препаратов Парнавел 8 мг (ООО «Озон» , Россия) и Престариум® 8 мг ( «Лаборатории Сервье» , Франция) Исследование проводили: ГУЗ ГКБ № 23 “Медсантруд”, Москва (отбор и госпитализация добровольцев); Научно-производственный центр Пробиотек, Москва (аналитическая часть исследования, статистический анализ) Парнавел полностью биоэквивалентен оригинальному периндоприлу (Престариум®, “Лаборатории Сервье”, Франция)
 ТЕНЗАР индапамид Состав: Индапамид 2, 5 мг Фармакотерапевтическая группа: Диуретическое средство. Тиазидоподобный диуретик Форма выпуска: Капсулы 2, 5 мг № 30 Показания к применению и дозы: артериальная гипертензия – доза 2, 5 мг в сутки, ТЕНЗАР полностью биоэквивалентен Средняя стоимость упаковки: препарату АРИФОН (Лаборатории Сервье, 25 -28 рублей Франция)
ТЕНЗАР индапамид Состав: Индапамид 2, 5 мг Фармакотерапевтическая группа: Диуретическое средство. Тиазидоподобный диуретик Форма выпуска: Капсулы 2, 5 мг № 30 Показания к применению и дозы: артериальная гипертензия – доза 2, 5 мг в сутки, ТЕНЗАР полностью биоэквивалентен Средняя стоимость упаковки: препарату АРИФОН (Лаборатории Сервье, 25 -28 рублей Франция)
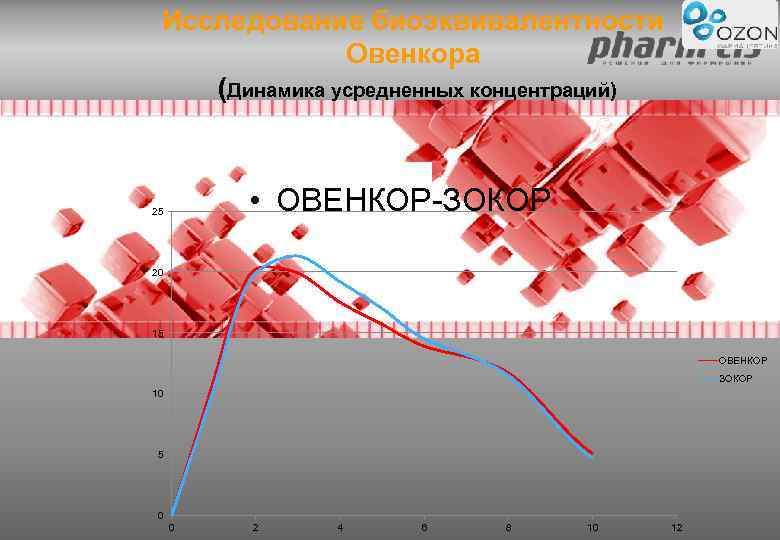 Исследование биоэквивалентности Овенкора (Динамика усредненных концентраций) • ОВЕНКОР-ЗОКОР 25 20 15 ОВЕНКОР ЗОКОР 10 5 0 0 2 4 6 8 10 12
Исследование биоэквивалентности Овенкора (Динамика усредненных концентраций) • ОВЕНКОР-ЗОКОР 25 20 15 ОВЕНКОР ЗОКОР 10 5 0 0 2 4 6 8 10 12
 Овенкор Симвастатин таб. 10 мг № 30 Симвастатин таб 20 мг № 30
Овенкор Симвастатин таб. 10 мг № 30 Симвастатин таб 20 мг № 30


