ИОН-ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ.ppt
- Количество слайдов: 23
 ВЗАИМОДЕЙСТВИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ Лекция 2
ВЗАИМОДЕЙСТВИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ Лекция 2
 ВИДЫ ВЗАИМОДЕЙСТВИЙ В РАСТВОРАХ n n Ион-дипольное - сольватация Ион-ионное – ионная ассоциация Диполь-дипольное- агрегация растворителя Ион- дипольное взаимодействие позволяет объяснить образование и устойчивость растворов электролитов.
ВИДЫ ВЗАИМОДЕЙСТВИЙ В РАСТВОРАХ n n Ион-дипольное - сольватация Ион-ионное – ионная ассоциация Диполь-дипольное- агрегация растворителя Ион- дипольное взаимодействие позволяет объяснить образование и устойчивость растворов электролитов.
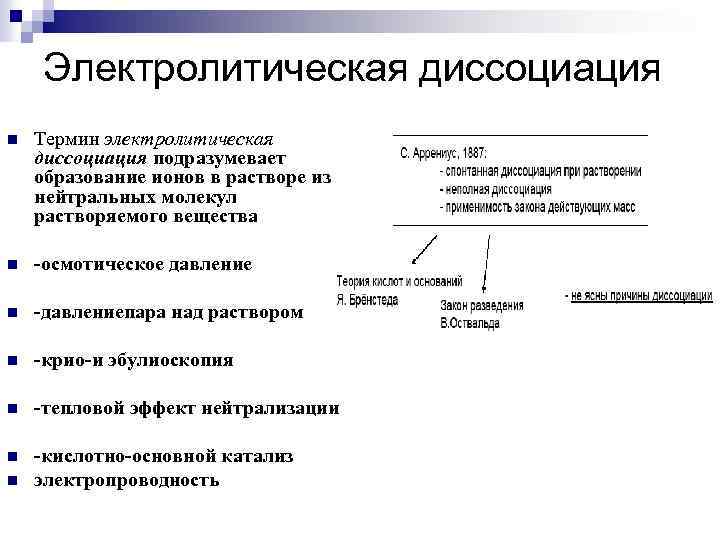 Электролитическая диссоциация n Термин электролитическая диссоциация подразумевает образование ионов в растворе из нейтральных молекул растворяемого вещества n -осмотическое давление n -давлениепара над раствором n -крио-и эбулиоскопия n -тепловой эффект нейтрализации n -кислотно-основной катализ электропроводность n
Электролитическая диссоциация n Термин электролитическая диссоциация подразумевает образование ионов в растворе из нейтральных молекул растворяемого вещества n -осмотическое давление n -давлениепара над раствором n -крио-и эбулиоскопия n -тепловой эффект нейтрализации n -кислотно-основной катализ электропроводность n
 Ионогены и ионофоры n n n . Вещества, содержащие ионы в исходном состоянии, иногда называют ионофорами, или истинными электролитами (твердый хлорид натрия представляет собой кристалл, построенныйиз ионов Na+ и Cl–) Вещества, образующие ионы лишь при растворении, называют ионогенами, или потенциальными электролитами.
Ионогены и ионофоры n n n . Вещества, содержащие ионы в исходном состоянии, иногда называют ионофорами, или истинными электролитами (твердый хлорид натрия представляет собой кристалл, построенныйиз ионов Na+ и Cl–) Вещества, образующие ионы лишь при растворении, называют ионогенами, или потенциальными электролитами.
 Механизмы образования растворов электролитов n При растворении ионофора происходит разрушение кристалла за счет взаимодействия ионов с диполями растворителя. n Чтобы доказать это, нужно рассчитать энергию, необходимую для разрушения кристаллической решетки, и сопоставить ее с энергией сольватации, т. е. с выигрышем энергии за счет взаимодействия ионов с растворителем. Если эти энергии окажутся близкими, то вывод о разрушении кристаллической решетки соли за счет иондипольного взаимодействия можно считать правильным n При взаимодействии ионогена с молекулами растворителя n при образовании раствора соляной кислоты энергия, необходимая для разрыва химической связи Н–Cl (она составляет 432 к. Дж/моль), компенсируется энергией связи протона с молекулой воды в ионе гидроксония и энергией гидратации ионов Н 3 O+ и Cl–.
Механизмы образования растворов электролитов n При растворении ионофора происходит разрушение кристалла за счет взаимодействия ионов с диполями растворителя. n Чтобы доказать это, нужно рассчитать энергию, необходимую для разрушения кристаллической решетки, и сопоставить ее с энергией сольватации, т. е. с выигрышем энергии за счет взаимодействия ионов с растворителем. Если эти энергии окажутся близкими, то вывод о разрушении кристаллической решетки соли за счет иондипольного взаимодействия можно считать правильным n При взаимодействии ионогена с молекулами растворителя n при образовании раствора соляной кислоты энергия, необходимая для разрыва химической связи Н–Cl (она составляет 432 к. Дж/моль), компенсируется энергией связи протона с молекулой воды в ионе гидроксония и энергией гидратации ионов Н 3 O+ и Cl–.
 Энергия кристаллической решетки n Энергия кристаллической решетки представляет собой работу, которую нужно затратить для разрушения решетки, т. е. для разведения составляющих ее ионов на бесконечно большое расстояние в вакууме. Энергию кристаллической решетки рассчитывают на моль исследуемого вещества
Энергия кристаллической решетки n Энергия кристаллической решетки представляет собой работу, которую нужно затратить для разрушения решетки, т. е. для разведения составляющих ее ионов на бесконечно большое расстояние в вакууме. Энергию кристаллической решетки рассчитывают на моль исследуемого вещества
 Основные положения модели Борна n n n Рассматриваются два противоположно заряженных иона, составляющих данную кристаллическую решетку Ионы имеют абсолютные заряды z 1 e 0 и z 2 e 0 (e 0 — элементарный заряд) Ионы находятся друг от друга на расстоянии r. Силу электростатического взаимодействия (притяжения) между этими ионами определяют по закону Кулона Первый ион закреплен в положении r = 0, а сила Fэл действует на второй ион в направлении первого иона
Основные положения модели Борна n n n Рассматриваются два противоположно заряженных иона, составляющих данную кристаллическую решетку Ионы имеют абсолютные заряды z 1 e 0 и z 2 e 0 (e 0 — элементарный заряд) Ионы находятся друг от друга на расстоянии r. Силу электростатического взаимодействия (притяжения) между этими ионами определяют по закону Кулона Первый ион закреплен в положении r = 0, а сила Fэл действует на второй ион в направлении первого иона
 Энергия кристаллической решетки(определение: работа по превращению кристалла в ионный пар)
Энергия кристаллической решетки(определение: работа по превращению кристалла в ионный пар)
 n константы Маделунга зависит от типа кристаллической решетки n Рентгеноструктурный анализ позволяет установить геометрию кристаллов и определить параметры А и r 0. Константа п обычно рассчитывается из данных по сжимаемости кристаллов. n Для Na. Cl n=7, 5; для других солей значение п колеблется от 5 до 12.
n константы Маделунга зависит от типа кристаллической решетки n Рентгеноструктурный анализ позволяет установить геометрию кристаллов и определить параметры А и r 0. Константа п обычно рассчитывается из данных по сжимаемости кристаллов. n Для Na. Cl n=7, 5; для других солей значение п колеблется от 5 до 12.
 Применение закона Гесса для расчета изменения энтальпии n n Поскольку в замкнутом термодинамическом цикле по закону Гесса ΣΔ Hi =0, то ΔH Na. Cl = –(ΔH 1 + ΔH 2 + ΔH 3 + ΔH 4 + ΔH 5) = 772 к. Дж/моль. n n n n Значение ΔH 1 можно приравнять потенциалу ионизации натрия, взятому с обратным знаком. Изменение энтальпии ΔH 2 определяется сродством к электрону атома хлора. Величина ΔH 3 тепловой эффекту при конденсации газообразного натрия, ΔH 4— тепловой эффект при рекомбинации атомов хлора. ΔH 5 - тепловой эффект при сжигании металлического натрия в атмосфере газообразного хлора. Экспериментально было найдено, что ΔH 1 = – 496, ΔH 2 = 365, ΔH 3 = – 109, ΔH 4 = – 121 и ΔH 5 = – 411 к. Дж/моль.
Применение закона Гесса для расчета изменения энтальпии n n Поскольку в замкнутом термодинамическом цикле по закону Гесса ΣΔ Hi =0, то ΔH Na. Cl = –(ΔH 1 + ΔH 2 + ΔH 3 + ΔH 4 + ΔH 5) = 772 к. Дж/моль. n n n n Значение ΔH 1 можно приравнять потенциалу ионизации натрия, взятому с обратным знаком. Изменение энтальпии ΔH 2 определяется сродством к электрону атома хлора. Величина ΔH 3 тепловой эффекту при конденсации газообразного натрия, ΔH 4— тепловой эффект при рекомбинации атомов хлора. ΔH 5 - тепловой эффект при сжигании металлического натрия в атмосфере газообразного хлора. Экспериментально было найдено, что ΔH 1 = – 496, ΔH 2 = 365, ΔH 3 = – 109, ΔH 4 = – 121 и ΔH 5 = – 411 к. Дж/моль.
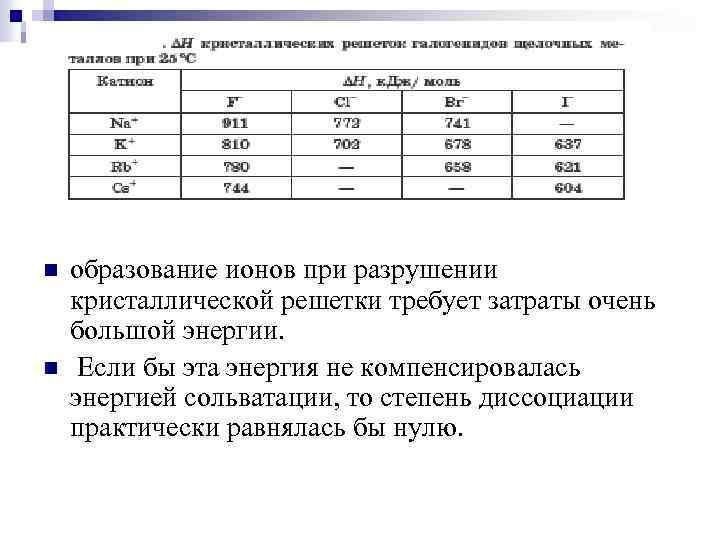 n n образование ионов при разрушении кристаллической решетки требует затраты очень большой энергии. Если бы эта энергия не компенсировалась энергией сольватации, то степень диссоциации практически равнялась бы нулю.
n n образование ионов при разрушении кристаллической решетки требует затраты очень большой энергии. Если бы эта энергия не компенсировалась энергией сольватации, то степень диссоциации практически равнялась бы нулю.
 Энергия сольватации n n n выигрыш в энергии, который получается при перенесении моля исследуемых ионов из вакуума в данный растворитель. При этом предполагается, что выигрыш энергии не включает в себя электростатическое взаимодействие ионов, т. е предположение электронейтральности раствора ( вводить в него соответствующее количество ионов противоположного знака, а взаимное притяжение катионов и анионов элиминировать достаточным (теоретически бесконечным) разбавлением раствора.
Энергия сольватации n n n выигрыш в энергии, который получается при перенесении моля исследуемых ионов из вакуума в данный растворитель. При этом предполагается, что выигрыш энергии не включает в себя электростатическое взаимодействие ионов, т. е предположение электронейтральности раствора ( вводить в него соответствующее количество ионов противоположного знака, а взаимное притяжение катионов и анионов элиминировать достаточным (теоретически бесконечным) разбавлением раствора.
 Метод циклов. Цикл Борна-Габера n n n n n ион рассматривается как заряженный шарик радиуса ri, растворитель — как сплошная однородная среда (континуум) с диэлектрической постоянной ε. Процесс переноса заряженного шарика из вакуума в среду разбивается на три этапа: 1) разряд шарика в вакууме; 2) перенос незаряженного шарика из вакуума в растворитель; 3) заряжение шарика в среде. При этом предполагается, что работа на втором этапе W 2 = 0, а для расчета работы на этапах 1 и 3 (W 1 и W 3) используются основные законы электростатики.
Метод циклов. Цикл Борна-Габера n n n n n ион рассматривается как заряженный шарик радиуса ri, растворитель — как сплошная однородная среда (континуум) с диэлектрической постоянной ε. Процесс переноса заряженного шарика из вакуума в среду разбивается на три этапа: 1) разряд шарика в вакууме; 2) перенос незаряженного шарика из вакуума в растворитель; 3) заряжение шарика в среде. При этом предполагается, что работа на втором этапе W 2 = 0, а для расчета работы на этапах 1 и 3 (W 1 и W 3) используются основные законы электростатики.

 Учитывая, что свободная энергия сольватации равна ΔGа= NА ΣW i, выводим основную формулу модели Борна
Учитывая, что свободная энергия сольватации равна ΔGа= NА ΣW i, выводим основную формулу модели Борна
 Уравнение Борна—Бьеррума
Уравнение Борна—Бьеррума
 Использование закона Гесса
Использование закона Гесса
 Химическая энергия сольватации На границе воздух/раствор из-за определенной ориентации диполей растворителя возникает некоторый скачок потенциала χ —поверхностный потенциал. Энергетический эффект, сопровождающий перенос заряженной частицы через границу воздух/раствор отражает не только ион -дипольное взаимодействие, но и электрическую работу, которая для моля iх ионов с зарядом zie 0 равна NAzie 0χ = zi. Fχ. Изменение свободной энергии, обусловленное только взаимодействием ионов с диполями растворителя и отнесенное к молю ионов, называется химической энергией сольватации ΔGs (хим)
Химическая энергия сольватации На границе воздух/раствор из-за определенной ориентации диполей растворителя возникает некоторый скачок потенциала χ —поверхностный потенциал. Энергетический эффект, сопровождающий перенос заряженной частицы через границу воздух/раствор отражает не только ион -дипольное взаимодействие, но и электрическую работу, которая для моля iх ионов с зарядом zie 0 равна NAzie 0χ = zi. Fχ. Изменение свободной энергии, обусловленное только взаимодействием ионов с диполями растворителя и отнесенное к молю ионов, называется химической энергией сольватации ΔGs (хим)
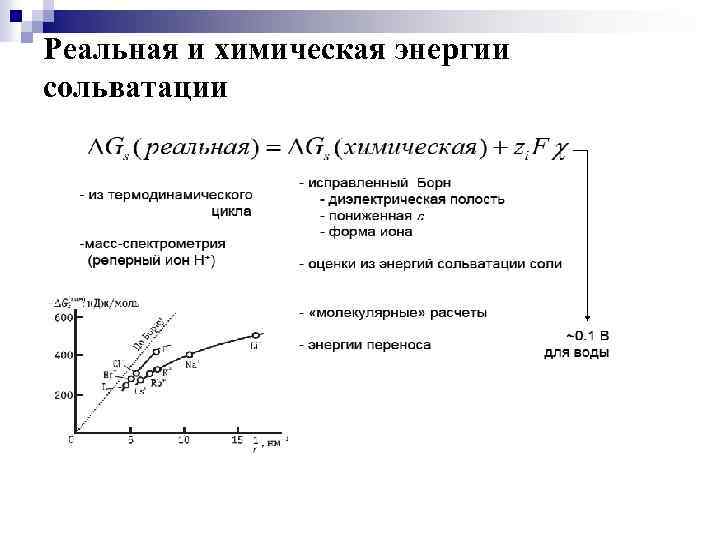 Реальная и химическая энергии сольватации
Реальная и химическая энергии сольватации
 Состояние ионов в растворах Данные по энтропии сольватации, по уменьшению диэлектрической проницаемости и объема растворителя в присутствии ионов, по снижению времени релаксации, а также по подвижности ионов в электрическом поле указывают на то, что часть молекул растворителя довольно прочно связана с ионами. Это предположение находит прямое подтверждение в различных структурных исследованиях растворов. Предельное значение числа сольватации определяется координационным числом (КЧ) сольватируемого иона (т. е. числом кратчайших эквивалентных связей, образуемых с молекулами растворителя без стеричеcких затруднений)
Состояние ионов в растворах Данные по энтропии сольватации, по уменьшению диэлектрической проницаемости и объема растворителя в присутствии ионов, по снижению времени релаксации, а также по подвижности ионов в электрическом поле указывают на то, что часть молекул растворителя довольно прочно связана с ионами. Это предположение находит прямое подтверждение в различных структурных исследованиях растворов. Предельное значение числа сольватации определяется координационным числом (КЧ) сольватируемого иона (т. е. числом кратчайших эквивалентных связей, образуемых с молекулами растворителя без стеричеcких затруднений)
 Числа гидратации
Числа гидратации
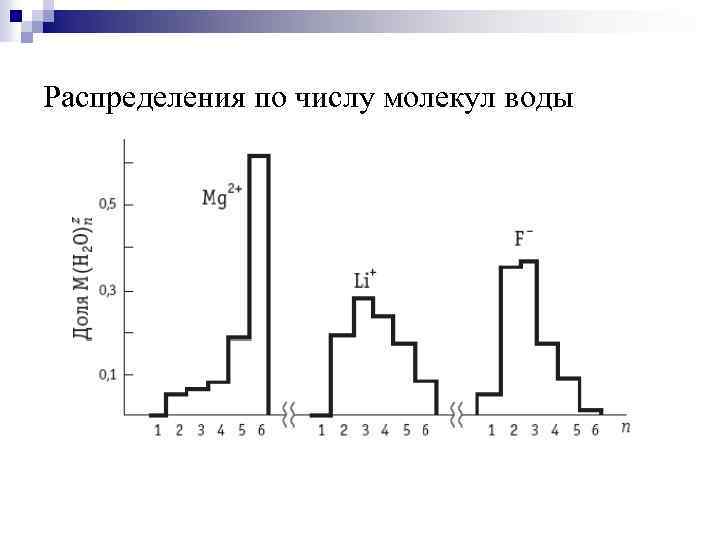 Распределения по числу молекул воды в сольватной оболочке
Распределения по числу молекул воды в сольватной оболочке
 Контрольные вопросы n n n 1. Дать определение электрохимии 2. Понятие окислительно-восстановительной реакции 3. Перечислить доказательства существования ионов в растворе. 4. Основные положения теории электролитической диссоциации 5. Недостатки теории Аррениуса
Контрольные вопросы n n n 1. Дать определение электрохимии 2. Понятие окислительно-восстановительной реакции 3. Перечислить доказательства существования ионов в растворе. 4. Основные положения теории электролитической диссоциации 5. Недостатки теории Аррениуса


