04 - Молекулы-1.pptx
- Количество слайдов: 16
 Выводы 1. Согласование классической химии и квантовой механики достигается за счет использования специальной модели — одноэлектронного приближения (ОЭП), • смысл ОЭП сводится к усреднению быстрого реального движения электрона и замене его статичным «электронным облаком» . 2. Основная задача ОЭП — найти для каждого электрона специфическую функцию — молекулярную орбиталь, которая характеризует все особенности движения этого электрона (электронного облака) в молекуле.
Выводы 1. Согласование классической химии и квантовой механики достигается за счет использования специальной модели — одноэлектронного приближения (ОЭП), • смысл ОЭП сводится к усреднению быстрого реального движения электрона и замене его статичным «электронным облаком» . 2. Основная задача ОЭП — найти для каждого электрона специфическую функцию — молекулярную орбиталь, которая характеризует все особенности движения этого электрона (электронного облака) в молекуле.
 Орбитальные модели молекул в квантовой химии
Орбитальные модели молекул в квантовой химии
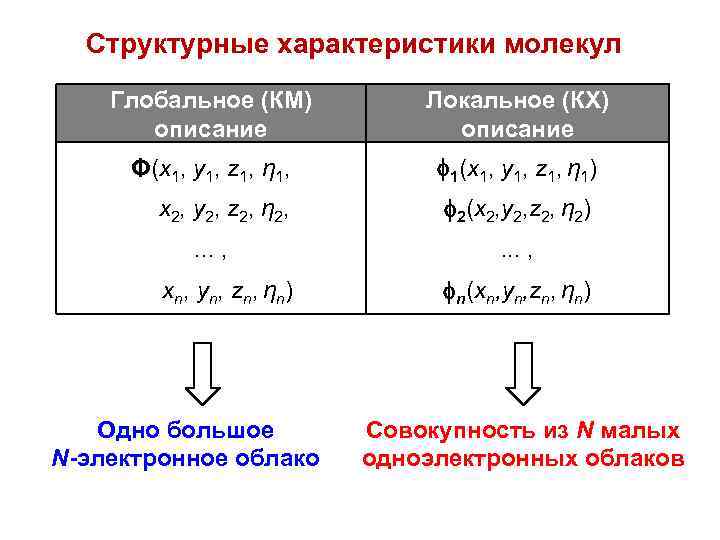 Структурные характеристики молекул Глобальное (КМ) описание Локальное (КХ) описание Φ(x 1, y 1, z 1, η 1, 1(x 1, y 1, z 1, η 1) x 2, y 2, z 2, η 2, 2(x 2, y 2, z 2, η 2) . . . , xn, yn, zn, ηn) Одно большое N-электронное облако . . . , n(xn, yn, zn, ηn) Совокупность из N малых одноэлектронных облаков
Структурные характеристики молекул Глобальное (КМ) описание Локальное (КХ) описание Φ(x 1, y 1, z 1, η 1, 1(x 1, y 1, z 1, η 1) x 2, y 2, z 2, η 2, 2(x 2, y 2, z 2, η 2) . . . , xn, yn, zn, ηn) Одно большое N-электронное облако . . . , n(xn, yn, zn, ηn) Совокупность из N малых одноэлектронных облаков
 Классическая химия Химические взаимодействия осуществляются ЛОКАЛЬНО, поэтому для их анализа идеально подходит именно локальное описание электронной оболочки молекулы на основе ОЭП. Характеристики МО 1. Энергия 2. Узловая структура 3. Пространственная симметрия
Классическая химия Химические взаимодействия осуществляются ЛОКАЛЬНО, поэтому для их анализа идеально подходит именно локальное описание электронной оболочки молекулы на основе ОЭП. Характеристики МО 1. Энергия 2. Узловая структура 3. Пространственная симметрия
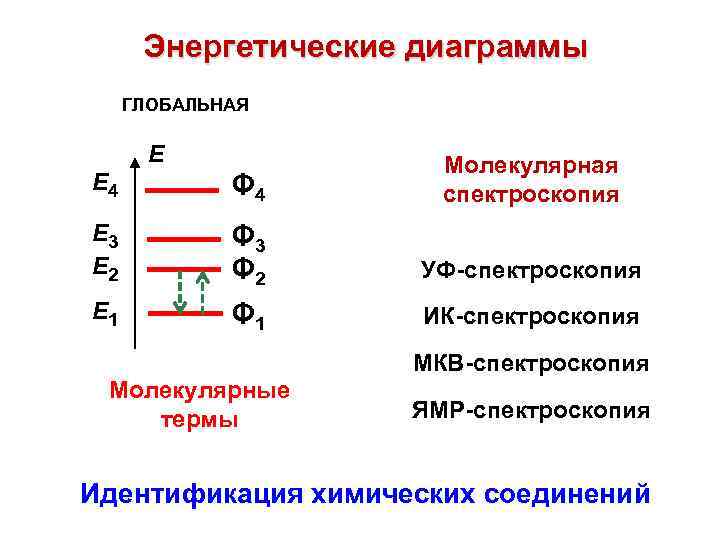 Энергетические диаграммы ГЛОБАЛЬНАЯ E Е 4 Φ 4 Молекулярная спектроскопия Е 3 Е 2 Φ 3 Φ 2 УФ-спектроскопия Е 1 Φ 1 ИК-спектроскопия МКВ-спектроскопия Молекулярные термы ЯМР-спектроскопия Идентификация химических соединений
Энергетические диаграммы ГЛОБАЛЬНАЯ E Е 4 Φ 4 Молекулярная спектроскопия Е 3 Е 2 Φ 3 Φ 2 УФ-спектроскопия Е 1 Φ 1 ИК-спектроскопия МКВ-спектроскопия Молекулярные термы ЯМР-спектроскопия Идентификация химических соединений
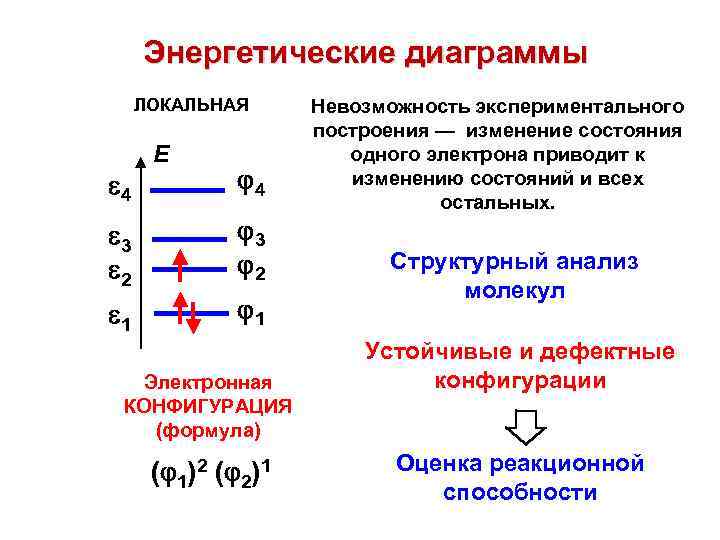 Энергетические диаграммы ЛОКАЛЬНАЯ 4 E 4 3 2 1 1 Электронная КОНФИГУРАЦИЯ (формула) ( 1)2 ( 2)1 Невозможность экспериментального построения — изменение состояния одного электрона приводит к изменению состояний и всех остальных. Структурный анализ молекул Устойчивые и дефектные конфигурации Оценка реакционной способности
Энергетические диаграммы ЛОКАЛЬНАЯ 4 E 4 3 2 1 1 Электронная КОНФИГУРАЦИЯ (формула) ( 1)2 ( 2)1 Невозможность экспериментального построения — изменение состояния одного электрона приводит к изменению состояний и всех остальных. Структурный анализ молекул Устойчивые и дефектные конфигурации Оценка реакционной способности
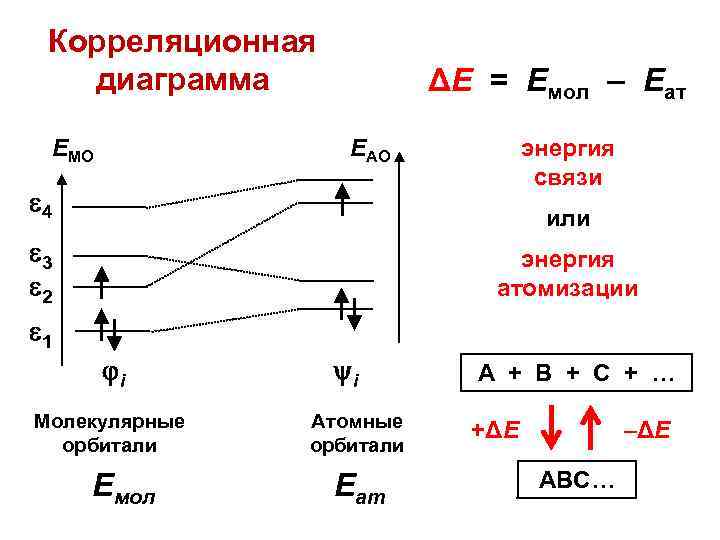 Корреляционная диаграмма EМО ΔЕ = Емол – Еат энергия связи EАО 4 или 3 2 энергия атомизации 1 i Молекулярные орбитали Емол i Атомные орбитали Еат А + В + С + … +ΔЕ –ΔЕ АВС…
Корреляционная диаграмма EМО ΔЕ = Емол – Еат энергия связи EАО 4 или 3 2 энергия атомизации 1 i Молекулярные орбитали Емол i Атомные орбитали Еат А + В + С + … +ΔЕ –ΔЕ АВС…
 Узловая структура МО Узловая поверхность Ψ(x, y, z) = 0 + + – – + От узловой структуры зависит характер движения электрона и его свойства (в т. ч. — химические)
Узловая структура МО Узловая поверхность Ψ(x, y, z) = 0 + + – – + От узловой структуры зависит характер движения электрона и его свойства (в т. ч. — химические)
 Бензол Е = 3 Е 3 – 2 = – 2 = +2 = – 1 = +1 – 1 = 0 о Энергетическая диаграмма Электронная конфигурация
Бензол Е = 3 Е 3 – 2 = – 2 = +2 = – 1 = +1 – 1 = 0 о Энергетическая диаграмма Электронная конфигурация
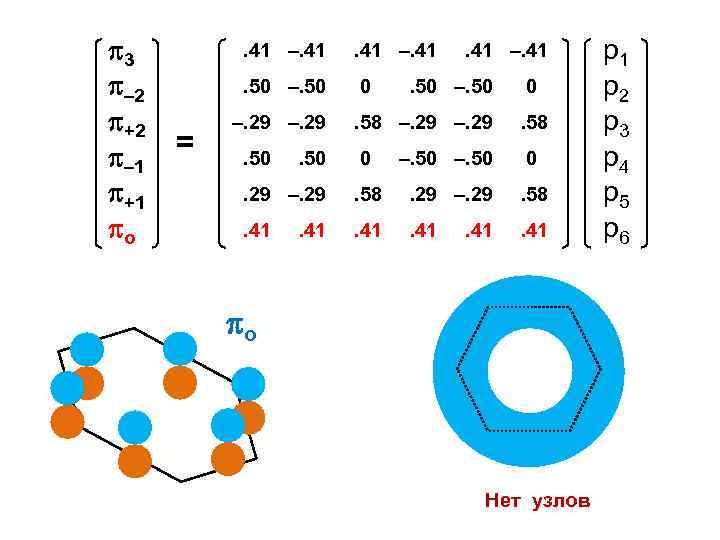 3 – 2 +2 – 1 +1 о . 41 –. 41. 50 –. 50 = . 41 –. 41 0 –. 29 . 41 –. 41 . 50 –. 50 0 . 58 –. 29 . 58 0 –. 50 0 . 29 –. 29 . 58 . 41 . 50. 41 о Нет узлов р1 р2 р3 р4 р5 р6
3 – 2 +2 – 1 +1 о . 41 –. 41. 50 –. 50 = . 41 –. 41 0 –. 29 . 41 –. 41 . 50 –. 50 0 . 58 –. 29 . 58 0 –. 50 0 . 29 –. 29 . 58 . 41 . 50. 41 о Нет узлов р1 р2 р3 р4 р5 р6
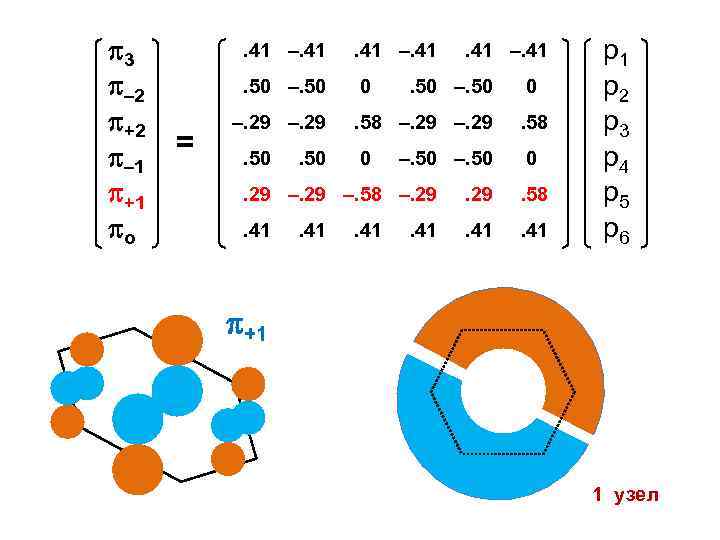 3 – 2 +2 – 1 +1 о . 41 –. 41. 50 –. 50 = . 41 –. 41 0 –. 29. 50 . 41 –. 41 . 50 –. 50 0 . 58 –. 29 . 58 0 0 –. 50 . 29 –. 58 –. 29 . 58 . 41 р1 р2 р3 р4 р5 р6 +1 1 узел
3 – 2 +2 – 1 +1 о . 41 –. 41. 50 –. 50 = . 41 –. 41 0 –. 29. 50 . 41 –. 41 . 50 –. 50 0 . 58 –. 29 . 58 0 0 –. 50 . 29 –. 58 –. 29 . 58 . 41 р1 р2 р3 р4 р5 р6 +1 1 узел
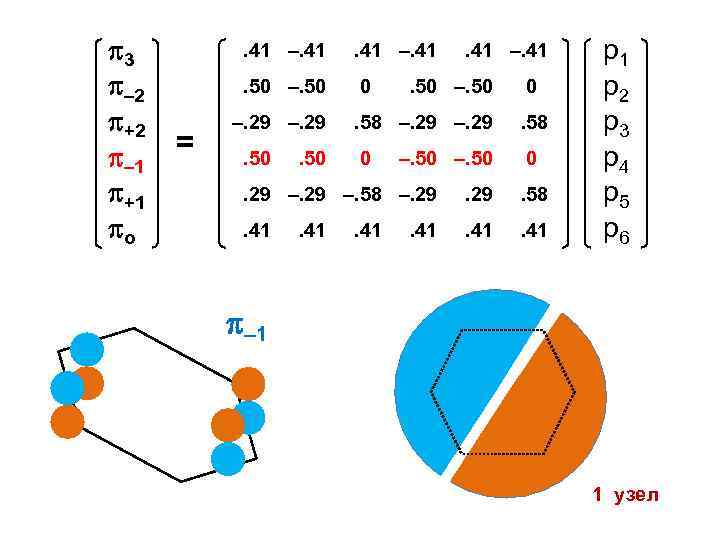 3 – 2 +2 – 1 +1 о . 41 –. 41. 50 –. 50 = . 41 –. 41 0 –. 29. 50 . 41 –. 41 . 50 –. 50 0 . 58 –. 29 . 58 0 0 –. 50 . 29 –. 58 –. 29 . 58 . 41 р1 р2 р3 р4 р5 р6 – 1 1 узел
3 – 2 +2 – 1 +1 о . 41 –. 41. 50 –. 50 = . 41 –. 41 0 –. 29. 50 . 41 –. 41 . 50 –. 50 0 . 58 –. 29 . 58 0 0 –. 50 . 29 –. 58 –. 29 . 58 . 41 р1 р2 р3 р4 р5 р6 – 1 1 узел
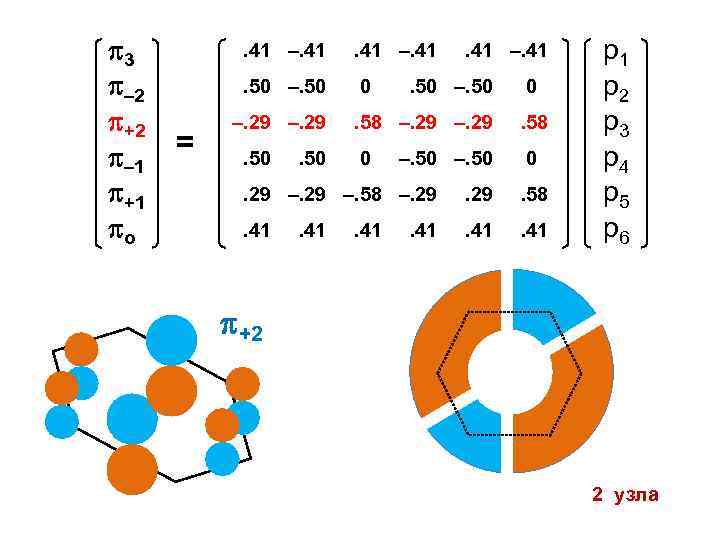 3 – 2 +2 – 1 +1 о . 41 –. 41. 50 –. 50 = . 41 –. 41 0 –. 29. 50 . 41 –. 41 . 50 –. 50 0 . 58 –. 29 . 58 0 0 –. 50 . 29 –. 58 –. 29 . 58 . 41 р1 р2 р3 р4 р5 р6 +2 2 узла
3 – 2 +2 – 1 +1 о . 41 –. 41. 50 –. 50 = . 41 –. 41 0 –. 29. 50 . 41 –. 41 . 50 –. 50 0 . 58 –. 29 . 58 0 0 –. 50 . 29 –. 58 –. 29 . 58 . 41 р1 р2 р3 р4 р5 р6 +2 2 узла
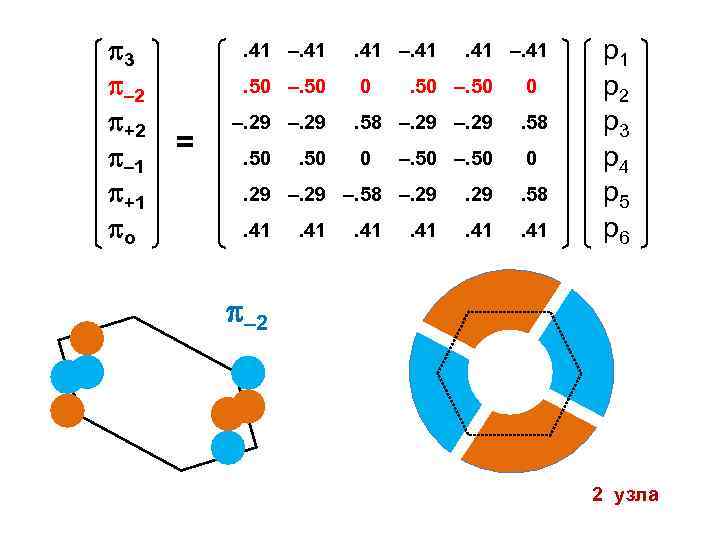 3 – 2 +2 – 1 +1 о . 41 –. 41. 50 –. 50 = . 41 –. 41 0 –. 29. 50 . 41 –. 41 . 50 –. 50 0 . 58 –. 29 . 58 0 0 –. 50 . 29 –. 58 –. 29 . 58 . 41 р1 р2 р3 р4 р5 р6 – 2 2 узла
3 – 2 +2 – 1 +1 о . 41 –. 41. 50 –. 50 = . 41 –. 41 0 –. 29. 50 . 41 –. 41 . 50 –. 50 0 . 58 –. 29 . 58 0 0 –. 50 . 29 –. 58 –. 29 . 58 . 41 р1 р2 р3 р4 р5 р6 – 2 2 узла
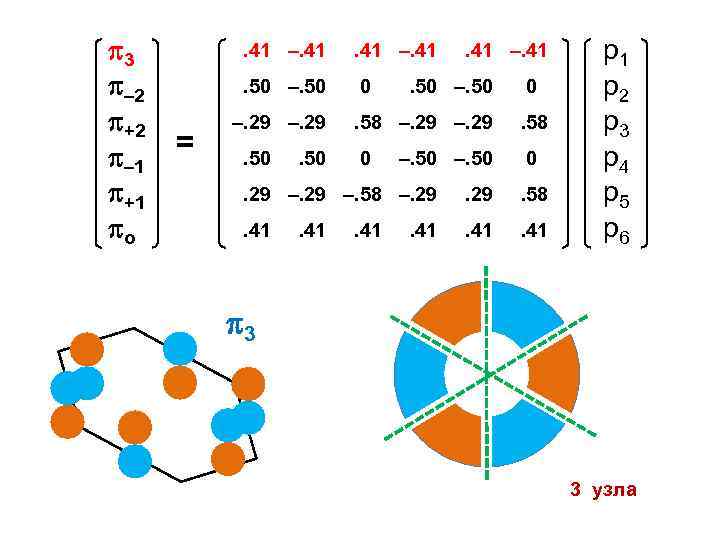 3 – 2 +2 – 1 +1 о . 41 –. 41. 50 –. 50 = . 41 –. 41 0 –. 29. 50 . 41 –. 41 . 50 –. 50 0 . 58 –. 29 . 58 0 0 –. 50 . 29 –. 58 –. 29 . 58 . 41 р1 р2 р3 р4 р5 р6 3 3 узла
3 – 2 +2 – 1 +1 о . 41 –. 41. 50 –. 50 = . 41 –. 41 0 –. 29. 50 . 41 –. 41 . 50 –. 50 0 . 58 –. 29 . 58 0 0 –. 50 . 29 –. 58 –. 29 . 58 . 41 р1 р2 р3 р4 р5 р6 3 3 узла
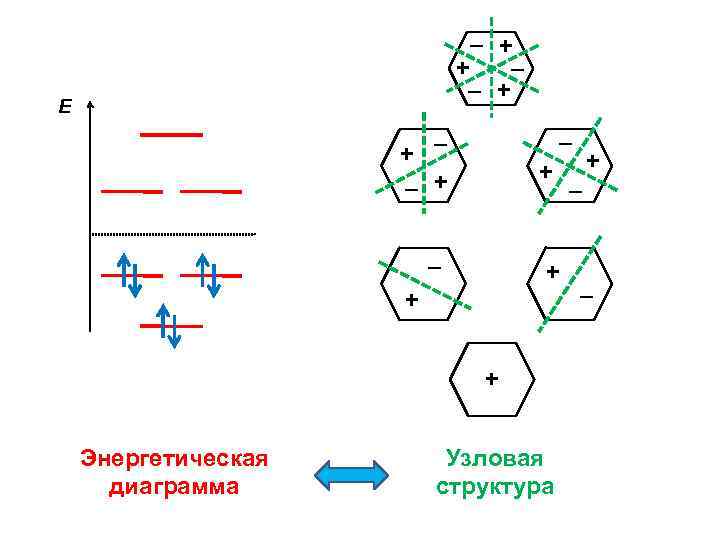 – + + – – + Е – + – – + + + Энергетическая диаграмма Узловая структура + – –
– + + – – + Е – + – – + + + Энергетическая диаграмма Узловая структура + – –


