Атом. Модели строения атомов.ppt
- Количество слайдов: 20
 Выполнила: студентка I курса 14 группы финансово-технологического колледжа Кильдеева Адиля
Выполнила: студентка I курса 14 группы финансово-технологического колледжа Кильдеева Адиля
 Атом. Что это такое? ► Атом (от греч. atomos — неделимый) - частица вещества микроскопических размеров и очень малой массы (микрочастица), наименьшая часть химического элемента, являющаяся носителем его свойств.
Атом. Что это такое? ► Атом (от греч. atomos — неделимый) - частица вещества микроскопических размеров и очень малой массы (микрочастица), наименьшая часть химического элемента, являющаяся носителем его свойств.
 Общая характеристика строения атома. ► Атом состоит из тяжёлого ядра, обладающего положительным электрическим зарядом, и окружающих его лёгких электронов с отрицательными электрическими зарядами, образующих электронные оболочки атома. Размеры атома в целом определяются размерами его электронной оболочки и велики по сравнению с размерами ядра атома.
Общая характеристика строения атома. ► Атом состоит из тяжёлого ядра, обладающего положительным электрическим зарядом, и окружающих его лёгких электронов с отрицательными электрическими зарядами, образующих электронные оболочки атома. Размеры атома в целом определяются размерами его электронной оболочки и велики по сравнению с размерами ядра атома.
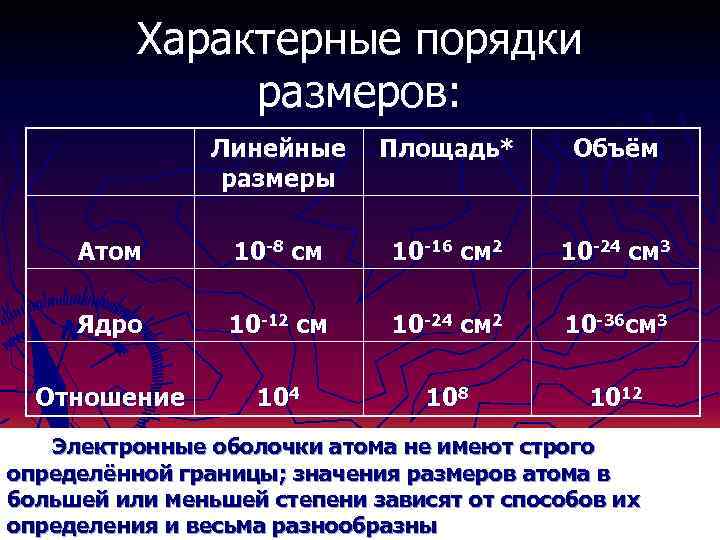 Характерные порядки размеров: Линейные размеры Площадь* Объём Атом 10 -8 см 10 -16 см 2 10 -24 см 3 Ядро 10 -12 см 10 -24 см 2 10 -36 см 3 Отношение 104 108 1012 Электронные оболочки атома не имеют строго определённой границы; значения размеров атома в большей или меньшей степени зависят от способов их определения и весьма разнообразны
Характерные порядки размеров: Линейные размеры Площадь* Объём Атом 10 -8 см 10 -16 см 2 10 -24 см 3 Ядро 10 -12 см 10 -24 см 2 10 -36 см 3 Отношение 104 108 1012 Электронные оболочки атома не имеют строго определённой границы; значения размеров атома в большей или меньшей степени зависят от способов их определения и весьма разнообразны
 СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН К середине 19 века было известно более 60 химических элементов, определены их атомные массы, накоплен обширный материал по физическим и химическим свойствам веществ, образованных элементами. Важнейшей задачей стало выявление взаимосвязи между элементами. В 1869 г. Д. И. Менделеев сформулировал открытый им периодический закон. Свойства простых тел, а также формы и свойства соединений находятся в периодической зависимости от атомных масс элементов. Открытый периодический закон позволил предсказать существование ряда новых элементов, описать их свойства, исправить значения атомных масс некоторых элементов. В настоящее время периодический закон используется химиками при создании новых соединений, при изучении их строения и свойств. Но причина периодической зависимости свойств элементов от атомной массы была не известна. И Менделеев был
СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН К середине 19 века было известно более 60 химических элементов, определены их атомные массы, накоплен обширный материал по физическим и химическим свойствам веществ, образованных элементами. Важнейшей задачей стало выявление взаимосвязи между элементами. В 1869 г. Д. И. Менделеев сформулировал открытый им периодический закон. Свойства простых тел, а также формы и свойства соединений находятся в периодической зависимости от атомных масс элементов. Открытый периодический закон позволил предсказать существование ряда новых элементов, описать их свойства, исправить значения атомных масс некоторых элементов. В настоящее время периодический закон используется химиками при создании новых соединений, при изучении их строения и свойств. Но причина периодической зависимости свойств элементов от атомной массы была не известна. И Менделеев был
 Модель атома Томсона. ► 1896 г. -Дж. Томсон - выдающийся ученый, директор знаменитой Кавендишской лаборатории, лауреат Нобелевской премии. открыл электрон. 1903 г. - Дж. Томсон выдвинул гипотезу о том, что электрон находится внутри атома. Но атом в целом нейтральный, поэтому ученый предположил, что отрицательные электроны окружены в атоме положительно заряженным веществом. Атом, по мысли Дж. Томсона, очень похож на "пудинг с изюмом", где "каша" - положительно заряженное вещество атома. , а электроны- " изюм" в ней.
Модель атома Томсона. ► 1896 г. -Дж. Томсон - выдающийся ученый, директор знаменитой Кавендишской лаборатории, лауреат Нобелевской премии. открыл электрон. 1903 г. - Дж. Томсон выдвинул гипотезу о том, что электрон находится внутри атома. Но атом в целом нейтральный, поэтому ученый предположил, что отрицательные электроны окружены в атоме положительно заряженным веществом. Атом, по мысли Дж. Томсона, очень похож на "пудинг с изюмом", где "каша" - положительно заряженное вещество атома. , а электроны- " изюм" в ней.
 Опыт Резерфорда по рассеянию альфа-частиц ► В 1911 г. - Э. Резерфорд ставит опыт по рассеянию альфа-частиц. Пучок aльфа-частиц пропускался через тонкую золотую фольгу.
Опыт Резерфорда по рассеянию альфа-частиц ► В 1911 г. - Э. Резерфорд ставит опыт по рассеянию альфа-частиц. Пучок aльфа-частиц пропускался через тонкую золотую фольгу.
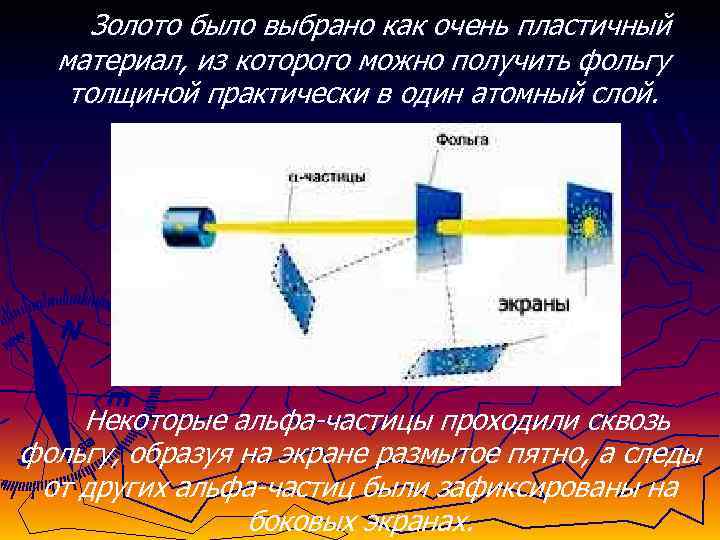 Золото было выбрано как очень пластичный материал, из которого можно получить фольгу толщиной практически в один атомный слой. Некоторые альфа-частицы проходили сквозь фольгу, образуя на экране размытое пятно, а следы от других альфа-частиц были зафиксированы на боковых экранах.
Золото было выбрано как очень пластичный материал, из которого можно получить фольгу толщиной практически в один атомный слой. Некоторые альфа-частицы проходили сквозь фольгу, образуя на экране размытое пятно, а следы от других альфа-частиц были зафиксированы на боковых экранах.
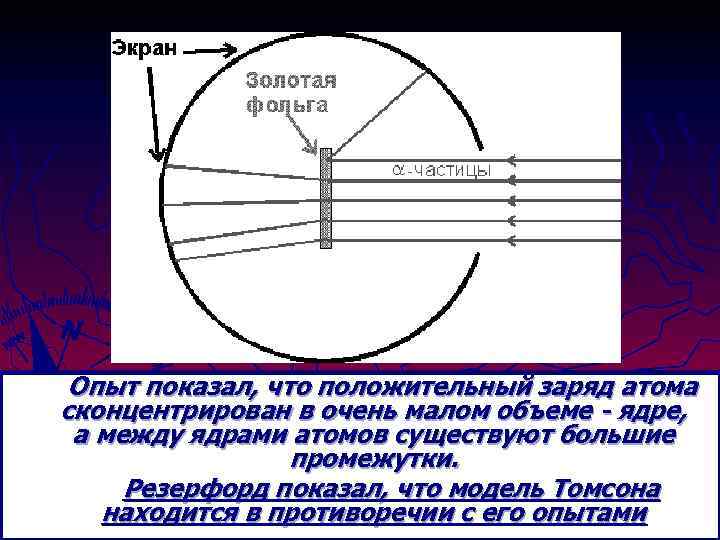 Опыт показал, что положительный заряд атома сконцентрирован в очень малом объеме - ядре, а между ядрами атомов существуют большие промежутки. Резерфорд показал, что модель Томсона находится в противоречии с его опытами
Опыт показал, что положительный заряд атома сконцентрирован в очень малом объеме - ядре, а между ядрами атомов существуют большие промежутки. Резерфорд показал, что модель Томсона находится в противоречии с его опытами
 Ядерная ( планетарная ) модель строения атома Резерфорда. ► 911 г. - Резерфорд предложил современную ядерную (планетарную) модель строения атома
Ядерная ( планетарная ) модель строения атома Резерфорда. ► 911 г. - Резерфорд предложил современную ядерную (планетарную) модель строения атома
 Резерфорд шел к своему открытию строения атома в течение 5 лет. Долгих пять лет проводил он опыты по исследованию строения атома Резерфорд установил, что: Атом имеет в центре ядро, размеры которого во много раз меньше размеров самого атома. Вокруг ядра по орбитам движутся электроны. Почти вся масса атома сконцентрирована в его ядре. Суммарный отрицательный заряд всех электронов равен суммарному положительному заряду ядра атома и компенсирует его.
Резерфорд шел к своему открытию строения атома в течение 5 лет. Долгих пять лет проводил он опыты по исследованию строения атома Резерфорд установил, что: Атом имеет в центре ядро, размеры которого во много раз меньше размеров самого атома. Вокруг ядра по орбитам движутся электроны. Почти вся масса атома сконцентрирована в его ядре. Суммарный отрицательный заряд всех электронов равен суммарному положительному заряду ядра атома и компенсирует его.
 Модель атома Бора Наглядная и простая ядерная модель атома Резерфорда противоречила классической электродинамике. Система вращающихся вокруг ядра электронов не может быть устойчивой, т. к. электрон при вращении должен непрерывно излучать энергию, и это должно было привести к его слиянию с ядром, т. е. разрушению атома. На самом деле атомы являются устойчивыми системами. Эти противоречия частично разрешил Нильс Бор, разработавший в 1913 г. теорию водородного атома, в основу которой он положил постулаты, связав их с законами классической механики и с квантовой теорией излучения энергии М. Планка:
Модель атома Бора Наглядная и простая ядерная модель атома Резерфорда противоречила классической электродинамике. Система вращающихся вокруг ядра электронов не может быть устойчивой, т. к. электрон при вращении должен непрерывно излучать энергию, и это должно было привести к его слиянию с ядром, т. е. разрушению атома. На самом деле атомы являются устойчивыми системами. Эти противоречия частично разрешил Нильс Бор, разработавший в 1913 г. теорию водородного атома, в основу которой он положил постулаты, связав их с законами классической механики и с квантовой теорией излучения энергии М. Планка:
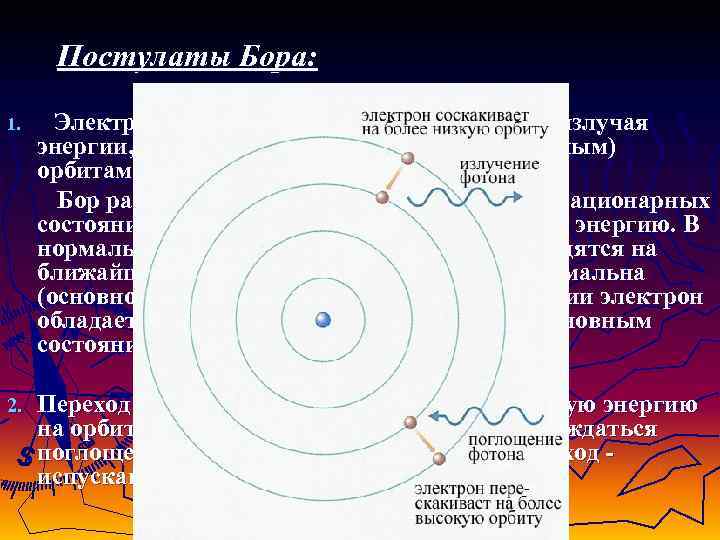 Постулаты Бора: 1. Электрон может вращаться вокруг ядра, не излучая энергии, только по определенным (стационарным) орбитам. Бор рассчитал радиус круговых орбит для стационарных состояний, скорость движения электрона и его энергию. В нормальном состоянии атома электроны находятся на ближайшей к ядру орбите и энергия его минимальна (основное состояние). В возбужденном состоянии электрон обладает большей энергией по сравнению с основным состоянием 2. Переход электрона с орбиты, имеющей меньшую энергию на орбиту с большей энергией должен сопровождаться поглощением кванта энергии. Обратный переход испусканием такого же кванта энергии.
Постулаты Бора: 1. Электрон может вращаться вокруг ядра, не излучая энергии, только по определенным (стационарным) орбитам. Бор рассчитал радиус круговых орбит для стационарных состояний, скорость движения электрона и его энергию. В нормальном состоянии атома электроны находятся на ближайшей к ядру орбите и энергия его минимальна (основное состояние). В возбужденном состоянии электрон обладает большей энергией по сравнению с основным состоянием 2. Переход электрона с орбиты, имеющей меньшую энергию на орбиту с большей энергией должен сопровождаться поглощением кванта энергии. Обратный переход испусканием такого же кванта энергии.
 Этими переходами Н. Бор объяснил происхождение и характер спектра водорода. Было известно, что атомы водорода, активированные нагреванием или электрическим полем, излучают свет. Спектр этого излучения состоит из волн строго определенной длины, т. е. спектр линейчатый, а не сплошной. Но теория Н. Бора непригодна для объяснения строения сложных атомов. А наличие стационарных орбит теоретически не было обосновано, оно постулировалось
Этими переходами Н. Бор объяснил происхождение и характер спектра водорода. Было известно, что атомы водорода, активированные нагреванием или электрическим полем, излучают свет. Спектр этого излучения состоит из волн строго определенной длины, т. е. спектр линейчатый, а не сплошной. Но теория Н. Бора непригодна для объяснения строения сложных атомов. А наличие стационарных орбит теоретически не было обосновано, оно постулировалось
 Современная квантово-механическая модель атома ► В 1924 г. французский физик Луи де Бройль высказал предположение, что электрон обладает не только свойствами частицы, но и свойствами волны (корпускулярно-волновая двойственность электрона). Согласно уравнению волны де Бройля: (где h - постоянная Планка ( [Дж. с])), частице с массой m, движущейся со скоростью v соответствует волна длиной λ. ► Таким образом, любой частице соответствует волна определенной длины, в том числе и потокам электронов соответствует волновой процесс, что было подтверждено экспериментально: потоки электронов, проходя через кристаллическую решетку, подвергаются дифракции, и дифракционная картина соответствует волновому процессу с длиной волны λ. Было доказано, что электрон обладает свойствами и частицы и волны. Корпускулярно-волновое представление об электроне позволяет утверждать, что электрон может находиться в любом месте атома, но вероятность его пребывания неодинакова, т. е. положение его неопределенно.
Современная квантово-механическая модель атома ► В 1924 г. французский физик Луи де Бройль высказал предположение, что электрон обладает не только свойствами частицы, но и свойствами волны (корпускулярно-волновая двойственность электрона). Согласно уравнению волны де Бройля: (где h - постоянная Планка ( [Дж. с])), частице с массой m, движущейся со скоростью v соответствует волна длиной λ. ► Таким образом, любой частице соответствует волна определенной длины, в том числе и потокам электронов соответствует волновой процесс, что было подтверждено экспериментально: потоки электронов, проходя через кристаллическую решетку, подвергаются дифракции, и дифракционная картина соответствует волновому процессу с длиной волны λ. Было доказано, что электрон обладает свойствами и частицы и волны. Корпускулярно-волновое представление об электроне позволяет утверждать, что электрон может находиться в любом месте атома, но вероятность его пребывания неодинакова, т. е. положение его неопределенно.

 Закон Мозли В 1913 г. английский физик Мозли измерил длины волн рентгеновских лучей, испускаемых разными металлами в катодной трубке, и построил график зависимости обратного значения квадратного корня из длины волны рентгеновских лучей от порядкового номера элемента. Этот график показывает, что порядковый номер отражает какую-то важную характеристику элемента. Мозли предположил, что этой характеристикой является заряд ядра атома, и что он возрастает на единицу при переходе от одного элемента к следующему за ним по порядку. Он назвал порядковый номер атомным номером - Z.
Закон Мозли В 1913 г. английский физик Мозли измерил длины волн рентгеновских лучей, испускаемых разными металлами в катодной трубке, и построил график зависимости обратного значения квадратного корня из длины волны рентгеновских лучей от порядкового номера элемента. Этот график показывает, что порядковый номер отражает какую-то важную характеристику элемента. Мозли предположил, что этой характеристикой является заряд ядра атома, и что он возрастает на единицу при переходе от одного элемента к следующему за ним по порядку. Он назвал порядковый номер атомным номером - Z.
 Закон Мозли: Корень квадратный из величины, обратной длине волны рентгеновских лучей, испускаемых атомами различных элементов, находится в линейной зависимости от порядкового номера элемента. где - длина волны, а – постоянная величина, Z – порядковый номер элемента (заряд ядра).
Закон Мозли: Корень квадратный из величины, обратной длине волны рентгеновских лучей, испускаемых атомами различных элементов, находится в линейной зависимости от порядкового номера элемента. где - длина волны, а – постоянная величина, Z – порядковый номер элемента (заряд ядра).
 Позже стало известно, что порядковый номер равен числу протонов в ядре. Таким образом, порядковый (атомный) номер равен заряду ядра и он же определяет наличие в нем протонов (положительных частиц). А так как атомы нейтральны, то число электронов в атоме должно быть равно числу протонов. Но массы атомов оказались больше суммарной массы протонов. Для объяснения избытка массы было высказано предположение о существовании нейтронов. Эти частицы должны были иметь ту же массу, что и протон, но нулевой заряд (1, 675. 10 -27 кг). Нейтрон был открыт сотрудником Резерфорда Чедвигом в 1932 г. Было окончательно установлено, что атом состоит из ядра и электронов, а ядро – из протонов и нейтронов. Их сумму называют нуклонным числом или массовым - А. А = Z + N, Z- число протонов, N- число нейтронов.
Позже стало известно, что порядковый номер равен числу протонов в ядре. Таким образом, порядковый (атомный) номер равен заряду ядра и он же определяет наличие в нем протонов (положительных частиц). А так как атомы нейтральны, то число электронов в атоме должно быть равно числу протонов. Но массы атомов оказались больше суммарной массы протонов. Для объяснения избытка массы было высказано предположение о существовании нейтронов. Эти частицы должны были иметь ту же массу, что и протон, но нулевой заряд (1, 675. 10 -27 кг). Нейтрон был открыт сотрудником Резерфорда Чедвигом в 1932 г. Было окончательно установлено, что атом состоит из ядра и электронов, а ядро – из протонов и нейтронов. Их сумму называют нуклонным числом или массовым - А. А = Z + N, Z- число протонов, N- число нейтронов.
 Источники… ► http: //dic. academic. ru/dic. nsf/bse/65901 ► http: //class-fizika. narod. ru/9_35. htm ► http: //ru. wikipedia. org/wiki/%F 2%EE%EC ► http: //chembsu. narod. ru/umk_chem_web. CD/C h 1/atom. htm
Источники… ► http: //dic. academic. ru/dic. nsf/bse/65901 ► http: //class-fizika. narod. ru/9_35. htm ► http: //ru. wikipedia. org/wiki/%F 2%EE%EC ► http: //chembsu. narod. ru/umk_chem_web. CD/C h 1/atom. htm


