1презент у шлепа.pptx
- Количество слайдов: 40

Выполнила: Студентка группы ЗОСб-0901 Батова К. Э ПРЕЗЕНТАЦИЯ ПО ДИСЦИПЛИНЕ: ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ЗАЩИТЫ ОКРУЖАЮЩЕЙ СРЕДЫ НА ТЕМУ: ОСНОВНЫЕ ФИЗИКОХИМИЧЕСКИЕ ЗАКОНОМЕРНОСТИ.


Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В то же время жидкость обладает рядом только ей присущих свойств, одно из которых – текучесть.

газ Газ (газообразное состояние) (от нидерл. gas) — агрегатное состояние вещества, характеризующееся очень слабыми связями между составляющими его частицами (молекулами, атомами или ионами), а также их большой подвижностью. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения.

Твердое состояние ТВЕРДОЕ СОСТОЯНИЕ, агрегатное состояние ВЕЩЕСТВА, в котором вещество имеет относительно постоянную форму и объем. Силы, действующие между атомами или молекулами, достаточно сильны, чтобы удерживать их в определенных ячейках (вблизи которых они могут колебаться) и противостоять сжатию.

жидкость 3 1 4 2 5 Твердое тело газ 6 1 -плавление 2 -кристаллизация 3 -парообразование 4 -конденсация 5 -сублимация 6 -десублимация

парообразование Парообразование — свойство капельных жидкостей изменять свое агрегатное состояние и превращаться в пар. Парообразование, происходящее лишь на поверхности капельной жидкости, называется испарением. Парообразование по всему объему жидкости называетсякипением; оно происходит при определенной температуре, зависящей от давления. Давление, при котором жидкость закипает при данной температуре, называется давлением насыщенных паров , его значение зависит от рода жидкости и ее температуры.

Конденсация паров Сублимация и десублимация Переход из твердого состояния в газообразное определяется как возгонка или сублимация. Обратный переход из газообразного состояния в твердое именуется десублимацей Примерами сублимации являются сушка продуктов, охлаждение «сухим льдом» (твердым диоксидом углерода), который непосредственно переходит в газообразное состояние. Явление десублимации лежит в основе выпадения инея на почву, замерзания стекол в окнах помещений и других природных процессов.

Переход из твердого состояния в жидкое называется плавлением, а обратный процесс - отвердеванием (или замерзанием, если оно имеет место при невысокой температуре). Переход из одной модификации твердого состояния в другую называется полиморфным превращением или просто переходом.

Кристаллиза ция — процесс фазового перехода вещества из жидкого состояния в твёрдое кристаллическое с образованием кристаллов. Фазой называется однородная часть термодинамической системы отделённая от других частей системы(других фаз) поверхностью раздела, при переходе через которую химический состав, структура и свойства вещества изменяются скачками. Кристаллизация — это процесс выделения твёрдой фазы в виде кристаллов из растворов или расплавов, в химической промышленности процесс кристаллизации используется для получения веществ в чистом виде.

Переход вещества из одного агрегатного состояния в другое или полиморфное превращение сопровождаются выделением или поглощением теплоты Q - энергия, которую тело теряет или приобретает при передаче тепла. Формула количества теплоты зависит от протекающего процесса.

Формулы количества теплоты при различных процессах: 1. Нагревание и охлаждение: 2. Плавление и кристаллизация 3. Кипение и испарение 4. Сгорание топлива:

Количество теплоты, переданное телу, идет на изменение его внутренней энергии и на совершение им работы В неподвижном металлическом проводнике вся энергия электрического тока превращается в тепло:
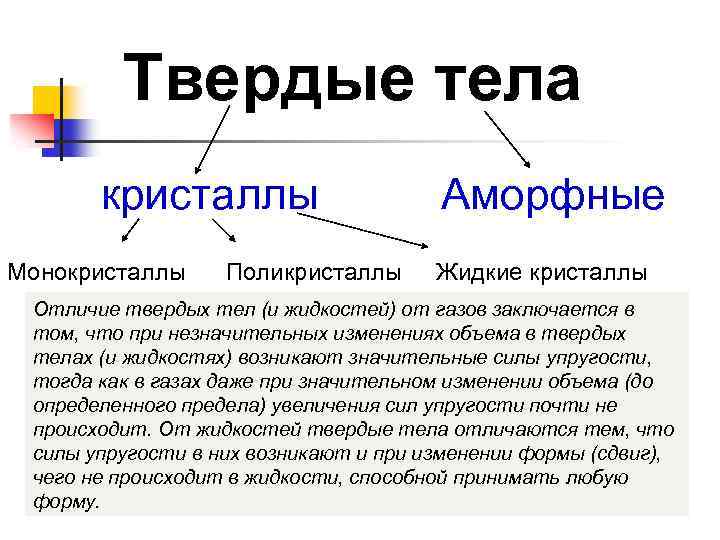
Твердые тела кристаллы Аморфные Монокристаллы Поликристаллы Жидкие кристаллы Отличие твердых тел (и жидкостей) от газов заключается в том, что при незначительных изменениях объема в твердых телах (и жидкостях) возникают значительные силы упругости, тогда как в газах даже при значительном изменении объема (до определенного предела) увеличения сил упругости почти не происходит. От жидкостей твердые тела отличаются тем, что силы упругости в них возникают и при изменении формы (сдвиг), чего не происходит в жидкости, способной принимать любую форму.

Свойства твердых тел 1. Упругость 2. Пластичность 3. Хрупкость

Типы кристаллических решеток 1. Ионные (Na. Cl) 2. Молекулярные (нафталин, парафин) 3. Атомные (графит, алмаз) 4. Металлические (металлы) :

Сравнительная характеристика Алмаз Графит Необычайно твердый Мягок(легко расщепляется) прозрачный Непрозрачен Диэлектрик электропроводен Имеет большую теплопроводность Жаропрочен Обработанные алмазыбриллианты Не похож на драгоценный камень Перестроение кристаллической решетки Р=10 ГПА t=2000 C

Объединенный газовый закон, или уравнение состояния идеального газа, устанавливает соотношение между тремя основными термодинамическими параметрами газа: давлением р, объемом v и абсолютной температурой Т (при произвольном числе n молей вещества) pv=n. RT (1. 1) где R - коэффициент пропорциональности, или универсальная газовая постоянная. Уравнение (1. 1) известно как уравнение Клапейрона – Менделеева.

Отнеся уравнение (1. 1) к одному молю (n = 1) и обозначив объем этого моля через V, получим: pv=RT (1. 2)

Идеальный газ n Идеальный газ - это такой гипотетический газ, молекулы которого не взаимодействуют друг с другом и занимают нулевой объем.


Частные случаи Частным случаем уравнения состояния идеального газа являются законы, описывающие его поведение в условиях, когда один из термодинамических параметров остается постоянным, т. е. имеет место изопроцесс (изос - равный, одинаковый). Различают: 1. изохорический (V = const), 2. изобарический (р = const) 3. изотермический (Т = const. ) процессы.
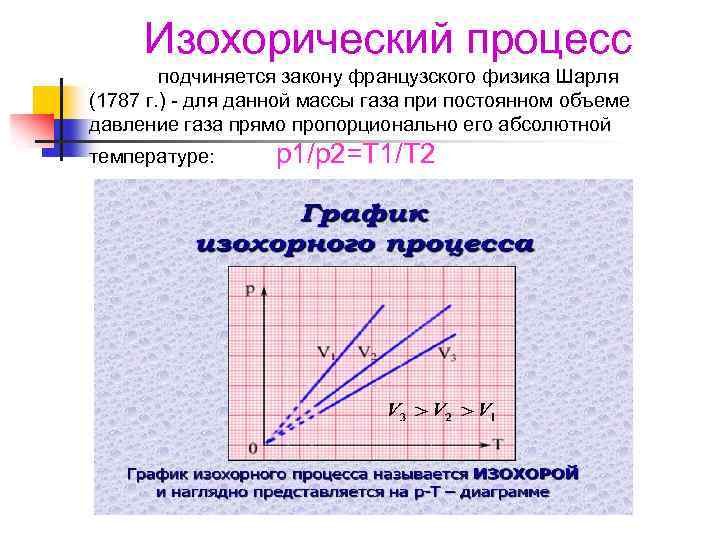
Изохорический процесс подчиняется закону французского физика Шарля (1787 г. ) - для данной массы газа при постоянном объеме давление газа прямо пропорционально его абсолютной температуре: p 1/p 2=T 1/T 2

Изобарический процесс подчиняется закону французского физика Гей. Люссака (1802 г. ) - для данной массы газа при постоянном давлении объем газа прямо пропорционален его абсолютной температуре: V 1/V 2 = T 1/T 2.

Изотермический процесс в газе впервые был изучен английским ученым Р. Бойлем (1606 г. ) и несколько позднее независимо от него французским ученым Э. Мариоттом. Открытый ими закон Бойля - Мариотта гласит: про-14 изведение давления данной массы газа на его объем постоянно, если температура газа не меняется: p. V=const

Основные понятия и законы термодинамики

Дисперсные системы - это такие системы, в которых одно вещество распределено в среде другого в виде очень мелких частиц. Они состоят из двух или большего числа фаз, т. е. являются гетерогенными. Распределяемое вещество называют дисперсной фазой, а вещество, в котором распределяется дисперсная фаза, - дисперсионной средой.

Традиционно считается, что термодинамика основывается на четырёх законах (началах), которые сформулированы на основе экспериментальных данных и поэтому могут быть приняты как постулаты.

ΔU = Q – A. Первый закон термодинамики (закон сохранения энергии для тепловых процессов) определяет количественное соотношение между изменением внутренней энергии системы дельта U, количеством теплоты Q, подведенным к ней, и суммарной работой внешних сил A, действующих на систему. Первый закон термодинамики - количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами

2 -й закон — второе начало термодинамики: Второй закон термодинамики исключает возможность создания вечного двигателя второго рода. Имеется несколько различных, но в то же время эквивалентных формулировок этого закона. 1 — Постулат Клаузиуса. Процесс, при котором не происходит других изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, то есть теплота не может перейти от холодного тела к горячему без каких-либо других изменений в системе. Это явление называют рассеиванием или диссипацией энергии. Приведем второе начало термодинамики в ещё одной формулировке Рудольфа Юлиуса Клаузиуса (1865): для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния , называемая энтропией, такая, что ее полный дифференциал . [3] 2 — Постулат Кельвина. Процесс, при котором работа переходит в теплоту без каких-либо других изменений в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе.

* 3 -й закон — третье начало термодинамики: Теорема Нернста: энтропия любой равновесной системы при абсолютном нуле температуры всегда равна нулю (традиционная формулировка). Здесь важно различать аксиомы, отражающие законы природы, и имеющие исторические корни соглашения, необходимые для построения шкалы измерения соответствующей термодинамической величины. Так, аксиомами являются утверждения, что и энтропия, и температура есть односторонне ограниченные величины, и что своих граничных значений обе величины достигают одновременно. Согласно стандартным соглашениям принято, что и энтропия, и температура ограничены снизу, т. е. не могут быть меньше некоторых предельных значений. Из этого логично вытекают следующие соглашения, согласно которым наименьшее значение энтропии принято равным нулю, а наименьшее (нулевое) значение температуры служит реперной точкой для построения термодинамической шкалы температур.

Одно из основных понятий термодинамики связано с определением «системы» . Система - тело или группа тел, находящихся во взаимодействии и мысленно обособляемых от окружающей среды.

По степени однородности свойств : -гомогенные (состоящие из одной фазы) -гетерогенные (состоящие из несколько фаз) По степени взаимодействия с ОС: -изолированные -неизолированные

Изолированные системы - это системы, имеющие постоянный объем, через границы которых не происходит обмена веществом или анергией с окружающей средой. В противном случае мы имеем дело с неизолированной системой.

Жидкости - это вещества, которые сохраняют свой объем, но не имеют постоянной формы, принимая форму сосуда, в котором находятся. Сохранение объема жидкости показывает, что между ее молекулами действуют силы притяжения, а расстояние между молекулами меньше радиуса молекулярного взаимодействия. Иными словами, в объеме, размеры которого меньше радиуса действия сил молекулярного взаимодействия, наблюдается упорядоченное, расположение молекул жидкости. Однако в объеме с размерами больше радиуса взаимодействия сил молекулярного притяжения доминируют силы броуновского движения молекул, что приводит к их хаотическому перемещению. Таким образом, все пространство, занятое жидкостью, состоит как бы из множества зародышей кристаллов, которые, однако, неустойчивы, распадаются в одном месте, но снова возникают в другом. В этом смысле говорят, что в жидкости существует ближний порядок. По своим свойствам жидкости занимают промежуточное положение между газами и твердыми телами.

Из явлений, связанных со свойствами жидкости, наиболее часто в технологических процессах имеют дело со смачиванием и капиллярными явлениями. При контакте различных веществ с жидкостями наблюдаются различной степени силовые и физико-химические взаимодействия. Например, при опускании и вынимании стеклянной палочки в ртуть и в воду оказывается, что молекулы ртути притягиваются друг к другу сильнее, чем к молекулам стекла, а молекулы воды притягиваются друг к другу слабее, чем к молекулам стекла. Если молекулы жидкости притягиваются друг к другу слабее, чем к молекулам твёрдого вещества, то жидкость называют смачивающей это вещество. Если молекулы жидкости притягиваются друг к другу сильнее, чем к молекулам твердого вещества, то жидкость называют не смачивающей это вещество
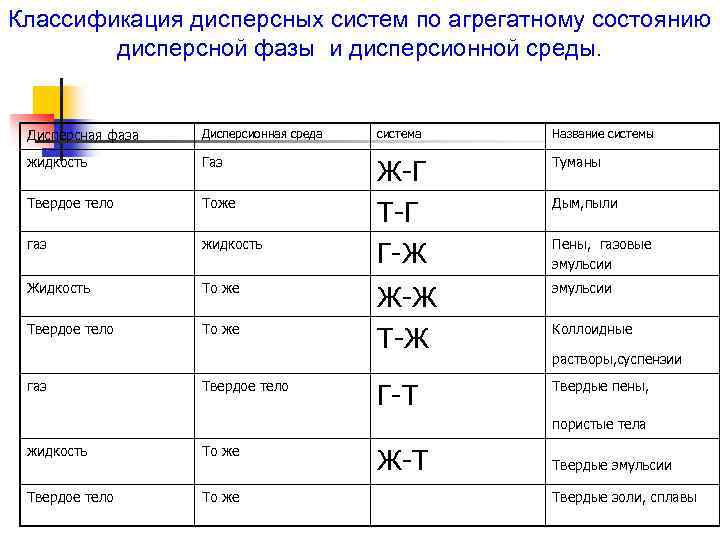
Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды. Дисперсная фаза Дисперсионная среда система Название системы жидкость Газ Твердое тело Тоже газ жидкость Ж-Г Т-Г Г-Ж Туманы Жидкость То же эмульсии Твердое тело То же Ж-Ж Т-Ж Г-Т Твердые пены, газ Твердое тело Дым, пыли Пены, газовые эмульсии Коллоидные растворы, суспензии пористые тела жидкость То же Твердое тело То же Ж-Т Твердые эмульсии Твердые золи, сплавы
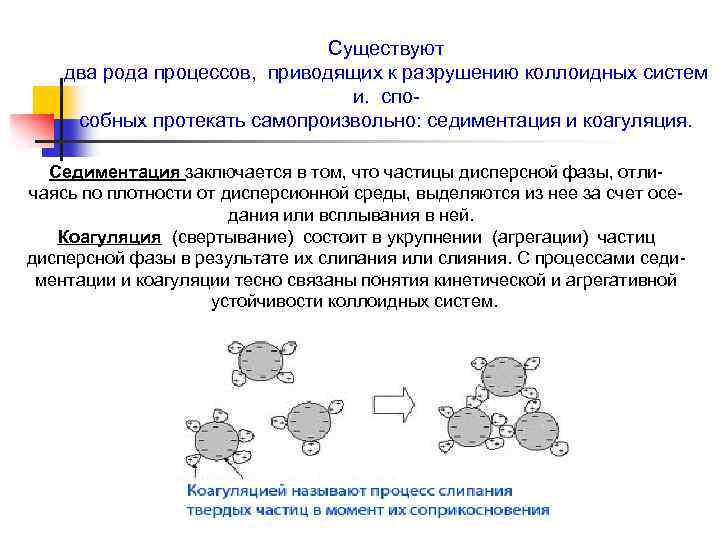
Существуют два рода процессов, приводящих к разрушению коллоидных систем и. способных протекать самопроизвольно: седиментация и коагуляция. Седиментация заключается в том, что частицы дисперсной фазы, отличаясь по плотности от дисперсионной среды, выделяются из нее за счет оседания или всплывания в ней. Коагуляция (свертывание) состоит в укрупнении (агрегации) частиц дисперсной фазы в результате их слипания или слияния. С процессами седиментации и коагуляции тесно связаны понятия кинетической и агрегативной устойчивости коллоидных систем.

Коллоидные системы представляют частный случай дисперсий, в которых поверхностные свойства вещества, отличающиеся от свойств в объеме, играют значительную роль. Сильное развитие поверхности (количественное изменение) приводит в данном случае к появлению новых качеств, новых свойств, присущих только коллоидам. Эти свойства позволяют рассматривать коллоидные системы как особое состояние вещества (качественное изменение), характеризуемое, в частности, сильным развитием адсорбционных процессов.

Поверхностные явления, вызываемые избытком свободной энергии в пограничном слое — поверхностной энергии, повышенной активностью и ориентацией молекул поверхностного слоя, особенностями его структуры и состава. П. я. определяются также тем, что хим. и физ. вз-ствия тел происходят прежде всего в поверхностных слоях. Осн. П. я. связаны с уменьшением поверхностной энергии, пропорциональной площади поверхности.
1презент у шлепа.pptx