Выполнила: студентка гр. 171108 Рубцова И.


Выполнила: студентка гр. 171108 Рубцова И. В. Преподаватель: д. физ. -мат. н. Ткаченко Г. И.

Эл ектрохим ическая коррозия

. Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости.

К электрохимической коррозии относятся такие виды местных разрушений, как питтинги, межкристаллитная коррозия, щелевая. Кроме того процессы электрохимической коррозии происходят в грунте, атмосфере, море.

По электрохимическому механизму корродируют металлы в контакте с растворами электролитов (морская вода, растворы кислот, щелочей, солей). В обычных атмосферных условиях и в земле металлы корродируют также по электрохимическому механизму , т. к. на их поверхности имеются капли влаги с растворенными компонентами воздуха и земли.

Механизм электрохимической коррозии может протекать по двум вариантам: 1) Гомогенный механизм электрохимической коррозии; 2) Гетерогенный механизм электрохимической коррозии.

Электрохимическая коррозия имеет некоторые особенности: делится на два одновременно протекающих процесса (катодный и анодный), которые кинетически зависимы друг от друга; на некоторых участках поверхности электрохимическая коррозия может принять локальный характер; растворение основного метала происходит именно на анодах.

Причины возникновения местных гальванических элементов могут быть самые разные: 1) неоднородность сплава; 2) неоднородность среды; 3) неоднородность физических условий.
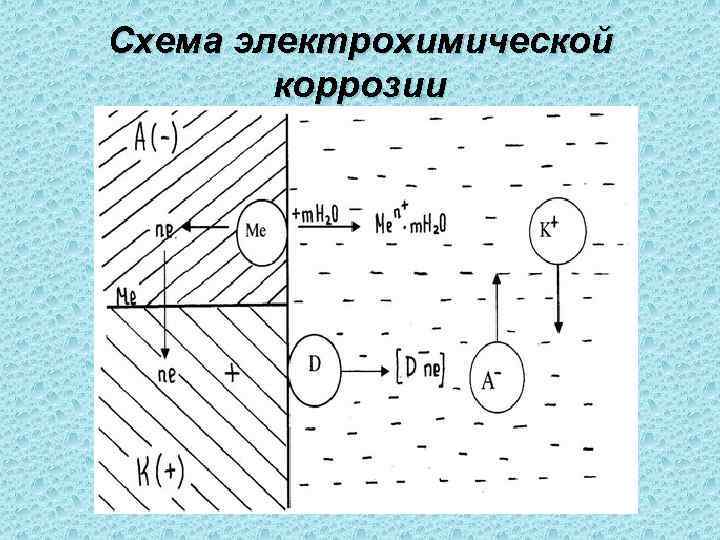
Схема электрохимической коррозии

При соприкосновении двух электропроводящих фаз (например, мет. - среда), когда одна из них заряжена положительно, а другая отрицательно, между ними возникает разность потенциала. Это явление связано с возникновением двойного электрического слоя (ДЭС). Заряженные частицы располагаются несимметрично на границе раздела фаз.

Скачок потенциала между двух фаз не может быть измерен, но при помощи компенсационного метода можно измерить электродвижущую силу элемента (ЭДС), который состоит из электрода сравнения и исследуемого электрода. В качестве электрода сравнения берется стандартный водородный электрод. ЭДС гальванического элемента (стандартный водородный электрод и исследуемый элемент) называют электродным потенциалом. Электродами сравнения могут также выступать хлорсеребряный, каломельный, насыщенный медно-сульфатный.

Скорость электрохимической коррозии тем меньше, чем больше поляризация. Поляризация характеризуется величиной перенапряжения.

Поляризация бывает трех типов: - электрохимическая (при замедлении анодного или катодного процессов); - концентрационная (наблюдается, когда скорость подхода деполяризатора к поверхности и отвода продуктов коррозии мала); - фазовая (связана с образованием на поверхности новой фазы).

Электрохимическая коррозия наблюдается также при контакте двух разнородных металлов. В электролите они образуют гальванопару. Более электроотрицательный из них будет анодом. Анод в процессе будет постепенно растворяться. При этом идет замедление или даже полное прекращение электрохимической коррозии на катоде (более

Электрохимическая коррозия является гетерогенным и многостадийным процессом. Ее причиной является термодинамическая неустойчивость металлов в данной коррозионной среде.

Учение о электрохимической коррозии ставит главный вопрос - вопрос о скорости коррозии и тех факторов, которые влияют на нее. С электрохимической точки зрения коррозия металла это не просто процесс окисления металла, т. к. этот переход должен сопровождаться сопряженно идущим восстановительным процессом.

Спасибо за внимание!!!
материаловедение.ppt
- Количество слайдов: 17

