Выполнила Каримтаева Тоха Д. И. Менделеев






















Periodicheskyзакон.ppt
- Количество слайдов: 24
 Выполнила Каримтаева Тоха
Выполнила Каримтаева Тоха
 Д. И. Менделеев сформулировал свой закон: Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов. В настоящее время периодический закон формулируется : свойства элементов и их соединений находятся в периодической зависимости зарядов ядер их атомов.
Д. И. Менделеев сформулировал свой закон: Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов. В настоящее время периодический закон формулируется : свойства элементов и их соединений находятся в периодической зависимости зарядов ядер их атомов.
 Причина периодичности - порядок заполнения электронной оболочки атомов. Периодическая система элементов состоит из периодов и групп. Период – это ряд элементов, начинающийся с активного щелочного металла и завершающийся благородным газом. Современная ПЭС состоит из 7 периодов. 1 -3 периоды - малые и состоят из одного ряда. 4 -7 периоды - большими и состоят из двух рядов. Период начинается элементом, в атоме которого появляется электрон с новым значением главного квантового числа n. Номер периода совпадает со значением n внешнего энергетического уровня. При движении вдоль периодической таблицы квантовые числа l и m вновь появляющегося электрона определяют группу, в которой находится элемент.
Причина периодичности - порядок заполнения электронной оболочки атомов. Периодическая система элементов состоит из периодов и групп. Период – это ряд элементов, начинающийся с активного щелочного металла и завершающийся благородным газом. Современная ПЭС состоит из 7 периодов. 1 -3 периоды - малые и состоят из одного ряда. 4 -7 периоды - большими и состоят из двух рядов. Период начинается элементом, в атоме которого появляется электрон с новым значением главного квантового числа n. Номер периода совпадает со значением n внешнего энергетического уровня. При движении вдоль периодической таблицы квантовые числа l и m вновь появляющегося электрона определяют группу, в которой находится элемент.
 Номер периода совпадает с номером заполняющегося уровня. Число элементов входящих в период определяется энергетической емкостью уровня. Например, в 3 -м периоде число элементов равно 18.
Номер периода совпадает с номером заполняющегося уровня. Число элементов входящих в период определяется энергетической емкостью уровня. Например, в 3 -м периоде число элементов равно 18.
 Элементы атомы, которых завершают заполнение своей электронной оболочки на s – подуровне называются s – элементами. Элементы атомы, которых завершают заполнение своей электронной оболочки на р – подуровне называются р – элементами. Элементы атомы, которых завершают заполнение своей электронной оболочки на d – подуровне называются d – элементами. Элементы атомы, которых завершают заполнение своей электронной оболочки на f – подуровне называются f – элементами.
Элементы атомы, которых завершают заполнение своей электронной оболочки на s – подуровне называются s – элементами. Элементы атомы, которых завершают заполнение своей электронной оболочки на р – подуровне называются р – элементами. Элементы атомы, которых завершают заполнение своей электронной оболочки на d – подуровне называются d – элементами. Элементы атомы, которых завершают заполнение своей электронной оболочки на f – подуровне называются f – элементами.
 В ПЭС - 8 групп, что соответствует максимальному числу электронов во внешних подоболочках. Номер группы показывает высшую степень окисления элемента по кислороду, исключение подгруппа меди и VIII группа. Группы делятся на главные и побочные. Подгруппы включают в себя элементы с аналогичными электронными структурами (электронные аналоги). Главные подгруппы включают в свой состав типические элементы (элементы II и III периодов). Побочные подгруппы в своем составе не имеют типических элементов.
В ПЭС - 8 групп, что соответствует максимальному числу электронов во внешних подоболочках. Номер группы показывает высшую степень окисления элемента по кислороду, исключение подгруппа меди и VIII группа. Группы делятся на главные и побочные. Подгруппы включают в себя элементы с аналогичными электронными структурами (электронные аналоги). Главные подгруппы включают в свой состав типические элементы (элементы II и III периодов). Побочные подгруппы в своем составе не имеют типических элементов.
 Первая группа - щелочные металлы. На внешнем электронном уровне один s -электрон. Электрон теряется очень легко, с образованием катиона Э +. Формула оксида - Э 2 О. Вторая группа - щелочноземельные металлы. На внешнем электронном уровне два s- электрона. Свойства похожи на свойства элементов I группы, но более слабо выражены. Формула оксида - ЭО. Третья группа - на внешнем слое два s и один p - электрон. . Их степень окисления +3, формула оксида Э 2 О 3.
Первая группа - щелочные металлы. На внешнем электронном уровне один s -электрон. Электрон теряется очень легко, с образованием катиона Э +. Формула оксида - Э 2 О. Вторая группа - щелочноземельные металлы. На внешнем электронном уровне два s- электрона. Свойства похожи на свойства элементов I группы, но более слабо выражены. Формула оксида - ЭО. Третья группа - на внешнем слое два s и один p - электрон. . Их степень окисления +3, формула оксида Э 2 О 3.
 Четвёртая группа - характерны ковалентные связи, – восьми электронная оболочка инертного газа образуется за счёт образования 4 -х электронных пар. Характерной особенностью элементов этой группы образовывать прочные связи друг с другом: …С-С-С… Легко образуют как оксид СО 2 (степень окисления углерода +4), так и гидрид СН 4 (метан, степень окисления углерода -4).
Четвёртая группа - характерны ковалентные связи, – восьми электронная оболочка инертного газа образуется за счёт образования 4 -х электронных пар. Характерной особенностью элементов этой группы образовывать прочные связи друг с другом: …С-С-С… Легко образуют как оксид СО 2 (степень окисления углерода +4), так и гидрид СН 4 (метан, степень окисления углерода -4).
 Пятая группа образуют только ковалентные связи. Низшая степень окисления у них -3 ( NH 3 - аммиак, РН 3 - фосфин). Высшая степень окисления у них +5, формула высшего оксида Э 2 O 5. Шестая группа , Кислород имеет стандартную степень окисления -2. Сера, селен, теллур имеют степени окисления от -2 до +6. Соответствующие высшие оксиды имеют формулы ЭО 3 и являются сильными окислителями. Седьмая группа – галогены. Могут проявлять степени окисления -1 до +7. Оксид Э 2 О 7. Восьмая группа - благородные газы. Имеют полностью достроенную электронную оболочку, поэтому дополнительных электронов им не нужно и они инертны к любым реакциям.
Пятая группа образуют только ковалентные связи. Низшая степень окисления у них -3 ( NH 3 - аммиак, РН 3 - фосфин). Высшая степень окисления у них +5, формула высшего оксида Э 2 O 5. Шестая группа , Кислород имеет стандартную степень окисления -2. Сера, селен, теллур имеют степени окисления от -2 до +6. Соответствующие высшие оксиды имеют формулы ЭО 3 и являются сильными окислителями. Седьмая группа – галогены. Могут проявлять степени окисления -1 до +7. Оксид Э 2 О 7. Восьмая группа - благородные газы. Имеют полностью достроенную электронную оболочку, поэтому дополнительных электронов им не нужно и они инертны к любым реакциям.
 d-элементы 1) d-орбитали заполняться не после р-орбиталей, а пропустив вперёд s -элементы следующего периода (в соответствии с правилом Клечковского). 2) высшие степени окисления и формулы высших оксидов элементов 3 – 7 групп главных и побочных подгрупп совпадают, положительные степени окисления элементов не совпадают. 3) У d -элементов почти всегда имеется несколько положительных степеней окисления, для них характерны переходы из одной степени окисления в другую.
d-элементы 1) d-орбитали заполняться не после р-орбиталей, а пропустив вперёд s -элементы следующего периода (в соответствии с правилом Клечковского). 2) высшие степени окисления и формулы высших оксидов элементов 3 – 7 групп главных и побочных подгрупп совпадают, положительные степени окисления элементов не совпадают. 3) У d -элементов почти всегда имеется несколько положительных степеней окисления, для них характерны переходы из одной степени окисления в другую.
 4) Обязательно имеют степень окисления +2, когда отрываются два электрона с s-орбитали. 5) Отрицательных степеней окисления у них нет. 6) Внутри системы d -элементов при заполнении орбиталей наблюдается “островок стабильности” - стремление сохранить и удержать систему из пяти электронов с параллельными спинами, по одному в каждой ячейке (nd 5). У хрома наблюдается перескок электрона с 4 s на 3 d- орбиталь, и создаётся “островок стабильности”. Проскок электрона также наблюдается у С u 3 d 10 4 s 1 (вместо 3 d 9 4 s 2 ), Nb 4 d 4 5 s 1 (вместо 4 d 3 5 s 2 ), R (вместо 4 d 6 5 s 2 ), Pd 4 d 10 5 s 0 (вместо 3 d 8 4 s 2 ) – дво проскок электронов Р t 5 d 9 6 s 1 (вместо 4 d 8 6 s 2 ), проскоки электронов наблюдаются и у f – элементов.
4) Обязательно имеют степень окисления +2, когда отрываются два электрона с s-орбитали. 5) Отрицательных степеней окисления у них нет. 6) Внутри системы d -элементов при заполнении орбиталей наблюдается “островок стабильности” - стремление сохранить и удержать систему из пяти электронов с параллельными спинами, по одному в каждой ячейке (nd 5). У хрома наблюдается перескок электрона с 4 s на 3 d- орбиталь, и создаётся “островок стабильности”. Проскок электрона также наблюдается у С u 3 d 10 4 s 1 (вместо 3 d 9 4 s 2 ), Nb 4 d 4 5 s 1 (вместо 4 d 3 5 s 2 ), R (вместо 4 d 6 5 s 2 ), Pd 4 d 10 5 s 0 (вместо 3 d 8 4 s 2 ) – дво проскок электронов Р t 5 d 9 6 s 1 (вместо 4 d 8 6 s 2 ), проскоки электронов наблюдаются и у f – элементов.
 7) Первые члены ряда d -элементов (в побочных подгруппах) имеют определённое сходство с соответствующими р – элементами. Вторая половина ряда d -элементов практически теряет какую-либо связь с основными подгруппами. 8) Три элемента - Fe , Co , Ni и т. д. поставлены в 8 группу, побочную подгруппу, хотя у них нет ничего общего с восьмой группой. 9) Медь, серебро и золото стоят явно не на своём месте, т. к. для них известна степень окисления +3 (для иона золота это основное состояние).
7) Первые члены ряда d -элементов (в побочных подгруппах) имеют определённое сходство с соответствующими р – элементами. Вторая половина ряда d -элементов практически теряет какую-либо связь с основными подгруппами. 8) Три элемента - Fe , Co , Ni и т. д. поставлены в 8 группу, побочную подгруппу, хотя у них нет ничего общего с восьмой группой. 9) Медь, серебро и золото стоят явно не на своём месте, т. к. для них известна степень окисления +3 (для иона золота это основное состояние).
 “Попятный ход” элементов по С. А. Щукареву: после достижения “островка стабильности” в 7 группе ( Mn , Tc , Re ) наступает естественное пошаговое уменьшение высшей валентности элементов: 6, 5, 4, 3 , 2, как если бы мы двигались назад по периодической таблице. Тогда нужно поместить Fe в 6 -ю группу, Co в 5 -ю, Ni в 4 -ю, Cu в 3 -ю, Zn во 2 -ю, а дальше всё как обычно - заполнение р - орбиталей.
“Попятный ход” элементов по С. А. Щукареву: после достижения “островка стабильности” в 7 группе ( Mn , Tc , Re ) наступает естественное пошаговое уменьшение высшей валентности элементов: 6, 5, 4, 3 , 2, как если бы мы двигались назад по периодической таблице. Тогда нужно поместить Fe в 6 -ю группу, Co в 5 -ю, Ni в 4 -ю, Cu в 3 -ю, Zn во 2 -ю, а дальше всё как обычно - заполнение р - орбиталей.
 Выводы из ПСЭ 1) число электронных уровней в атоме определяется номером периода, в котором находится элемент. 2) Суммарное число электронов, находящихся на орбиталях внешнего и предвнешнего уровня определяет номер группы, в которой находится элемент. а) для s –элементов – это число s –электронов. б) для р – элементов – это число s и р – электронов. в) для первых 6 d –элементов номер группы определяется суммой электронов на s -орбитали внешнего и d –орбитали предвнешнего уровня, седьмой и восьмой элементы находятся в триадах, а 9 и 10 в побочных подгруппах I и II группы. 3) f – элементы находятся либо в побочной подгруппе III группы, либо главной подгруппе II группы. 4) Атомы одной подгруппы имеют одинаковое строение электронных уровней и обладают близкими химическими свойствами, т. е. являются химическими аналогами.
Выводы из ПСЭ 1) число электронных уровней в атоме определяется номером периода, в котором находится элемент. 2) Суммарное число электронов, находящихся на орбиталях внешнего и предвнешнего уровня определяет номер группы, в которой находится элемент. а) для s –элементов – это число s –электронов. б) для р – элементов – это число s и р – электронов. в) для первых 6 d –элементов номер группы определяется суммой электронов на s -орбитали внешнего и d –орбитали предвнешнего уровня, седьмой и восьмой элементы находятся в триадах, а 9 и 10 в побочных подгруппах I и II группы. 3) f – элементы находятся либо в побочной подгруппе III группы, либо главной подгруппе II группы. 4) Атомы одной подгруппы имеют одинаковое строение электронных уровней и обладают близкими химическими свойствами, т. е. являются химическими аналогами.
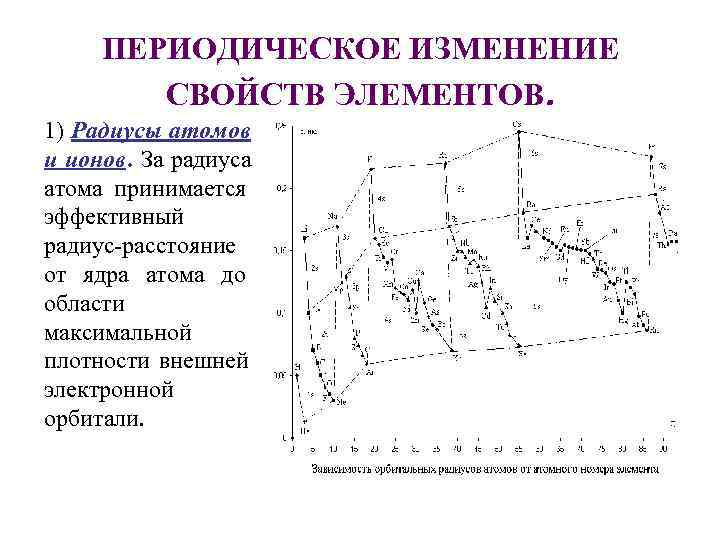
 ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ЭЛЕМЕНТОВ. 1) Радиусы атомов и ионов. За радиуса атома принимается эффективный радиус-расстояние от ядра атома до области максимальной плотности внешней электронной орбитали.
ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ЭЛЕМЕНТОВ. 1) Радиусы атомов и ионов. За радиуса атома принимается эффективный радиус-расстояние от ядра атома до области максимальной плотности внешней электронной орбитали.
 Радиусы атомов уменьшаются в периодах с ростом порядкового номера элемента (заряда ядра). Увеличивающийся заряд ядра стягивает плотнее электронную оболочку. Резкий рост радиуса атома наступает в новом периоде, при начале заполнения нового слоя, в щелочных элементах.
Радиусы атомов уменьшаются в периодах с ростом порядкового номера элемента (заряда ядра). Увеличивающийся заряд ядра стягивает плотнее электронную оболочку. Резкий рост радиуса атома наступает в новом периоде, при начале заполнения нового слоя, в щелочных элементах.
 Радиусы катионов меньше, а анионов – больше, чем радиусы атомов. Минимальные размеры имеют катионы высшей степени окисления с максимальным зарядом. r Мg 2 + < r а + , т. к. одинаковое число электронов в оболочке притягивается в ионе магния большим положительным зарядом, чем в ионе натрия. В периодах слева направо радиус атомов уменьшается, в группах сверху вниз увеличивается.
Радиусы катионов меньше, а анионов – больше, чем радиусы атомов. Минимальные размеры имеют катионы высшей степени окисления с максимальным зарядом. r Мg 2 + < r а + , т. к. одинаковое число электронов в оболочке притягивается в ионе магния большим положительным зарядом, чем в ионе натрия. В периодах слева направо радиус атомов уменьшается, в группах сверху вниз увеличивается.
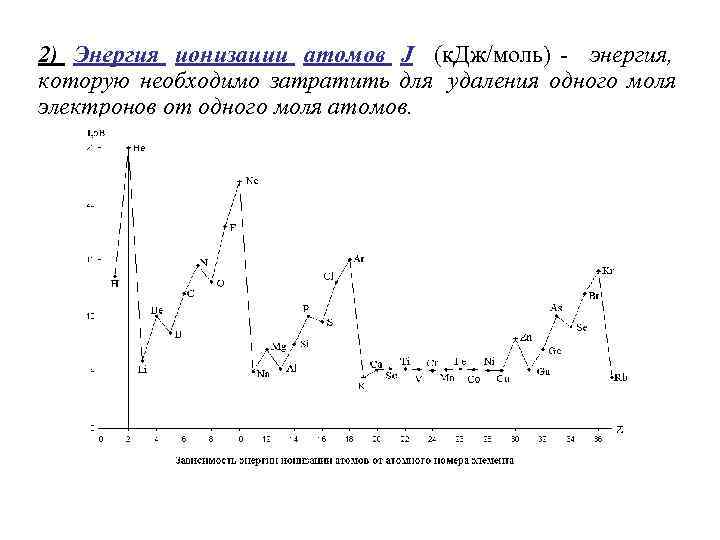
 2) Энергия ионизации атомов J (к. Дж/моль) - энергия, которую необходимо затратить для удаления одного моля электронов от одного моля атомов.
2) Энергия ионизации атомов J (к. Дж/моль) - энергия, которую необходимо затратить для удаления одного моля электронов от одного моля атомов.
 Высокие значения J 1 наблюдаются у элементов, которые имеют достроенные оболочки. Не, е – достроенная р - оболочка, Ве, Мg – достроенная s- оболочка, , Р – построена половина р - оболочки, на ней имеются три электрона с параллельными спинами, тоже своего рода ''островок стабильности''. У элемента, следующего за стабильным, наблюдается, наоборот, уменьшенное значение J 1 , т. к. стабильным теперь оказывается получающийся ион. Самый глубокий минимум у щелочных металлов, самый высокий максимум - у благородных газов. По периоду слева на право энергия ионизации увеличивается.
Высокие значения J 1 наблюдаются у элементов, которые имеют достроенные оболочки. Не, е – достроенная р - оболочка, Ве, Мg – достроенная s- оболочка, , Р – построена половина р - оболочки, на ней имеются три электрона с параллельными спинами, тоже своего рода ''островок стабильности''. У элемента, следующего за стабильным, наблюдается, наоборот, уменьшенное значение J 1 , т. к. стабильным теперь оказывается получающийся ион. Самый глубокий минимум у щелочных металлов, самый высокий максимум - у благородных газов. По периоду слева на право энергия ионизации увеличивается.
 3) При движении по периоду слева на право восстановительная способность падает, а окислительная растет. При движении по подгруппе сверху вниз окислительная способность падает, а восстановительная растет. Самый сильный восстановитель находится в левом нижнем углу ПЭС – это франций, а самый сильный окислитель находится в правом верхнем углу – это фтор.
3) При движении по периоду слева на право восстановительная способность падает, а окислительная растет. При движении по подгруппе сверху вниз окислительная способность падает, а восстановительная растет. Самый сильный восстановитель находится в левом нижнем углу ПЭС – это франций, а самый сильный окислитель находится в правом верхнем углу – это фтор.
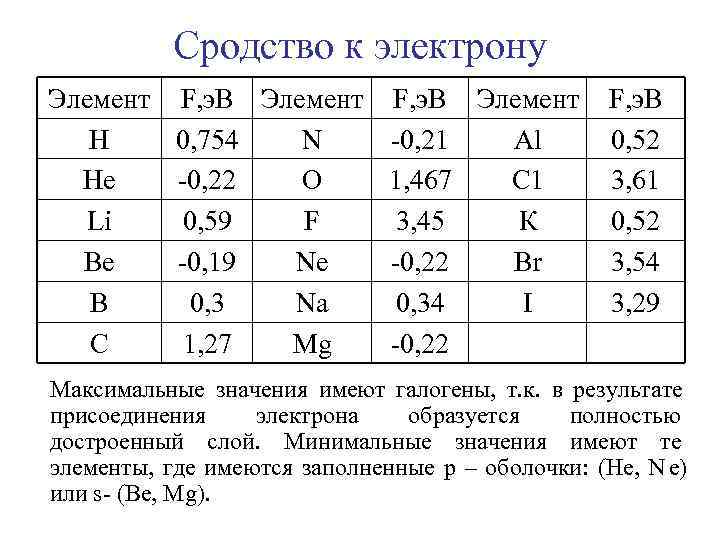
 4) Сродство к электрону. Наименьшие значения сродства к электрону у атомов с заполненным s и р -подуровнем –Не, Ве, Мg и др. Сродство к электрону у атома азота и фосфора меньше, чем соседних р - элементов периода. Это говорит о повышенной устойчивости незаполненного, наполовину и полностью заполненного подуровня. Для образования ионов Ве - , N е - , М g - требуется затрата энергии, поэтому эти ионы неустойчивы. В подгруппе сверху вниз энергия сродства должна уменьшаться, однако при переходе от фтора к хлору и от кислорода к сере она неожиданно увеличивается. Вероятно это связано с наличием d-орбиталей у атомов элементов 3 -го периода. Сродство к электрону до некоторой степени обратная энергии ионизации. F 1 коррелируется с окислительной способностью элементов.
4) Сродство к электрону. Наименьшие значения сродства к электрону у атомов с заполненным s и р -подуровнем –Не, Ве, Мg и др. Сродство к электрону у атома азота и фосфора меньше, чем соседних р - элементов периода. Это говорит о повышенной устойчивости незаполненного, наполовину и полностью заполненного подуровня. Для образования ионов Ве - , N е - , М g - требуется затрата энергии, поэтому эти ионы неустойчивы. В подгруппе сверху вниз энергия сродства должна уменьшаться, однако при переходе от фтора к хлору и от кислорода к сере она неожиданно увеличивается. Вероятно это связано с наличием d-орбиталей у атомов элементов 3 -го периода. Сродство к электрону до некоторой степени обратная энергии ионизации. F 1 коррелируется с окислительной способностью элементов.
 Сродство к электрону Элемент F, э. В Элемент F, э. В Н 0, 754 N -0, 21 Al 0, 52 Не -0, 22 О 1, 467 С 1 3, 61 Li 0, 59 F 3, 45 К 0, 52 Ве -0, 19 Nе -0, 22 Вr 3, 54 В 0, 3 Nа 0, 34 I 3, 29 С 1, 27 Mg -0, 22 Максимальные значения имеют галогены, т. к. в результате присоединения электрона образуется полностью достроенный слой. Минимальные значения имеют те элементы, где имеются заполненные р – оболочки: (Не, е) или s- (Ве, Мg).
Сродство к электрону Элемент F, э. В Элемент F, э. В Н 0, 754 N -0, 21 Al 0, 52 Не -0, 22 О 1, 467 С 1 3, 61 Li 0, 59 F 3, 45 К 0, 52 Ве -0, 19 Nе -0, 22 Вr 3, 54 В 0, 3 Nа 0, 34 I 3, 29 С 1, 27 Mg -0, 22 Максимальные значения имеют галогены, т. к. в результате присоединения электрона образуется полностью достроенный слой. Минимальные значения имеют те элементы, где имеются заполненные р – оболочки: (Не, е) или s- (Ве, Мg).
 5) Электроотрицательность. В периодах слева на право увеличивается. В группах сверху вниз уменьшается. Самый электроотрицательный элемент стоит в верхнем правом углу ПЭС. 6) В периодах при движении слева на право усиливаются неметаллические свойства, а металлические ослабевают. 7) В группах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают.
5) Электроотрицательность. В периодах слева на право увеличивается. В группах сверху вниз уменьшается. Самый электроотрицательный элемент стоит в верхнем правом углу ПЭС. 6) В периодах при движении слева на право усиливаются неметаллические свойства, а металлические ослабевают. 7) В группах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают.
 Значение периодического закона Д. И. Менделеева 1)Возможность предсказания существования не известных элементов. 2)Предсказание свойств неизвестных элементов. 3) Пересмотр и изменение ряд принятых в то время атомных масс элементов.
Значение периодического закона Д. И. Менделеева 1)Возможность предсказания существования не известных элементов. 2)Предсказание свойств неизвестных элементов. 3) Пересмотр и изменение ряд принятых в то время атомных масс элементов.

