Типы связей Павел Барышев.pptx
- Количество слайдов: 18

Выполнил: Павел Барышев Студент группы АП-11

Образование химических соединений обусловлено возникновением химической связи между атомами в молекулах и кристаллах.

Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения. Главную роль играют электроны

Валентность - способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов. Периодической системы зависит от числа электронов, находящихся на внешнем электронном слое. Поэтому эти внешние электроны принято называть валентными. Для элементов побочных подгрупп в качестве валентных электронов могут выступать как электроны внешнего слоя, так и электроны внутренних подуровней. Различают три основных типа химической связи: ковалентную, ионную, металлическую.
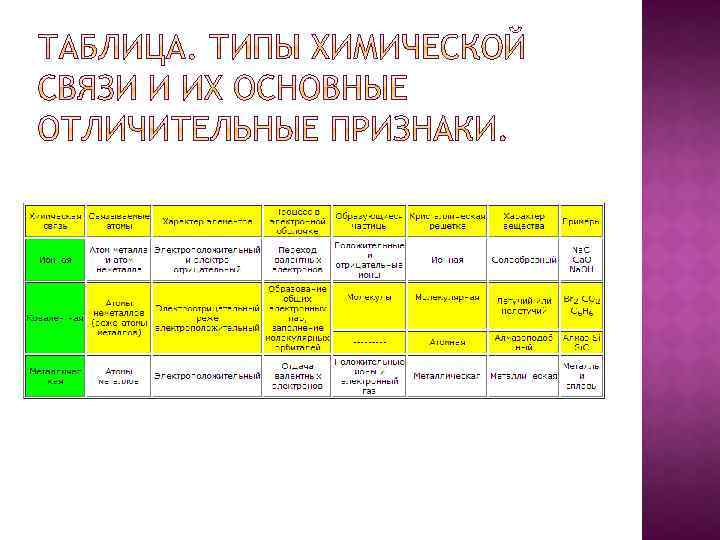

Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H 2, O 2, N 2, Cl 2 и др. Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H 2 O, NF 3, CO 2. Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером.

Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1, 5 по шкале Полинга) электроотрицательность, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Это притяжение ионов как разноименно заряженных тел.

Металлическая связь — химическая связь, которая обусловлена за счёт взаимодействия положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.

Электроотрицательность - это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
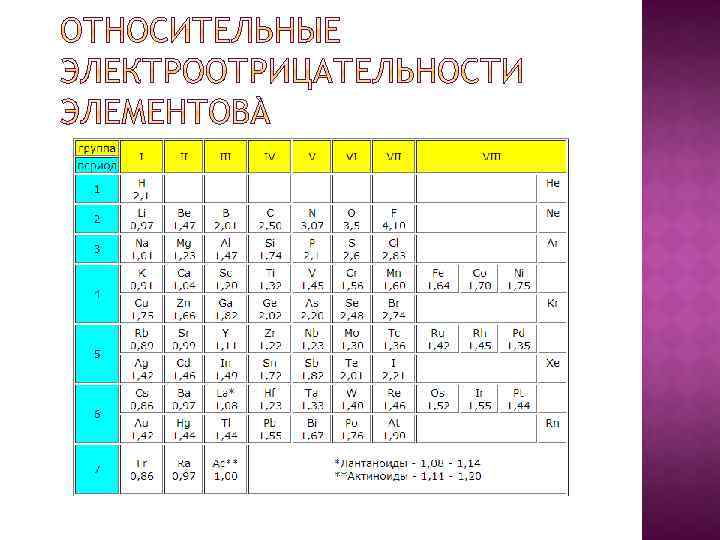

Если ЭО меньше 2 то это металл Если ЭО больше 2 то это неметалл Чем больше металличность, тем меньше ЭО Чем больше неметалличность, тем больше ЭО

Простейшая одноэлектронная химическая связь создаётся единственным валентным электроном. Оказывается, что один электрон способен удерживать в едином целом два положительно заряженных иона. В одноэлектронной связи кулоновские силы отталкивания положительно заряженных частиц компенсируются кулоновскими силами притяжения этих частиц к отрицательно заряженному электрону. Валентный электрон становится общим для двух ядер молекулы. Примерами таких химических соединений являются молекулярные ионы: H 2+, Li 2+, Na 2+, K 2+, Rb 2+, Cs 2+

Одинарная ковалентная химическая связь создаётся связывающей электронной парой. Во всех существующих теориях (теория валентных связей, теория молекулярных орбиталей, теория отталкивания валентных электронных пар, боровская модель химической связи) связывающая электронная пара располагается в пространстве между атомами молекулы. Различают полярную и неполярную ковалентную связи.

Кратные ковалентные связи представлены непредельными органическими соединениями, содержащими двойную и тройную химические связи. Для описания природы непредельных соединений Л. Полинг вводит понятия сигма- и π-связей, гибридизации атомных орбиталей.

1. Химическая связь 2. Валентность 3. Ковалентная связь 4. Электроотрицательность

Маррел Дж. , Кеттл С. , Теддер Дж. Химическая связь. М. : Мир, 1980. 384 с. Пиментел Г. , Спратли Р. Как квантовая механика объясняет химическую связь. Пер. с англ. М. : Мир, 1973. 332 с. Рюденберг К. Физическая природа химической связи. М. : Мир, 1964. 164 c. Бердетт Дж. Химическая связь. М. : Бином. Лаборатория знаний, 2008. 248 с. ISBN 978 -5 -94774 -760 -7, ISBN 978 -5 -03 -003847 -6, ISBN 0 -471 -97129 -4 Яцимирский К. Б. , Яцимирский В. К. Химическая связь. Киев: Вища школа, 1975. 304 c. Краснов К. С. Молекулы и химическая связь. 2 -ое изд. М: Высшая школа, 1984. 295 с. Татевский В. М. Строение молекул. М. : Химия, 1977. 512 с (Глава VIII. «Проблема химической связи в квантовой механике» ) Татевский В. М. Квантовая механика и теория строения молекул. М. : Изд-во МГУ, 1965. 162 с. (§§ 30 -31) Бейдер Р. Атомы в молекулах. Квантовая теория. М. : Мир, 2001. 532 c. ISBN 5 -03 -003363 -7 Глава 7. Модели химической связи.

http: //alhimikov. net/himsvyas/Page-1. html http: //www. xumuk. ru/encyklopedia/2/5323. html http: //www. myshared. ru/slide/219022/ http: //ru. wikipedia. org/wiki/%D 5%E 8%EC%E 8 %F 7%E 5%F 1%EA%E 0%FF_%F 1%E 2%FF%E 7%FC

Типы связей Павел Барышев.pptx