ВЫДЕЛЕНИЕ ДНК












































































 ВЫДЕЛЕНИЕ ДНК
ВЫДЕЛЕНИЕ ДНК
 Пространственная модель строения молекулы ДНК.
Пространственная модель строения молекулы ДНК.
 Свойства ДНК 1. ДНК хорошо растворима в воде (лучше всего процесс растворения происходит в слабощелочных средах) и слаборастворима в растворах с высоким процентным содержанием спиртов. 2. Цепочки в молекуле ДНК соединены водородными связями по принципу комплементарности – нековалентные водородные связи характеризуются непрочностью , легко разрываются – процесс денатурации, и восстанавливаются – процесс ренатурации. 3. Денатурация молекул ДНК происходит под воздействием температур в диапазоне 80 -90 0 С, в щелочных и сильнокислых средах, в присутствии формамида и мочевины.
Свойства ДНК 1. ДНК хорошо растворима в воде (лучше всего процесс растворения происходит в слабощелочных средах) и слаборастворима в растворах с высоким процентным содержанием спиртов. 2. Цепочки в молекуле ДНК соединены водородными связями по принципу комплементарности – нековалентные водородные связи характеризуются непрочностью , легко разрываются – процесс денатурации, и восстанавливаются – процесс ренатурации. 3. Денатурация молекул ДНК происходит под воздействием температур в диапазоне 80 -90 0 С, в щелочных и сильнокислых средах, в присутствии формамида и мочевины.
 Соединение по принципу комплементарности в молекуле ДНК
Соединение по принципу комплементарности в молекуле ДНК
 В клетке молекула ДНК находится в структуре хроматина (комплексная структура: ДНК + гистоновые белки, связь осуществляется за счет щелочных аминокислот молекул гистоновых белков и кислотных остатков сахарофосфатного остова ДНК)
В клетке молекула ДНК находится в структуре хроматина (комплексная структура: ДНК + гистоновые белки, связь осуществляется за счет щелочных аминокислот молекул гистоновых белков и кислотных остатков сахарофосфатного остова ДНК)
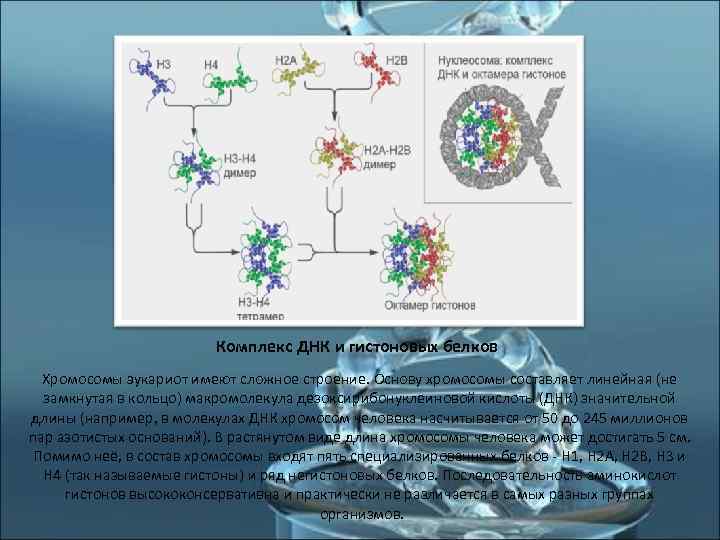
 Комплекс ДНК и гистоновых белков Хромосомы эукариот имеют сложное строение. Основу хромосомы составляет линейная (не замкнутая в кольцо) макромолекула дезоксирибонуклеиновой кислоты (ДНК) значительной длины (например, в молекулах ДНК хромосом человека насчитывается от 50 до 245 миллионов пар азотистых оснований). В растянутом виде длина хромосомы человека может достигать 5 см. Помимо неё, в состав хромосомы входят пять специализированных белков - H 1, H 2 A, H 2 B, H 3 и H 4 (так называемые гистоны) и ряд негистоновых белков. Последовательность аминокислот гистонов высококонсервативна и практически не различается в самых разных группах организмов.
Комплекс ДНК и гистоновых белков Хромосомы эукариот имеют сложное строение. Основу хромосомы составляет линейная (не замкнутая в кольцо) макромолекула дезоксирибонуклеиновой кислоты (ДНК) значительной длины (например, в молекулах ДНК хромосом человека насчитывается от 50 до 245 миллионов пар азотистых оснований). В растянутом виде длина хромосомы человека может достигать 5 см. Помимо неё, в состав хромосомы входят пять специализированных белков - H 1, H 2 A, H 2 B, H 3 и H 4 (так называемые гистоны) и ряд негистоновых белков. Последовательность аминокислот гистонов высококонсервативна и практически не различается в самых разных группах организмов.
 В процессе хранения выделенной ДНК разрушаются фосфодиэфирные связи - под воздействием ионов тяжелых металлов, свободных радикалов, эндонуклеаз. Как следствие – наблюдается деградация ДНК. В буфере (ТЕ-буфер) выделенная ДНК хранится значительно лучше, чем в дистиллированной воде.
В процессе хранения выделенной ДНК разрушаются фосфодиэфирные связи - под воздействием ионов тяжелых металлов, свободных радикалов, эндонуклеаз. Как следствие – наблюдается деградация ДНК. В буфере (ТЕ-буфер) выделенная ДНК хранится значительно лучше, чем в дистиллированной воде.
 Содержание ДНК в биологических материалах Жидкая кровь – 20000 -40000 нг/мл Пятна крови – 250 -500 нг/см 2 Жидкая сперма – 150000 -300000 нг/мл Тампон с содержимым влагалища – 10 -300 нг Вырванный волос – 1 -750 нг Выпавший волос – 1 -10 нг Жидкая слюна – 1000 -10000 нг/мл Моча – 1 -20 нг/мл Кость – 3 -10 нг/мг Мягкие ткани – 50 -500 нг/мг
Содержание ДНК в биологических материалах Жидкая кровь – 20000 -40000 нг/мл Пятна крови – 250 -500 нг/см 2 Жидкая сперма – 150000 -300000 нг/мл Тампон с содержимым влагалища – 10 -300 нг Вырванный волос – 1 -750 нг Выпавший волос – 1 -10 нг Жидкая слюна – 1000 -10000 нг/мл Моча – 1 -20 нг/мл Кость – 3 -10 нг/мг Мягкие ткани – 50 -500 нг/мг
 Работа с биологическими объектами на этапе осмотра объектов и выделения ДНК • использование УФ, работа в ламинарных боксах; • смена перчаток; • осмотр объектов и выделение ДНК производится в разных помещениях; • в целях осуществления внутреннего лабораторного контроля препараты обозначаются по стандартной схеме, обязательной для каждого сотрудника лаборатории: индивидуальная буква эксперта + №экспертизы + №объекта. В случае работы с препаратами после дифференциального лизиса к названию препарата добавляются обозначения sp и ep (спермальная, эпителиальная фракции);
Работа с биологическими объектами на этапе осмотра объектов и выделения ДНК • использование УФ, работа в ламинарных боксах; • смена перчаток; • осмотр объектов и выделение ДНК производится в разных помещениях; • в целях осуществления внутреннего лабораторного контроля препараты обозначаются по стандартной схеме, обязательной для каждого сотрудника лаборатории: индивидуальная буква эксперта + №экспертизы + №объекта. В случае работы с препаратами после дифференциального лизиса к названию препарата добавляются обозначения sp и ep (спермальная, эпителиальная фракции);
 • препараты ДНК, выделенные из биологических следов (экспертизы) и образцы ДНК проверяемых лиц (справки, экспертизы) исследуются раздельно на всех стадиях , исключая этап оценки количества выделенной ДНК. Исследование образцов ДНК проверяемых лиц в лаборатории проводится 1 -2 экспертами из числа наиболее опытных сотрудников. Эти сотрудники осуществляют весь цикл исследования образцов. Описание упаковки, методов исследования, результатов оформляется ими в виде отдельного приложения к экспертизе, которое ими подписывается. Образцы приеме экспертизы нумеруются, номер и ФИО проверяемого лица вносятся в специальный журнал регистрации образцов. Под этими номерами образцы исследуются весь цикл. Образцы обозначаются согласно их номерам в журнале регистрации с добавлением окончания RS.
• препараты ДНК, выделенные из биологических следов (экспертизы) и образцы ДНК проверяемых лиц (справки, экспертизы) исследуются раздельно на всех стадиях , исключая этап оценки количества выделенной ДНК. Исследование образцов ДНК проверяемых лиц в лаборатории проводится 1 -2 экспертами из числа наиболее опытных сотрудников. Эти сотрудники осуществляют весь цикл исследования образцов. Описание упаковки, методов исследования, результатов оформляется ими в виде отдельного приложения к экспертизе, которое ими подписывается. Образцы приеме экспертизы нумеруются, номер и ФИО проверяемого лица вносятся в специальный журнал регистрации образцов. Под этими номерами образцы исследуются весь цикл. Образцы обозначаются согласно их номерам в журнале регистрации с добавлением окончания RS.
 Это позволяет избежать: 1) перекрестной контаминации препаратов ДНК и образцов (кросс-контаминация); 2) ошибок, допущенных при постановке ПЦР или фореза, когда данные ДНК проверяемого лица могут ошибочно попасть в лунку, обозначенную как препарат ДНК, выделенной из объекта, изъятого на месте происшествия. Примечание: в качестве контроля в случае несовпадения данных ДНК лица и ДНК следа в рамках одного уголовного дела, полученный из следа генотип проверяется по всей плашке с образцами для выявления возможного совпадения (контроль ошибки при постановке ПЦР или фореза с образцами) • обязателен контроль выделения ДНК.
Это позволяет избежать: 1) перекрестной контаминации препаратов ДНК и образцов (кросс-контаминация); 2) ошибок, допущенных при постановке ПЦР или фореза, когда данные ДНК проверяемого лица могут ошибочно попасть в лунку, обозначенную как препарат ДНК, выделенной из объекта, изъятого на месте происшествия. Примечание: в качестве контроля в случае несовпадения данных ДНК лица и ДНК следа в рамках одного уголовного дела, полученный из следа генотип проверяется по всей плашке с образцами для выявления возможного совпадения (контроль ошибки при постановке ПЦР или фореза с образцами) • обязателен контроль выделения ДНК.
 Препарат для обработки рабочих поверхностей столов и ламинаров в помещениях для выделения и амплификации ДНК (DNA-Exitus Plus, Appli. Chem) – средство борьбы с контаминированием.
Препарат для обработки рабочих поверхностей столов и ламинаров в помещениях для выделения и амплификации ДНК (DNA-Exitus Plus, Appli. Chem) – средство борьбы с контаминированием.
 Методы выделения ДНК 1. Выделение ДНК с использованием Chelex-100 2. Выделение ДНК на сорбентах 3. Метод органической экстракции 4. FTA-card
Методы выделения ДНК 1. Выделение ДНК с использованием Chelex-100 2. Выделение ДНК на сорбентах 3. Метод органической экстракции 4. FTA-card
 Цели выделения ДНК - разрушение цитоплазматических и ядерных мембран; - гидролиз протеинов, образующих комплекс с ДНК; - устранение ингибиторов ПЦР*
Цели выделения ДНК - разрушение цитоплазматических и ядерных мембран; - гидролиз протеинов, образующих комплекс с ДНК; - устранение ингибиторов ПЦР*
 Выделение ДНК Требования к методу: - безопасность; - экономичность; - быстрота и простота выполнения; - работа с различными субстратами; - низкие потери ДНК; - высокое качество ДНК; - возможность автоматизации.
Выделение ДНК Требования к методу: - безопасность; - экономичность; - быстрота и простота выполнения; - работа с различными субстратами; - низкие потери ДНК; - высокое качество ДНК; - возможность автоматизации.
 Выделение ДНК с использованием Chelex-100
Выделение ДНК с использованием Chelex-100
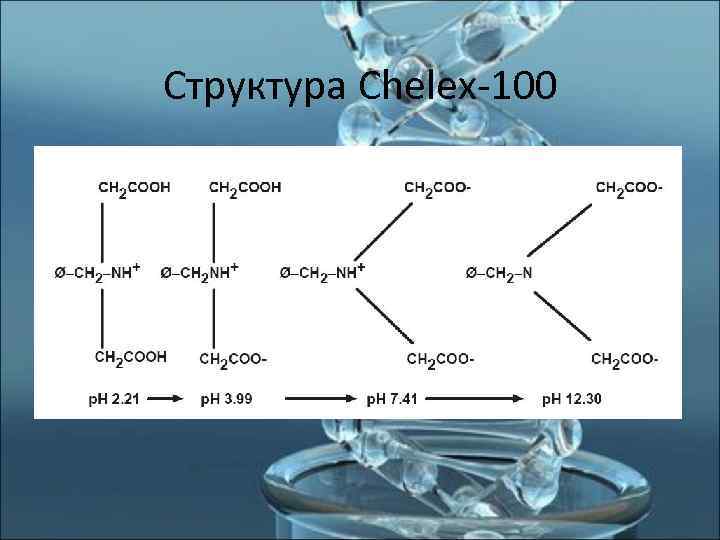
 Chelex-100 • Chelex-100 – хелатирующий агент; • представляет собой сополимер стирола и дивинилбензола с аминодиацетатными группами; • имеет макропористую структуру; • обладает свойствами ПАВ (детергент); • является ионообменной смолой (связывает ионы двухвалентных металлов); • нерастворим в воде; • устойчив в широких диапазонах р. Н.
Chelex-100 • Chelex-100 – хелатирующий агент; • представляет собой сополимер стирола и дивинилбензола с аминодиацетатными группами; • имеет макропористую структуру; • обладает свойствами ПАВ (детергент); • является ионообменной смолой (связывает ионы двухвалентных металлов); • нерастворим в воде; • устойчив в широких диапазонах р. Н.
 Структура Chelex-100
Структура Chelex-100
 Набор «DNA Purification System» (Promega)
Набор «DNA Purification System» (Promega)
 Протеиназа К Протеиназа K (протеаза K, эндопептидаза K) Протеиназа K— сериновая протеаза широкого спектра. Обнаружена в 1974 году в экстракте грибка Engyodontium album. Протеиназа К способна расщеплять кератин, основной белок волос, отсюда и пошло её название. Основные участки в пептиде, распознаваемые и гидролизуемые протеиназой, — пептидные связи, соседствующие с карбоксильной группой алифатических и ароматических аминокислот с закрытой альфа-амино-группой. Структура Протеиназа К состоит из 279 аминокислот. В молекулярной биологии протеиназа К применяется для удаления белковой примеси в препаратах нуклеиновых кислот. Кроме этого, протеиназа К быстро расщепляет и инактивирует нуклеазы в препаратах ДНК. Протеиназа К устойчива ко многим денатурирующим агентам, таким как додецил-сульфат натрия и мочевина, и сульфгидрильным реагентам. Денатурирующие агенты повышают доступность пептидных связей белков для протеиназы К и, таким образом, ускоряют их гидролиз (добавление 0, 5 -1% додецил-сульфат натрия или 1 -4 М р-ра мочевины увеличивают активность протеиназы К). Протеиназа К работает в широком диапазоне p. H (4 -12), её оптимум - p. H 7, 5 -12, 0. Начало инактивации протеиназы К (при нагревании до 50 0 С) наступает через 10 мин после начала реакции. Расщепление протеиназы К ускоряется при снижении концентрации ионов Са 2+ и увеличении количества ионных детергентов (например, SDS)
Протеиназа К Протеиназа K (протеаза K, эндопептидаза K) Протеиназа K— сериновая протеаза широкого спектра. Обнаружена в 1974 году в экстракте грибка Engyodontium album. Протеиназа К способна расщеплять кератин, основной белок волос, отсюда и пошло её название. Основные участки в пептиде, распознаваемые и гидролизуемые протеиназой, — пептидные связи, соседствующие с карбоксильной группой алифатических и ароматических аминокислот с закрытой альфа-амино-группой. Структура Протеиназа К состоит из 279 аминокислот. В молекулярной биологии протеиназа К применяется для удаления белковой примеси в препаратах нуклеиновых кислот. Кроме этого, протеиназа К быстро расщепляет и инактивирует нуклеазы в препаратах ДНК. Протеиназа К устойчива ко многим денатурирующим агентам, таким как додецил-сульфат натрия и мочевина, и сульфгидрильным реагентам. Денатурирующие агенты повышают доступность пептидных связей белков для протеиназы К и, таким образом, ускоряют их гидролиз (добавление 0, 5 -1% додецил-сульфат натрия или 1 -4 М р-ра мочевины увеличивают активность протеиназы К). Протеиназа К работает в широком диапазоне p. H (4 -12), её оптимум - p. H 7, 5 -12, 0. Начало инактивации протеиназы К (при нагревании до 50 0 С) наступает через 10 мин после начала реакции. Расщепление протеиназы К ускоряется при снижении концентрации ионов Са 2+ и увеличении количества ионных детергентов (например, SDS)
 Приготовленный раствор протеиназы К хранят при -20 0 С. Неоднократные циклы заморозки-разморозки раствора протеиназы К значительно снижают ее активность. Рекомендуется: 1) разделение рабочего раствора протеиназы К на отдельные аликвоты; 2) приготовление рабочего раствора протеиназы К на основе «незамерзающего» буфера с глицеролом и использование в процессе работы с протеиназой К штативов для пробирок с хладагентами
Приготовленный раствор протеиназы К хранят при -20 0 С. Неоднократные циклы заморозки-разморозки раствора протеиназы К значительно снижают ее активность. Рекомендуется: 1) разделение рабочего раствора протеиназы К на отдельные аликвоты; 2) приготовление рабочего раствора протеиназы К на основе «незамерзающего» буфера с глицеролом и использование в процессе работы с протеиназой К штативов для пробирок с хладагентами
 Общая методика выделения ДНК с использованием Chelex-100 • К биологическому материалу добавляют суспензию Chelex-100 (лизис клеточных мембран в высокощелочной среде, «связывание» ионов двухвалентных металлов Са 2+ и Мg 2+ - кофакторов нуклеаз); • добавляют протеиназу К; • встряхивают (vortex), центрифугируют (для сброса капель со стенок и крышек пробирок); • термостатируют при 56 0 С (оптимальные температурные условия для работы протеиназы К – происходит гидролиз белков клеточных стенок, гистоновых белков и нуклеаз); • встряхивают (vortex), центрифугируют (для сброса капель со стенок и крышек пробирок, чтобы раствор, содержащий протеиназу К, не остался на крышках) • термостатируют при 99 0 С (разрушение, инактивация нуклеаз и протеиназы К – в случае попадания протеиназы К в пробирку, в которой будет ставиться ПЦР, может произойти гидролиз полимеразы); • встряхивают ( vortex) , центрифугируют в течение 2 -3 мин (осаждение частиц Chelex-100 - в случае попадания Chelex-100 в пробирку, в которой будет ставиться ПЦР, может произойти ингибирование реакции: Chelex-100 связывает ионы Мg 2+ - кофакторы полимеразы); • хранят препараты с выделенной ДНК при 4 0 С в течение нескольких дней. Для более длительных сроков применяют замораживание и хранение при – 20 0 С.
Общая методика выделения ДНК с использованием Chelex-100 • К биологическому материалу добавляют суспензию Chelex-100 (лизис клеточных мембран в высокощелочной среде, «связывание» ионов двухвалентных металлов Са 2+ и Мg 2+ - кофакторов нуклеаз); • добавляют протеиназу К; • встряхивают (vortex), центрифугируют (для сброса капель со стенок и крышек пробирок); • термостатируют при 56 0 С (оптимальные температурные условия для работы протеиназы К – происходит гидролиз белков клеточных стенок, гистоновых белков и нуклеаз); • встряхивают (vortex), центрифугируют (для сброса капель со стенок и крышек пробирок, чтобы раствор, содержащий протеиназу К, не остался на крышках) • термостатируют при 99 0 С (разрушение, инактивация нуклеаз и протеиназы К – в случае попадания протеиназы К в пробирку, в которой будет ставиться ПЦР, может произойти гидролиз полимеразы); • встряхивают ( vortex) , центрифугируют в течение 2 -3 мин (осаждение частиц Chelex-100 - в случае попадания Chelex-100 в пробирку, в которой будет ставиться ПЦР, может произойти ингибирование реакции: Chelex-100 связывает ионы Мg 2+ - кофакторы полимеразы); • хранят препараты с выделенной ДНК при 4 0 С в течение нескольких дней. Для более длительных сроков применяют замораживание и хранение при – 20 0 С.
 Преимущества выделения ДНК с использованием Chelex-100 - метод является одним из самых дешевых; - прост в исполнении, не требует значительных временных затрат; - отсутствуют потери, связанные с переносом ДНК из пробирки в пробирку
Преимущества выделения ДНК с использованием Chelex-100 - метод является одним из самых дешевых; - прост в исполнении, не требует значительных временных затрат; - отсутствуют потери, связанные с переносом ДНК из пробирки в пробирку
 Недостатки выделения ДНК с использованием Chelex-100 - очистка ДНК «грубая» (не устраняется большинство ингибиторов); - в результате использования Chelex-100 получаем одноцепочечную ДНК (нестабильна); - метод подходит при работе не со всеми объектами (неприменим, например, с объектами, содержащими значительное количество белков - мышцами); - Chelex-100 является ингибитором ПЦР.
Недостатки выделения ДНК с использованием Chelex-100 - очистка ДНК «грубая» (не устраняется большинство ингибиторов); - в результате использования Chelex-100 получаем одноцепочечную ДНК (нестабильна); - метод подходит при работе не со всеми объектами (неприменим, например, с объектами, содержащими значительное количество белков - мышцами); - Chelex-100 является ингибитором ПЦР.
 Действие ингибиторов ПЦР - изменение температуры отжига праймеров; - блокирование активных центров молекул полимеразы; - изменение пространственной структуры молекул полимеразы, разрушение молекул полимеразы; - связывание ионов Мg 2+ - кофакторов полимеразы.
Действие ингибиторов ПЦР - изменение температуры отжига праймеров; - блокирование активных центров молекул полимеразы; - изменение пространственной структуры молекул полимеразы, разрушение молекул полимеразы; - связывание ионов Мg 2+ - кофакторов полимеразы.
 Примеры ингибиторов ПЦР - ЭДТА (хелатирующий агент, связывает ионы Мg) - - антикоагулянт; - гепарин (связывает активные центры молекул полимеразы) - антикоагулянт; - гем - кровь; - гуминовые кислоты - почва; - избыток ионов Са 2+ и Мg 2+ (связываются с ДНК, изменяя температуру отжига праймеров) - кости; - Chelex 100 (связывает ионы Мg 2+ – кофаторы полимеразы); - полисахариды - каловые массы, фрукты; - соли желчных кислот – каловые массы; - индиго – джинсовая ткань; - мочевина (изменяет температуру отжига праймеров) - моча; - меланин - волосы; - вещества, используемые для дубления кож; - неорганические соли в высоких концентрациях (например, Na. Cl); - фенол, хлороформ; - гуанидинтиоцианат; - ПАВ (в том числе SDS); - мыльные растворы (сапонаты) – средства гигиены, порошки.
Примеры ингибиторов ПЦР - ЭДТА (хелатирующий агент, связывает ионы Мg) - - антикоагулянт; - гепарин (связывает активные центры молекул полимеразы) - антикоагулянт; - гем - кровь; - гуминовые кислоты - почва; - избыток ионов Са 2+ и Мg 2+ (связываются с ДНК, изменяя температуру отжига праймеров) - кости; - Chelex 100 (связывает ионы Мg 2+ – кофаторы полимеразы); - полисахариды - каловые массы, фрукты; - соли желчных кислот – каловые массы; - индиго – джинсовая ткань; - мочевина (изменяет температуру отжига праймеров) - моча; - меланин - волосы; - вещества, используемые для дубления кож; - неорганические соли в высоких концентрациях (например, Na. Cl); - фенол, хлороформ; - гуанидинтиоцианат; - ПАВ (в том числе SDS); - мыльные растворы (сапонаты) – средства гигиены, порошки.
 Выделение ДНК из крови 1) Вырезку (смыв, соскоб) помещаем в Э. пробирку, добавляем 1 мл дистиллированной воды. 2) Встряхиваем в течение 20 мин, центрифугируем (макс. число об. , 5 мин). 3) Удаляем супернатант, оставляя предмет-носитель и 50 мкл жидкости с осадком. 4) В случае, если полученный раствор имеет насыщенный цвет, промывку повторяем (2 -3 раза). 5) Добавляем 200 мкл 5% раствора Chelex 100 (наконечником с широким отверстием) и 3 мкл раствора протеиназы К. 6) Vortex, центрифугируем (макс. число об. , 15 сек) 7) Термостатируем при 56 0 С в течение 30 -40 мин. 8) Vortex, центрифугируем (макс. число об. , 15 сек) 9) Термостатируем при 99 0 С в течение 8 мин. 10) Vortex, центрифугируем (макс число об. , 2 -3 мин). 11) Храним при 4 0 С или -20 0 С.
Выделение ДНК из крови 1) Вырезку (смыв, соскоб) помещаем в Э. пробирку, добавляем 1 мл дистиллированной воды. 2) Встряхиваем в течение 20 мин, центрифугируем (макс. число об. , 5 мин). 3) Удаляем супернатант, оставляя предмет-носитель и 50 мкл жидкости с осадком. 4) В случае, если полученный раствор имеет насыщенный цвет, промывку повторяем (2 -3 раза). 5) Добавляем 200 мкл 5% раствора Chelex 100 (наконечником с широким отверстием) и 3 мкл раствора протеиназы К. 6) Vortex, центрифугируем (макс. число об. , 15 сек) 7) Термостатируем при 56 0 С в течение 30 -40 мин. 8) Vortex, центрифугируем (макс. число об. , 15 сек) 9) Термостатируем при 99 0 С в течение 8 мин. 10) Vortex, центрифугируем (макс число об. , 2 -3 мин). 11) Храним при 4 0 С или -20 0 С.
 Выделение ДНК из слюны 1) Вырезку (смыв, соскоб) помещаем в Э. пробирку. 2) Если вырезка имеет значительные размеры (фрагмент шапки-маски, платка, отрезок бумаги) – измельчаем, помещаем в центрифужную пробирку объемом 50 мл, заливаем дистиллированной водой или ТЕ- буфером, экстрагируем в течение 1 – 2 ч. Затем пинцетом помещаем фрагменты вырезки в марлевый мешочек, закрепляем в той же пробирке, фиксируем крышкой пробирки и центрифугируем (5 -10 мин, макс. число об. ). Отбираем супернатант, оставляя в пробирке около 1 мл жидкости и осадка, суспендируем и переносим в Э. пробирку. Центрифугируем (5 мин, макс. число об. ), отбираем супернатант, оставляя около 50 – 100 мкл жидкости и осадка. 3) Добавляем 200 мкл 5% раствора Chelex 100 и 3 мкл раствора протеиназы К. 4) Vortex, центрифугируем (макс. число об. , 15 сек). 5) Термостатируем при 56 0 С в течение 30 -40 мин. 6) Vortex, центрифугируем (макс. число об. , 15 сек). 7) Термостатируем при 99 0 С в течение 8 мин. 8) Vortex, центрифугируем (макс. число об. , 2 -3 мин). 9) Храним при 4 0 С или -20 0 С.
Выделение ДНК из слюны 1) Вырезку (смыв, соскоб) помещаем в Э. пробирку. 2) Если вырезка имеет значительные размеры (фрагмент шапки-маски, платка, отрезок бумаги) – измельчаем, помещаем в центрифужную пробирку объемом 50 мл, заливаем дистиллированной водой или ТЕ- буфером, экстрагируем в течение 1 – 2 ч. Затем пинцетом помещаем фрагменты вырезки в марлевый мешочек, закрепляем в той же пробирке, фиксируем крышкой пробирки и центрифугируем (5 -10 мин, макс. число об. ). Отбираем супернатант, оставляя в пробирке около 1 мл жидкости и осадка, суспендируем и переносим в Э. пробирку. Центрифугируем (5 мин, макс. число об. ), отбираем супернатант, оставляя около 50 – 100 мкл жидкости и осадка. 3) Добавляем 200 мкл 5% раствора Chelex 100 и 3 мкл раствора протеиназы К. 4) Vortex, центрифугируем (макс. число об. , 15 сек). 5) Термостатируем при 56 0 С в течение 30 -40 мин. 6) Vortex, центрифугируем (макс. число об. , 15 сек). 7) Термостатируем при 99 0 С в течение 8 мин. 8) Vortex, центрифугируем (макс. число об. , 2 -3 мин). 9) Храним при 4 0 С или -20 0 С.
 Выделение ДНК из волос Необходимое условие: волос должен иметь луковицу (оптимально с влагалищной оболочкой) 1) Аккуратно (чтобы не повредить влагалищную оболочку) промываем волос в емкости с дистиллированной водой или с раствором Tween-20 (ПАВ)). 2) Срезаем часть волоса со стороны луковицы (около 1, 5 см), помещаем в Э. пробирку. 3) С противоположной стороны срезаем около 1, 5 см волоса, помещаем во вторую Э. пробирку, используем качестве контроля. 4) Добавляем 200 мкл 5% раствора Chelex 100 и 3 мкл протеиназы К. 5) Добавляем 10 мкл 1 М раствора DTT. 6) Vortex, центрифугируем (макс. число об. , 15 сек). 7) Термостатируем при 56 0 С до момента полного растворения волоса. 8) Vortex, центрифугируем (макс. число об. , 15 сек). 9) Термостатируем при 99 0 С в течение 8 мин. 10) Vortex, центрифугируем (макс. число об. , 2 -3 мин). 11) Храним при 4 0 С или -20 0 С. Комментарий: в случае, когда на разрешение экспертизы поставлен вопрос о наличии на волосе следов пота, спермы, крови, перед промывкой необходимо маленьким отрезком стерильной марли, смоченным дистиллированной водой или ТЕ буфером, сделать с поверхности волоса смыв и исследовать отдельно (экстракция, удаление предмета-носителя, надосадочную жидкость исследуем методом ТСХ на наличие крови, осадок исследуем цитологически и методом ДНК).
Выделение ДНК из волос Необходимое условие: волос должен иметь луковицу (оптимально с влагалищной оболочкой) 1) Аккуратно (чтобы не повредить влагалищную оболочку) промываем волос в емкости с дистиллированной водой или с раствором Tween-20 (ПАВ)). 2) Срезаем часть волоса со стороны луковицы (около 1, 5 см), помещаем в Э. пробирку. 3) С противоположной стороны срезаем около 1, 5 см волоса, помещаем во вторую Э. пробирку, используем качестве контроля. 4) Добавляем 200 мкл 5% раствора Chelex 100 и 3 мкл протеиназы К. 5) Добавляем 10 мкл 1 М раствора DTT. 6) Vortex, центрифугируем (макс. число об. , 15 сек). 7) Термостатируем при 56 0 С до момента полного растворения волоса. 8) Vortex, центрифугируем (макс. число об. , 15 сек). 9) Термостатируем при 99 0 С в течение 8 мин. 10) Vortex, центрифугируем (макс. число об. , 2 -3 мин). 11) Храним при 4 0 С или -20 0 С. Комментарий: в случае, когда на разрешение экспертизы поставлен вопрос о наличии на волосе следов пота, спермы, крови, перед промывкой необходимо маленьким отрезком стерильной марли, смоченным дистиллированной водой или ТЕ буфером, сделать с поверхности волоса смыв и исследовать отдельно (экстракция, удаление предмета-носителя, надосадочную жидкость исследуем методом ТСХ на наличие крови, осадок исследуем цитологически и методом ДНК).
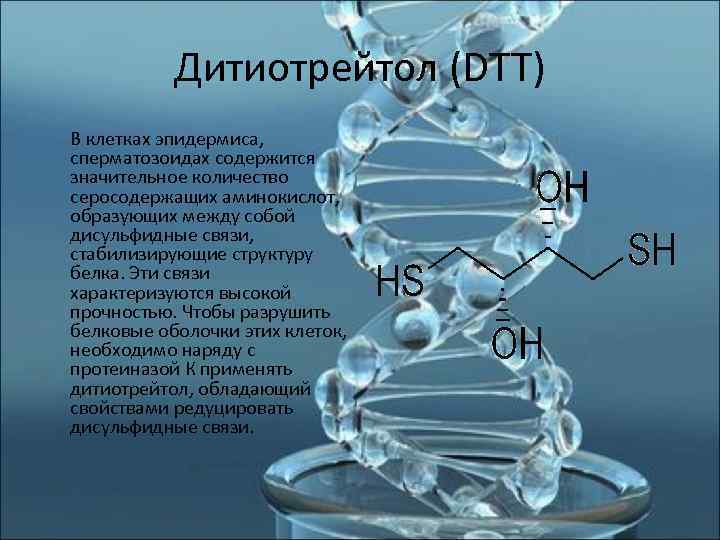
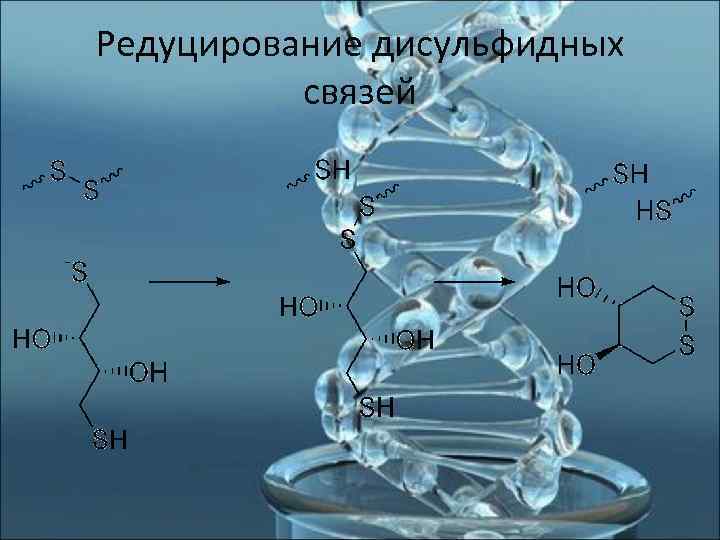
 Дитиотрейтол (DTT) В клетках эпидермиса, сперматозоидах содержится значительное количество серосодержащих аминокислот, образующих между собой дисульфидные связи, стабилизирующие структуру белка. Эти связи характеризуются высокой прочностью. Чтобы разрушить белковые оболочки этих клеток, необходимо наряду с протеиназой К применять дитиотрейтол, обладающий свойствами редуцировать дисульфидные связи.
Дитиотрейтол (DTT) В клетках эпидермиса, сперматозоидах содержится значительное количество серосодержащих аминокислот, образующих между собой дисульфидные связи, стабилизирующие структуру белка. Эти связи характеризуются высокой прочностью. Чтобы разрушить белковые оболочки этих клеток, необходимо наряду с протеиназой К применять дитиотрейтол, обладающий свойствами редуцировать дисульфидные связи.
 Редуцирование дисульфидных связей
Редуцирование дисульфидных связей
 Приготовление 1 M раствора DTT 1. Готовим 1 М раствор ацетата натрия (р. Н 5, 2) – растворяем 13, 6 г СН 3 СООNa*3 Н 2 О в 80 мл деионизованной воды, доводим значение р. Н до 5, 2, добавляя ледяную уксусную кислоту, и доводим объем полученного раствора до 100 мл. Полученный раствор автоклавируем, храним при комнатной температуре. 2. 0, 77 г DTT растворяем в 5 мл деионизованной воды, добавляем 50 мкл полученного 1 M раствора ацетата натрия.
Приготовление 1 M раствора DTT 1. Готовим 1 М раствор ацетата натрия (р. Н 5, 2) – растворяем 13, 6 г СН 3 СООNa*3 Н 2 О в 80 мл деионизованной воды, доводим значение р. Н до 5, 2, добавляя ледяную уксусную кислоту, и доводим объем полученного раствора до 100 мл. Полученный раствор автоклавируем, храним при комнатной температуре. 2. 0, 77 г DTT растворяем в 5 мл деионизованной воды, добавляем 50 мкл полученного 1 M раствора ацетата натрия.
 Выделение ДНК из спермы
Выделение ДНК из спермы
 Состав спермы (на примере спермограммы), нарушения состава Норма для спермограммы: • р. Н 7, 2 -7, 8 • количество спермиев в 1 мл 20 -120 млн. • количество спермиев в эякуляте 40 -500 млн. • патологические сперматозоиды не более 50 % • количество округлых клеток не более 5 млн. • лейкоциты до 3 -5 в поле зрения. Также в сперме присутствуют: - клетки плоского и цилиндрического эпителия - эритроциты (иногда) - простатические зерна и др. Термины, используемые в медицинской практике для описания нарушений состава спермы. Нормоспермия - все характеристики эякулята в норме, нормальная сперма. Олигоспермия - недостаточный объем эякулята (менее 2 мл). Олигозооспермия - недостаточное количество сперматозоидов (концентрация менее 20 млн/мл). Астенозооспермия - недостаточная подвижность сперматозоидов (А<25% или A+B<50%). Акинозооспермия - полная неподвижность сперматозоидов. Тератозооспермия - повышено содержание аномальных сперматозоидов (более 50% при исследовании нативного эякулята или более 85% при исследовании окрашенного мазка спермы). Некрозооспермия - отсутствие живых сперматозоидов. Лейкоцитоспермия - повышено содержание лейкоцитов (более 1 млн/мл). Гемоспермия - присутствие эритроцитов в эякуляте. Азооспермия - отсутствие сперматозоидов в эякуляте.
Состав спермы (на примере спермограммы), нарушения состава Норма для спермограммы: • р. Н 7, 2 -7, 8 • количество спермиев в 1 мл 20 -120 млн. • количество спермиев в эякуляте 40 -500 млн. • патологические сперматозоиды не более 50 % • количество округлых клеток не более 5 млн. • лейкоциты до 3 -5 в поле зрения. Также в сперме присутствуют: - клетки плоского и цилиндрического эпителия - эритроциты (иногда) - простатические зерна и др. Термины, используемые в медицинской практике для описания нарушений состава спермы. Нормоспермия - все характеристики эякулята в норме, нормальная сперма. Олигоспермия - недостаточный объем эякулята (менее 2 мл). Олигозооспермия - недостаточное количество сперматозоидов (концентрация менее 20 млн/мл). Астенозооспермия - недостаточная подвижность сперматозоидов (А<25% или A+B<50%). Акинозооспермия - полная неподвижность сперматозоидов. Тератозооспермия - повышено содержание аномальных сперматозоидов (более 50% при исследовании нативного эякулята или более 85% при исследовании окрашенного мазка спермы). Некрозооспермия - отсутствие живых сперматозоидов. Лейкоцитоспермия - повышено содержание лейкоцитов (более 1 млн/мл). Гемоспермия - присутствие эритроцитов в эякуляте. Азооспермия - отсутствие сперматозоидов в эякуляте.
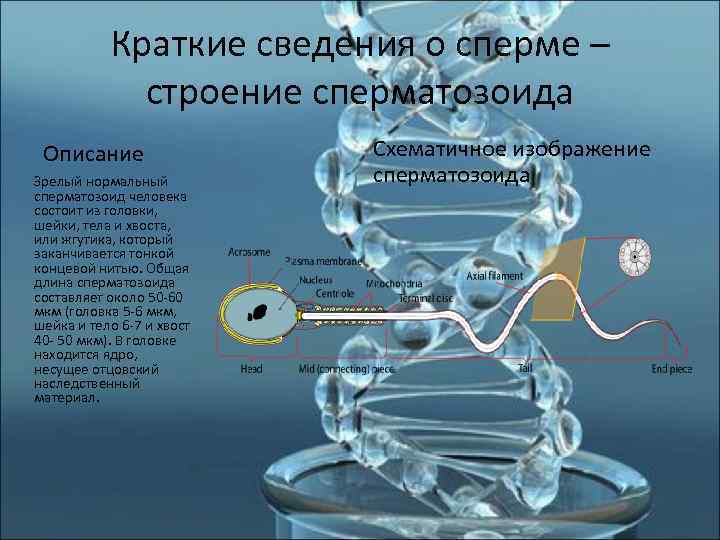
 Краткие сведения о сперме – строение сперматозоида Описание Схематичное изображение Зрелый нормальный сперматозоида сперматозоид человека состоит из головки, шейки, тела и хвоста, или жгутика, который заканчивается тонкой концевой нитью. Общая длина сперматозоида составляет около 50 -60 мкм (головка 5 -6 мкм, шейка и тело 6 -7 и хвост 40 - 50 мкм). В головке находится ядро, несущее отцовский наследственный материал.
Краткие сведения о сперме – строение сперматозоида Описание Схематичное изображение Зрелый нормальный сперматозоида сперматозоид человека состоит из головки, шейки, тела и хвоста, или жгутика, который заканчивается тонкой концевой нитью. Общая длина сперматозоида составляет около 50 -60 мкм (головка 5 -6 мкм, шейка и тело 6 -7 и хвост 40 - 50 мкм). В головке находится ядро, несущее отцовский наследственный материал.
 Строение сперматозоида - головка Головка сперматозоида человека имеет форму эллипсоида, сжатого с боков, с одной из сторон имеется небольшая ямка, поэтому иногда принято употреблять выражение «ложковидная форма головки сперматозоида» . В головке сперматозоида располагаются следующие клеточные структуры: 1) Ядро, несущее одинарный набор хромосом. Такое ядро называют гаплоидным. После слияния сперматозоида и яйцеклетки (ядро которой также гаплоидно) образуется зигота - новый диплоидный организм, несущий материнские и отцовские хромосомы. Ядро сперматозоида значительно мельче ядер других клеток, это во многом связано с уникальной организацией строения хроматина сперматозоида (см. протамины). В связи с сильной конденсацией хроматин неактивен - в ядре сперматозоида не синтезируется РНК. 2) Акросома - видоизмененная лизосома - мембранный пузырек, несущий литические ферменты - вещества, растворяющие оболочку яйцеклетки. Акросома занимает около половины объема головки и по своему размеру приблизительно равна ядру. Она лежит спереди от ядра и покрывает собой половину ядра (поэтому часто акросому сравнивают с шапочкой). При контакте с яйцеклеткой акросома выбрасывает свои ферменты наружу и растворяет небольшой участок оболочки яйцеклетки, благодаря чему образуется небольшой «проход» для проникновения сперматозоида. В акросоме содержится около 15 литических ферментов, основным из который является акрозин. 3) Центросома - центр организации микротрубочек, обеспечивает движение хвоста сперматозоида, а также предположительно участвует в сближении ядер зиготы и первом клеточном делении зиготы.
Строение сперматозоида - головка Головка сперматозоида человека имеет форму эллипсоида, сжатого с боков, с одной из сторон имеется небольшая ямка, поэтому иногда принято употреблять выражение «ложковидная форма головки сперматозоида» . В головке сперматозоида располагаются следующие клеточные структуры: 1) Ядро, несущее одинарный набор хромосом. Такое ядро называют гаплоидным. После слияния сперматозоида и яйцеклетки (ядро которой также гаплоидно) образуется зигота - новый диплоидный организм, несущий материнские и отцовские хромосомы. Ядро сперматозоида значительно мельче ядер других клеток, это во многом связано с уникальной организацией строения хроматина сперматозоида (см. протамины). В связи с сильной конденсацией хроматин неактивен - в ядре сперматозоида не синтезируется РНК. 2) Акросома - видоизмененная лизосома - мембранный пузырек, несущий литические ферменты - вещества, растворяющие оболочку яйцеклетки. Акросома занимает около половины объема головки и по своему размеру приблизительно равна ядру. Она лежит спереди от ядра и покрывает собой половину ядра (поэтому часто акросому сравнивают с шапочкой). При контакте с яйцеклеткой акросома выбрасывает свои ферменты наружу и растворяет небольшой участок оболочки яйцеклетки, благодаря чему образуется небольшой «проход» для проникновения сперматозоида. В акросоме содержится около 15 литических ферментов, основным из который является акрозин. 3) Центросома - центр организации микротрубочек, обеспечивает движение хвоста сперматозоида, а также предположительно участвует в сближении ядер зиготы и первом клеточном делении зиготы.
 Строение сперматозоида – шейка, хвост Позади головки располагается так называемая «средняя часть» сперматозоида. От головки среднюю часть отделяет небольшое сужение - «шейка» . Позади средней части располагается хвост. Через всю среднюю часть сперматозоида проходит цитоскелет жгутика, который состоит из микротрубочек. В средней части вокруг цитоскелета жгутика располагается митохондрион - гигантская митохондрия сперматозоида. Митохондрион имеет спиральную форму и как бы обвивает цитоскелет жгутика. Митохондрион выполняет функцию синтеза АТФ и тем самым обеспечивает движение жгутика. Хвост, или жгутик, расположен за средней частью. Он тоньше средней части и значительно длиннее ее. Хвост - орган движения сперматозоида. Его строение типично для клеточных жгутиков эукариот.
Строение сперматозоида – шейка, хвост Позади головки располагается так называемая «средняя часть» сперматозоида. От головки среднюю часть отделяет небольшое сужение - «шейка» . Позади средней части располагается хвост. Через всю среднюю часть сперматозоида проходит цитоскелет жгутика, который состоит из микротрубочек. В средней части вокруг цитоскелета жгутика располагается митохондрион - гигантская митохондрия сперматозоида. Митохондрион имеет спиральную форму и как бы обвивает цитоскелет жгутика. Митохондрион выполняет функцию синтеза АТФ и тем самым обеспечивает движение жгутика. Хвост, или жгутик, расположен за средней частью. Он тоньше средней части и значительно длиннее ее. Хвост - орган движения сперматозоида. Его строение типично для клеточных жгутиков эукариот.
 Движение сперматозоидов Сперматозоид человека движется при помощи жгутика. Во время движения сперматозоид обычно вращается вокруг своей оси. Скорость движения сперматозоида человека может достигать 0, 1 мм в сек. или более 30 см в час. В организме мужчины сперматозоиды находятся в неактивном состоянии, движения жгутиков у них незначительны. Перемещение сперматозоидов по половым путям мужчины (семенные канальцы, проток эпидидимиса, семявыносящий проток) происходит пассивно за счет перестальтических сокращений мышц протоков и биения ресничек клеток стенок протоков. Сперматозоиды приобретают активность после эякуляции за счет воздействия на них ферментов простатического сока. Движение сперматозоидов по половым путям женщины является самостоятельным и осуществляется против движения жидкости. Для осуществления оплодотворения сперматозоидам необходимо преодолеть путь длинной около 20 см (цервикальный канал - около 2 см, полость матки - около 5 см, фаллопиева труба - около 12 см). Среда влагалища является губительной для сперматозоидов. Из влагалища сперматозоиды движутся по направлению к шейке матки. Направление движения сперматозоид определяет, воспринимая p. H окружающей среды. Он движется по направлению уменьшения кислотности; p. H влагалища около 6, 0, p. H шейки матки около 7, 2. Как правило, большая часть сперматозоидов не способна достичь шейки матки и погибает во влагалище (по критериям ВОЗ, используемым в посткоитальном тесте, спустя 2 часа после коитуса во влагалище не остается живых сперматозоидов). После прохождения шейки матки сперматозоиды оказываются в матке, среда которой благоприятна для сперматозоидов, в матке они могут достаточно долго сохранять свою подвижность (отдельные сперматозоиды до 3 -х дней).
Движение сперматозоидов Сперматозоид человека движется при помощи жгутика. Во время движения сперматозоид обычно вращается вокруг своей оси. Скорость движения сперматозоида человека может достигать 0, 1 мм в сек. или более 30 см в час. В организме мужчины сперматозоиды находятся в неактивном состоянии, движения жгутиков у них незначительны. Перемещение сперматозоидов по половым путям мужчины (семенные канальцы, проток эпидидимиса, семявыносящий проток) происходит пассивно за счет перестальтических сокращений мышц протоков и биения ресничек клеток стенок протоков. Сперматозоиды приобретают активность после эякуляции за счет воздействия на них ферментов простатического сока. Движение сперматозоидов по половым путям женщины является самостоятельным и осуществляется против движения жидкости. Для осуществления оплодотворения сперматозоидам необходимо преодолеть путь длинной около 20 см (цервикальный канал - около 2 см, полость матки - около 5 см, фаллопиева труба - около 12 см). Среда влагалища является губительной для сперматозоидов. Из влагалища сперматозоиды движутся по направлению к шейке матки. Направление движения сперматозоид определяет, воспринимая p. H окружающей среды. Он движется по направлению уменьшения кислотности; p. H влагалища около 6, 0, p. H шейки матки около 7, 2. Как правило, большая часть сперматозоидов не способна достичь шейки матки и погибает во влагалище (по критериям ВОЗ, используемым в посткоитальном тесте, спустя 2 часа после коитуса во влагалище не остается живых сперматозоидов). После прохождения шейки матки сперматозоиды оказываются в матке, среда которой благоприятна для сперматозоидов, в матке они могут достаточно долго сохранять свою подвижность (отдельные сперматозоиды до 3 -х дней).
 Предварительный тест на наличие спермы – PSA -тест Тест выпускается фирмой Seratec diagnostica. PSA – гликопротеин (простат- специфический антиген), присутствует в простатической жидкости, семенной жидкости, ткани простаты. В очень низких концентрациях присутствует и у женщин. PSA – сериновая протеаза, ответственная за поддержание вязкости семенной жидкости. В сперме содержится в сотни тысяч раз в большем количестве, чем в других тканях и выделениях человека. В сперме – 80 - 200000 нг/мл, в крови здорового человека – менее 4 нг/мл, в вагинальных выделениях – 1 нг/мл. Белок PSA считается стабильным (при хороших условиях хранения). Диапазон измерения для теста – 2 нг/мл - 100 мг/мл. Концентрация, соответствующая интенсивности окрашивания полосы внутреннего стандарта, - 4 нг/мл. Тест следует считать предварительным (не доказательным) методом исследования.
Предварительный тест на наличие спермы – PSA -тест Тест выпускается фирмой Seratec diagnostica. PSA – гликопротеин (простат- специфический антиген), присутствует в простатической жидкости, семенной жидкости, ткани простаты. В очень низких концентрациях присутствует и у женщин. PSA – сериновая протеаза, ответственная за поддержание вязкости семенной жидкости. В сперме содержится в сотни тысяч раз в большем количестве, чем в других тканях и выделениях человека. В сперме – 80 - 200000 нг/мл, в крови здорового человека – менее 4 нг/мл, в вагинальных выделениях – 1 нг/мл. Белок PSA считается стабильным (при хороших условиях хранения). Диапазон измерения для теста – 2 нг/мл - 100 мг/мл. Концентрация, соответствующая интенсивности окрашивания полосы внутреннего стандарта, - 4 нг/мл. Тест следует считать предварительным (не доказательным) методом исследования.
 Цитологический метод установления наличия спермы* 1) Вырезку из пятна помещаем в Э. , экстрагируем в буфере для экстракции в течение 18 ч при 4 0 С. 2) Удаляем предмет-носитель (вырезку помещаем в spin-basket, центрифугируем в течение 5 мин, 2500 об. /мин). 3) Отбираем супернатант, оставляя около 50 мкл жидкости и осадка, суспендируем, отбираем около 7 мкл, наносим на предварительно обезжиренное стекло. 4) Помещаем стекло на нагревательный столик до высыхания пятна. 5) Фиксируем препарат спиртом в течение 15 мин, высушиваем стекло. 6) Увлажняем препарат водой, наносим на пятно препарата несколько капель кристаллического фиолетового, выдерживаем в течение 1 мин. 7) Смываем водой. 8) Наносим на пятно препарата несколько капель раствора Люголя, выдерживаем 1 мин. 9) Смываем ацетоном, сушим на воздухе. 10) Наносим на пятно препарата несколько капель ядерного быстрого красного, выдерживаем в течение 15 мин. 11) Смываем водой. 12) Наносим на пятно препарата несколько капель пикроиндигокармина, выдерживаем 15 -30 сек. 13) Смываем 96 % этиловым спиртом, высушиваем при 56 0 С. 14) Полученный препарат исследуем микроскопически с использованием окуляра 10×/18, объективов 10×-100× с масляной иммерсией в световом режиме. * - Amp. Fl. STR SGM Plus PCR Amplification Kit Users Manual. Applied Biosystems, 2005 г.
Цитологический метод установления наличия спермы* 1) Вырезку из пятна помещаем в Э. , экстрагируем в буфере для экстракции в течение 18 ч при 4 0 С. 2) Удаляем предмет-носитель (вырезку помещаем в spin-basket, центрифугируем в течение 5 мин, 2500 об. /мин). 3) Отбираем супернатант, оставляя около 50 мкл жидкости и осадка, суспендируем, отбираем около 7 мкл, наносим на предварительно обезжиренное стекло. 4) Помещаем стекло на нагревательный столик до высыхания пятна. 5) Фиксируем препарат спиртом в течение 15 мин, высушиваем стекло. 6) Увлажняем препарат водой, наносим на пятно препарата несколько капель кристаллического фиолетового, выдерживаем в течение 1 мин. 7) Смываем водой. 8) Наносим на пятно препарата несколько капель раствора Люголя, выдерживаем 1 мин. 9) Смываем ацетоном, сушим на воздухе. 10) Наносим на пятно препарата несколько капель ядерного быстрого красного, выдерживаем в течение 15 мин. 11) Смываем водой. 12) Наносим на пятно препарата несколько капель пикроиндигокармина, выдерживаем 15 -30 сек. 13) Смываем 96 % этиловым спиртом, высушиваем при 56 0 С. 14) Полученный препарат исследуем микроскопически с использованием окуляра 10×/18, объективов 10×-100× с масляной иммерсией в световом режиме. * - Amp. Fl. STR SGM Plus PCR Amplification Kit Users Manual. Applied Biosystems, 2005 г.
 Микрофотографии препаратов, полученные при увеличении х400 На фотографиях препаратов можно увидеть головки сперматозоидов, имеющие характерное окрашивание (красные с розовой акросомой), и эпителиальные клетки (зеленая цитоплазма, красные ядра).
Микрофотографии препаратов, полученные при увеличении х400 На фотографиях препаратов можно увидеть головки сперматозоидов, имеющие характерное окрашивание (красные с розовой акросомой), и эпителиальные клетки (зеленая цитоплазма, красные ядра).
 Принцип дифференциального лизиса Очень важный в экспертной практике частный случай — получение ДНК из спермы и смешанных следов, содержащих сперму. Особенность в том, что хроматин сперматозоидов имеет принципиальное отличие от хроматина соматических клеток — его структура дополнительно стабилизирована дисульфидными связями. Поэтому применяемый по стандартной процедуре выделения ДНК протеолиз в случае спермального хроматина малоэффективен и идет очень медленно, а используемые для диссоциации нуклеопротеинов детергенты практически не оказывают на него солюбилизирующего действия. В результате выход спермальной ДНК оказывается практически нулевым. Для преодоления этой трудности при выделении ДНК из спермы в клеточный лизат вводят дополнительно реагенты-тиовосстановители, например дитиотрейтол или 2 -меркалтоэтанол, которые разрушают дисульфидные белковые сшивки. Это позволяет продолжить процесс по стандартной схеме. На использовании описанной особенности спермального хроматина основан общепринятый метод селективного выделения ДНК сперматозоидов из смешанных следов, содержащих сперму. Это двухэтапная процедура, получившая название дифференциального лизиса клеток. Суть ее заключается в том, что при выделении ДНК из смеси сперматозоидов и соматических клеток на первом этапе, представляющем собой стандартный протеазно-детергентный лизис, солюбилизируется только хроматин соматических клеток. Его раствор отделяют центрифугированием от остающегося структурированным (и потому нерастворимым) спермального хроматина и используют для экстрагирования соматической ДНК. Отделенный же спермальный хроматин подвергают второму литическому циклу, но уже с добавлением реагентов- тиовосстановителей, и уже потом из получившегося лизата экстрагируют спермальную ДНК.
Принцип дифференциального лизиса Очень важный в экспертной практике частный случай — получение ДНК из спермы и смешанных следов, содержащих сперму. Особенность в том, что хроматин сперматозоидов имеет принципиальное отличие от хроматина соматических клеток — его структура дополнительно стабилизирована дисульфидными связями. Поэтому применяемый по стандартной процедуре выделения ДНК протеолиз в случае спермального хроматина малоэффективен и идет очень медленно, а используемые для диссоциации нуклеопротеинов детергенты практически не оказывают на него солюбилизирующего действия. В результате выход спермальной ДНК оказывается практически нулевым. Для преодоления этой трудности при выделении ДНК из спермы в клеточный лизат вводят дополнительно реагенты-тиовосстановители, например дитиотрейтол или 2 -меркалтоэтанол, которые разрушают дисульфидные белковые сшивки. Это позволяет продолжить процесс по стандартной схеме. На использовании описанной особенности спермального хроматина основан общепринятый метод селективного выделения ДНК сперматозоидов из смешанных следов, содержащих сперму. Это двухэтапная процедура, получившая название дифференциального лизиса клеток. Суть ее заключается в том, что при выделении ДНК из смеси сперматозоидов и соматических клеток на первом этапе, представляющем собой стандартный протеазно-детергентный лизис, солюбилизируется только хроматин соматических клеток. Его раствор отделяют центрифугированием от остающегося структурированным (и потому нерастворимым) спермального хроматина и используют для экстрагирования соматической ДНК. Отделенный же спермальный хроматин подвергают второму литическому циклу, но уже с добавлением реагентов- тиовосстановителей, и уже потом из получившегося лизата экстрагируют спермальную ДНК.
 Случаи неэффективного дифференциального лизиса 1. Единичные сперматозоиды, значительные количества соматических клеток (эпителиальные клетки, клетки крови). В этом случае сперматозоиды могут разрушиться на этапе лизиса соматических клеток, и ДНК спермы попадает в ep -фракцию. В соответствии с инструкцией по применению набора реагентов Ampl STR Identifiler гарантируется выявление обоих компонентов смеси при их соотношении не более, чем 1: 10. При соотношении компонентов мужской : женский менее, чем 1: 10 при исследовании STR- локусов получим смешанный профиль; при соотношении компонентов более 1: 10 – получим чистый женский генотип, мужской компонент возможно исследовать с использованием наборов для исследования локусов, расположенных на Y- хромосоме (например, Yfiler, Power. Plex Y); 2. Единичные соматические клетки, преобладают сперматозоиды. В спермальной фракции получим чистый мужской генотип. В ep - фракцию, содержащую ДНК соматических клеток, может попасть значительное количество ДНК сперматозоидов, разрушившихся случайным образом на этапе лизиса соматических клеток. Как правило, при этом происходит потеря данных женского генотипа.
Случаи неэффективного дифференциального лизиса 1. Единичные сперматозоиды, значительные количества соматических клеток (эпителиальные клетки, клетки крови). В этом случае сперматозоиды могут разрушиться на этапе лизиса соматических клеток, и ДНК спермы попадает в ep -фракцию. В соответствии с инструкцией по применению набора реагентов Ampl STR Identifiler гарантируется выявление обоих компонентов смеси при их соотношении не более, чем 1: 10. При соотношении компонентов мужской : женский менее, чем 1: 10 при исследовании STR- локусов получим смешанный профиль; при соотношении компонентов более 1: 10 – получим чистый женский генотип, мужской компонент возможно исследовать с использованием наборов для исследования локусов, расположенных на Y- хромосоме (например, Yfiler, Power. Plex Y); 2. Единичные соматические клетки, преобладают сперматозоиды. В спермальной фракции получим чистый мужской генотип. В ep - фракцию, содержащую ДНК соматических клеток, может попасть значительное количество ДНК сперматозоидов, разрушившихся случайным образом на этапе лизиса соматических клеток. Как правило, при этом происходит потеря данных женского генотипа.
 Установление данных ДНК женского компонента Установление данных ДНК женского компонента в ряде случаев имеет важное доказательное значение. Обвиняемый в случае выявления только его генотипа, без женского компонента, может строить свою защиту в суде, основываясь на отсутствии данных о потерпевшей в следах, обнаруженных при осмотре места происшествия (например, смыв со ступенек, пола, пятна на простынях…). Очевидно, что семяизвержение на простынь, например, не является само по себе уголовно наказуемым деянием, и необходимо еще доказать, что это имеет отношение к эпизоду изнасилования, и сперма, обнаруженная на месте происшествия, «вытекла» из влагалища потерпевшей, была ею выплюнута и т. д. В случаях, когда предоставляются вроде бы заведомо произошедшие от потерпевшей следы (смывы из влагалища, нпо и т. д. ), установление признаков ДНК потерпевшей также имеет доказательное значение – позволяет отсекать предположения о случайном «перепутывании» объектов в СМЭ, или намеренной замене (подлоге) вещественных доказательств на различных этапах следственных действий.
Установление данных ДНК женского компонента Установление данных ДНК женского компонента в ряде случаев имеет важное доказательное значение. Обвиняемый в случае выявления только его генотипа, без женского компонента, может строить свою защиту в суде, основываясь на отсутствии данных о потерпевшей в следах, обнаруженных при осмотре места происшествия (например, смыв со ступенек, пола, пятна на простынях…). Очевидно, что семяизвержение на простынь, например, не является само по себе уголовно наказуемым деянием, и необходимо еще доказать, что это имеет отношение к эпизоду изнасилования, и сперма, обнаруженная на месте происшествия, «вытекла» из влагалища потерпевшей, была ею выплюнута и т. д. В случаях, когда предоставляются вроде бы заведомо произошедшие от потерпевшей следы (смывы из влагалища, нпо и т. д. ), установление признаков ДНК потерпевшей также имеет доказательное значение – позволяет отсекать предположения о случайном «перепутывании» объектов в СМЭ, или намеренной замене (подлоге) вещественных доказательств на различных этапах следственных действий.
 Случаи, когда сперма не обнаружена, мужской генотип выявлен в смеси 1. Половой акт не был закончен семяизвержением, в биологических следах присутствуют кровь либо эпителиальные клетки, произошедшие от мужчины. (Эпителиальные клетки могут происходить с головки или тела полового члена, кровь может присутствовать в случае механических повреждений полового члена. В смеси могут присутствовать и клетки буккального эпителия мужчины – преступник в качестве «смазки» перед половым актом мог использовать свою слюну). 2. Сперматозоиды, присутствовавшие изначально в смеси клеток, в процессе хранения объекта-носителя частично или полностью лизировались. (Также не исключается вариант сравнительно позднего изъятия смывов у потерпевшей, когда агрессивная среда влагалища начала разрушать сперматозоиды. В процессе разрушения сперматозоидов от них остались отдельные ядра, из которых могла выделиться ДНК); 3. Азооспермия, олигозооспермия (в состав спермы помимо сперматозоидов входят лейкоциты, клетки эпителия, отдельные формы недоразвитых и недоформированных сперматозоидов).
Случаи, когда сперма не обнаружена, мужской генотип выявлен в смеси 1. Половой акт не был закончен семяизвержением, в биологических следах присутствуют кровь либо эпителиальные клетки, произошедшие от мужчины. (Эпителиальные клетки могут происходить с головки или тела полового члена, кровь может присутствовать в случае механических повреждений полового члена. В смеси могут присутствовать и клетки буккального эпителия мужчины – преступник в качестве «смазки» перед половым актом мог использовать свою слюну). 2. Сперматозоиды, присутствовавшие изначально в смеси клеток, в процессе хранения объекта-носителя частично или полностью лизировались. (Также не исключается вариант сравнительно позднего изъятия смывов у потерпевшей, когда агрессивная среда влагалища начала разрушать сперматозоиды. В процессе разрушения сперматозоидов от них остались отдельные ядра, из которых могла выделиться ДНК); 3. Азооспермия, олигозооспермия (в состав спермы помимо сперматозоидов входят лейкоциты, клетки эпителия, отдельные формы недоразвитых и недоформированных сперматозоидов).
 Выделение ДНК из спермы 1) Помещаем в Э. вырезку из объекта, содержащего сперму, добавляем 1 мл буфера для экстракции. 2) Экстрагируем при 4 0 С в течение 6 -18 ч. 3) Удаляем предмет-носитель (вырезку помещаем в spin-basket, центрифугируем в течение 5 мин, 2500 -3000 об/мин). 4) Отбираем супернатант, оставляя около 50 мкл жидкости и осадка*, суспендируем, отбираем около 7 мкл на цитологическое исследование. 5) Если обнаружены только сперматозоиды – п. 14, если обнаружены сперматозоиды в смеси с кровью и эпителиальными клетками – проводим процедуру дифференциального лизиса – п. 6. 6) Добавляем лизирующий раствор до объема 200 мкл, и 2 -6 мкл протеиназы К (в зависимости от количества эпителиальных клеток и крови), vortex. 7) Центрифугируем в течение 15 сек, при максимальных оборотах. Термостатируем при 56 0 С в течение 1 -2 ч. 8) Центрифугируем 5 мин при 2500 -3000 об/мин. 9) Переносим 150 мкл супернатанта в чистый Э. (содержит ДНК эпителиальных клеток, крови), добавляем 50 мкл 20% раствора Chelex 100. 10) Суспендируем осадок в 0, 5 мл лизирующего раствора, центрифугируем 5 мин при макс. об. , удаляем супернатант, оставляя 50 мкл. 11) Повторяем п. 10 1 -2 раза.
Выделение ДНК из спермы 1) Помещаем в Э. вырезку из объекта, содержащего сперму, добавляем 1 мл буфера для экстракции. 2) Экстрагируем при 4 0 С в течение 6 -18 ч. 3) Удаляем предмет-носитель (вырезку помещаем в spin-basket, центрифугируем в течение 5 мин, 2500 -3000 об/мин). 4) Отбираем супернатант, оставляя около 50 мкл жидкости и осадка*, суспендируем, отбираем около 7 мкл на цитологическое исследование. 5) Если обнаружены только сперматозоиды – п. 14, если обнаружены сперматозоиды в смеси с кровью и эпителиальными клетками – проводим процедуру дифференциального лизиса – п. 6. 6) Добавляем лизирующий раствор до объема 200 мкл, и 2 -6 мкл протеиназы К (в зависимости от количества эпителиальных клеток и крови), vortex. 7) Центрифугируем в течение 15 сек, при максимальных оборотах. Термостатируем при 56 0 С в течение 1 -2 ч. 8) Центрифугируем 5 мин при 2500 -3000 об/мин. 9) Переносим 150 мкл супернатанта в чистый Э. (содержит ДНК эпителиальных клеток, крови), добавляем 50 мкл 20% раствора Chelex 100. 10) Суспендируем осадок в 0, 5 мл лизирующего раствора, центрифугируем 5 мин при макс. об. , удаляем супернатант, оставляя 50 мкл. 11) Повторяем п. 10 1 -2 раза.
 Выделение ДНК из спермы (продолжение) 12) Суспендируем осадок в 1 мл дистиллированной воды, центрифугируем 5 мин при 2500 -3000 об, удаляем супернатант, оставив 25 мкл, суспендируем осадок. 13) Проводим цитологическое исследование, при обнаружении эпителиальных клеток – повторяем процедуру дифференциального лизиса (с п. 6, сократив время инкубации до 30 мин), повторяем промывание осадка. 14) К осадку добавляем 5% раствор Chelex 100 до объема 200 мкл, 2 мкл раствора протеиназы К и 7 мкл 1 М раствора DTT, vortex. 15) Вместе с препаратами эпителиальной фракции (п. 9) термостатируем при 56 0 С в течение 30 -60 мин. 16) Vortex, центрифугирование (макс. число об. , 15 сек). 17) Термостатируем при 99 0 С, 8 мин. 18) Vortex, центрифугирование (макс число об. , 2 -3 мин). 19) Храним при 4 0 С или -20 0 С. *- если цвет жидкости бурый, дополнительно проводим отмывку (добавляем 1 мл буфера для экстракции, встряхиваем на vortex, центрифугируем в течение 5 минут при максимальных оборотах, удаляем супернатант, оставляя около 50 мкл жидкости и осадка)
Выделение ДНК из спермы (продолжение) 12) Суспендируем осадок в 1 мл дистиллированной воды, центрифугируем 5 мин при 2500 -3000 об, удаляем супернатант, оставив 25 мкл, суспендируем осадок. 13) Проводим цитологическое исследование, при обнаружении эпителиальных клеток – повторяем процедуру дифференциального лизиса (с п. 6, сократив время инкубации до 30 мин), повторяем промывание осадка. 14) К осадку добавляем 5% раствор Chelex 100 до объема 200 мкл, 2 мкл раствора протеиназы К и 7 мкл 1 М раствора DTT, vortex. 15) Вместе с препаратами эпителиальной фракции (п. 9) термостатируем при 56 0 С в течение 30 -60 мин. 16) Vortex, центрифугирование (макс. число об. , 15 сек). 17) Термостатируем при 99 0 С, 8 мин. 18) Vortex, центрифугирование (макс число об. , 2 -3 мин). 19) Храним при 4 0 С или -20 0 С. *- если цвет жидкости бурый, дополнительно проводим отмывку (добавляем 1 мл буфера для экстракции, встряхиваем на vortex, центрифугируем в течение 5 минут при максимальных оборотах, удаляем супернатант, оставляя около 50 мкл жидкости и осадка)
 Приготовление буфера для экстракции (0, 01 М трис-HCl, 0, 01 М ЭДТА, 0, 1 М Na. Cl, р. Н 7, 6) В мерную колбу на 1 л наливаем 20 мл 0, 5 М раствора ЭДТА, 10 мл 1 М раствора трис-HCl и 20 мл 5 М раствора Na. Cl, наливаем деионизованную воду до метки. Полученный раствор автоклавируем и храним при 4 0 С.
Приготовление буфера для экстракции (0, 01 М трис-HCl, 0, 01 М ЭДТА, 0, 1 М Na. Cl, р. Н 7, 6) В мерную колбу на 1 л наливаем 20 мл 0, 5 М раствора ЭДТА, 10 мл 1 М раствора трис-HCl и 20 мл 5 М раствора Na. Cl, наливаем деионизованную воду до метки. Полученный раствор автоклавируем и храним при 4 0 С.
 Приготовление лизирующего раствора (10 m. M трис-HCl, 10 m. M ЭДТА, 1 мл 50 m. М Na. Cl, 2% SDS, р. Н 7, 5) К 1 мл 1 М раствора трис-HCl добавляем 2 мл 0, 5 М раствора ЭДТА, 1 мл 5 М раствора Na. Cl и 10 мл 20% раствора SDS, 86 мл деионизованной воды. Полученный раствор храним при комнатной температуре (при 4 -6 0 С SDS выпадает в растворе в осадок)
Приготовление лизирующего раствора (10 m. M трис-HCl, 10 m. M ЭДТА, 1 мл 50 m. М Na. Cl, 2% SDS, р. Н 7, 5) К 1 мл 1 М раствора трис-HCl добавляем 2 мл 0, 5 М раствора ЭДТА, 1 мл 5 М раствора Na. Cl и 10 мл 20% раствора SDS, 86 мл деионизованной воды. Полученный раствор храним при комнатной температуре (при 4 -6 0 С SDS выпадает в растворе в осадок)
 Выделение ДНК из пота В экспертной практике нередко возникает вопрос о корректности написания в экспертизе: «ДНК, выделенная из пота…» . Можно возразить - сам по себе пот не содержит клеток, пригодных для ПЦР (в его состав входят 98 -99% воды, азотистые вещества, некоторые аминокислоты (серин, гистидин), белок в следовых количествах, летучие жирные кислоты, мыла, холестерин, соли щелочных металлов и т. д. , но не клетки). Отсюда следует, что установление наличия пота (ТСХ на наличие серина) само по себе не устанавливает наличие ДНК, и установление факта отсутствия пота также не может свидетельствовать об отсутствии ДНК находится в клетках, их обломках, ядрах. На ношенных вещах клетки кожного эпителия, клеточные ядра обнаруживаются в местах наиболее длительного или плотного контакта (натирания), и как правило в этих же местах наиболее вероятно обнаружение пота (подмышечные области, пах, область пояса брюк, воротничок, перчатки). Таким образом, факт обнаружения ДНК в объекте, содержащем пот, носит скорее опосредованный характер, и связь с наличием пота не является прямой. Поэтому для таких объектов параллельно с установлением наличия пота желательно проводить и цитологическое исследование на предмет обнаружения эпителиальных клеток, их фрагментов, клеточных ядер.
Выделение ДНК из пота В экспертной практике нередко возникает вопрос о корректности написания в экспертизе: «ДНК, выделенная из пота…» . Можно возразить - сам по себе пот не содержит клеток, пригодных для ПЦР (в его состав входят 98 -99% воды, азотистые вещества, некоторые аминокислоты (серин, гистидин), белок в следовых количествах, летучие жирные кислоты, мыла, холестерин, соли щелочных металлов и т. д. , но не клетки). Отсюда следует, что установление наличия пота (ТСХ на наличие серина) само по себе не устанавливает наличие ДНК, и установление факта отсутствия пота также не может свидетельствовать об отсутствии ДНК находится в клетках, их обломках, ядрах. На ношенных вещах клетки кожного эпителия, клеточные ядра обнаруживаются в местах наиболее длительного или плотного контакта (натирания), и как правило в этих же местах наиболее вероятно обнаружение пота (подмышечные области, пах, область пояса брюк, воротничок, перчатки). Таким образом, факт обнаружения ДНК в объекте, содержащем пот, носит скорее опосредованный характер, и связь с наличием пота не является прямой. Поэтому для таких объектов параллельно с установлением наличия пота желательно проводить и цитологическое исследование на предмет обнаружения эпителиальных клеток, их фрагментов, клеточных ядер.
 Особенности ДНК, выделенной из пота Объекты, на которых обнаружен пот, как правило содержат очень мало клеточных элементов, и они могут находиться в различной степени деградации – клетки частично разрушены, клеточные ядра повреждены, клетки преимущественно находятся в состоянии апоптоза * (из-за чего следует ожидать более или менее выраженную деградацию ДНК). Таким образом, ДНК в этих объектах содержится в небольших количествах , зачастую меньших, чем требуется для постановки ПЦР, и ее качество очень низкое. Нередки случаи частичной деградации ДНК – деградация в отдельных локусах, где фрагменты ДНК имеют сравнительно большую длину (FGA, D 18 S 51). Как частный случай деградации встречается и лэддер- эффект, маскирующий истинные пики (зачастую «посторонние» пики имеют высоту даже большую, нежели у истинных аллелей). Также следует отметить, что с объектами, на которых обнаружен пот, нередко контактировали разные люди, и полученный генотип может быть смешанным . Сложность его анализа состоит в том, что смеси часто оказываются «не классическим» – нарушены соотношения высот пиков в гетерозиготных профилях, не соблюдаются пропорции соотношений минорных и мажорных компонентов. Также могут иметь место выпадения в гетерозиготных локусах отдельных аллелей – «ложная гомозигота» (следствие стохастического эффекта, вызванного низкими значениями концентрации полученной ДНК и ее неудовлетворительным качеством). Следует дифференцировать деградированную ДНК с выраженным лэддер- эффектом и смешанный генотип.
Особенности ДНК, выделенной из пота Объекты, на которых обнаружен пот, как правило содержат очень мало клеточных элементов, и они могут находиться в различной степени деградации – клетки частично разрушены, клеточные ядра повреждены, клетки преимущественно находятся в состоянии апоптоза * (из-за чего следует ожидать более или менее выраженную деградацию ДНК). Таким образом, ДНК в этих объектах содержится в небольших количествах , зачастую меньших, чем требуется для постановки ПЦР, и ее качество очень низкое. Нередки случаи частичной деградации ДНК – деградация в отдельных локусах, где фрагменты ДНК имеют сравнительно большую длину (FGA, D 18 S 51). Как частный случай деградации встречается и лэддер- эффект, маскирующий истинные пики (зачастую «посторонние» пики имеют высоту даже большую, нежели у истинных аллелей). Также следует отметить, что с объектами, на которых обнаружен пот, нередко контактировали разные люди, и полученный генотип может быть смешанным . Сложность его анализа состоит в том, что смеси часто оказываются «не классическим» – нарушены соотношения высот пиков в гетерозиготных профилях, не соблюдаются пропорции соотношений минорных и мажорных компонентов. Также могут иметь место выпадения в гетерозиготных локусах отдельных аллелей – «ложная гомозигота» (следствие стохастического эффекта, вызванного низкими значениями концентрации полученной ДНК и ее неудовлетворительным качеством). Следует дифференцировать деградированную ДНК с выраженным лэддер- эффектом и смешанный генотип.
 Апоптоз* Апоптоз , или запрограммированная смерть клетки, представляет собой процесс, посредством которого внутренние или внешние факторы, активируя генетическую программу, приводят к гибели клетки и ее эффективному удалению из ткани. Апоптоз – это биохимически специфический тип гибели клетки, который характеризуется активацией нелизосомных эндогенных эндонуклеаз, которые расщепляют ядерную ДНК на маленькие фрагменты (расщепление происходит в местах, связывающих отдельные нуклеосомы, что приводит к развитию большого количества фрагментов, в которых число пар оснований делится на 180 -200. При электрофорезе фрагменты дают характерную картину лестницы). Фрагментация ДНК в нуклеосомах происходит под действием кальций чувствительной эндонуклеазы. Эндонуклеаза в некоторых клетках находится постоянно и активируется появлением в цитоплазме свободного кальция, а в других клетках синтезируется перед началом апоптоза. Морфологически апоптоз проявляется гибелью единичных, беспорядочно расположенных клеток, что сопровождается формированием округлых, окруженных мембраной телец ( «апоптотические тельца» ), которые тут же фагоцитируются окружающими клетками. Это процесс, посредством которого удаляются нежелательные и дефектные клетки организма. Он является механизмом постоянного контроля размеров органов. При снижении апоптоза происходит накопление клеток, пример – опухолевый рост. При увеличении апоптоза наблюдается прогрессивное уменьшение количества клеток в ткани, пример – атрофия.
Апоптоз* Апоптоз , или запрограммированная смерть клетки, представляет собой процесс, посредством которого внутренние или внешние факторы, активируя генетическую программу, приводят к гибели клетки и ее эффективному удалению из ткани. Апоптоз – это биохимически специфический тип гибели клетки, который характеризуется активацией нелизосомных эндогенных эндонуклеаз, которые расщепляют ядерную ДНК на маленькие фрагменты (расщепление происходит в местах, связывающих отдельные нуклеосомы, что приводит к развитию большого количества фрагментов, в которых число пар оснований делится на 180 -200. При электрофорезе фрагменты дают характерную картину лестницы). Фрагментация ДНК в нуклеосомах происходит под действием кальций чувствительной эндонуклеазы. Эндонуклеаза в некоторых клетках находится постоянно и активируется появлением в цитоплазме свободного кальция, а в других клетках синтезируется перед началом апоптоза. Морфологически апоптоз проявляется гибелью единичных, беспорядочно расположенных клеток, что сопровождается формированием округлых, окруженных мембраной телец ( «апоптотические тельца» ), которые тут же фагоцитируются окружающими клетками. Это процесс, посредством которого удаляются нежелательные и дефектные клетки организма. Он является механизмом постоянного контроля размеров органов. При снижении апоптоза происходит накопление клеток, пример – опухолевый рост. При увеличении апоптоза наблюдается прогрессивное уменьшение количества клеток в ткани, пример – атрофия.
 Выделение ДНК из пота 1) Если вырезка имеет значительные размеры* (участок перчатки, носка и пр. ) – измельчаем, помещаем в центрифужную пробирку объемом 50 мл или 15 мл, заливаем дистиллированной водой или 1% раствором Tween 20. 2) Экстрагируем при 4 0 С в течение 6 - 18 ч. 3) Удаляем предмет-носитель (помещаем пинцетом фрагменты вырезки в марлевый мешочек, закрепляем в той же пробирке, фиксируем крышкой и отжимаем при помощи центрифугирования (5 -10 мин, макс. об. ) 4) Отбираем максимально супернатант, оставляя около 100 мкл жидкости и осадка, суспендируем, отбираем около 7 мкл на цитологическое исследование. 5) Добавляем 1000 мкл 70% раствора этилового спирта. 6) Vortex, центрифугирование (макс. об. , 10 мин). 7) Отбираем максимально супернатант, оставляя около 100 мкл жидкости и осадка. 8) Добавляем 1000 мкл деионизованной воды. 9) Vortex, центрифугирование (макс. об. , 10 мин). 10) Отбираем максимально супернатант, оставляя около 100 мкл жидкости и осадка, которые переносим в чистый Э. 11) Добавляем 50 мкл 20% Chelex-100, 3 -4 мкл протеиназы К и 7 мкл 1 М DTT. 12) Vortex, центрифугирование (макс об. , 15 сек). 13) Термостатируем при 56 0 С в течение 30 -40 мин. 14) Vortex, центрифугирование (макс. об. , 15 сек). 15) Термостатируем при 99 0 С, 8 мин 16) Vortex, центрифугирование (макс об. , 2 -3 мин) 17) Храним при 4 0 С или -20 0 С. *Если объект имеет небольшие размеры, то помещаем объект в Э. и применяем методику, начиная с п. 11, с поправкой – добавляем 200 мкл 20% Chelex-100, 3 -4 мкл протеиназы К и 7 мкл 1 М DTT.
Выделение ДНК из пота 1) Если вырезка имеет значительные размеры* (участок перчатки, носка и пр. ) – измельчаем, помещаем в центрифужную пробирку объемом 50 мл или 15 мл, заливаем дистиллированной водой или 1% раствором Tween 20. 2) Экстрагируем при 4 0 С в течение 6 - 18 ч. 3) Удаляем предмет-носитель (помещаем пинцетом фрагменты вырезки в марлевый мешочек, закрепляем в той же пробирке, фиксируем крышкой и отжимаем при помощи центрифугирования (5 -10 мин, макс. об. ) 4) Отбираем максимально супернатант, оставляя около 100 мкл жидкости и осадка, суспендируем, отбираем около 7 мкл на цитологическое исследование. 5) Добавляем 1000 мкл 70% раствора этилового спирта. 6) Vortex, центрифугирование (макс. об. , 10 мин). 7) Отбираем максимально супернатант, оставляя около 100 мкл жидкости и осадка. 8) Добавляем 1000 мкл деионизованной воды. 9) Vortex, центрифугирование (макс. об. , 10 мин). 10) Отбираем максимально супернатант, оставляя около 100 мкл жидкости и осадка, которые переносим в чистый Э. 11) Добавляем 50 мкл 20% Chelex-100, 3 -4 мкл протеиназы К и 7 мкл 1 М DTT. 12) Vortex, центрифугирование (макс об. , 15 сек). 13) Термостатируем при 56 0 С в течение 30 -40 мин. 14) Vortex, центрифугирование (макс. об. , 15 сек). 15) Термостатируем при 99 0 С, 8 мин 16) Vortex, центрифугирование (макс об. , 2 -3 мин) 17) Храним при 4 0 С или -20 0 С. *Если объект имеет небольшие размеры, то помещаем объект в Э. и применяем методику, начиная с п. 11, с поправкой – добавляем 200 мкл 20% Chelex-100, 3 -4 мкл протеиназы К и 7 мкл 1 М DTT.
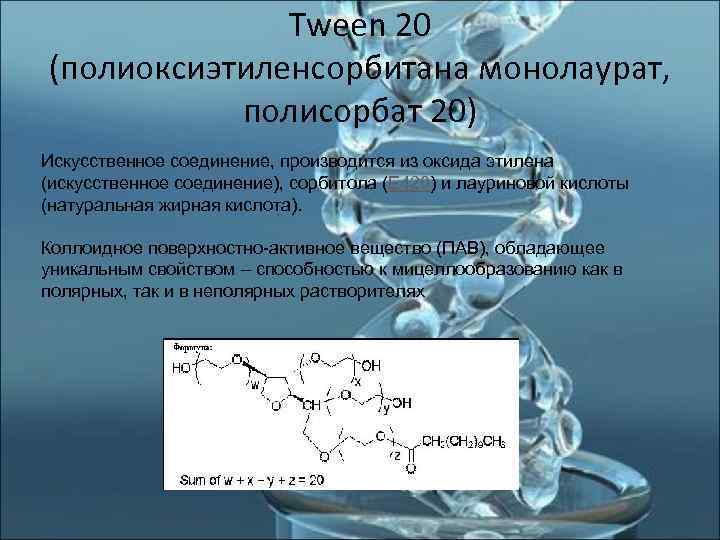
 Tween 20 (полиоксиэтиленсорбитана монолаурат, полисорбат 20) Искусственное соединение, производится из оксида этилена (искусственное соединение), сорбитола (Е 420) и лауриновой кислоты (натуральная жирная кислота). Коллоидное поверхностно-активное вещество (ПАВ), обладающее уникальным свойством – способностью к мицеллообразованию как в полярных, так и в неполярных растворителях
Tween 20 (полиоксиэтиленсорбитана монолаурат, полисорбат 20) Искусственное соединение, производится из оксида этилена (искусственное соединение), сорбитола (Е 420) и лауриновой кислоты (натуральная жирная кислота). Коллоидное поверхностно-активное вещество (ПАВ), обладающее уникальным свойством – способностью к мицеллообразованию как в полярных, так и в неполярных растворителях
 Концентрирование ДНК с помощью устройства «Microcon-100»
Концентрирование ДНК с помощью устройства «Microcon-100»
 Набор «Microcon-100»
Набор «Microcon-100»
 В состав набора «Microcon-100» входят: 1. пробирки 2. вкладыши с фильтрами* *Фильтр представляет собой целлюлозную мембрану, на которую нанесён раствор на глицериновой основе. Диаметр пор мембраны соответствует молекуле с весом 100 к. Дальтон (около 300 нуклеотидов одноцепочечной ДНК или около 125 нуклеотидов двухцепочечной ДНК).
В состав набора «Microcon-100» входят: 1. пробирки 2. вкладыши с фильтрами* *Фильтр представляет собой целлюлозную мембрану, на которую нанесён раствор на глицериновой основе. Диаметр пор мембраны соответствует молекуле с весом 100 к. Дальтон (около 300 нуклеотидов одноцепочечной ДНК или около 125 нуклеотидов двухцепочечной ДНК).
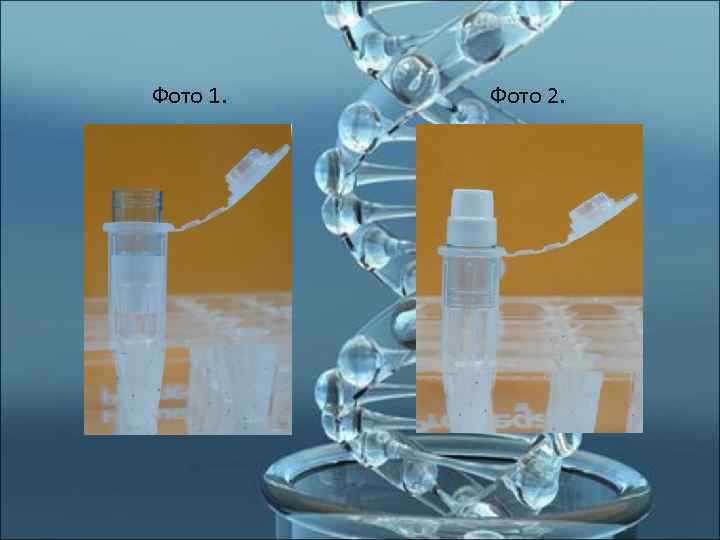
 Концентрирование ДНК с помощью устройства Microcon-100 1) Из пробирки с выделенной ДНК отбираем жидкость, не затрагивая частиц Chelex -100 (остатки жидкости отбираем, погружая наконечник в слой Chelex -100 до упора в дно пробирки, медленно отбираем жидкость, стараясь не допускать попадания в наконечник частиц Chelex-100). 1) В пробирку из набора Microcon-100 помещаем вкладыш с фильтром (фото 1). 2) Переносим на мембрану вкладыша раствор с выделенной ДНК, добавляем деионизованную воду (до общего объёма жидкости 400 -500 мкл). 3) Центрифугируем (500 х g) до тех пор, пока на мембране не останется 20 -25 мкл жидкости. 4) Добавляем деионизованную воду (до общего объёма жидкости 400 -500 мкл). 5) Центрифугируем (500 х g) до тех пор, пока на мембране не останется 20 -25 мкл жидкости. 6) Подписываем новые пробирки, помещаем в них вкладыши-мембраны в перевёрнутом виде (фото 2). 7) Центрифугируем (500 х g, 5 мин). 8) Вкладыши-мембраны выбрасываем; 9) Выделенную ДНК храним при +4 С или при -20 С.
Концентрирование ДНК с помощью устройства Microcon-100 1) Из пробирки с выделенной ДНК отбираем жидкость, не затрагивая частиц Chelex -100 (остатки жидкости отбираем, погружая наконечник в слой Chelex -100 до упора в дно пробирки, медленно отбираем жидкость, стараясь не допускать попадания в наконечник частиц Chelex-100). 1) В пробирку из набора Microcon-100 помещаем вкладыш с фильтром (фото 1). 2) Переносим на мембрану вкладыша раствор с выделенной ДНК, добавляем деионизованную воду (до общего объёма жидкости 400 -500 мкл). 3) Центрифугируем (500 х g) до тех пор, пока на мембране не останется 20 -25 мкл жидкости. 4) Добавляем деионизованную воду (до общего объёма жидкости 400 -500 мкл). 5) Центрифугируем (500 х g) до тех пор, пока на мембране не останется 20 -25 мкл жидкости. 6) Подписываем новые пробирки, помещаем в них вкладыши-мембраны в перевёрнутом виде (фото 2). 7) Центрифугируем (500 х g, 5 мин). 8) Вкладыши-мембраны выбрасываем; 9) Выделенную ДНК храним при +4 С или при -20 С.
 Фото 1. Фото 2.
Фото 1. Фото 2.
 Выделение ДНК на сорбентах Преимущества: - полное устранение ингибиторов; - ДНК в экстракте двуцепочечная и стабильна; - небольшой конечный объем; - безопасность; - возможность автоматизации. Недостатки: - дороговизна; - относительно высокий уровень потерь ДНК; - трудоемкость ручной экстракции.
Выделение ДНК на сорбентах Преимущества: - полное устранение ингибиторов; - ДНК в экстракте двуцепочечная и стабильна; - небольшой конечный объем; - безопасность; - возможность автоматизации. Недостатки: - дороговизна; - относительно высокий уровень потерь ДНК; - трудоемкость ручной экстракции.
 Принцип действия метода Клетки лизируются, ДНК связывается с сорбентом в высокосолевых условиях (в присутствии хаотропных агентов), сорбент отделяется и отмывается, ДНК элюируется в низкосолевых условиях.
Принцип действия метода Клетки лизируются, ДНК связывается с сорбентом в высокосолевых условиях (в присутствии хаотропных агентов), сорбент отделяется и отмывается, ДНК элюируется в низкосолевых условиях.
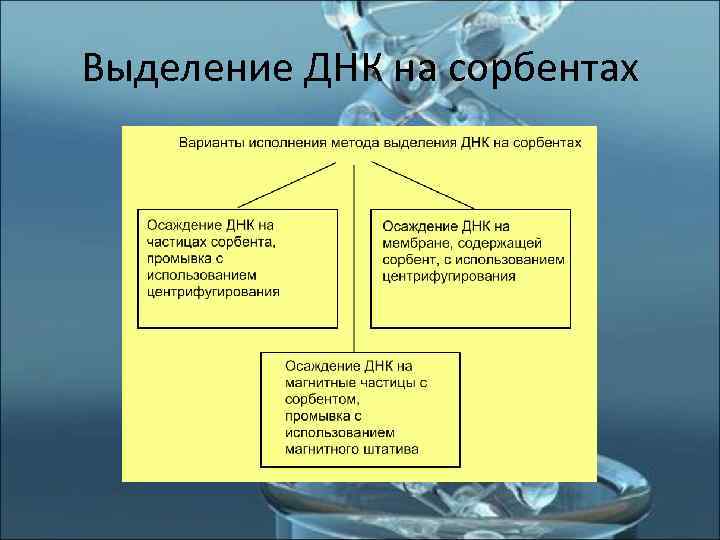
 Выделение ДНК на сорбентах
Выделение ДНК на сорбентах
 Набор «DNA IQ System» (Promega)
Набор «DNA IQ System» (Promega)
 Набор «DNA IQ System» Набор состоит из: 1. Лизирующий буфер (Lysis buffer). Готовый лизирующий буфер включает в себя: - гуанидин тиоцианат; - DTT; - буфер. 2. Магнитные частицы (Resin) 3. Отмывочный буфер (Wash buffer) Готовый отмывочный буфер включает в себя: - буфер; - этанол; - изопропанол. 4. Элюирующий буфер (Elution buffer). Элюирующий буфер в составе содержит трис HCl (10 m. M) и ЭДТА (0, 1 m. M) Примечание: красным цветом выделены компоненты, не входящие в состав набора и добавляемые при работе с набором.
Набор «DNA IQ System» Набор состоит из: 1. Лизирующий буфер (Lysis buffer). Готовый лизирующий буфер включает в себя: - гуанидин тиоцианат; - DTT; - буфер. 2. Магнитные частицы (Resin) 3. Отмывочный буфер (Wash buffer) Готовый отмывочный буфер включает в себя: - буфер; - этанол; - изопропанол. 4. Элюирующий буфер (Elution buffer). Элюирующий буфер в составе содержит трис HCl (10 m. M) и ЭДТА (0, 1 m. M) Примечание: красным цветом выделены компоненты, не входящие в состав набора и добавляемые при работе с набором.
 Lysis buffer готовится из расчета: на 1 мл готового Lysis buffer из набора – 10 мкл DTT (1 М)
Lysis buffer готовится из расчета: на 1 мл готового Lysis buffer из набора – 10 мкл DTT (1 М)
 Гуанидин тиоцианат – хаотропный агент в составе лизирующего буфера Формула: NH 2 C(=NH)NH 2*HSCN Гуанидиновые соли хорошо известны благодаря их денатурирующему действию на белки. Наиболее известен гуанидин хлорид – в его 6 М растворе практически все белки с упорядоченной структурой теряют свою упорядоченность. Концентрация гуанидиновых солей и свободная энергия раскрытия (для денатурации белков) находятся в линейной зависимости. Свойства гуанидин тиоцианата, используемые для выделения ДНК: - способствует денатурации белков (лизис клеточных стенок, ядерных мембран) и клеточных нуклеаз; - являясь хаотропным агентом, способствует присоединению выделенной ДНК в высокосолевом растворе (с высокой ионной силой) к частицам Resin (механизм этого явления до конца не выяснен. Считается, что хаотропные агенты разрушают связь ДНК-молекул и воды в растворе, «вынуждая» ДНК искать новую связь и присоединяться к частицам Silica , имеющим противоположный заряд на поверхности).
Гуанидин тиоцианат – хаотропный агент в составе лизирующего буфера Формула: NH 2 C(=NH)NH 2*HSCN Гуанидиновые соли хорошо известны благодаря их денатурирующему действию на белки. Наиболее известен гуанидин хлорид – в его 6 М растворе практически все белки с упорядоченной структурой теряют свою упорядоченность. Концентрация гуанидиновых солей и свободная энергия раскрытия (для денатурации белков) находятся в линейной зависимости. Свойства гуанидин тиоцианата, используемые для выделения ДНК: - способствует денатурации белков (лизис клеточных стенок, ядерных мембран) и клеточных нуклеаз; - являясь хаотропным агентом, способствует присоединению выделенной ДНК в высокосолевом растворе (с высокой ионной силой) к частицам Resin (механизм этого явления до конца не выяснен. Считается, что хаотропные агенты разрушают связь ДНК-молекул и воды в растворе, «вынуждая» ДНК искать новую связь и присоединяться к частицам Silica , имеющим противоположный заряд на поверхности).
 Wash buffer готовится из расчета: к готовому раствору Wash buffer(70 мл) добавляют 35 мл 96% этанола и 35 мл изопропанола. Из-за содержания спиртов в высоких концентрациях Wash buffer является жидкостью, в которой ДНК не растворяется, оставаясь связанной с сорбентом. При помощи Wash buffer ДНК на сорбенте отмывается от ингибиторов и остатков гуанидин тиоцианата (который тоже является сильным ингибитором!).
Wash buffer готовится из расчета: к готовому раствору Wash buffer(70 мл) добавляют 35 мл 96% этанола и 35 мл изопропанола. Из-за содержания спиртов в высоких концентрациях Wash buffer является жидкостью, в которой ДНК не растворяется, оставаясь связанной с сорбентом. При помощи Wash buffer ДНК на сорбенте отмывается от ингибиторов и остатков гуанидин тиоцианата (который тоже является сильным ингибитором!).
 Частицы Resin представляют собой магнитные частицы, покрытые Si. O 2. Частицы Resin характеризуются емкостью поверхности - 7 мкл Resin способны связывать около 100 нг ДНК. Частицы Resin не обладают абсолютной специфичностью сорбента (наряду с исследуемой ДНК происходит присоединение бактериальной ДНК, части белков). Потери ДНК, связанные с отсутствием абсолютной специфичности сорбента, зависят от соотношения ДНК человека и бактериальной ДНК, а также примеси белков в растворе (практика показывает, что, например, при выделении ДНК из крови с использованием набора DNA IQ System желательно предварительно произвести отмывку гема).
Частицы Resin представляют собой магнитные частицы, покрытые Si. O 2. Частицы Resin характеризуются емкостью поверхности - 7 мкл Resin способны связывать около 100 нг ДНК. Частицы Resin не обладают абсолютной специфичностью сорбента (наряду с исследуемой ДНК происходит присоединение бактериальной ДНК, части белков). Потери ДНК, связанные с отсутствием абсолютной специфичности сорбента, зависят от соотношения ДНК человека и бактериальной ДНК, а также примеси белков в растворе (практика показывает, что, например, при выделении ДНК из крови с использованием набора DNA IQ System желательно предварительно произвести отмывку гема).
 Elution buffer За счет низкой концентрации солей в отсутствии спиртов и хаотропных агентов ДНК снова переходит в раствор. Процесс сорбции-элюции является равновесным процессом. Для смещения равновесия в сторону элюции очень важна температура – пробирки с частицами Resin и Elution buffer термостатируют при 65 -67 0 С.
Elution buffer За счет низкой концентрации солей в отсутствии спиртов и хаотропных агентов ДНК снова переходит в раствор. Процесс сорбции-элюции является равновесным процессом. Для смещения равновесия в сторону элюции очень важна температура – пробирки с частицами Resin и Elution buffer термостатируют при 65 -67 0 С.
 «DNA IQ System» (выделение ДНК из жидких образцов) 1) В пробирку вносим 5 -10 мкл жидкой крови, добавляем 200 мкл Lysis buffer с DTT и 7 мкл Resin (частицы предварительно встряхнуть на vortex), оставляем на столе в течение 5 мин, периодически переворачивая. 2) Vortex, ставим пробирки на магнитный штатив. Удаляем супернатант полностью, добавляем 100 мкл Lysis buffer с DTT. 3) Vortex, ставим пробирки на магнитный штатив. Удаляем супернатант, добавляем 100 мкл Wash buffer, на магнитный штатив. Удаляем супернатант. 4) Действия п. 3 повторяем еще 2 раза. 5) Высушиваем частицы Resin 5 мин на магнитном штативе (можно 1 мин сушить при 67 0 С и затем 3 мин сушить на воздухе при комнатной температуре). 6) Добавляем 25 -100 мкл Elution buffer, vortex. 7) Термостатируем 5 мин при 65 -67 0 С (элюция). 8) По одной пробирке: vortex, ставим пробирку на магнитный штатив, очень быстро (так как процесс сорбции-элюции равновесный и при остывании раствора равновесие может сместиться в сторону сорбции) отобрать в чистую подписанную пробирку жидкость, содержащую ДНК.
«DNA IQ System» (выделение ДНК из жидких образцов) 1) В пробирку вносим 5 -10 мкл жидкой крови, добавляем 200 мкл Lysis buffer с DTT и 7 мкл Resin (частицы предварительно встряхнуть на vortex), оставляем на столе в течение 5 мин, периодически переворачивая. 2) Vortex, ставим пробирки на магнитный штатив. Удаляем супернатант полностью, добавляем 100 мкл Lysis buffer с DTT. 3) Vortex, ставим пробирки на магнитный штатив. Удаляем супернатант, добавляем 100 мкл Wash buffer, на магнитный штатив. Удаляем супернатант. 4) Действия п. 3 повторяем еще 2 раза. 5) Высушиваем частицы Resin 5 мин на магнитном штативе (можно 1 мин сушить при 67 0 С и затем 3 мин сушить на воздухе при комнатной температуре). 6) Добавляем 25 -100 мкл Elution buffer, vortex. 7) Термостатируем 5 мин при 65 -67 0 С (элюция). 8) По одной пробирке: vortex, ставим пробирку на магнитный штатив, очень быстро (так как процесс сорбции-элюции равновесный и при остывании раствора равновесие может сместиться в сторону сорбции) отобрать в чистую подписанную пробирку жидкость, содержащую ДНК.
 «DNA IQ System» (выделение из пятен на предметах-носителях) 1) Вырезку помещаем в Э. , добавляем 200 мкл Lysis buffer с DTT, термостатируем 20 мин при 56 - 950 С. 2) Переносим вырезку в spin-basket, центрифугируем 2 -5 мин при 3000 об. Удаляем вырезку и spin-basket. 3) Добавляем 7 мкл Resin (частицы предварительно встряхнуть на vortex), оставляем на столе в течение 5 мин, периодически переворачивая. 4) Vortex, ставим пробирки на магнитный штатив. Удаляем супернатант, добавляем 100 мкл Lysis buffer с DTT. 5) Vortex, ставим пробирки на магнитный штатив. Удаляем супернатант, добавляем 100 мкл Wash buffer, на магнитный штатив. Удаляем супернатант. 6) Действия п. 5 повторяем еще 2 раза. 7) Высушиваем частицы Resin в течение 5 мин на магнитном штативе (можно 1 мин сушить при 67 0 С, и затем 3 мин сушить на воздухе при комнатной температуре). 8) Добавляем 25 -100 мкл Elution buffer, vortex. 9) Термостатируем 5 мин при 65 -67 0 С 10) По одной пробирке: vortex, ставим пробирку на магнитный штатив, очень быстро (так как процесс элюции-сорбции равновесный и при остывании раствора равновесие может сместиться в сторону сорбции) переносим в чистую подписанную пробирку супернатант, содержащий ДНК.
«DNA IQ System» (выделение из пятен на предметах-носителях) 1) Вырезку помещаем в Э. , добавляем 200 мкл Lysis buffer с DTT, термостатируем 20 мин при 56 - 950 С. 2) Переносим вырезку в spin-basket, центрифугируем 2 -5 мин при 3000 об. Удаляем вырезку и spin-basket. 3) Добавляем 7 мкл Resin (частицы предварительно встряхнуть на vortex), оставляем на столе в течение 5 мин, периодически переворачивая. 4) Vortex, ставим пробирки на магнитный штатив. Удаляем супернатант, добавляем 100 мкл Lysis buffer с DTT. 5) Vortex, ставим пробирки на магнитный штатив. Удаляем супернатант, добавляем 100 мкл Wash buffer, на магнитный штатив. Удаляем супернатант. 6) Действия п. 5 повторяем еще 2 раза. 7) Высушиваем частицы Resin в течение 5 мин на магнитном штативе (можно 1 мин сушить при 67 0 С, и затем 3 мин сушить на воздухе при комнатной температуре). 8) Добавляем 25 -100 мкл Elution buffer, vortex. 9) Термостатируем 5 мин при 65 -67 0 С 10) По одной пробирке: vortex, ставим пробирку на магнитный штатив, очень быстро (так как процесс элюции-сорбции равновесный и при остывании раствора равновесие может сместиться в сторону сорбции) переносим в чистую подписанную пробирку супернатант, содержащий ДНК.
 Очистка препаратов ДНК от ингибиторов с использованием набора «DNA IQ System» Препараты иногда необходимо очистить от присутствия ингибиторов в растворе ДНК после выделения с использованием Chelex 100 или концентрирования (Microcon, Amicon). Для этого предмет-носитель (оставшийся в пробирке после выделения Chelex-100) помещаем в spin-basket, центрифугируем 2 -5 мин при макс. числе об. Удаляем вырезку и spin-basket, отбираем в подписанную чистую пробирку надосадочную жидкость, не затрагивая частицы Chelex-100. В пробирку с раствором ДНК добавляем двукратный объем Lysis buffer с DTT и 7 мкл Resin, оставляем на столе в течение 5 мин, периодически переворачивая. Далее согласно п. 2 -8 методики «выделение ДНК из жидких образцов – кровь» (см выше).
Очистка препаратов ДНК от ингибиторов с использованием набора «DNA IQ System» Препараты иногда необходимо очистить от присутствия ингибиторов в растворе ДНК после выделения с использованием Chelex 100 или концентрирования (Microcon, Amicon). Для этого предмет-носитель (оставшийся в пробирке после выделения Chelex-100) помещаем в spin-basket, центрифугируем 2 -5 мин при макс. числе об. Удаляем вырезку и spin-basket, отбираем в подписанную чистую пробирку надосадочную жидкость, не затрагивая частицы Chelex-100. В пробирку с раствором ДНК добавляем двукратный объем Lysis buffer с DTT и 7 мкл Resin, оставляем на столе в течение 5 мин, периодически переворачивая. Далее согласно п. 2 -8 методики «выделение ДНК из жидких образцов – кровь» (см выше).
 Набор «Tissue and Hair Extraction Kit»
Набор «Tissue and Hair Extraction Kit»
 Выделение ДНК из мышц (наборы «Tissue and Hair Extraction Kit» , «DNA IQ System» ) Набор «Tissue and Hair Extraction Kit» включает Incubation buffer Перед работой необходимо приготовить: 1. 1 М DTT 2. Протеиназу К – 100 мг+5, 5 мл Incubation buffer из набора 3. Incubation buffer – на общий объем 1000 мкл: 800 мкл Incubation buffer из набора +100 мкл 1 М DTT+100 мкл протеиназы К.
Выделение ДНК из мышц (наборы «Tissue and Hair Extraction Kit» , «DNA IQ System» ) Набор «Tissue and Hair Extraction Kit» включает Incubation buffer Перед работой необходимо приготовить: 1. 1 М DTT 2. Протеиназу К – 100 мг+5, 5 мл Incubation buffer из набора 3. Incubation buffer – на общий объем 1000 мкл: 800 мкл Incubation buffer из набора +100 мкл 1 М DTT+100 мкл протеиназы К.
 Выделение ДНК из мышц (наборы «Tissue and Hair Extraction Kit» и «DNA IQ System» ) 1. Кусочки мышц помещаем в Э. 2. Добавляем 50 -100 мкл приготовленного Incubation buffer. 3. Инкубируем при 560 С в течении 2 ч. 4. Vortex, центрифугируем 1 -2 мин, макс число об. 5. Переносим супернатант в подписанную пробирку, добавляем 1 или 2 объема Lysis buffer (зависит от объема супернатанта). 6. Далее п. 3 -10 методики «DNA IQ System выделение из пятен на предметах-носителях» .
Выделение ДНК из мышц (наборы «Tissue and Hair Extraction Kit» и «DNA IQ System» ) 1. Кусочки мышц помещаем в Э. 2. Добавляем 50 -100 мкл приготовленного Incubation buffer. 3. Инкубируем при 560 С в течении 2 ч. 4. Vortex, центрифугируем 1 -2 мин, макс число об. 5. Переносим супернатант в подписанную пробирку, добавляем 1 или 2 объема Lysis buffer (зависит от объема супернатанта). 6. Далее п. 3 -10 методики «DNA IQ System выделение из пятен на предметах-носителях» .
 Набор «Differex» (Promega)
Набор «Differex» (Promega)
 Дифференциальный лизис с использованием наборов «Differex» и «DNA IQ System» 1. В Э помещаем вырезку, добавляем 400 мкл Digestion Solution и 4 -6 мкл протеиназы К, vortex, инкубируем при 56 0 С 1 -2 ч. 2. Vortex, центрифугируем 15 сек. 3. В заранее подписанную пробирку вносим 100 мкл Separation Solution, ставим spin-basket. 4. В spin-basket переносим вырезку и весь объем Digestion Solution, центрифугируем в течение 5 мин при макс числе об. , удаляем spin-basket. 5. Отобираем Digestion Solution (желтый, верхняя фракция), не затрагивая Separation Solution (бесцветный, нижняя фракция) и помещаем в подписанный Э. – раствор содержит эпителиальную фракцию ДНК. 6. В пробирку с Separation Solution очень аккуратно, по стенке, смывая с нее Digestion Solution, по каплям вносим 1 мл дистиллированной воды, оставляем на столе не менее чем на 30 сек. 7. Удаляем воду, не затрагивая Separation Solution. 8. Повторяем п. 6, 7 еще несколько раз, пока вода не перестанет окрашиваться в желтый цвет. С последней порцией воды удаляем интерфазу. Осадок под Separation Solution содержит спермальную фракцию ДНК. 9. Добавляем 2 объема Lysis buffer (800 мкл к эпителиальной и 200 мкл к спермальной фракции), выделяем с набором DNA IQ System (п. 3 -10 методики «DNA IQ System выделение из пятен на предметах-носителях» ).
Дифференциальный лизис с использованием наборов «Differex» и «DNA IQ System» 1. В Э помещаем вырезку, добавляем 400 мкл Digestion Solution и 4 -6 мкл протеиназы К, vortex, инкубируем при 56 0 С 1 -2 ч. 2. Vortex, центрифугируем 15 сек. 3. В заранее подписанную пробирку вносим 100 мкл Separation Solution, ставим spin-basket. 4. В spin-basket переносим вырезку и весь объем Digestion Solution, центрифугируем в течение 5 мин при макс числе об. , удаляем spin-basket. 5. Отобираем Digestion Solution (желтый, верхняя фракция), не затрагивая Separation Solution (бесцветный, нижняя фракция) и помещаем в подписанный Э. – раствор содержит эпителиальную фракцию ДНК. 6. В пробирку с Separation Solution очень аккуратно, по стенке, смывая с нее Digestion Solution, по каплям вносим 1 мл дистиллированной воды, оставляем на столе не менее чем на 30 сек. 7. Удаляем воду, не затрагивая Separation Solution. 8. Повторяем п. 6, 7 еще несколько раз, пока вода не перестанет окрашиваться в желтый цвет. С последней порцией воды удаляем интерфазу. Осадок под Separation Solution содержит спермальную фракцию ДНК. 9. Добавляем 2 объема Lysis buffer (800 мкл к эпителиальной и 200 мкл к спермальной фракции), выделяем с набором DNA IQ System (п. 3 -10 методики «DNA IQ System выделение из пятен на предметах-носителях» ).
 Дифференциальный лизис с использованием набора «DNA IQ System» Преимущества метода: - «мягкие» условия экстракции и лизиса эпителиальных клеток позволяют избежать преждевременного разрушения сперматозоидов от осмотического шока; - выделение ДНК с использованием набора «DNA IQ System» позволяет использовать все преимущества этого метода выделения (устранение ингибиторов, небольшой конечный объем раствора ДНК).
Дифференциальный лизис с использованием набора «DNA IQ System» Преимущества метода: - «мягкие» условия экстракции и лизиса эпителиальных клеток позволяют избежать преждевременного разрушения сперматозоидов от осмотического шока; - выделение ДНК с использованием набора «DNA IQ System» позволяет использовать все преимущества этого метода выделения (устранение ингибиторов, небольшой конечный объем раствора ДНК).
 Методика дифференциального лизиса с использованием набора «DNA IQ System» 1. Вырезку (0, 5 х0, 5 см) помещаем в Э, добавляем 600 -1000 мкл буфера для экстракции (0, 01 М ЭДТА, 0, 01 М трис НСl, 0, 1 М Na. Cl), экстрагируем в течение 12 ч при 40 С. 2. Удаляем предмет-носитель с помощью spin-basket (центрифугируем 5 мин 2500 -3000 об/мин). 3. Удаляем супернатант, оставляя 50 -100 мкл жидкости и осадка. Суспендируем, отбираем 7 мкл на цитологическое исследование. 4. Добавляем лизирующий буфер с SDS* до получения объема в пробирке 300 мкл и 15 мкл протеиназы К (концентрация протеиназы К в итоговом растворе должна составлять 500 мкг/мл). 5. Инкубируем при 56 0 С 2 ч (желательно встряхивать на vortex через каждые 30 мин). 6. Vortex, центрифугируем 5 мин, макс. число об. 7. Отбираем в заранее подписанные пробирки по 200 мкл супернатанта – эпителиальная фракция. 8. К оставшемуся осадку добавляем 1 мл буфера с SDS, Vortex, центрифугируем 5 мин, макс число об. 9. Отбираем 1 мл. 10. П. 8, 9 повторяем 2 раза, вместо лизирующего буфера с SDS используем дистиллированную воду или буфер для экстракции. 11. Оставшиеся 100 мкл в пробирках – спермальная фракция. 12. К спермальной и эпителиальной фракциям в пробирках добавляем 2 объема Lysis buffer (400 мкл к эпителиальной и 100 мкл к спермальной фракции), выделяем с набором DNA IQ System (п. 3 -10 методики «DNA IQ System выделение из пятен на предметах-носителях» ).
Методика дифференциального лизиса с использованием набора «DNA IQ System» 1. Вырезку (0, 5 х0, 5 см) помещаем в Э, добавляем 600 -1000 мкл буфера для экстракции (0, 01 М ЭДТА, 0, 01 М трис НСl, 0, 1 М Na. Cl), экстрагируем в течение 12 ч при 40 С. 2. Удаляем предмет-носитель с помощью spin-basket (центрифугируем 5 мин 2500 -3000 об/мин). 3. Удаляем супернатант, оставляя 50 -100 мкл жидкости и осадка. Суспендируем, отбираем 7 мкл на цитологическое исследование. 4. Добавляем лизирующий буфер с SDS* до получения объема в пробирке 300 мкл и 15 мкл протеиназы К (концентрация протеиназы К в итоговом растворе должна составлять 500 мкг/мл). 5. Инкубируем при 56 0 С 2 ч (желательно встряхивать на vortex через каждые 30 мин). 6. Vortex, центрифугируем 5 мин, макс. число об. 7. Отбираем в заранее подписанные пробирки по 200 мкл супернатанта – эпителиальная фракция. 8. К оставшемуся осадку добавляем 1 мл буфера с SDS, Vortex, центрифугируем 5 мин, макс число об. 9. Отбираем 1 мл. 10. П. 8, 9 повторяем 2 раза, вместо лизирующего буфера с SDS используем дистиллированную воду или буфер для экстракции. 11. Оставшиеся 100 мкл в пробирках – спермальная фракция. 12. К спермальной и эпителиальной фракциям в пробирках добавляем 2 объема Lysis buffer (400 мкл к эпителиальной и 100 мкл к спермальной фракции), выделяем с набором DNA IQ System (п. 3 -10 методики «DNA IQ System выделение из пятен на предметах-носителях» ).
 Лаурилсульфат натрия (SDS)* Лаурилсульфат натрия (англ. sodium lauryl sulfate, SLS) или додецилсулфат натрия (англ. sodium dodecyl sulfate, SDS) — натриевая соль лаурилсулфокислоты, анионоактивное ПАВ. SDS вызывает денатурацию белков и поддерживает их в денатурированном состоянии.
Лаурилсульфат натрия (SDS)* Лаурилсульфат натрия (англ. sodium lauryl sulfate, SLS) или додецилсулфат натрия (англ. sodium dodecyl sulfate, SDS) — натриевая соль лаурилсулфокислоты, анионоактивное ПАВ. SDS вызывает денатурацию белков и поддерживает их в денатурированном состоянии.
 Приготовление лизирующего буфера (0, 01 М трис-HCl, 0, 01 М ЭДТА, 0, 1 М Na. Cl, 1% SDS) К 99 г буфера для экстракции добавляем 1 г SDS, растворяем при интенсивном перемешивании. Полученный раствор храним при комнатной температуре.
Приготовление лизирующего буфера (0, 01 М трис-HCl, 0, 01 М ЭДТА, 0, 1 М Na. Cl, 1% SDS) К 99 г буфера для экстракции добавляем 1 г SDS, растворяем при интенсивном перемешивании. Полученный раствор храним при комнатной температуре.
 Набор «Prep. Filer» (Applied Biosystems)
Набор «Prep. Filer» (Applied Biosystems)
 Набор «Prep. Filer» (Applied Biosystems) Для работы с набором необходимы: 1. Лизирующий буфер (Lysis buffer). 2. DTT (1 М). 3. Магнитные частицы (Magnetic Particles). 4. Изопропанол (Binding buffer) (желательно ОСЧ). 5. Отмывочный буфер (Wash buffer). Готовый отмывочный буфер включает в себя: - концентрат отмывочного буфера; - этанол (95%). 6. Элюирующий буфер (Elution buffer). 7. Пробирки. 8. Фильтровальные колонки. 9. Магнитный штатив. Примечание: - красным цветом выделены компоненты, не входящие в состав набора и добавляемые при работе с набором; - Wash buffer готовится из расчета: к концентрату отмывочного буфера Wash buffer(26 мл) добавляют 74 мл 95% этанола.
Набор «Prep. Filer» (Applied Biosystems) Для работы с набором необходимы: 1. Лизирующий буфер (Lysis buffer). 2. DTT (1 М). 3. Магнитные частицы (Magnetic Particles). 4. Изопропанол (Binding buffer) (желательно ОСЧ). 5. Отмывочный буфер (Wash buffer). Готовый отмывочный буфер включает в себя: - концентрат отмывочного буфера; - этанол (95%). 6. Элюирующий буфер (Elution buffer). 7. Пробирки. 8. Фильтровальные колонки. 9. Магнитный штатив. Примечание: - красным цветом выделены компоненты, не входящие в состав набора и добавляемые при работе с набором; - Wash buffer готовится из расчета: к концентрату отмывочного буфера Wash buffer(26 мл) добавляют 74 мл 95% этанола.
 Условия хранения набора Prep. Filer™ для выделения ДНК из образцов для криминалистического анализа. Реактив Условия хранения • 4 -8 °C после получения • После первого использования можно хранить при комнатной Магнитные частицы температуре (18 -25 °C) в течение 3 месяцев или при 4 °C в течение более длительного периода (до истечения срока годности) Лизирующий буфер, изопропанол, концентрат отмывочного буфера, Комнатная температура (18 -25 °C) подготовленный отмывочный буфер, буфер для элюции
Условия хранения набора Prep. Filer™ для выделения ДНК из образцов для криминалистического анализа. Реактив Условия хранения • 4 -8 °C после получения • После первого использования можно хранить при комнатной Магнитные частицы температуре (18 -25 °C) в течение 3 месяцев или при 4 °C в течение более длительного периода (до истечения срока годности) Лизирующий буфер, изопропанол, концентрат отмывочного буфера, Комнатная температура (18 -25 °C) подготовленный отмывочный буфер, буфер для элюции
 «Prep. Filer» (выделение из пятен на предметах-носителях) 1) Вырезку помещаем в Э. , добавляем 300 мкл Lysis buffer + 3 мкл 1 М DTT, термостатируем 30 -20 мин при 50 - 700 С (90°С – для образцов, содержащих сперму). 2) Переносим вырезку в spin-basket, центрифугируем 2 -5 мин при 3000 об/мин. Удаляем вырезку и spin-basket. 3) Добавляем 15 мкл магнитных частиц (частицы предварительно встряхнуть на vortex), 180 мкл изопропанола, оставляем на столе в течение 10 мин, периодически переворачивая. 4) Vortex, ставим пробирки на магнитный штатив на 30 -60 сек. Удаляем супернатант, добавляем 300 мкл Wash buffer, на магнитный штатив. Удаляем супернатант. 5) Действия п. 4 повторяем еще 2 раза. 6) Высушиваем магнитные частицы в течение 7 мин на магнитном штативе. 7) Добавляем 50 мкл Elution buffer, vortex. 8) Термостатируем 5 мин при 70 0 С 9) Vortex, ставим пробирку на магнитный штатив, переносим в чистую подписанную пробирку супернатант, содержащий ДНК. Примечание: если вырезка большая, то в п. 1 добавляем 500 мкл Lysis buffer + 5 мкл DTT, а в п. 3 добавляем 300 мкл изопропанола
«Prep. Filer» (выделение из пятен на предметах-носителях) 1) Вырезку помещаем в Э. , добавляем 300 мкл Lysis buffer + 3 мкл 1 М DTT, термостатируем 30 -20 мин при 50 - 700 С (90°С – для образцов, содержащих сперму). 2) Переносим вырезку в spin-basket, центрифугируем 2 -5 мин при 3000 об/мин. Удаляем вырезку и spin-basket. 3) Добавляем 15 мкл магнитных частиц (частицы предварительно встряхнуть на vortex), 180 мкл изопропанола, оставляем на столе в течение 10 мин, периодически переворачивая. 4) Vortex, ставим пробирки на магнитный штатив на 30 -60 сек. Удаляем супернатант, добавляем 300 мкл Wash buffer, на магнитный штатив. Удаляем супернатант. 5) Действия п. 4 повторяем еще 2 раза. 6) Высушиваем магнитные частицы в течение 7 мин на магнитном штативе. 7) Добавляем 50 мкл Elution buffer, vortex. 8) Термостатируем 5 мин при 70 0 С 9) Vortex, ставим пробирку на магнитный штатив, переносим в чистую подписанную пробирку супернатант, содержащий ДНК. Примечание: если вырезка большая, то в п. 1 добавляем 500 мкл Lysis buffer + 5 мкл DTT, а в п. 3 добавляем 300 мкл изопропанола
 FTA card Образец наносится на карту и высушивается. Содержащиеся на карте вещества лизируют клетки, денатурируют белки, инактивируют нуклеазы, связывают и стабилизируют ДНК. Из карты вырезается диск (перфорат) диаметром 1, 2 -1, 5 мм, промывается и напрямую используется для амплификации.
FTA card Образец наносится на карту и высушивается. Содержащиеся на карте вещества лизируют клетки, денатурируют белки, инактивируют нуклеазы, связывают и стабилизируют ДНК. Из карты вырезается диск (перфорат) диаметром 1, 2 -1, 5 мм, промывается и напрямую используется для амплификации.
 Электронная микрофотография, показывающая ДНК, захваченную в пределах матрицы FTA
Электронная микрофотография, показывающая ДНК, захваченную в пределах матрицы FTA
 FTA card Преимущества: - безопасность; - ДНК стабильна несколько лет при комнатной температуре (лиофилизациея реакционной смеси); - возможность автоматизации; - амплификация непосредственно с перфората. Недостатки: - дороговизна; - пригодность только для жидких образцов; - невозможность определения концентрации; - необходимость корректировки программы амплификации.
FTA card Преимущества: - безопасность; - ДНК стабильна несколько лет при комнатной температуре (лиофилизациея реакционной смеси); - возможность автоматизации; - амплификация непосредственно с перфората. Недостатки: - дороговизна; - пригодность только для жидких образцов; - невозможность определения концентрации; - необходимость корректировки программы амплификации.

