Вводная лекция, 1гр. катионов.ppt
- Количество слайдов: 20
 ВВОДНАЯ ЛЕКЦИЯ КАТИОНЫ I АНАЛИТИЧЕСКОЙ ГРУППЫ
ВВОДНАЯ ЛЕКЦИЯ КАТИОНЫ I АНАЛИТИЧЕСКОЙ ГРУППЫ
 Условия выполнения и чувствительность аналитических реакций минимальная (предельная) концентрация (Сmin ) где V – объем растворителя (см 3), в котором содержится 1 г исследуемых ионов или вещества;
Условия выполнения и чувствительность аналитических реакций минимальная (предельная) концентрация (Сmin ) где V – объем растворителя (см 3), в котором содержится 1 г исследуемых ионов или вещества;
 Условия выполнения и чувствительность аналитических реакций предельное разбавление (W) – величина, обратная минимальной концентрации; открываемый минимум (m) – наименьшая масса вещества, которая может быть определена с помощью данной реакции в минимальном объеме раствора.
Условия выполнения и чувствительность аналитических реакций предельное разбавление (W) – величина, обратная минимальной концентрации; открываемый минимум (m) – наименьшая масса вещества, которая может быть определена с помощью данной реакции в минимальном объеме раствора.
 Условия выполнения и чувствительность аналитических реакций
Условия выполнения и чувствительность аналитических реакций
 Условия выполнения и чувствительность аналитических реакций
Условия выполнения и чувствительность аналитических реакций
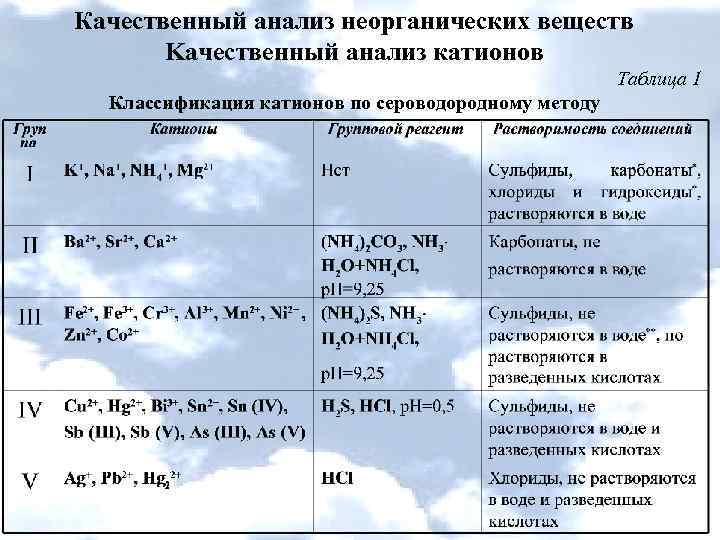 Качественный анализ неорганических веществ Kачественный анализ катионов Таблица 1 Классификация катионов по сероводородному методу
Качественный анализ неорганических веществ Kачественный анализ катионов Таблица 1 Классификация катионов по сероводородному методу
 Качественный анализ неорганических веществ Kачественный анализ катионов Таблица Классификация катионов по аммиачно-фосфатному методу 2
Качественный анализ неорганических веществ Kачественный анализ катионов Таблица Классификация катионов по аммиачно-фосфатному методу 2
 Качественный анализ неорганических веществ Kачественный анализ катионов Таблица 3 Классификация катионов по кислотно-основному методу
Качественный анализ неорганических веществ Kачественный анализ катионов Таблица 3 Классификация катионов по кислотно-основному методу
 Реакции ионов калия K+ 1. Действие натрия гидротартрата Na. HC 4 H 4 O 6 Ионы калия гидротартрата: образуют белый кристаллический осадок калия KCl + Na. HC 4 H 4 O 6 KHC 4 H 4 O 6 a. Cl Обнаружение ионов калия также проводят с раствором винной кислоты в присутствия натрия ацетата и этанола (фармакопейная реакция): H 2 C 4 H 4 O 6 +CH 3 COONa Na. HC 4 H 4 O 6 +CH 3 COOH Осадок растворим в растворах минеральных кислот и щелочей: KHC 4 H 4 O 6 + HCl KCl + H 2 C 4 H 4 O 6 KHC 4 H 4 O 6 + 2 Na. OH KOH + Na 2 C 4 H 4 O 6 + H 2 O
Реакции ионов калия K+ 1. Действие натрия гидротартрата Na. HC 4 H 4 O 6 Ионы калия гидротартрата: образуют белый кристаллический осадок калия KCl + Na. HC 4 H 4 O 6 KHC 4 H 4 O 6 a. Cl Обнаружение ионов калия также проводят с раствором винной кислоты в присутствия натрия ацетата и этанола (фармакопейная реакция): H 2 C 4 H 4 O 6 +CH 3 COONa Na. HC 4 H 4 O 6 +CH 3 COOH Осадок растворим в растворах минеральных кислот и щелочей: KHC 4 H 4 O 6 + HCl KCl + H 2 C 4 H 4 O 6 KHC 4 H 4 O 6 + 2 Na. OH KOH + Na 2 C 4 H 4 O 6 + H 2 O
 Реакции катионов I аналитической группы Реакции ионов калия K+ 2. Действие натрия гексанитрокобальтата (III) Na 3[Co(NO 2)6] Ионы калия образуют желтый кристаллический осадок калия натрия гексанитрокобальтата (III): 2 KCl +Na 3[Co(NO 2)6] K 2 Na[Co(NO 2)6] a. Cl Осадок растворим в минеральных кислотах с образованием нестойкой кислоты H 3[Co(NO 2)6] при p. Н < 4: K 2 Na[Co(NO 2)6] + 3 HСl → 2 KСl + Na. Сl + H 3[Co(NO 2)6]
Реакции катионов I аналитической группы Реакции ионов калия K+ 2. Действие натрия гексанитрокобальтата (III) Na 3[Co(NO 2)6] Ионы калия образуют желтый кристаллический осадок калия натрия гексанитрокобальтата (III): 2 KCl +Na 3[Co(NO 2)6] K 2 Na[Co(NO 2)6] a. Cl Осадок растворим в минеральных кислотах с образованием нестойкой кислоты H 3[Co(NO 2)6] при p. Н < 4: K 2 Na[Co(NO 2)6] + 3 HСl → 2 KСl + Na. Сl + H 3[Co(NO 2)6]
 Реакции катионов I аналитической группы Реакции ионов калия K+ 2. Действие натрия гексанитрокобальтата (III) Na 3[Co(NO 2)6] Щелочи разлагают реагент с образованием бурого осадка Co(OH)3 : Na 3[Co(NO 2)6 + 3 Na. OH Co(OH)3 + 6 Na. NO 2 Ионы аммония мешают обнаружению ионов калия, так как они тоже образуют аналогичный осадок.
Реакции катионов I аналитической группы Реакции ионов калия K+ 2. Действие натрия гексанитрокобальтата (III) Na 3[Co(NO 2)6] Щелочи разлагают реагент с образованием бурого осадка Co(OH)3 : Na 3[Co(NO 2)6 + 3 Na. OH Co(OH)3 + 6 Na. NO 2 Ионы аммония мешают обнаружению ионов калия, так как они тоже образуют аналогичный осадок.
 Реакции катионов I аналитической группы Реакции ионов калия K+ 3. Микрокристаллоскопическая реакция с натрия свинца гексанитрокупратом (II) Na 2 Pb[Cu(NO 2)6] Ионы калия в нейтральной среде образуют с Na 2 Pb[Cu(NO 2)6] черный осадок калия свинца гексанитрокупрата (II): 2 KCl +Na 2 Pb[Cu(NO 2)6] K 2 Pb[Cu(NO 2)6] 2 Na. Cl Ионы аммония мешают определению ионов калия, так как они тоже образуют аналогичный осадок.
Реакции катионов I аналитической группы Реакции ионов калия K+ 3. Микрокристаллоскопическая реакция с натрия свинца гексанитрокупратом (II) Na 2 Pb[Cu(NO 2)6] Ионы калия в нейтральной среде образуют с Na 2 Pb[Cu(NO 2)6] черный осадок калия свинца гексанитрокупрата (II): 2 KCl +Na 2 Pb[Cu(NO 2)6] K 2 Pb[Cu(NO 2)6] 2 Na. Cl Ионы аммония мешают определению ионов калия, так как они тоже образуют аналогичный осадок.
 Реакции катионов I аналитической группы Реакции ионов натрия Na+ 1. Действие калия гексагидроксостибата (V) K[Sb(OH)6] Концентрированные растворы солей натрия образуют белый кристаллический осадок натрия гексагидроксостибата: Na. Cl + K[Sb(OH)6] Na[Sb(OH)6] KCl Образованию осадка Na[Sb(OH)6] способствует охлаждение раствора и потирание стеклянной палочкой внутренней стенки пробирки. В сильнощелочной среде осадок не образуется.
Реакции катионов I аналитической группы Реакции ионов натрия Na+ 1. Действие калия гексагидроксостибата (V) K[Sb(OH)6] Концентрированные растворы солей натрия образуют белый кристаллический осадок натрия гексагидроксостибата: Na. Cl + K[Sb(OH)6] Na[Sb(OH)6] KCl Образованию осадка Na[Sb(OH)6] способствует охлаждение раствора и потирание стеклянной палочкой внутренней стенки пробирки. В сильнощелочной среде осадок не образуется.
 Реакции катионов I аналитической группы Реакции ионов натрия Na+ 1. Действие калия гексагидроксостибата (V) K[Sb(OH)6] В кислой среде реагент разлагается с образованием белого аморфного осадка метасурьмяной кислоты HSb. O 3 : K[Sb(OH)6] + HCl →H[Sb(OH)6] + KСl H[Sb(OH)6] HSb. O 3 + 3 H 2 O, который по ошибке может быть принят за осадок натрия гексагидроксостибата.
Реакции катионов I аналитической группы Реакции ионов натрия Na+ 1. Действие калия гексагидроксостибата (V) K[Sb(OH)6] В кислой среде реагент разлагается с образованием белого аморфного осадка метасурьмяной кислоты HSb. O 3 : K[Sb(OH)6] + HCl →H[Sb(OH)6] + KСl H[Sb(OH)6] HSb. O 3 + 3 H 2 O, который по ошибке может быть принят за осадок натрия гексагидроксостибата.
 Реакции катионов I аналитической группы Реакции ионов натрия Na+ 2. Действие цинкуранилацетата Zn(UO 2)3(CH 3 COO)8 (фармакопейная реакция) Ионы натрия в нейтральных или уксуснокислых растворах образуют желтый кристаллический осадок натрия цинкуранилацетата: Na. Cl +Zn(UO 2)3(СH 3 COO)8 +СН 3 СООН +9 H 2 O
Реакции катионов I аналитической группы Реакции ионов натрия Na+ 2. Действие цинкуранилацетата Zn(UO 2)3(CH 3 COO)8 (фармакопейная реакция) Ионы натрия в нейтральных или уксуснокислых растворах образуют желтый кристаллический осадок натрия цинкуранилацетата: Na. Cl +Zn(UO 2)3(СH 3 COO)8 +СН 3 СООН +9 H 2 O
 Реакции катионов I аналитической группы Реакции ионов аммония NH + 4 1. Действие щелочей (фармакопейная реакция) Ионы аммония реагируют с растворами щелочей (Na. OH и KOH) при нагревании с выделением аммиака: NH 4 Cl + Na. OH NH 3 Н 2 O + Na. Cl NH 3 + H 2 O
Реакции катионов I аналитической группы Реакции ионов аммония NH + 4 1. Действие щелочей (фармакопейная реакция) Ионы аммония реагируют с растворами щелочей (Na. OH и KOH) при нагревании с выделением аммиака: NH 4 Cl + Na. OH NH 3 Н 2 O + Na. Cl NH 3 + H 2 O
 Реакции катионов I аналитической группы Реакции ионов аммония NH + 4 2. Действие реактива Несслера K 2[Hg. I 4] + КОН Ионы аммония с реактивом Несслера (K 2[Hg. I 4] + КОН) образуют красно-бурый или желто-бурый (при небольших концентрациях иона аммония) аморфный осадок амидного комплекса ртути (II): Hg NH Cl + 2 K [Hg. I ] + 4 KOH → [O NH ]I↓ + 7 KI + KCl + 3 H O 4 2 2 Hg
Реакции катионов I аналитической группы Реакции ионов аммония NH + 4 2. Действие реактива Несслера K 2[Hg. I 4] + КОН Ионы аммония с реактивом Несслера (K 2[Hg. I 4] + КОН) образуют красно-бурый или желто-бурый (при небольших концентрациях иона аммония) аморфный осадок амидного комплекса ртути (II): Hg NH Cl + 2 K [Hg. I ] + 4 KOH → [O NH ]I↓ + 7 KI + KCl + 3 H O 4 2 2 Hg
 Реакции катионов I аналитической группы Реакции ионов аммония NH + 4 3. Действие калия гексагидроксостибата (V) K[Sb(OH)6] Водные растворы солей, образованные катионами аммония и анионами сильных кислот, вследствие гидролиза имеют р. Н меньше 7, что приводит к разрушению реагента и образованию белого осадка HSb. O 3 : NH 4+ + H 2 O H+ + NH 3 Н 2 O [Sb(OH)6]- + H+ Н[Sb(OH)6] HSb. O 3 + 3 Н 2 О Поэтому ионы аммония мешают определению ионов натрия с этим реагентом.
Реакции катионов I аналитической группы Реакции ионов аммония NH + 4 3. Действие калия гексагидроксостибата (V) K[Sb(OH)6] Водные растворы солей, образованные катионами аммония и анионами сильных кислот, вследствие гидролиза имеют р. Н меньше 7, что приводит к разрушению реагента и образованию белого осадка HSb. O 3 : NH 4+ + H 2 O H+ + NH 3 Н 2 O [Sb(OH)6]- + H+ Н[Sb(OH)6] HSb. O 3 + 3 Н 2 О Поэтому ионы аммония мешают определению ионов натрия с этим реагентом.
 Реакции катионов I аналитической группы Реакции ионов аммония NH + 4 4. Отношение солей аммония к нагреванию Соли аммония при высокой температуре разлагаются. В зависимости от природы аниона различают несколько типов их термического разложения. Соли летучих кислот при нагревании разлагаются полностью: NH 4 Cl NH 3 + HCl Соли нелетучих кислот разлагаются частично: (NH 4)2 SO 4 NH 3 + NH 4 HSO 4
Реакции катионов I аналитической группы Реакции ионов аммония NH + 4 4. Отношение солей аммония к нагреванию Соли аммония при высокой температуре разлагаются. В зависимости от природы аниона различают несколько типов их термического разложения. Соли летучих кислот при нагревании разлагаются полностью: NH 4 Cl NH 3 + HCl Соли нелетучих кислот разлагаются частично: (NH 4)2 SO 4 NH 3 + NH 4 HSO 4
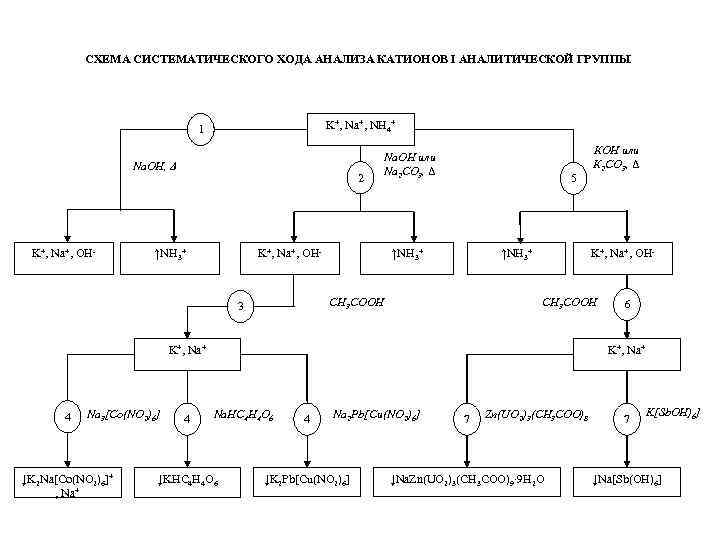 СХЕМА СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА КАТИОНОВ І АНАЛИТИЧЕСКОЙ ГРУППЫ K+, Na+, NH 4+ 1 Na. OH, Δ K+, Na+, OH- 2 ↑NH 3+ Na. OH или Na 2 CO 3, Δ K+, Na+, OH- 5 ↑NH 3+ CH 3 COOH 3 K+, Na+, OH- CH 3 COOH K+, Na+ 4 Na 3[Co(NO 2)6] ↓K 2 Na[Co(NO 2)6]+ , Na+ 4 КOH или К 2 CO 3, Δ 6 K+, Na+ Na. HC 4 H 4 O 6 ↓KHC 4 H 4 O 6 4 Na 2 Pb[Cu(NO 2)6] ↓K 2 Pb[Cu(NO 2)6] 7 Zn(UO 2)3(CH 3 COO)8 ↓Na. Zn(UO 2)3(CH 3 COO)9∙ 9 H 2 O 7 K[Sb. OH)6] ↓Na[Sb(OH)6]
СХЕМА СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА КАТИОНОВ І АНАЛИТИЧЕСКОЙ ГРУППЫ K+, Na+, NH 4+ 1 Na. OH, Δ K+, Na+, OH- 2 ↑NH 3+ Na. OH или Na 2 CO 3, Δ K+, Na+, OH- 5 ↑NH 3+ CH 3 COOH 3 K+, Na+, OH- CH 3 COOH K+, Na+ 4 Na 3[Co(NO 2)6] ↓K 2 Na[Co(NO 2)6]+ , Na+ 4 КOH или К 2 CO 3, Δ 6 K+, Na+ Na. HC 4 H 4 O 6 ↓KHC 4 H 4 O 6 4 Na 2 Pb[Cu(NO 2)6] ↓K 2 Pb[Cu(NO 2)6] 7 Zn(UO 2)3(CH 3 COO)8 ↓Na. Zn(UO 2)3(CH 3 COO)9∙ 9 H 2 O 7 K[Sb. OH)6] ↓Na[Sb(OH)6]


