374165.ppt
- Количество слайдов: 12

 Введение. Впервые разрешение на Своим появлением на производство свет серная кислота серной кислоты и обязана арабскому "духа купоросного", т. е. серного алхимику Джабиру ибн ангидрида, было Хайяну (Геберу), дано Петром I в жившему в VIII–IX вв. До 1718 г. XIV в. Первые заводы по Пирит в природе под производству действием кислорода и воды постепенно квасцов были окисляется и построены образует сульфаты на Руси в двух- и XVIII веке. Установка для получения серной кислоты трехвалентного сжиганием серы в присутствии селитры, XVIII в. : железа и серную 1 – печь, разогреваемая углями; 2 – стеклянный сосуд, кислоту где образующиеся газы взаимодействуют с парами воды; 3 – колбы, в которые собирают олеум Из сернокислого железа В конце XVIII в. готовили чернила, отдельные заводы использовали его при изготовляли в год по 1 крашении тканей, в 2 т. иконописи, при золочении, обработке Первое современное кожи и в медицине. промышленное производство серной На Руси серная кислота кислоты "контактным появилась в XVII в. методом" было создано в России на Она производилась Тентелевском для нужд аптек и химическом заводе в алхимических Санкт-Петербурге в 1903 году лабораторий.
Введение. Впервые разрешение на Своим появлением на производство свет серная кислота серной кислоты и обязана арабскому "духа купоросного", т. е. серного алхимику Джабиру ибн ангидрида, было Хайяну (Геберу), дано Петром I в жившему в VIII–IX вв. До 1718 г. XIV в. Первые заводы по Пирит в природе под производству действием кислорода и воды постепенно квасцов были окисляется и построены образует сульфаты на Руси в двух- и XVIII веке. Установка для получения серной кислоты трехвалентного сжиганием серы в присутствии селитры, XVIII в. : железа и серную 1 – печь, разогреваемая углями; 2 – стеклянный сосуд, кислоту где образующиеся газы взаимодействуют с парами воды; 3 – колбы, в которые собирают олеум Из сернокислого железа В конце XVIII в. готовили чернила, отдельные заводы использовали его при изготовляли в год по 1 крашении тканей, в 2 т. иконописи, при золочении, обработке Первое современное кожи и в медицине. промышленное производство серной На Руси серная кислота кислоты "контактным появилась в XVII в. методом" было создано в России на Она производилась Тентелевском для нужд аптек и химическом заводе в алхимических Санкт-Петербурге в 1903 году лабораторий.
 Физические свойства. • бесцветная маслянистая жидкость, застывающая в кристаллическую массу при +10 °С. • серная кислота имеет обычно плотность 1, 84 г/см 3. • температура кипения 269, 2ºС. Строение моногидрата • температура плавления моногидрата равна 10, 37 °С
Физические свойства. • бесцветная маслянистая жидкость, застывающая в кристаллическую массу при +10 °С. • серная кислота имеет обычно плотность 1, 84 г/см 3. • температура кипения 269, 2ºС. Строение моногидрата • температура плавления моногидрата равна 10, 37 °С
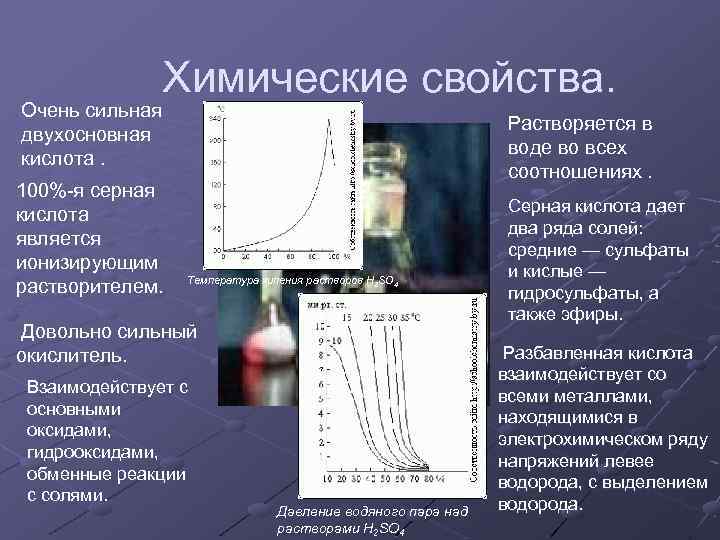 Химические свойства. Очень сильная двухосновная кислота. 100%-я серная кислота является ионизирующим растворителем. Растворяется в воде во всех соотношениях. Температура кипения растворов H 2 SO 4 Довольно сильный окислитель. Взаимодействует с основными оксидами, гидрооксидами, обменные реакции с солями. Давление водяного пара над растворами H 2 SO 4 Серная кислота дает два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Разбавленная кислота взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода, с выделением водорода.
Химические свойства. Очень сильная двухосновная кислота. 100%-я серная кислота является ионизирующим растворителем. Растворяется в воде во всех соотношениях. Температура кипения растворов H 2 SO 4 Довольно сильный окислитель. Взаимодействует с основными оксидами, гидрооксидами, обменные реакции с солями. Давление водяного пара над растворами H 2 SO 4 Серная кислота дает два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Разбавленная кислота взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода, с выделением водорода.
 Взаимодействия серной кислоты. 1. Взаимодействие с металлами. 3. Взаимодействие с 2. Взаимодействия с основными оксидами и неметаллами. основаниями. H 2 SO 4 образует два типа солей: средние соли – сульфаты и кислые соли – гидросульфаты. Cu. O + H 2 SO 4 = Cu. SO 4 + H 2 O сульфат меди 2 КОН+Н 2 SO 4 = K 2 SO 4+2 H 2 O сульфат калия КОН+Н 2 SO 4 = KHSO 4+H 2 O гидросульфат калия Al 2 O 3+3 H 2 SO 4 = Al 2(SO 4)3+3 Н 2 О сульфат алюминия Может окислять неметаллы, например: S+2 H 2 SO 4=3 SO 2+2 H 2 O Может проявляться как восстановитель: 2 KBr+2 H 2 SO 4=Br 2+SO 2+K 2 SO 4+2 H 2 O
Взаимодействия серной кислоты. 1. Взаимодействие с металлами. 3. Взаимодействие с 2. Взаимодействия с основными оксидами и неметаллами. основаниями. H 2 SO 4 образует два типа солей: средние соли – сульфаты и кислые соли – гидросульфаты. Cu. O + H 2 SO 4 = Cu. SO 4 + H 2 O сульфат меди 2 КОН+Н 2 SO 4 = K 2 SO 4+2 H 2 O сульфат калия КОН+Н 2 SO 4 = KHSO 4+H 2 O гидросульфат калия Al 2 O 3+3 H 2 SO 4 = Al 2(SO 4)3+3 Н 2 О сульфат алюминия Может окислять неметаллы, например: S+2 H 2 SO 4=3 SO 2+2 H 2 O Может проявляться как восстановитель: 2 KBr+2 H 2 SO 4=Br 2+SO 2+K 2 SO 4+2 H 2 O
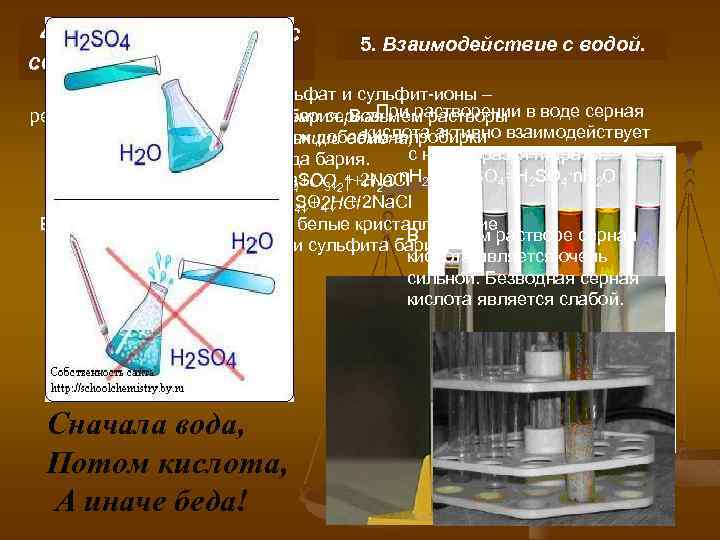 4. Взаимодействие с солями. 5. Взаимодействие с водой. Качественная реакция на сульфат и сульфит-ионы – При растворении в воде серная реакция с растворимой солью бария. Возьмем растворы С некоторыми солями серная кислота активно взаимодействует сульфата и сульфита натрия и добавим в пробирки кислота вступает в реакции обмена, с ней, образуя гидраты: раствор хлорида бария. например: Ba. Cl 2 + Na 4 = Ca. SO 4+СО 2↑+Н 2 О n. H Са. СО 3+Н 2 SO 3 = Ba. SO 3↓ + 2 Na. Cl 2 O+H 2 SO 4=H 2 SO 4·n. H 2 O Ba. Cl 2 + Na 2 SO 4 = Ba. SO 4↓ + 2 Na. Cl КСl 2+H 2 SO 4 = КSO 4↓+2 HCl В двух пробирках появляются белые кристаллические В водном растворе серная осадки сульфата бария и сульфита бария. кислота является очень сильной. Безводная серная кислота является слабой. Сначала вода, Потом кислота, А иначе беда!
4. Взаимодействие с солями. 5. Взаимодействие с водой. Качественная реакция на сульфат и сульфит-ионы – При растворении в воде серная реакция с растворимой солью бария. Возьмем растворы С некоторыми солями серная кислота активно взаимодействует сульфата и сульфита натрия и добавим в пробирки кислота вступает в реакции обмена, с ней, образуя гидраты: раствор хлорида бария. например: Ba. Cl 2 + Na 4 = Ca. SO 4+СО 2↑+Н 2 О n. H Са. СО 3+Н 2 SO 3 = Ba. SO 3↓ + 2 Na. Cl 2 O+H 2 SO 4=H 2 SO 4·n. H 2 O Ba. Cl 2 + Na 2 SO 4 = Ba. SO 4↓ + 2 Na. Cl КСl 2+H 2 SO 4 = КSO 4↓+2 HCl В двух пробирках появляются белые кристаллические В водном растворе серная осадки сульфата бария и сульфита бария. кислота является очень сильной. Безводная серная кислота является слабой. Сначала вода, Потом кислота, А иначе беда!
 Гигроскопичность серной кислоты. • Концентрированная серная кислота жадно набирает воду отовсюду и способна для этого даже разрушать молекулы. Древесина состоит из множества органических веществ, среди которых – целлюлоза (C 6 H 7 O 2(OH)3)n. Концентрированная серная кислота разрушает органические молекулы, отнимая водород и кислород – составляющие воды. Разрушение органических молекул сопровождается выделением свободного углерода. Поэтому лучинка при соприкосновении с концентрированной серной кислотой чернеет, обугливается. Кислота ведет себя, как обезвоживающий агент. Если поставить открытую емкость концентрированной серной кислотой в помещении, через некоторое время объем жидкости заметно увеличится: кислота будет притягивать влагу из воздуха. Взаимодействие серной кислоты с органическими веществами. • Возьмем сахар – это органическое вещество сахароза. C 12 H 22 O 11. Молекула сахарозы состоит из атомов углерода, водорода и кислорода. Добавим в сахарную пудру воды и прильем концентрированную серную кислоту. Через несколько секунд начинается бурная реакция. Выделяется уголь и газы: сернистый SO 2 и углекислый CO 2. Газы вспучивают смесь, и она поднимается в стакане. Кислота ведет себя, как дегидратирующий агент – вещество, отбирающее воду из соединений, и как окислитель.
Гигроскопичность серной кислоты. • Концентрированная серная кислота жадно набирает воду отовсюду и способна для этого даже разрушать молекулы. Древесина состоит из множества органических веществ, среди которых – целлюлоза (C 6 H 7 O 2(OH)3)n. Концентрированная серная кислота разрушает органические молекулы, отнимая водород и кислород – составляющие воды. Разрушение органических молекул сопровождается выделением свободного углерода. Поэтому лучинка при соприкосновении с концентрированной серной кислотой чернеет, обугливается. Кислота ведет себя, как обезвоживающий агент. Если поставить открытую емкость концентрированной серной кислотой в помещении, через некоторое время объем жидкости заметно увеличится: кислота будет притягивать влагу из воздуха. Взаимодействие серной кислоты с органическими веществами. • Возьмем сахар – это органическое вещество сахароза. C 12 H 22 O 11. Молекула сахарозы состоит из атомов углерода, водорода и кислорода. Добавим в сахарную пудру воды и прильем концентрированную серную кислоту. Через несколько секунд начинается бурная реакция. Выделяется уголь и газы: сернистый SO 2 и углекислый CO 2. Газы вспучивают смесь, и она поднимается в стакане. Кислота ведет себя, как дегидратирующий агент – вещество, отбирающее воду из соединений, и как окислитель.
 Производство серной кислоты. 1 -я стадия. Печь для обжига колчедана. Получение оксида серы II : 4 Fe. S 2 + 11 O 2 --> 2 Fe 2 O 3 + 8 SO 2 + Q 2 -я стадия. Получение серного ангидрида (450°С - 500°С; катализатор V 2 O 5): 2 SO 2 + O 2 <--> 2 SO 3 3 -я стадия. Поглотительная башня: Получение олеума n. SO 3 + H 2 SO 4(конц) --> (H 2 SO 4 · n. SO 3)(олеум)
Производство серной кислоты. 1 -я стадия. Печь для обжига колчедана. Получение оксида серы II : 4 Fe. S 2 + 11 O 2 --> 2 Fe 2 O 3 + 8 SO 2 + Q 2 -я стадия. Получение серного ангидрида (450°С - 500°С; катализатор V 2 O 5): 2 SO 2 + O 2 <--> 2 SO 3 3 -я стадия. Поглотительная башня: Получение олеума n. SO 3 + H 2 SO 4(конц) --> (H 2 SO 4 · n. SO 3)(олеум)
 Сорта серной кислоты. Токсическое действие. Серная кислота и олеум — чрезвычайно агрессивные вещества, поражают - Серную кислоту выпускают дыхательные пути, кожу, слизистые нескольких сортов. Они оболочки, вызывают затруднение дыхания, отличаются концентрацией и кашель. количеством примесей. Поражающая концентрация паров серной кислоты 0, 008 мг/л (экспозиция 60 мин), смертельная 0, 18 мг/л (60 мин). Сорта: - купоросное масло - 92, 2 - 92, 5% чистой кислоты - аккумуляторная кислота - 91 -92% чистой кислоты - для особых целей выпускают олеум - 60%
Сорта серной кислоты. Токсическое действие. Серная кислота и олеум — чрезвычайно агрессивные вещества, поражают - Серную кислоту выпускают дыхательные пути, кожу, слизистые нескольких сортов. Они оболочки, вызывают затруднение дыхания, отличаются концентрацией и кашель. количеством примесей. Поражающая концентрация паров серной кислоты 0, 008 мг/л (экспозиция 60 мин), смертельная 0, 18 мг/л (60 мин). Сорта: - купоросное масло - 92, 2 - 92, 5% чистой кислоты - аккумуляторная кислота - 91 -92% чистой кислоты - для особых целей выпускают олеум - 60%
 Дополнительные сведения. Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому после особо сильных вулканических извержений могут произойти значительные изменения климата. Адское озеро. Это место без преувеличения можно назвать адским - здесь, в кратере вулкана Иджен на острове Ява, расположено большое горячее озеро серной кислоты, по берегам которого местные жители в нечеловеческих условиях добывают серу. Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 г. ) повышенная концентрация Носильщики серы набивают по 70 - 80 кг пыли в атмосфере держалась около 2 сырья в специальные корзины, неся их в лет, а характерные серебристые одну ходку. Дневная зарплата работника - облака серной кислоты наблюдались около 5 долларов. Средняя даже в Париже. Взрыв вулкана Пинатубо в 1991 году, отправивший в продолжительность жизни индонезийского атмосферу 3· 107 тонн серы, привёл к добытчика серы составляет 30 лет. . . тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994.
Дополнительные сведения. Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому после особо сильных вулканических извержений могут произойти значительные изменения климата. Адское озеро. Это место без преувеличения можно назвать адским - здесь, в кратере вулкана Иджен на острове Ява, расположено большое горячее озеро серной кислоты, по берегам которого местные жители в нечеловеческих условиях добывают серу. Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 г. ) повышенная концентрация Носильщики серы набивают по 70 - 80 кг пыли в атмосфере держалась около 2 сырья в специальные корзины, неся их в лет, а характерные серебристые одну ходку. Дневная зарплата работника - облака серной кислоты наблюдались около 5 долларов. Средняя даже в Париже. Взрыв вулкана Пинатубо в 1991 году, отправивший в продолжительность жизни индонезийского атмосферу 3· 107 тонн серы, привёл к добытчика серы составляет 30 лет. . . тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994.
 Заключение. Серная кислота – важнейший продукт химической промышленности. Серную кислоту применяют: - в производстве минеральных удобрений; - как электролит в свинцовых аккумуляторах; - в металлургии прокате стали; - для получения различных минеральных кислот и солей; - в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ; - в текстильной, кожевенной отраслях промышленности; - в металлообрабатывающей промышленности; - используется как осушитель воздуха; - в нефтяной промышленности; -в пищевой промышленности; - в промышленном органическом синтезе в реакциях.
Заключение. Серная кислота – важнейший продукт химической промышленности. Серную кислоту применяют: - в производстве минеральных удобрений; - как электролит в свинцовых аккумуляторах; - в металлургии прокате стали; - для получения различных минеральных кислот и солей; - в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ; - в текстильной, кожевенной отраслях промышленности; - в металлообрабатывающей промышленности; - используется как осушитель воздуха; - в нефтяной промышленности; -в пищевой промышленности; - в промышленном органическом синтезе в реакциях.
 Тест. 1. Формула серной кислоты: а. H 2 SO 3 б. H 2 S в. H 2 SO 4 г. SO 3 2. Лакмус в растворе серной кислоты: а. красный б. синий в. фиолетовый г. малиновый 3. Свойство, характерное для серы: а. хорошо растворима в воде б. имеет металлический блеск в. твёрдое вещество жёлтого цвета г. проводит электрический ток 4. Пара ионов, которая может одновременно находиться в растворе: а. H+ и Si. O 2 - б. Cu 2+ и OH- в. H+ и SO 2 -4 г. Ag+ и Cl- 5. Пирит имеет формулу: а. Na 2 SO 4*10 H 2 O б. Fe. S в. Fe. S 2 г. Na 2 S 6. Раствор SO 3 в 100%-ной серной кислоте называют: а. царской водкой б. плавиковой кислотой в. олеумом г. олеиновой кислотой 7. Разбавленная серная кислота реагирует с а. Zn б. H 2 O в. Cu г. P 2 O 5 8. Качественная реакция на сульфат-ионы: а. SO 42 - + 2 H+= SO 3↓+ H 2 O б. Ba 2+ + SO 42 - = Ba. SO 4↓ в. Ba 2+ + SO 32 - = Ba. SO 3↓ г. 2 NH 4++ SO 42 - = 2 NH 3↑ + H 2 SO 4
Тест. 1. Формула серной кислоты: а. H 2 SO 3 б. H 2 S в. H 2 SO 4 г. SO 3 2. Лакмус в растворе серной кислоты: а. красный б. синий в. фиолетовый г. малиновый 3. Свойство, характерное для серы: а. хорошо растворима в воде б. имеет металлический блеск в. твёрдое вещество жёлтого цвета г. проводит электрический ток 4. Пара ионов, которая может одновременно находиться в растворе: а. H+ и Si. O 2 - б. Cu 2+ и OH- в. H+ и SO 2 -4 г. Ag+ и Cl- 5. Пирит имеет формулу: а. Na 2 SO 4*10 H 2 O б. Fe. S в. Fe. S 2 г. Na 2 S 6. Раствор SO 3 в 100%-ной серной кислоте называют: а. царской водкой б. плавиковой кислотой в. олеумом г. олеиновой кислотой 7. Разбавленная серная кислота реагирует с а. Zn б. H 2 O в. Cu г. P 2 O 5 8. Качественная реакция на сульфат-ионы: а. SO 42 - + 2 H+= SO 3↓+ H 2 O б. Ba 2+ + SO 42 - = Ba. SO 4↓ в. Ba 2+ + SO 32 - = Ba. SO 3↓ г. 2 NH 4++ SO 42 - = 2 NH 3↑ + H 2 SO 4


