 Введение в химию
Введение в химию
 Химия – это наука, изучающая процессы превращения веществ, сопровождающиеся изменением их структуры и состава.
Химия – это наука, изучающая процессы превращения веществ, сопровождающиеся изменением их структуры и состава.
 Тело • материальный объект, имеющий массу, объём и отделенный от других тел границей раздела • (кусочек мела) • совокупность атомов или молекул, находящихся в определенном агрегатном состоянии Вещество • (мел Ca. CO 3) • мельчайшая частица вещества, которая сохраняет его химические свойства Молекула • (1 частица - молекула Ca. CO 3) Атом • наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств • (Ca, или C, или O)
Тело • материальный объект, имеющий массу, объём и отделенный от других тел границей раздела • (кусочек мела) • совокупность атомов или молекул, находящихся в определенном агрегатном состоянии Вещество • (мел Ca. CO 3) • мельчайшая частица вещества, которая сохраняет его химические свойства Молекула • (1 частица - молекула Ca. CO 3) Атом • наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств • (Ca, или C, или O)
 Вещества Простые Сложны е Вещества, которые образованы атомами только одного химического элемента Вещества, которые образованы атомами разных химических элементов
Вещества Простые Сложны е Вещества, которые образованы атомами только одного химического элемента Вещества, которые образованы атомами разных химических элементов
 Простые вещества Сера S Натрий Na Фосфор P Медь Cu Бром Br 2 Ртуть Hg
Простые вещества Сера S Натрий Na Фосфор P Медь Cu Бром Br 2 Ртуть Hg
 Сложные вещества Вода H 2 O Кварц Si. O 2 Бурый газ NO 2 Поваренная соль Na. Cl Цинковая обманка Zn. S
Сложные вещества Вода H 2 O Кварц Si. O 2 Бурый газ NO 2 Поваренная соль Na. Cl Цинковая обманка Zn. S
 Свойства веществ – это признаки, по которым одни вещества отличаются от других. Физические свойства: • агрегатное состояние • цвет • запах • вкус • растворимость в воде • теплопроводность • электропроводность • температуры плавления • температура кипения • удельный вес • плотность Химические свойства: • способность реагировать с другими веществами
Свойства веществ – это признаки, по которым одни вещества отличаются от других. Физические свойства: • агрегатное состояние • цвет • запах • вкус • растворимость в воде • теплопроводность • электропроводность • температуры плавления • температура кипения • удельный вес • плотность Химические свойства: • способность реагировать с другими веществами
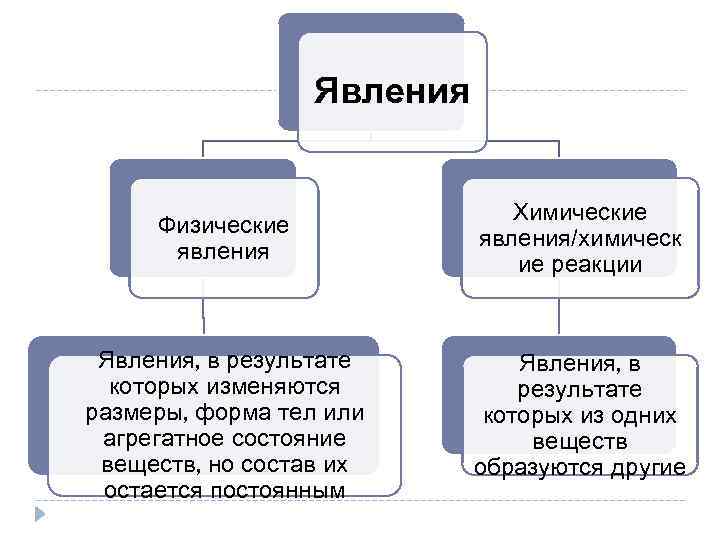 Явления Физические явления Химические явления/химическ ие реакции Явления, в результате которых изменяются размеры, форма тел или агрегатное состояние веществ, но состав их остается постоянным Явления, в результате которых из одних веществ образуются другие
Явления Физические явления Химические явления/химическ ие реакции Явления, в результате которых изменяются размеры, форма тел или агрегатное состояние веществ, но состав их остается постоянным Явления, в результате которых из одних веществ образуются другие
 Признаки химических реакций: изменение цвета выделение газа появление запаха образование осадка выделение тепла и света
Признаки химических реакций: изменение цвета выделение газа появление запаха образование осадка выделение тепла и света
 Горение древесины Плавление галлия на ладони Пожелтели листья Скисание молока Таяние льда
Горение древесины Плавление галлия на ладони Пожелтели листья Скисание молока Таяние льда
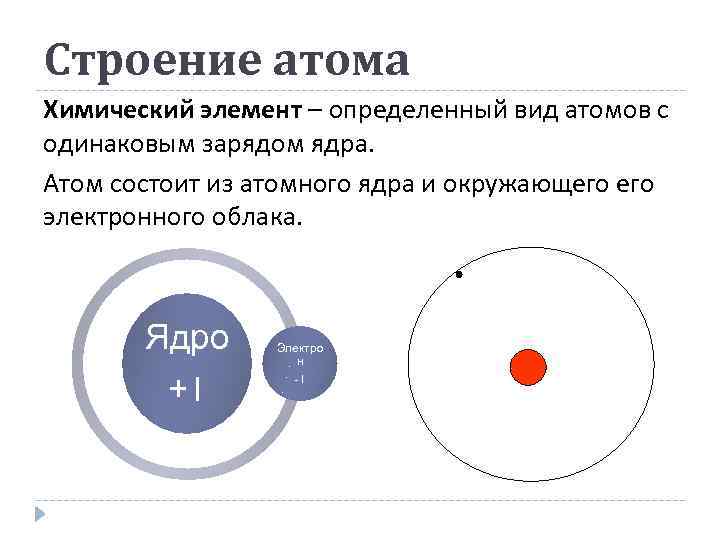 Строение атома Химический элемент – определенный вид атомов с одинаковым зарядом ядра. Атом состоит из атомного ядра и окружающего электронного облака. Ядро +1 Электро н -1
Строение атома Химический элемент – определенный вид атомов с одинаковым зарядом ядра. Атом состоит из атомного ядра и окружающего электронного облака. Ядро +1 Электро н -1
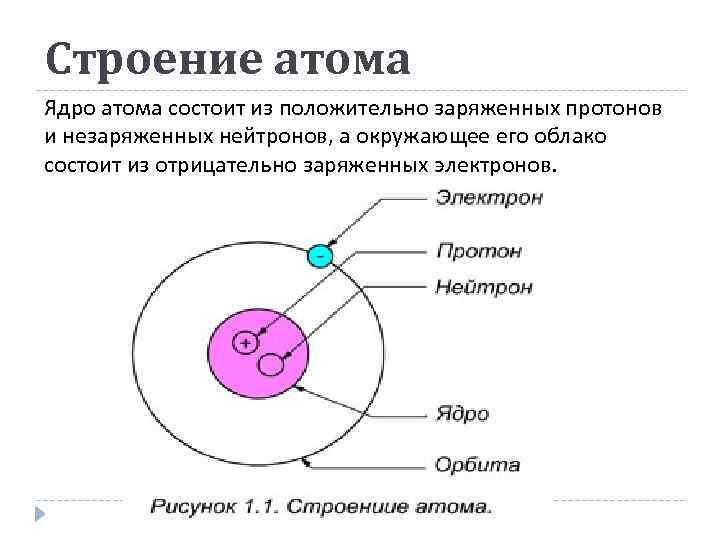 Строение атома Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов.
Строение атома Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов.
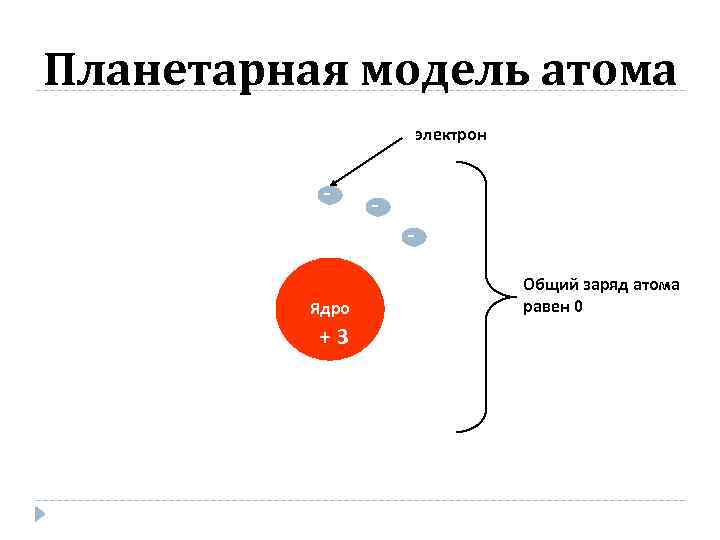 Планетарная модель атома электрон - - Ядро +3 Общий заряд атома равен 0
Планетарная модель атома электрон - - Ядро +3 Общий заряд атома равен 0
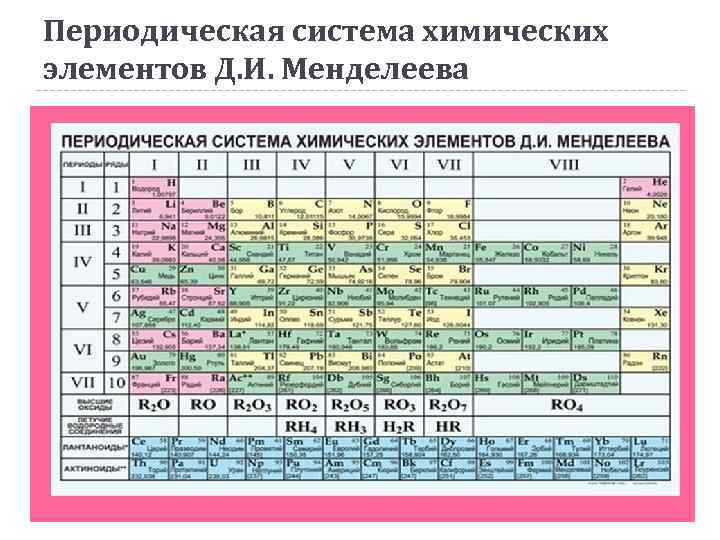 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева
 Периодическая система элементов по IUPAC
Периодическая система элементов по IUPAC
 Периодический закон Д. И. Менделеев (1869 г. ): «Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса» . Современная формулировка: свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Периодический закон Д. И. Менделеев (1869 г. ): «Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса» . Современная формулировка: свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
 Периодическая система химических элементов Д. И. Менделеева Г р у п п ы Периоды Малые периоды (1 -3) Большие периоды (47) Главные подгруппы (со стороны Н) Побочные подгруппы (с противоположной стороны от Н)
Периодическая система химических элементов Д. И. Менделеева Г р у п п ы Периоды Малые периоды (1 -3) Большие периоды (47) Главные подгруппы (со стороны Н) Побочные подгруппы (с противоположной стороны от Н)
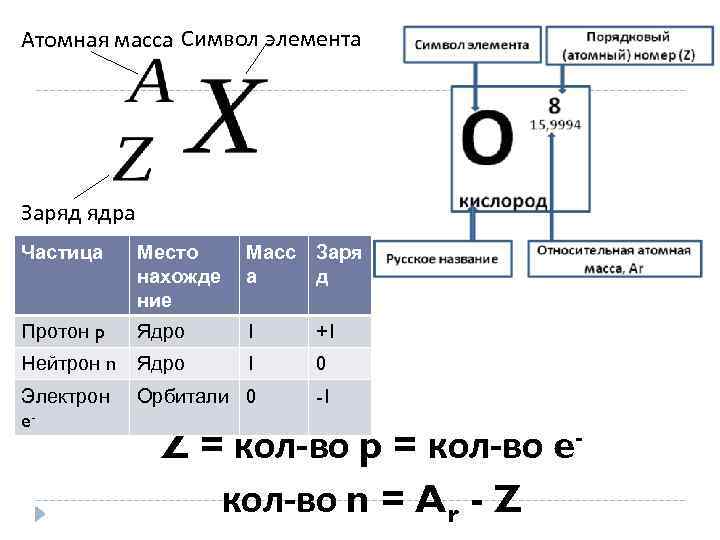 Атомная масса Символ элемента Заряд ядра Частица Место нахожде ние Масс Заря а д Протон p Ядро 1 +1 Нейтрон n Ядро 1 0 Электрон e- Орбитали 0 -1 Z = кол-во p = кол-во eкол-во n = Ar - Z
Атомная масса Символ элемента Заряд ядра Частица Место нахожде ние Масс Заря а д Протон p Ядро 1 +1 Нейтрон n Ядро 1 0 Электрон e- Орбитали 0 -1 Z = кол-во p = кол-во eкол-во n = Ar - Z
 Строение ядра Протон – масса = 1, заряд = +1 Не+2 Li +3 Аr = 1 Аr = 4 Аr = 7 +1 Нейтрон – масса = 1, заряд = 0 +1 +1 +1
Строение ядра Протон – масса = 1, заряд = +1 Не+2 Li +3 Аr = 1 Аr = 4 Аr = 7 +1 Нейтрон – масса = 1, заряд = 0 +1 +1 +1
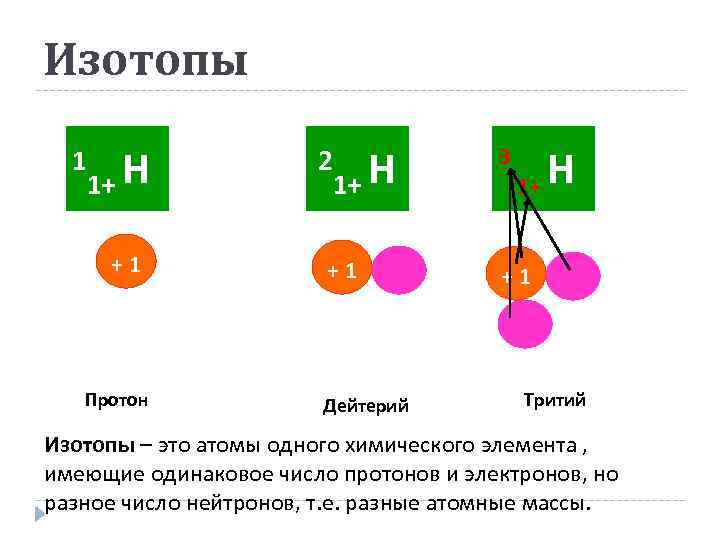 Изотопы 1 1+ Н +1 Протон 1+ Н 3 +1 +1 2 Дейтерий 1+ Н Тритий Изотопы – это атомы одного химического элемента , имеющие одинаковое число протонов и электронов, но разное число нейтронов, т. е. разные атомные массы.
Изотопы 1 1+ Н +1 Протон 1+ Н 3 +1 +1 2 Дейтерий 1+ Н Тритий Изотопы – это атомы одного химического элемента , имеющие одинаковое число протонов и электронов, но разное число нейтронов, т. е. разные атомные массы.
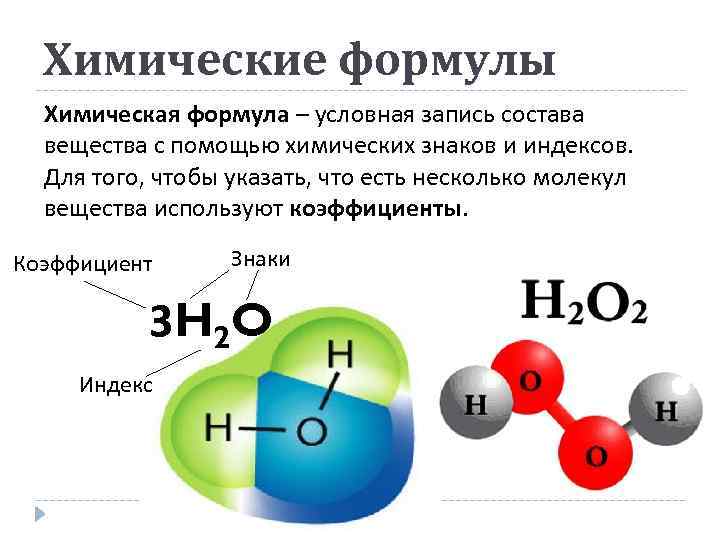 Химические формулы Химическая формула – условная запись состава вещества с помощью химических знаков и индексов. Для того, чтобы указать, что есть несколько молекул вещества используют коэффициенты. Коэффициент Знаки 3 H 2 O Индекс
Химические формулы Химическая формула – условная запись состава вещества с помощью химических знаков и индексов. Для того, чтобы указать, что есть несколько молекул вещества используют коэффициенты. Коэффициент Знаки 3 H 2 O Индекс



