Termokhimia.ppt
- Количество слайдов: 20
 Введение в термохимию* 9 класс (естественнонаучный) *Термохимия – раздел химии, изучающий энергетику химических реакций Автор: Демидова О. Э. , учитель химии МОУ Гимназия № 44
Введение в термохимию* 9 класс (естественнонаучный) *Термохимия – раздел химии, изучающий энергетику химических реакций Автор: Демидова О. Э. , учитель химии МОУ Гимназия № 44
 Сегодня нам предстоит: предстоит • Узнать, как протекают химические процессы; • Выяснить, почему одни реакции протекают с выделением, а другие с поглощением тепла; • Научиться строить энергетические диаграммы химических реакций; • Познакомиться с известным химиком и его законом;
Сегодня нам предстоит: предстоит • Узнать, как протекают химические процессы; • Выяснить, почему одни реакции протекают с выделением, а другие с поглощением тепла; • Научиться строить энергетические диаграммы химических реакций; • Познакомиться с известным химиком и его законом;
 В чем суть химических реакций? Сущность реакций сводится к разрыву связей в молекулах реагентов (исходных веществ) и возникновению новых связей в продуктах реакции. Смотреть анимацию Еразр > Е Еразр < Е обр - энергия поглощается - энергия выделяется
В чем суть химических реакций? Сущность реакций сводится к разрыву связей в молекулах реагентов (исходных веществ) и возникновению новых связей в продуктах реакции. Смотреть анимацию Еразр > Е Еразр < Е обр - энергия поглощается - энергия выделяется
 Энергетические эффекты • Тепловая энергия Сгорание топлива; Разложение при t 0;
Энергетические эффекты • Тепловая энергия Сгорание топлива; Разложение при t 0;
 Энергетические эффекты • Электрическая энергия Возникновение электрического тока при реакциях; Электролиз;
Энергетические эффекты • Электрическая энергия Возникновение электрического тока при реакциях; Электролиз;
 Энергетические эффекты • Световая энергия Горение магния; Разложение Ag. Br светом в фотографическом процессе
Энергетические эффекты • Световая энергия Горение магния; Разложение Ag. Br светом в фотографическом процессе
 Энергетические эффекты • Механическая энергия Разложение взрывчатых веществ при ударе; Взрыв артиллерийского снаряда;
Энергетические эффекты • Механическая энергия Разложение взрывчатых веществ при ударе; Взрыв артиллерийского снаряда;
 Термохимические уравнения - условная запись химической реакции с указанием энергетического эффекта; Экзотермический процесс: СН 4 + 2 О 2 → СО 2 + 2 Н 2 О + 890 к. Дж или СН 4 + 2 О 2 - 890 к. Дж → СО 2 + 2 Н 2 О или СН 4 + 2 О 2 → СО 2 + 2 Н 2 О ΔН = -890 к. Дж Эндотермический процесс: C + 2 S → CS 2 – 88 к. Дж C + 2 S + 88 к. Дж → CS 2 C + 2 S → CS 2 ΔН = 88 к. Дж или
Термохимические уравнения - условная запись химической реакции с указанием энергетического эффекта; Экзотермический процесс: СН 4 + 2 О 2 → СО 2 + 2 Н 2 О + 890 к. Дж или СН 4 + 2 О 2 - 890 к. Дж → СО 2 + 2 Н 2 О или СН 4 + 2 О 2 → СО 2 + 2 Н 2 О ΔН = -890 к. Дж Эндотермический процесс: C + 2 S → CS 2 – 88 к. Дж C + 2 S + 88 к. Дж → CS 2 C + 2 S → CS 2 ΔН = 88 к. Дж или
 Энтальпия (ΔН) Мера энергии, накапливаемая веществом при его образовании; (к. Дж) В эндотермических реакциях ΔН > 0 (Энергия поступает извне) Н продуктов Н Δ исходных в-в Н>0
Энтальпия (ΔН) Мера энергии, накапливаемая веществом при его образовании; (к. Дж) В эндотермических реакциях ΔН > 0 (Энергия поступает извне) Н продуктов Н Δ исходных в-в Н>0
 Энтальпия (ΔН) В экзотермических реакциях ΔН < 0 (Энергия уходит из реакционной системы) Н исходных в-в Δ Н<0 Н продуктов
Энтальпия (ΔН) В экзотермических реакциях ΔН < 0 (Энергия уходит из реакционной системы) Н исходных в-в Δ Н<0 Н продуктов
 Энтальпия (ΔН) • Зависит от условий протекания реакции. В стандартных условиях (Р = 1 атм. t 0 = 250 С) ΔН 0 • Зависит от агрегатного состояния вещества: ΔН 0 Н 2 О(г) = -492 к. Дж; ΔН 0 Н 2 О(ж) = -572 к. Дж;
Энтальпия (ΔН) • Зависит от условий протекания реакции. В стандартных условиях (Р = 1 атм. t 0 = 250 С) ΔН 0 • Зависит от агрегатного состояния вещества: ΔН 0 Н 2 О(г) = -492 к. Дж; ΔН 0 Н 2 О(ж) = -572 к. Дж;
 Что такое энергетическая диаграмма? Выделяемую и поглощаемую энергию можно представить в виде энергетической диаграммы. CH 4(г) + 2 O 2(г) CO 2(г) + 2 H 2 O(ж) ΔH = - 890, 4 к. Дж ΔH – величина отрицательная Прямая реакция экзотермическая (H продуктов < H реагентов) Обратная реакция эндотермическая (H продуктов > H реагентов)
Что такое энергетическая диаграмма? Выделяемую и поглощаемую энергию можно представить в виде энергетической диаграммы. CH 4(г) + 2 O 2(г) CO 2(г) + 2 H 2 O(ж) ΔH = - 890, 4 к. Дж ΔH – величина отрицательная Прямая реакция экзотермическая (H продуктов < H реагентов) Обратная реакция эндотермическая (H продуктов > H реагентов)
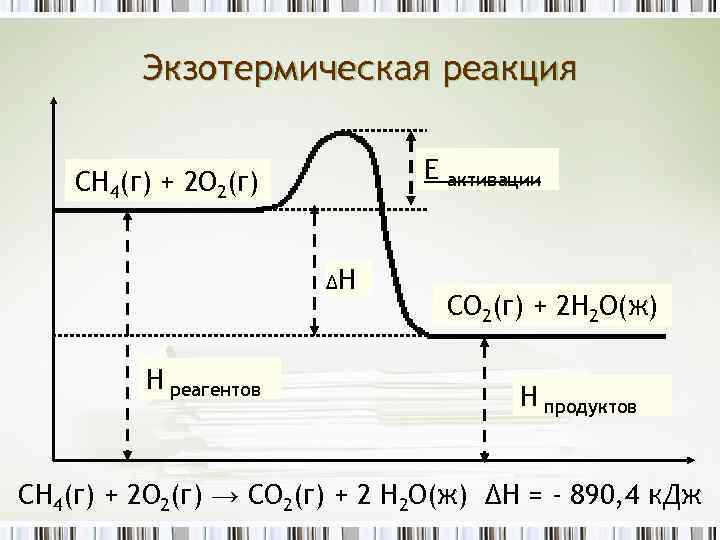 Экзотермическая реакция Е СН 4(г) + 2 О 2(г) ΔН Н реагентов активации СО 2(г) + 2 Н 2 О(ж) Н продуктов CH 4(г) + 2 O 2(г) → CO 2(г) + 2 H 2 O(ж) ΔH = - 890, 4 к. Дж
Экзотермическая реакция Е СН 4(г) + 2 О 2(г) ΔН Н реагентов активации СО 2(г) + 2 Н 2 О(ж) Н продуктов CH 4(г) + 2 O 2(г) → CO 2(г) + 2 H 2 O(ж) ΔH = - 890, 4 к. Дж
 Энергия активации Е - минимальное количество энергии, необходимое для того, чтобы вступить в химическую реакцию акт Смотреть анимацию
Энергия активации Е - минимальное количество энергии, необходимое для того, чтобы вступить в химическую реакцию акт Смотреть анимацию
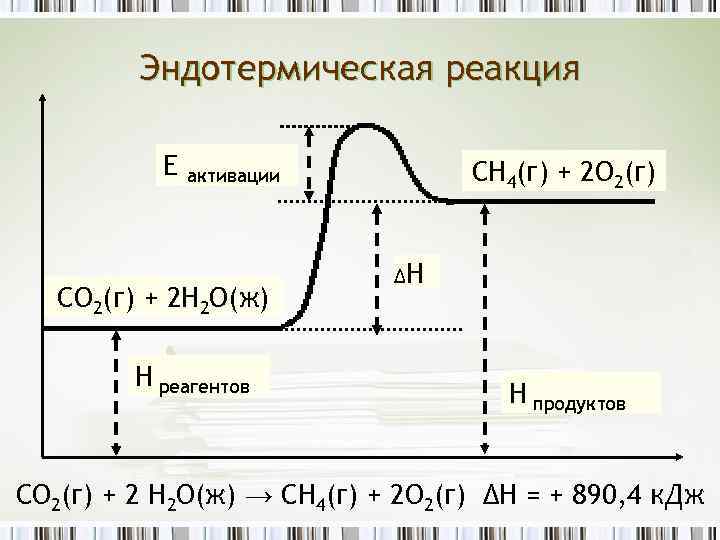 Эндотермическая реакция Е СН 4(г) + 2 О 2(г) активации СО 2(г) + 2 Н 2 О(ж) Н реагентов ΔН Н продуктов CO 2(г) + 2 H 2 O(ж) → CH 4(г) + 2 O 2(г) ΔH = + 890, 4 к. Дж
Эндотермическая реакция Е СН 4(г) + 2 О 2(г) активации СО 2(г) + 2 Н 2 О(ж) Н реагентов ΔН Н продуктов CO 2(г) + 2 H 2 O(ж) → CH 4(г) + 2 O 2(г) ΔH = + 890, 4 к. Дж
 Гесс Герман Иванович (7. VIII. 1802– 12. XII. 1850) Русский химик, один из основоположников термохимии. Открыл в 1840 г. основной закон термохимии (закон Гесса).
Гесс Герман Иванович (7. VIII. 1802– 12. XII. 1850) Русский химик, один из основоположников термохимии. Открыл в 1840 г. основной закон термохимии (закон Гесса).
 Закон Гесса Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса; ΔН 0 = ∑ΔН 0 продуктов - ∑ΔН 0 реагентов + О 2 С + ½ О 2 → СО СО 2 + ½ О 2
Закон Гесса Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса; ΔН 0 = ∑ΔН 0 продуктов - ∑ΔН 0 реагентов + О 2 С + ½ О 2 → СО СО 2 + ½ О 2
 1 Следствие из закона Гесса Теплота (энтальпия) образования вещества – это энергетический эффект реакции образования 1 моль вещества из простых веществ, устойчивых при стандартных условиях; ΔН 0 простых веществ = 0 Согласно первому следствию, тепловой эффект химической реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ : ΔH 0 = ΣΔH 0 обр прод - ΣΔH 0 обр исх
1 Следствие из закона Гесса Теплота (энтальпия) образования вещества – это энергетический эффект реакции образования 1 моль вещества из простых веществ, устойчивых при стандартных условиях; ΔН 0 простых веществ = 0 Согласно первому следствию, тепловой эффект химической реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ : ΔH 0 = ΣΔH 0 обр прод - ΣΔH 0 обр исх
 2 Следствие из закона Гесса Теплота (энтальпия) сгорания вещества, содержащего C, H, N, O называется тепловой эффект реакции сгорания 1 моля этого вещества в достаточном количестве кислорода с образованием CO 2, H 2 O (ж) и N 2; Согласно второму следствию, тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции: ΔH 0 = ΣΔH 0 сгор исх - ΣΔH 0 сгор прод
2 Следствие из закона Гесса Теплота (энтальпия) сгорания вещества, содержащего C, H, N, O называется тепловой эффект реакции сгорания 1 моля этого вещества в достаточном количестве кислорода с образованием CO 2, H 2 O (ж) и N 2; Согласно второму следствию, тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции: ΔH 0 = ΣΔH 0 сгор исх - ΣΔH 0 сгор прод
 Е Е разр Еразр > Е Еразр < Е обр обр. - энергия поглощается - энергия выделяется
Е Е разр Еразр > Е Еразр < Е обр обр. - энергия поглощается - энергия выделяется


