ProteomicsLection_1_Introduction_to_proteomics.ppt
- Количество слайдов: 43
 ВВЕДЕНИЕ В ПРОТЕОМИКУ Лекция 1 Янцевич Алексей Викторович Протеомика , БГУ 2013
ВВЕДЕНИЕ В ПРОТЕОМИКУ Лекция 1 Янцевич Алексей Викторович Протеомика , БГУ 2013
 Литература к курсу №№ п/п Список литературы Год издания Основная (ЛО) 1. 2. 3. Нолтинг Б. Новейшие методы исследования биосистем. Филиппович, Ю. Б. Основы биохимии Финкельштейн, А. В. , Птицын, О. Б. Физика белка: Курс лекций с цветными и стереоскопическими иллюстрациями и задачами. 2005 1999 2005 4. Twyman, R. M. (2004). Principles Of Proteomics (Advanced Text Series). 2004 5. Naven T, Westermeier R. (2002). Proteomics in Practice: A Laboratory Manual of Proteome Analysis. 2002 6. Wilkins, M. R. , Williams, K. L. , Appel R. D. , Hochstrasser D. F. (1997). Proteome Research: New Frontiers in Functional Genomics (Principles and Practice). 1997 7. Palzkill, T. Proteomics 2002 1. Дополнительная (ЛД) Vikas Dhingraa, Mukta Gupta, Tracy Andacht and Zhen F. Fu (2005). "New frontiers in proteomics research: A perspective". International Journal of Pharmaceutics 1983
Литература к курсу №№ п/п Список литературы Год издания Основная (ЛО) 1. 2. 3. Нолтинг Б. Новейшие методы исследования биосистем. Филиппович, Ю. Б. Основы биохимии Финкельштейн, А. В. , Птицын, О. Б. Физика белка: Курс лекций с цветными и стереоскопическими иллюстрациями и задачами. 2005 1999 2005 4. Twyman, R. M. (2004). Principles Of Proteomics (Advanced Text Series). 2004 5. Naven T, Westermeier R. (2002). Proteomics in Practice: A Laboratory Manual of Proteome Analysis. 2002 6. Wilkins, M. R. , Williams, K. L. , Appel R. D. , Hochstrasser D. F. (1997). Proteome Research: New Frontiers in Functional Genomics (Principles and Practice). 1997 7. Palzkill, T. Proteomics 2002 1. Дополнительная (ЛД) Vikas Dhingraa, Mukta Gupta, Tracy Andacht and Zhen F. Fu (2005). "New frontiers in proteomics research: A perspective". International Journal of Pharmaceutics 1983
 План лекции 1. Протеомика как постгеномная технология. 2. Многообразие белковых веществ. 3. Строение и функционирование белков в клетке. 4. Методология протеомики 5. Использование белков для характеристики метаболических процессов и функционального состояния организма.
План лекции 1. Протеомика как постгеномная технология. 2. Многообразие белковых веществ. 3. Строение и функционирование белков в клетке. 4. Методология протеомики 5. Использование белков для характеристики метаболических процессов и функционального состояния организма.
 Масштабные направления Ø геномика - геном Ø транскриптомика - транскриптом Ø метаболомика - метаболом Ø цитомика - цитом Ø пептидомика - пептидом
Масштабные направления Ø геномика - геном Ø транскриптомика - транскриптом Ø метаболомика - метаболом Ø цитомика - цитом Ø пептидомика - пептидом

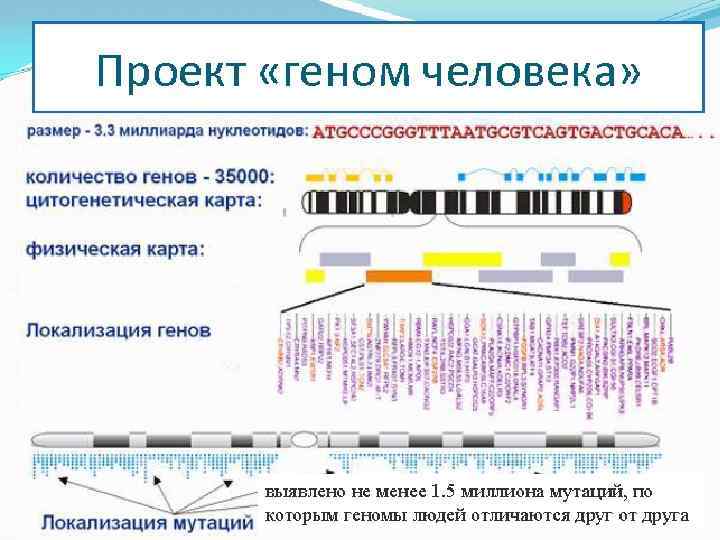 Протеомика , БГУ 2011
Протеомика , БГУ 2011
 Протеомика , БГУ 2011
Протеомика , БГУ 2011
 1. Что такое протеомика? Протеом — термин для обозначения совокупности белков (протеинов) организма. Термин был предложен в 1994 -5 году австралийским исследователем Марком Уилкинсом по аналогии с термином геном. "PROTEins" и "gen. OMe" Протеомика — изучает белки и их взаимодействия в живых организмах. Идентификация, характеристика и количественный учет ВСЕХ белков метаболического пути, органеллы, клетки, ткани, органа и всего организма. 2001 Международная Организация протеома человека (Human Proteome Organization / HUPO).
1. Что такое протеомика? Протеом — термин для обозначения совокупности белков (протеинов) организма. Термин был предложен в 1994 -5 году австралийским исследователем Марком Уилкинсом по аналогии с термином геном. "PROTEins" и "gen. OMe" Протеомика — изучает белки и их взаимодействия в живых организмах. Идентификация, характеристика и количественный учет ВСЕХ белков метаболического пути, органеллы, клетки, ткани, органа и всего организма. 2001 Международная Организация протеома человека (Human Proteome Organization / HUPO).
 Клеточный протеом – все белки определенной клетки на конкретной стадии дифференцировки, развивающейся в определенных условиях. Гепатоцит (клетка печени) содержит 10000 -20000 различных белков, каждый из которых может находиться в количестве 20 тыс. – 100 млн. копий на одну клетку. Протеом гепатоцита имеет массу 0, 5 нг, что составляет 18 -20 % от общей массы клетки. Общий протеом организма - весь набор белков конкретного организма в данный момент времени, и в том числе объединяет различные клеточные протеомы. Один и тот же организм может иметь различный протеом в зависимости от стадии жизненного цикла, окружающих условий среды и т. д. Протеом человека включает в среднем 2 миллиона различных белков, каждый из которых имеет свою структуру и обладает различными функциями.
Клеточный протеом – все белки определенной клетки на конкретной стадии дифференцировки, развивающейся в определенных условиях. Гепатоцит (клетка печени) содержит 10000 -20000 различных белков, каждый из которых может находиться в количестве 20 тыс. – 100 млн. копий на одну клетку. Протеом гепатоцита имеет массу 0, 5 нг, что составляет 18 -20 % от общей массы клетки. Общий протеом организма - весь набор белков конкретного организма в данный момент времени, и в том числе объединяет различные клеточные протеомы. Один и тот же организм может иметь различный протеом в зависимости от стадии жизненного цикла, окружающих условий среды и т. д. Протеом человека включает в среднем 2 миллиона различных белков, каждый из которых имеет свою структуру и обладает различными функциями.
 Цель протеомики - интегральное изучение поведения и функций клеточных белков в живой клетке Задачи протеомики 1) идентификация белков 2) количественное определение белков и дифференциальный анализ 3) белок-белковые взаимодействия 4) посттрансляционные модификации 5) структурная протеомика
Цель протеомики - интегральное изучение поведения и функций клеточных белков в живой клетке Задачи протеомики 1) идентификация белков 2) количественное определение белков и дифференциальный анализ 3) белок-белковые взаимодействия 4) посттрансляционные модификации 5) структурная протеомика
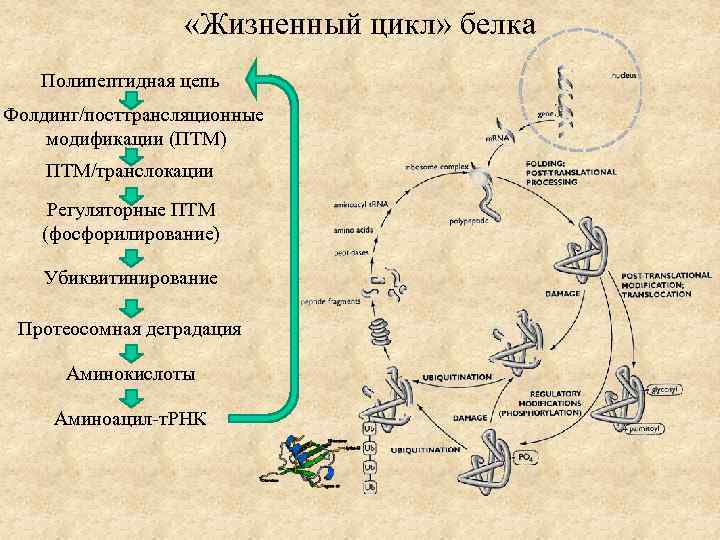 «Жизненный цикл» белка Полипептидная цепь Фолдинг/посттрансляционные модификации (ПТМ) ПТМ/транслокации Регуляторные ПТМ (фосфорилирование) Убиквитинирование Протеосомная деградация Аминокислоты Аминоацил-т. РНК
«Жизненный цикл» белка Полипептидная цепь Фолдинг/посттрансляционные модификации (ПТМ) ПТМ/транслокации Регуляторные ПТМ (фосфорилирование) Убиквитинирование Протеосомная деградация Аминокислоты Аминоацил-т. РНК
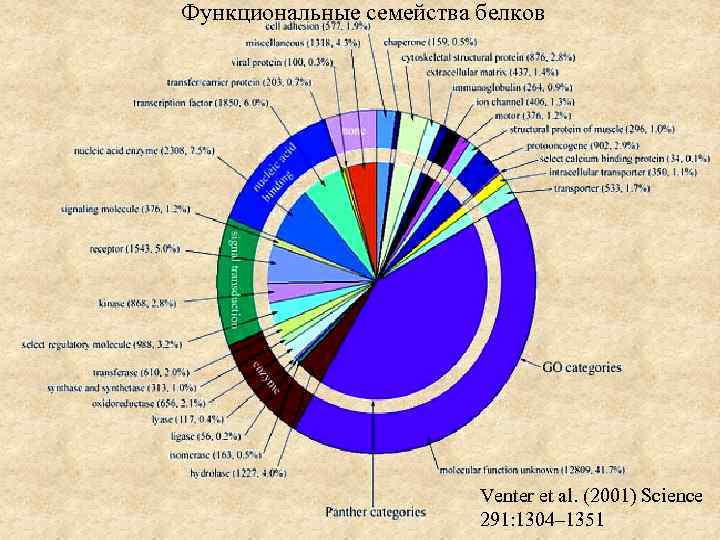 Функциональные семейства белков Venter et al. (2001) Science 291: 1304– 1351
Функциональные семейства белков Venter et al. (2001) Science 291: 1304– 1351
 • Основной метаболизм – 15% • Структурные белки и синтез белка – 15 -20% цитоскелет, рибосомальные белки, шапероны, белки протеосомы • Сигнальные и ДНК-связывающие белки – 20 -25% • Функция неизвестна – 40% Функциональная геномика – поиск функций неизвестных генов Гены и геномы Гомологичные последовательности называют ортологичными, если к их разделению привел акт видообразования: если ген существует у некоего вида, который дивергирует с образованием двух видов, то копии этого гена у дочерних видов называются ортологами. Гомологичные последовательности называют паралогичными, если к их разделению привело удвоение гена: если в пределах одного организма в результате хромосомной мутации произошло удвоение гена, то его копии называют паралогами.
• Основной метаболизм – 15% • Структурные белки и синтез белка – 15 -20% цитоскелет, рибосомальные белки, шапероны, белки протеосомы • Сигнальные и ДНК-связывающие белки – 20 -25% • Функция неизвестна – 40% Функциональная геномика – поиск функций неизвестных генов Гены и геномы Гомологичные последовательности называют ортологичными, если к их разделению привел акт видообразования: если ген существует у некоего вида, который дивергирует с образованием двух видов, то копии этого гена у дочерних видов называются ортологами. Гомологичные последовательности называют паралогичными, если к их разделению привело удвоение гена: если в пределах одного организма в результате хромосомной мутации произошло удвоение гена, то его копии называют паралогами.
 Гены и количество экспрессируемого белка Кол-во молекул белка в клетке - 10 -106 Экспрессируется 30 -80% от возможных продуктов генома Кол-во белка зависит от факторов: • • Скорость транскрипции Скорость трансляции Скорость деградации белка Используемость кодонов
Гены и количество экспрессируемого белка Кол-во молекул белка в клетке - 10 -106 Экспрессируется 30 -80% от возможных продуктов генома Кол-во белка зависит от факторов: • • Скорость транскрипции Скорость трансляции Скорость деградации белка Используемость кодонов
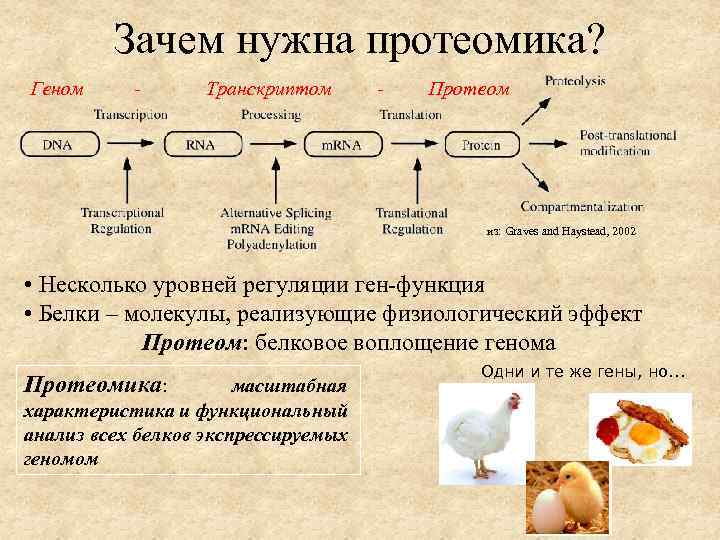 Зачем нужна протеомика? Геном - Транскриптом - Протеом из: Graves and Haystead, 2002 • Несколько уровней регуляции ген-функция • Белки – молекулы, реализующие физиологический эффект Протеом: белковое воплощение генома Протеомика: масштабная характеристика и функциональный анализ всех белков экспрессируемых геномом Одни и те же гены, но. . .
Зачем нужна протеомика? Геном - Транскриптом - Протеом из: Graves and Haystead, 2002 • Несколько уровней регуляции ген-функция • Белки – молекулы, реализующие физиологический эффект Протеом: белковое воплощение генома Протеомика: масштабная характеристика и функциональный анализ всех белков экспрессируемых геномом Одни и те же гены, но. . .
 Протеомика и геномика ДНК Статична Может быть амплифицирована Простота строения (1 компонент) Хорошая растворимость Белки Очень динамичны Не может быть амплифицирована Высокая сложность строения (модификации) Растворимость различная Полностью изучен ряд геномов, но до сих пор полностью не охарактеризован ни один эукариотический протеом
Протеомика и геномика ДНК Статична Может быть амплифицирована Простота строения (1 компонент) Хорошая растворимость Белки Очень динамичны Не может быть амплифицирована Высокая сложность строения (модификации) Растворимость различная Полностью изучен ряд геномов, но до сих пор полностью не охарактеризован ни один эукариотический протеом
 Протеомика и белковая химия Белковая химия Индивидуальные белки Протеомика Сложные смеси белков Полный анализ последовательности Частичный анализ последовательности Акцент на структуре Акцент на и функции идентификации по базам данных Структурная биология Системная биология
Протеомика и белковая химия Белковая химия Индивидуальные белки Протеомика Сложные смеси белков Полный анализ последовательности Частичный анализ последовательности Акцент на структуре Акцент на и функции идентификации по базам данных Структурная биология Системная биология
 2. Многообразие белковых соединений Мы различаем белки по СТРУКТУРЕ, СВОЙСТВАМ ФУНКЦИЯМ
2. Многообразие белковых соединений Мы различаем белки по СТРУКТУРЕ, СВОЙСТВАМ ФУНКЦИЯМ
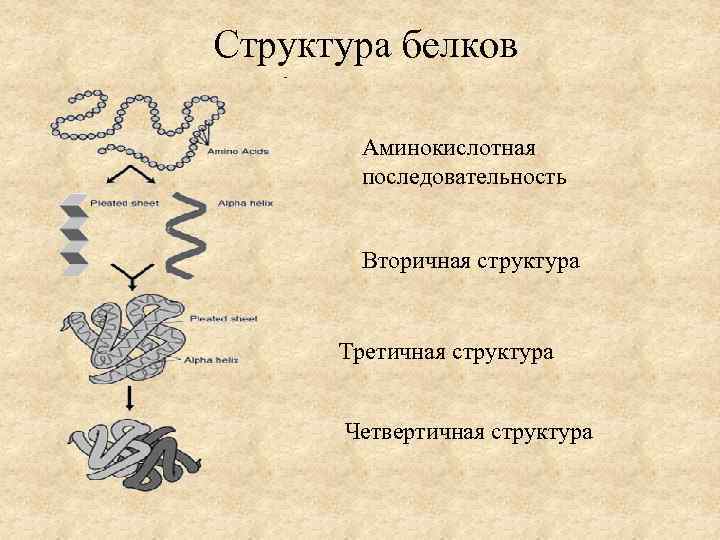 Структура белков Аминокислотная последовательность Вторичная структура Третичная структура Четвертичная структура
Структура белков Аминокислотная последовательность Вторичная структура Третичная структура Четвертичная структура
 Посттрансляционная модификация — это химическая модификация белка после его трансляции. Это одна из последних стадий процесса биосинтеза белка для многих белков. q ацетилирование q фосфорилирование q гликозилирование q изменение природы аминокислоты q метилирование q протеолиз
Посттрансляционная модификация — это химическая модификация белка после его трансляции. Это одна из последних стадий процесса биосинтеза белка для многих белков. q ацетилирование q фосфорилирование q гликозилирование q изменение природы аминокислоты q метилирование q протеолиз
 Белки – «модульные» соединения Домен – часть белковой молекулы, имеющая собственную 3 D структуру. Независимая структурная единица. Может эволюционировать независимо от остального белка На основании доменной структуры белки подразделяются на семейства Примеры доменов: Zn-пальцы, домены иммуноглобулинов
Белки – «модульные» соединения Домен – часть белковой молекулы, имеющая собственную 3 D структуру. Независимая структурная единица. Может эволюционировать независимо от остального белка На основании доменной структуры белки подразделяются на семейства Примеры доменов: Zn-пальцы, домены иммуноглобулинов
 Свойства белков Размер белковой молекулы: Дрожжи - 466 аминокислот и имеют молекулярную массу 53 к. Да (в среднем). Титин —компонент саркомеров мышц; молекулярная масса различных изоформ в интервале от 3000 до 3700 к. Да, он состоит из 38 138 аминокислот. Заряд белковой молекулы: Белки являются амфотерными полиэлектролитами (полиамфолитами). Изоэлектрическая точка в основном - 5, 5 до 7, 0, значения лежат в экстремальных областях: пепсин — протеолитического фермента сильнокислого желудочного сока - p. I ~ 1, сальмин — протамин молок лосося (чрезвычайно высокое содержание аргинина) - p. I ~ 12. Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот, часто являются основными белками. Примером таких белков служат гистоны и протамины. Растворимость в воде: Большинство белков – растворимые. Нерастворимые - кератин и фиброин. Белки - гидрофильные и гидрофобные. Гидрофильные – большинство белков цитоплазмы, ядра и межклеточного вещества, в т. ч. нерастворимые кератин и фиброин. Гидрофобные - большинство белков, входящих в состав биологических мембран интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны (есть и небольшие гидрофильные участки).
Свойства белков Размер белковой молекулы: Дрожжи - 466 аминокислот и имеют молекулярную массу 53 к. Да (в среднем). Титин —компонент саркомеров мышц; молекулярная масса различных изоформ в интервале от 3000 до 3700 к. Да, он состоит из 38 138 аминокислот. Заряд белковой молекулы: Белки являются амфотерными полиэлектролитами (полиамфолитами). Изоэлектрическая точка в основном - 5, 5 до 7, 0, значения лежат в экстремальных областях: пепсин — протеолитического фермента сильнокислого желудочного сока - p. I ~ 1, сальмин — протамин молок лосося (чрезвычайно высокое содержание аргинина) - p. I ~ 12. Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот, часто являются основными белками. Примером таких белков служат гистоны и протамины. Растворимость в воде: Большинство белков – растворимые. Нерастворимые - кератин и фиброин. Белки - гидрофильные и гидрофобные. Гидрофильные – большинство белков цитоплазмы, ядра и межклеточного вещества, в т. ч. нерастворимые кератин и фиброин. Гидрофобные - большинство белков, входящих в состав биологических мембран интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны (есть и небольшие гидрофильные участки).
 Функционально белки связаны между собой в рамках отдельных метаболических путей • Метаболические белки – катализаторы химических реакций • Сигнальные белки – участвуют в передаче сигнала. • Регуляторные – специфически контролируют скорость химических реакций или поступления веществ в клетку • Структурные • Транспортные • Двигательные • ДНК и РНК связывающие • Защитные
Функционально белки связаны между собой в рамках отдельных метаболических путей • Метаболические белки – катализаторы химических реакций • Сигнальные белки – участвуют в передаче сигнала. • Регуляторные – специфически контролируют скорость химических реакций или поступления веществ в клетку • Структурные • Транспортные • Двигательные • ДНК и РНК связывающие • Защитные
 Инструментарий протеомики
Инструментарий протеомики
 Направления в протеомике ü выделение белков, их разделение и идентификация; ü определение аминокислотной последовательности, вторичной и третичной структуры белков (структурная протеомика); ü посттрансляционные модификации белковых молекул; ü белок-белковые взаимодействия; ü клеточная протеомика (изучение внутриклеточной локализации белков, их участия в реализации отдельных стадий клеточного цикла); ü экспериментальная биоинформатика в области протеомики (создание и усовершенствование существующих экспериментальных и биоинформационных методов; ü выявление новой информации и создание новых баз данных о белках).
Направления в протеомике ü выделение белков, их разделение и идентификация; ü определение аминокислотной последовательности, вторичной и третичной структуры белков (структурная протеомика); ü посттрансляционные модификации белковых молекул; ü белок-белковые взаимодействия; ü клеточная протеомика (изучение внутриклеточной локализации белков, их участия в реализации отдельных стадий клеточного цикла); ü экспериментальная биоинформатика в области протеомики (создание и усовершенствование существующих экспериментальных и биоинформационных методов; ü выявление новой информации и создание новых баз данных о белках).
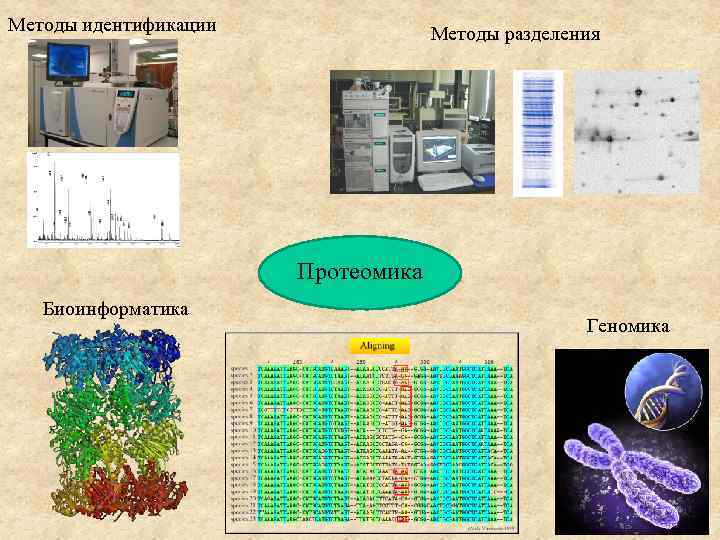 Методы идентификации Методы разделения Протеомика Биоинформатика Геномика
Методы идентификации Методы разделения Протеомика Биоинформатика Геномика
 Масс-спектрометрия (масс-спектроскопия, масс-спектрография, масс-спектральный анализ, масс-спектрометрический анализ) — метод исследования вещества путём определения отношения массы к заряду (качества) и количества заряженных частиц, образующихся при том или ином процессе воздействия на вещество (ионизация).
Масс-спектрометрия (масс-спектроскопия, масс-спектрография, масс-спектральный анализ, масс-спектрометрический анализ) — метод исследования вещества путём определения отношения массы к заряду (качества) и количества заряженных частиц, образующихся при том или ином процессе воздействия на вещество (ионизация).
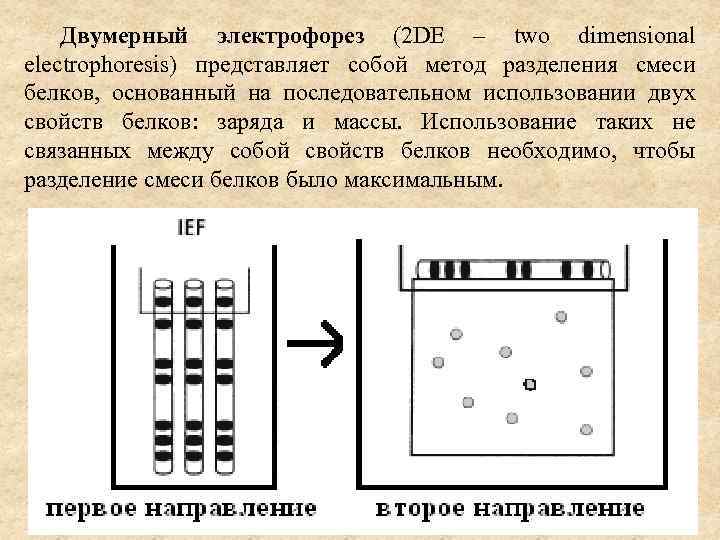 Двумерный электрофорез (2 DE – two dimensional electrophoresis) представляет собой метод разделения смеси белков, основанный на последовательном использовании двух свойств белков: заряда и массы. Использование таких не связанных между собой свойств белков необходимо, чтобы разделение смеси белков было максимальным.
Двумерный электрофорез (2 DE – two dimensional electrophoresis) представляет собой метод разделения смеси белков, основанный на последовательном использовании двух свойств белков: заряда и массы. Использование таких не связанных между собой свойств белков необходимо, чтобы разделение смеси белков было максимальным.
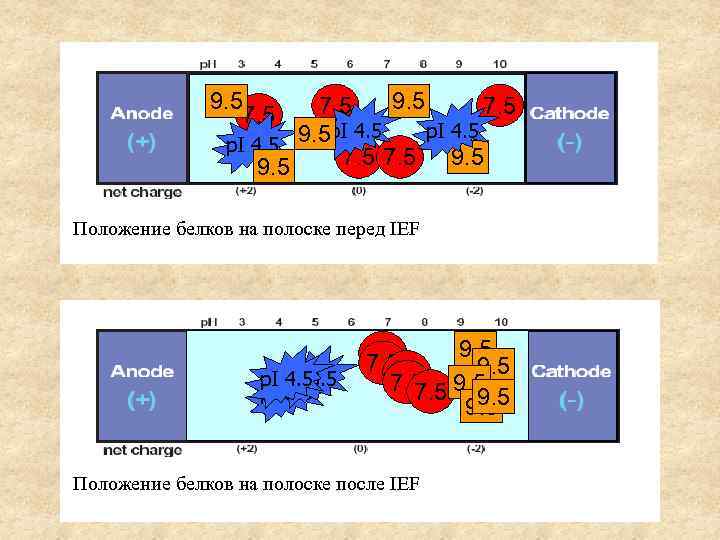 9. 5 7. 5 p. I 4. 5 9. 5 7. 5 9. 5 Положение белков на полоске перед IEF p. I 3. 5 4. 5 p. I 3. 5 9. 5 7. 5 9. 5 Положение белков на полоске после IEF Протеомика , БГУ 2011
9. 5 7. 5 p. I 4. 5 9. 5 7. 5 9. 5 Положение белков на полоске перед IEF p. I 3. 5 4. 5 p. I 3. 5 9. 5 7. 5 9. 5 Положение белков на полоске после IEF Протеомика , БГУ 2011
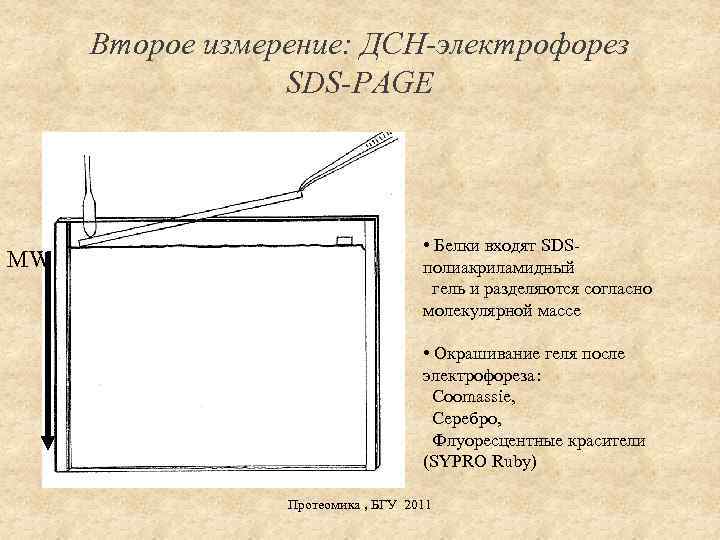 Второе измерение: ДСН-электрофорез SDS-PAGE MW • Белки входят SDSполиакриламидный гель и разделяются согласно молекулярной массе • Окрашивание геля после электрофореза: Coomassie, Серебро, Флуоресцентные красители (SYPRO Ruby) Протеомика , БГУ 2011
Второе измерение: ДСН-электрофорез SDS-PAGE MW • Белки входят SDSполиакриламидный гель и разделяются согласно молекулярной массе • Окрашивание геля после электрофореза: Coomassie, Серебро, Флуоресцентные красители (SYPRO Ruby) Протеомика , БГУ 2011
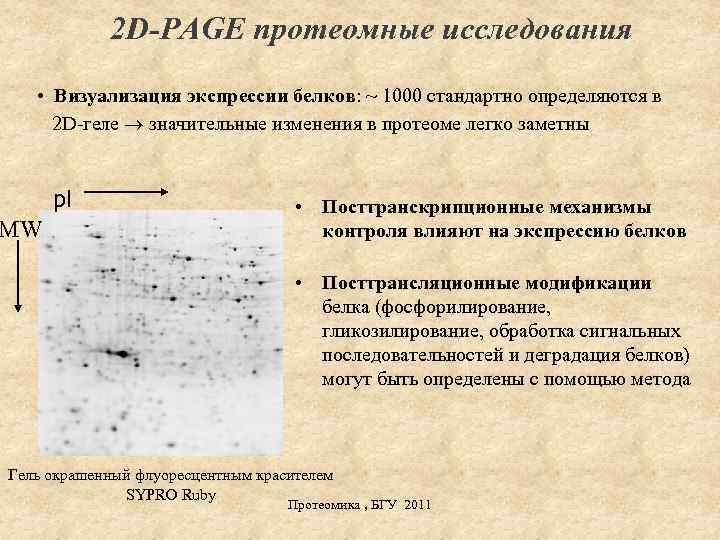 2 D-PAGE протеомные исследования • Визуализация экспрессии белков: ~ 1000 стандартно определяются в 2 D-геле значительные изменения в протеоме легко заметны p. I MW • Посттранскрипционные механизмы контроля влияют на экспрессию белков • Посттрансляционные модификации белка (фосфорилирование, гликозилирование, обработка сигнальных последовательностей и деградация белков) могут быть определены с помощью метода Гель окрашенный флуоресцентным красителем SYPRO Ruby Протеомика , БГУ 2011
2 D-PAGE протеомные исследования • Визуализация экспрессии белков: ~ 1000 стандартно определяются в 2 D-геле значительные изменения в протеоме легко заметны p. I MW • Посттранскрипционные механизмы контроля влияют на экспрессию белков • Посттрансляционные модификации белка (фосфорилирование, гликозилирование, обработка сигнальных последовательностей и деградация белков) могут быть определены с помощью метода Гель окрашенный флуоресцентным красителем SYPRO Ruby Протеомика , БГУ 2011
 ВЭЖХ Высокоэффективная жидкостная хроматография (ВЭЖХ, англ. HPLC, High performance liquid chromatography) — один из эффективных методов разделения сложных смесей веществ, широко применяемый как в аналитической химии, так и в химической технологии. Основой хроматографического разделения является участие компонентов разделяемой смеси в сложной системе Ван-дер-Ваальсовых взаимодействий (преимущественно межмолекулярных) на границе раздела фаз. Полученные простые смеси анализируются затем обычными физико-химическими методами или специальными методами, созданными для хроматографии. Виды ВЭЖХ: 1. Адсорбционная основанный на способности твёрдого вещества — неподвижной фазы — сорбировать примеси, находящиеся в подвижной фазе 2. Распределительная (обращеннофазовая, нормальнофазовая) неподвижная (стационарная) фаза химически связана с поверхностью неподвижного носителя. Подвижной фазой является жидкость, которая служит растворителем, или газ (газовая хроматография). Разделение происходит за счёт различия полярности разделяемых веществ. 3. Ионообменная (катионообменная, анионообменная) разделение по заряду 4. Эксклюзионная (молекулярные сита) разделение по размеру за счет разной способности проникать в поры сорбента 5. Лигандообменная (аффинная) Арчер Мартин и Ричард Синг в 1952 году за разработку основ метода распределительной хроматографии получили Нобелевскую премию.
ВЭЖХ Высокоэффективная жидкостная хроматография (ВЭЖХ, англ. HPLC, High performance liquid chromatography) — один из эффективных методов разделения сложных смесей веществ, широко применяемый как в аналитической химии, так и в химической технологии. Основой хроматографического разделения является участие компонентов разделяемой смеси в сложной системе Ван-дер-Ваальсовых взаимодействий (преимущественно межмолекулярных) на границе раздела фаз. Полученные простые смеси анализируются затем обычными физико-химическими методами или специальными методами, созданными для хроматографии. Виды ВЭЖХ: 1. Адсорбционная основанный на способности твёрдого вещества — неподвижной фазы — сорбировать примеси, находящиеся в подвижной фазе 2. Распределительная (обращеннофазовая, нормальнофазовая) неподвижная (стационарная) фаза химически связана с поверхностью неподвижного носителя. Подвижной фазой является жидкость, которая служит растворителем, или газ (газовая хроматография). Разделение происходит за счёт различия полярности разделяемых веществ. 3. Ионообменная (катионообменная, анионообменная) разделение по заряду 4. Эксклюзионная (молекулярные сита) разделение по размеру за счет разной способности проникать в поры сорбента 5. Лигандообменная (аффинная) Арчер Мартин и Ричард Синг в 1952 году за разработку основ метода распределительной хроматографии получили Нобелевскую премию.
 Основной инструментарий Двухмерный электрофорез (2 D-PAGE) клеточных лизатов Полная картина экспрессии белков + Масс-спектрометрия Идентификация белков «методом отпечатков пальцев» анализ - 2 D-PAGE высокого разрешения, впервые разработан в 1975 (O’Farrell and Klose) масштабная визуализация - Комбинация с масс-спектрометрией биомолекул (1990 s) дифференциальной экспрессии белков - Доступность последовательностей, кодирующих белки в базах данных центральная роль в протеомных исследованиях
Основной инструментарий Двухмерный электрофорез (2 D-PAGE) клеточных лизатов Полная картина экспрессии белков + Масс-спектрометрия Идентификация белков «методом отпечатков пальцев» анализ - 2 D-PAGE высокого разрешения, впервые разработан в 1975 (O’Farrell and Klose) масштабная визуализация - Комбинация с масс-спектрометрией биомолекул (1990 s) дифференциальной экспрессии белков - Доступность последовательностей, кодирующих белки в базах данных центральная роль в протеомных исследованиях
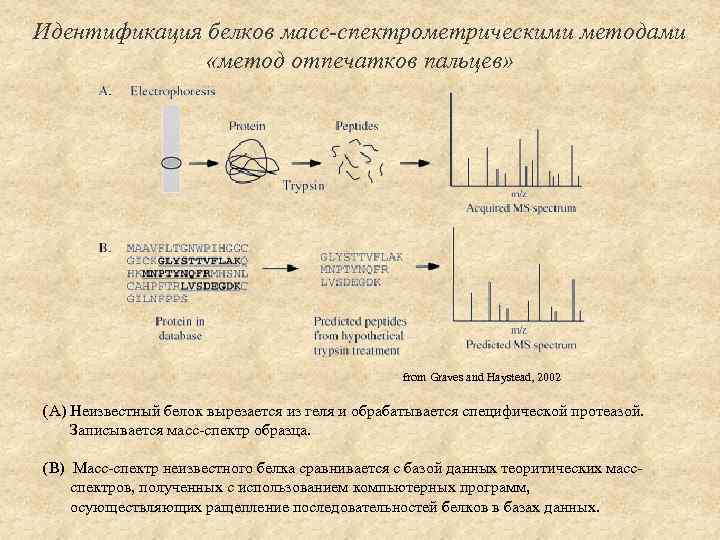 Идентификация белков масс-спектрометрическими методами «метод отпечатков пальцев» from Graves and Haystead, 2002 (A) Неизвестный белок вырезается из геля и обрабатывается специфической протеазой. Записывается масс-спектр образца. (B) Масс-спектр неизвестного белка сравнивается с базой данных теоритических массспектров, полученных с использованием компьютерных программ, осующествляющих ращепление последовательностей белков в базах данных.
Идентификация белков масс-спектрометрическими методами «метод отпечатков пальцев» from Graves and Haystead, 2002 (A) Неизвестный белок вырезается из геля и обрабатывается специфической протеазой. Записывается масс-спектр образца. (B) Масс-спектр неизвестного белка сравнивается с базой данных теоритических массспектров, полученных с использованием компьютерных программ, осующествляющих ращепление последовательностей белков в базах данных.
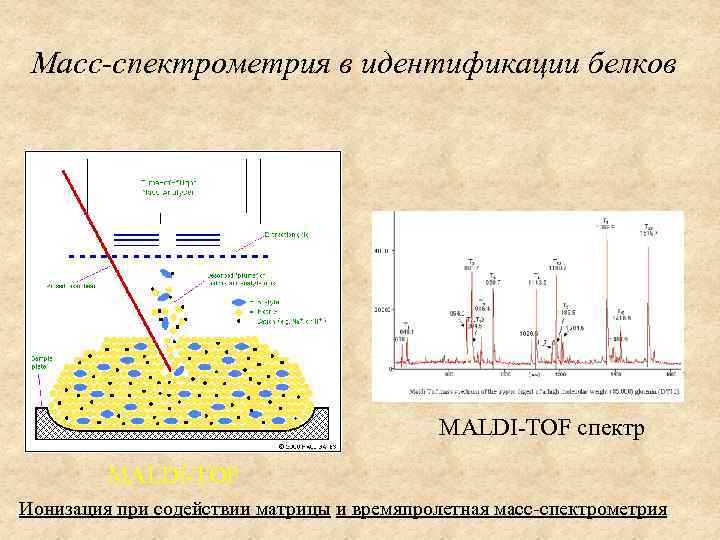 Масс-спектрометрия в идентификации белков MALDI-TOF спектр MALDI-TOF Ионизация при содействии матрицы и времяпролетная масс-спектрометрия
Масс-спектрометрия в идентификации белков MALDI-TOF спектр MALDI-TOF Ионизация при содействии матрицы и времяпролетная масс-спектрометрия
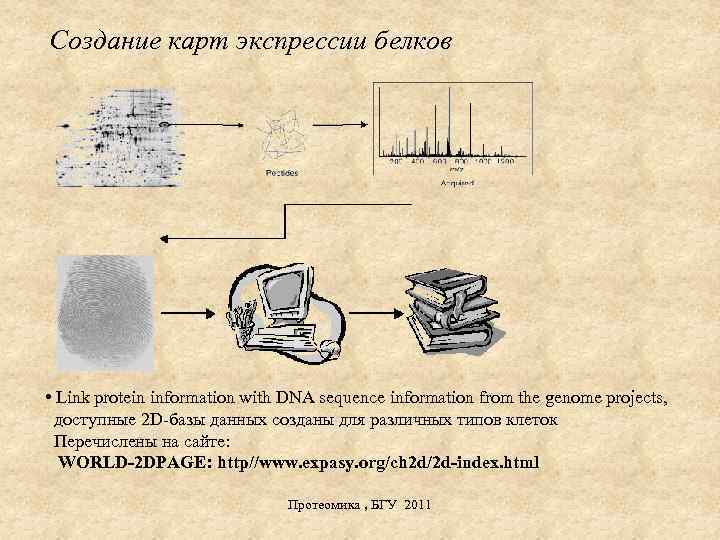 Создание карт экспрессии белков • Link protein information with DNA sequence information from the genome projects, доступные 2 D-базы данных созданы для различных типов клеток Перечислены на сайте: WORLD-2 DPAGE: http//www. expasy. org/ch 2 d/2 d-index. html Протеомика , БГУ 2011
Создание карт экспрессии белков • Link protein information with DNA sequence information from the genome projects, доступные 2 D-базы данных созданы для различных типов клеток Перечислены на сайте: WORLD-2 DPAGE: http//www. expasy. org/ch 2 d/2 d-index. html Протеомика , БГУ 2011
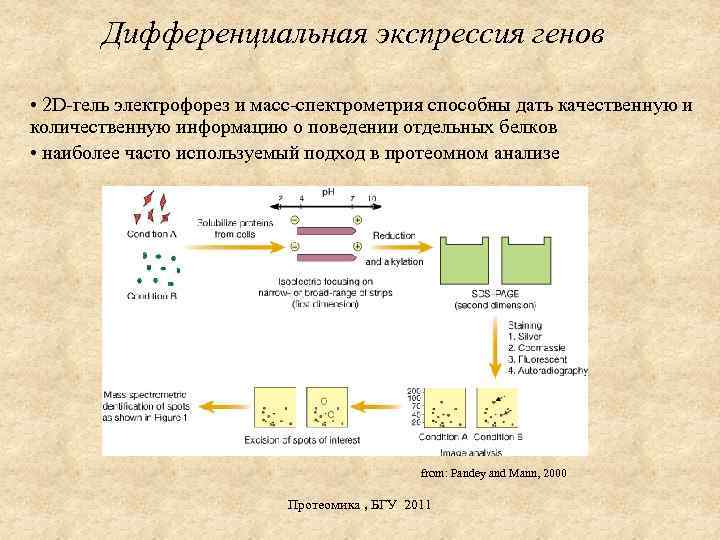 Дифференциальная экспрессия генов • 2 D-гель электрофорез и масс-спектрометрия способны дать качественную и количественную информацию о поведении отдельных белков • наиболее часто используемый подход в протеомном анализе from: Pandey and Mann, 2000 Протеомика , БГУ 2011
Дифференциальная экспрессия генов • 2 D-гель электрофорез и масс-спектрометрия способны дать качественную и количественную информацию о поведении отдельных белков • наиболее часто используемый подход в протеомном анализе from: Pandey and Mann, 2000 Протеомика , БГУ 2011
 Биоинформатика - использование математических средств для извлечения полезной информации из «шумных» или слишком объёмных данных о структуре ДНК и белков, полученных экспериментально. Биоинформа тика 1. математические методы компьютерного анализа в сравнительной геномике (геномная биоинформатика). 2. разработка алгоритмов и программ для предсказания пространственной структуры белков (структурная биоинформатика). 3. исследований стратегий, соответствующих вычислительных методологий, а также общее управление информационной сложности биологических систем [1]. Биоинформационные программы BLAST — поиск родственных последовательностей в базе данных нуклеотидных и аминокислотных последовательностей Clustal. W — множественное выравнивание нуклеотидных и аминокислотных последовательностей Clustal. X — множественное выравнивание нуклеотидных и аминокислотных последовательностей Биоинформатика помогает связать геномные и протеомные проекты, к примеру, помогая в использовании последовательности ДНК для идентификации белков.
Биоинформатика - использование математических средств для извлечения полезной информации из «шумных» или слишком объёмных данных о структуре ДНК и белков, полученных экспериментально. Биоинформа тика 1. математические методы компьютерного анализа в сравнительной геномике (геномная биоинформатика). 2. разработка алгоритмов и программ для предсказания пространственной структуры белков (структурная биоинформатика). 3. исследований стратегий, соответствующих вычислительных методологий, а также общее управление информационной сложности биологических систем [1]. Биоинформационные программы BLAST — поиск родственных последовательностей в базе данных нуклеотидных и аминокислотных последовательностей Clustal. W — множественное выравнивание нуклеотидных и аминокислотных последовательностей Clustal. X — множественное выравнивание нуклеотидных и аминокислотных последовательностей Биоинформатика помогает связать геномные и протеомные проекты, к примеру, помогая в использовании последовательности ДНК для идентификации белков.
 4. Использование белков для характеристики метаболических процессов и функционального состояния организма. Основной вопрос: • Идентификация белков в клетке, которые изменяются в количестве, локализации, или модификации в ответ на определенное биологическое воздействие • Часто комбинируют со смежной методологией (биохимия белка, молекулярная биология и клеточная физиология) Если: - Наблюдаются количественные изменения в интересующем биологическом процессе - Наблюдаются количественные изменения в модификации белков Тогда: 2 D-электрофорез является подходящим методом Протеомика , БГУ 2011
4. Использование белков для характеристики метаболических процессов и функционального состояния организма. Основной вопрос: • Идентификация белков в клетке, которые изменяются в количестве, локализации, или модификации в ответ на определенное биологическое воздействие • Часто комбинируют со смежной методологией (биохимия белка, молекулярная биология и клеточная физиология) Если: - Наблюдаются количественные изменения в интересующем биологическом процессе - Наблюдаются количественные изменения в модификации белков Тогда: 2 D-электрофорез является подходящим методом Протеомика , БГУ 2011
 Клиническое и биомедицинское применение протеомики • Требуется в ряде клинических ситуаций • Клинические применения 2 -D PAGE & MS – Идентификация происхождения образцов жидкостей организма и образцов тканей, полученных биопсией. – Анализ белковых фенотипов и посттрансляционных модификаций в жидкостях, клетках или тканях. – Изучение клональности иммуноглобулинов и определение клонов, которые не могут быть определены обычными методами. – Наблюдение за процессом течения болезни и экспрессией белков. – Определение новых биомаркеров болезней и/или шаблонов в клетках и тканях. Протеомика , БГУ 2011
Клиническое и биомедицинское применение протеомики • Требуется в ряде клинических ситуаций • Клинические применения 2 -D PAGE & MS – Идентификация происхождения образцов жидкостей организма и образцов тканей, полученных биопсией. – Анализ белковых фенотипов и посттрансляционных модификаций в жидкостях, клетках или тканях. – Изучение клональности иммуноглобулинов и определение клонов, которые не могут быть определены обычными методами. – Наблюдение за процессом течения болезни и экспрессией белков. – Определение новых биомаркеров болезней и/или шаблонов в клетках и тканях. Протеомика , БГУ 2011
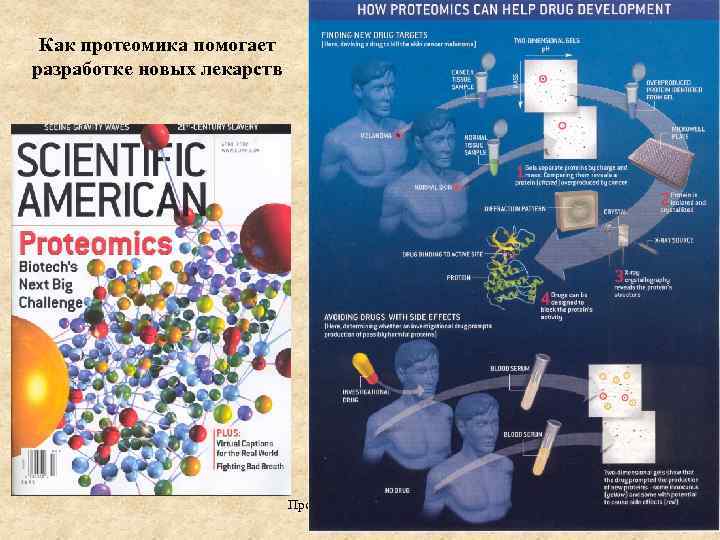 Как протеомика помогает разработке новых лекарств Протеомика , БГУ 2011
Как протеомика помогает разработке новых лекарств Протеомика , БГУ 2011
 Клиническое применение 2 -D электрофореза • Физиологические жидкости – – – – – Клетки крови Плазма и сыворотка Моча Цереброспинальная жидкость Амниотическая жидкость Синовиальная жидкость Слюна Пот Слезная жидкость • Твердые ткани – Сердце – Мозг – Щитовидная железа – Мышца • Злокачественые опухоли • Культура тканей • Малигнизированные клетки • Бактериальные белки Young & Tracy Journal of Chromatography A, 698 (1995) 163 -179 Протеомика , БГУ 2011
Клиническое применение 2 -D электрофореза • Физиологические жидкости – – – – – Клетки крови Плазма и сыворотка Моча Цереброспинальная жидкость Амниотическая жидкость Синовиальная жидкость Слюна Пот Слезная жидкость • Твердые ткани – Сердце – Мозг – Щитовидная железа – Мышца • Злокачественые опухоли • Культура тканей • Малигнизированные клетки • Бактериальные белки Young & Tracy Journal of Chromatography A, 698 (1995) 163 -179 Протеомика , БГУ 2011
 Заключение • Протеом — совокупность белков организма. • Протеомика — изучает белки и их взаимодействия в живых организмах. • Цель протеомики - интегральное изучение поведения и функций клеточных белков в живой клетке • Задачи протеомики: – каталогизация всех белков, синтезируемых различными типами клеток; – выяснение характера влияния возраста, условий окружающей среды и заболеваний на синтезируемые клеткой протеины; – выяснение функций идентифицированных белков; – составление схем связей между повышением или понижением уровня синтеза белков и происходящими в организме процессами, например, при развитии заболевания, инфицировании организма или биохимическими реакциями сельскохозяйственного растения, происходящими в ответ на нападение насекомых; – изучение взаимодействий различных белков с другими белками, содержащимися внутри клетки и во внеклеточном пространстве. • Основная методология – двумерный электрофорез – ВЭЖХ – масс –спектроскопия - биоинформатика Протеомика , БГУ 2011
Заключение • Протеом — совокупность белков организма. • Протеомика — изучает белки и их взаимодействия в живых организмах. • Цель протеомики - интегральное изучение поведения и функций клеточных белков в живой клетке • Задачи протеомики: – каталогизация всех белков, синтезируемых различными типами клеток; – выяснение характера влияния возраста, условий окружающей среды и заболеваний на синтезируемые клеткой протеины; – выяснение функций идентифицированных белков; – составление схем связей между повышением или понижением уровня синтеза белков и происходящими в организме процессами, например, при развитии заболевания, инфицировании организма или биохимическими реакциями сельскохозяйственного растения, происходящими в ответ на нападение насекомых; – изучение взаимодействий различных белков с другими белками, содержащимися внутри клетки и во внеклеточном пространстве. • Основная методология – двумерный электрофорез – ВЭЖХ – масс –спектроскопия - биоинформатика Протеомика , БГУ 2011


