ВВед в орг геох 1-2.ppt
- Количество слайдов: 41
 Введение в органическую геохимию Геологический факультет МГУ им. М. В. Ломоносова Кафедра геологии и геохимии горючих ископаемых
Введение в органическую геохимию Геологический факультет МГУ им. М. В. Ломоносова Кафедра геологии и геохимии горючих ископаемых
 1. Введение
1. Введение
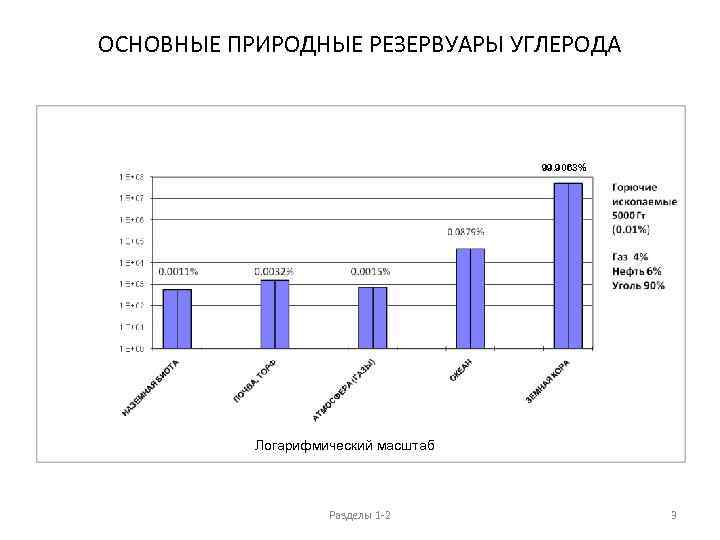 ОСНОВНЫЕ ПРИРОДНЫЕ РЕЗЕРВУАРЫ УГЛЕРОДА 99. 9063% Логарифмический масштаб Разделы 1 -2 3
ОСНОВНЫЕ ПРИРОДНЫЕ РЕЗЕРВУАРЫ УГЛЕРОДА 99. 9063% Логарифмический масштаб Разделы 1 -2 3
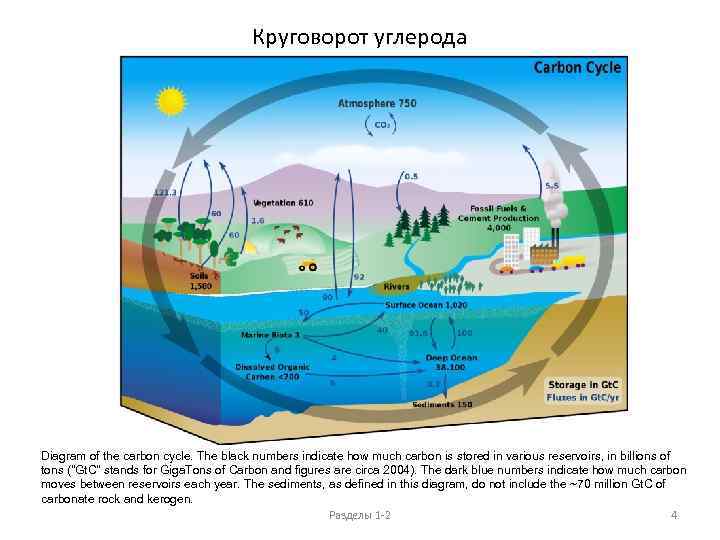 Круговорот углерода Diagram of the carbon cycle. The black numbers indicate how much carbon is stored in various reservoirs, in billions of tons ("Gt. C" stands for Giga. Tons of Carbon and figures are circa 2004). The dark blue numbers indicate how much carbon moves between reservoirs each year. The sediments, as defined in this diagram, do not include the ~70 million Gt. C of carbonate rock and kerogen. Разделы 1 -2 4
Круговорот углерода Diagram of the carbon cycle. The black numbers indicate how much carbon is stored in various reservoirs, in billions of tons ("Gt. C" stands for Giga. Tons of Carbon and figures are circa 2004). The dark blue numbers indicate how much carbon moves between reservoirs each year. The sediments, as defined in this diagram, do not include the ~70 million Gt. C of carbonate rock and kerogen. Разделы 1 -2 4
 Соединения углерода в природных резервуарах Содержание в атмосфере, об. %: CO 2 0, 035% (350 ppm) CO 0. 02 x 10 -4 % (0. 02 ppm) CH 4 1. 7 x 10 -4% (1. 7 ppm) Углерод в природе находится частично в составе органических соединений, число которых чрезвычайно велико, но в основном (по массе) в виде сравнительно небольшого числа (около 200) неорганических соединений и в свободных формах. В осадочных породах он содержится главным образом в составе карбонатных минералов и органических веществ (соответственно около 80 и приблизительно 20 %). Углерод - основная часть всех животных и растений, но по массе его в атмосфере в два раза больше, чем в живой материи. В атмосфере почти весь углерод находится в составе СО 2. В гидросфере более 90 % углерода представлено в виде СО 2 и ионов СО 32 -, НСО 3 -. Разделы 1 -2 5
Соединения углерода в природных резервуарах Содержание в атмосфере, об. %: CO 2 0, 035% (350 ppm) CO 0. 02 x 10 -4 % (0. 02 ppm) CH 4 1. 7 x 10 -4% (1. 7 ppm) Углерод в природе находится частично в составе органических соединений, число которых чрезвычайно велико, но в основном (по массе) в виде сравнительно небольшого числа (около 200) неорганических соединений и в свободных формах. В осадочных породах он содержится главным образом в составе карбонатных минералов и органических веществ (соответственно около 80 и приблизительно 20 %). Углерод - основная часть всех животных и растений, но по массе его в атмосфере в два раза больше, чем в живой материи. В атмосфере почти весь углерод находится в составе СО 2. В гидросфере более 90 % углерода представлено в виде СО 2 и ионов СО 32 -, НСО 3 -. Разделы 1 -2 5
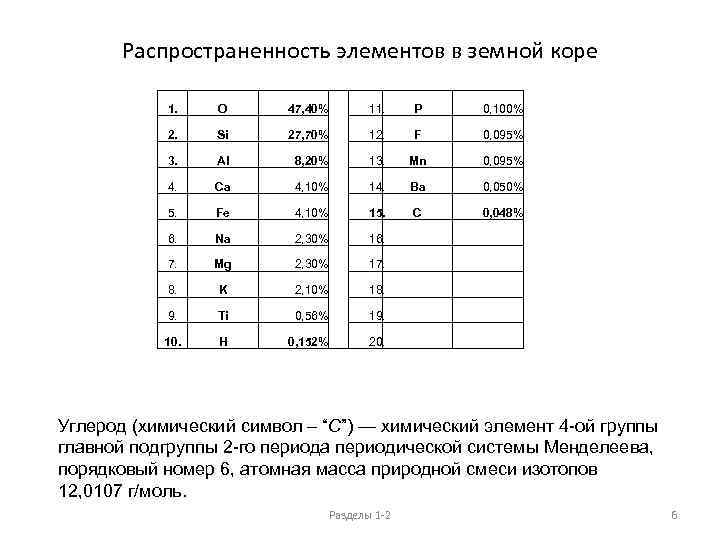 Распространенность элементов в земной коре 1. O 47, 40% 11. P 0, 100% 2. Si 27, 70% 12. F 0, 095% 3. Al 8, 20% 13. Mn 0, 095% 4. Ca 4, 10% 14. Ba 0, 050% 5. Fe 4, 10% 15. C 0, 048% 6. Na 2, 30% 16. 7. Mg 2, 30% 17. 8. K 2, 10% 18. 9. Ti 0, 56% 19. 10. H 0, 152% 20. Углерод (химический символ – “C”) — химический элемент 4 -ой группы главной подгруппы 2 -го периода периодической системы Менделеева, порядковый номер 6, атомная масса природной смеси изотопов 12, 0107 г/моль. Разделы 1 -2 6
Распространенность элементов в земной коре 1. O 47, 40% 11. P 0, 100% 2. Si 27, 70% 12. F 0, 095% 3. Al 8, 20% 13. Mn 0, 095% 4. Ca 4, 10% 14. Ba 0, 050% 5. Fe 4, 10% 15. C 0, 048% 6. Na 2, 30% 16. 7. Mg 2, 30% 17. 8. K 2, 10% 18. 9. Ti 0, 56% 19. 10. H 0, 152% 20. Углерод (химический символ – “C”) — химический элемент 4 -ой группы главной подгруппы 2 -го периода периодической системы Менделеева, порядковый номер 6, атомная масса природной смеси изотопов 12, 0107 г/моль. Разделы 1 -2 6
 Изотопный состав углерода Изотопы - атомы одного и того же химического элемента с разными массовыми числами. Различают изотопы радиоактивные и стабильные. Для углерода известны изотопы от 8 С до 22 С. Изотоп Протоны, Z Нейтроны, N Масс. число, Содержание, A % 12 С 6 6 6 12 98. 93 13 С 6 6 7 13 1. 07 14 С* 6 6 8 14 10 -12 14 С*; T 6 1/2 = 5730 лет Радиоактивный Углерод-14 образуется в верхних слоях тропосферы и стратосферы в результате поглощения атомами азота-14 тепловых нейтронов, которые в свою очередь являются результатом взаимодействия космических лучей и вещества атмосферы: Атомы 14 С* нестабильны и превращаются в 14 N при b-распаде. Радиоуглерод, соединяясь с кислородом, образует диоксид углерода 14 СО 2. Вместе с обычным диоксидом углерода (12 СО 2) последний участвует в фотосинтезе. Все живое имеет то же соотношение 14 С/12 С, что и атмосфера. После отмирания организмов радиоактивный распад приводит к уменьшению содержания 14 С, постоянство 14 С/12 С нарушается. На этом и основана углеродная геохронология. Однако, поскольку период полураспада 14 С сравнительно короткий (5730 лет), метод применим лишь для объектов моложе 70 тыс. лет. Разделы 1 -2 7
Изотопный состав углерода Изотопы - атомы одного и того же химического элемента с разными массовыми числами. Различают изотопы радиоактивные и стабильные. Для углерода известны изотопы от 8 С до 22 С. Изотоп Протоны, Z Нейтроны, N Масс. число, Содержание, A % 12 С 6 6 6 12 98. 93 13 С 6 6 7 13 1. 07 14 С* 6 6 8 14 10 -12 14 С*; T 6 1/2 = 5730 лет Радиоактивный Углерод-14 образуется в верхних слоях тропосферы и стратосферы в результате поглощения атомами азота-14 тепловых нейтронов, которые в свою очередь являются результатом взаимодействия космических лучей и вещества атмосферы: Атомы 14 С* нестабильны и превращаются в 14 N при b-распаде. Радиоуглерод, соединяясь с кислородом, образует диоксид углерода 14 СО 2. Вместе с обычным диоксидом углерода (12 СО 2) последний участвует в фотосинтезе. Все живое имеет то же соотношение 14 С/12 С, что и атмосфера. После отмирания организмов радиоактивный распад приводит к уменьшению содержания 14 С, постоянство 14 С/12 С нарушается. На этом и основана углеродная геохронология. Однако, поскольку период полураспада 14 С сравнительно короткий (5730 лет), метод применим лишь для объектов моложе 70 тыс. лет. Разделы 1 -2 7
 Изотопный состав углерода Соотношение стабильных изотопов углерода 126 С и 136 С (изотопный состав углерода) в органической геохимии широко используется для решения ряда генетических вопросов. Для сопоставления изотопного состава исследуемых объектов используют величину 13 С: где в качестве стандарта используется эталон PDB (Pee Dee Belemnite) - углерод карбоната кальция белемнита (Belimnitella Americana) позднемелового возраста из формации Пи-Ди в Южной Каролине (США). Этот стандарт отличается аномально высоким соотношением 13 C: 12 C (0. 0112372, или 1123. 72· 10 -5). 13 С со знаком плюс соответствует избытку, а со знаком минус - дефициту тяжелого изотопа по сравнению со стандартом. В результате химических и биохимических процессов происходит фракционирование изотопов углерода. При усвоении углерода живым веществом связывается преимущественно 12 С, поэтому живое вещество и его производные - ОВ осадков, уголь, нефть, метан - характеризуются относительно низкими содержаниями 13 С по сравнению с источниками усваиваемого организмами углерода. Фотосинтез приводит к значительному обогащению легким изотопом 12 С, карбонатообразование ведет к смещению. в сторону «утяжеления» - повышению относительного содержания 13 С. Разделы 1 -2 8
Изотопный состав углерода Соотношение стабильных изотопов углерода 126 С и 136 С (изотопный состав углерода) в органической геохимии широко используется для решения ряда генетических вопросов. Для сопоставления изотопного состава исследуемых объектов используют величину 13 С: где в качестве стандарта используется эталон PDB (Pee Dee Belemnite) - углерод карбоната кальция белемнита (Belimnitella Americana) позднемелового возраста из формации Пи-Ди в Южной Каролине (США). Этот стандарт отличается аномально высоким соотношением 13 C: 12 C (0. 0112372, или 1123. 72· 10 -5). 13 С со знаком плюс соответствует избытку, а со знаком минус - дефициту тяжелого изотопа по сравнению со стандартом. В результате химических и биохимических процессов происходит фракционирование изотопов углерода. При усвоении углерода живым веществом связывается преимущественно 12 С, поэтому живое вещество и его производные - ОВ осадков, уголь, нефть, метан - характеризуются относительно низкими содержаниями 13 С по сравнению с источниками усваиваемого организмами углерода. Фотосинтез приводит к значительному обогащению легким изотопом 12 С, карбонатообразование ведет к смещению. в сторону «утяжеления» - повышению относительного содержания 13 С. Разделы 1 -2 8
 2. Основные положения химии соединений углерода
2. Основные положения химии соединений углерода
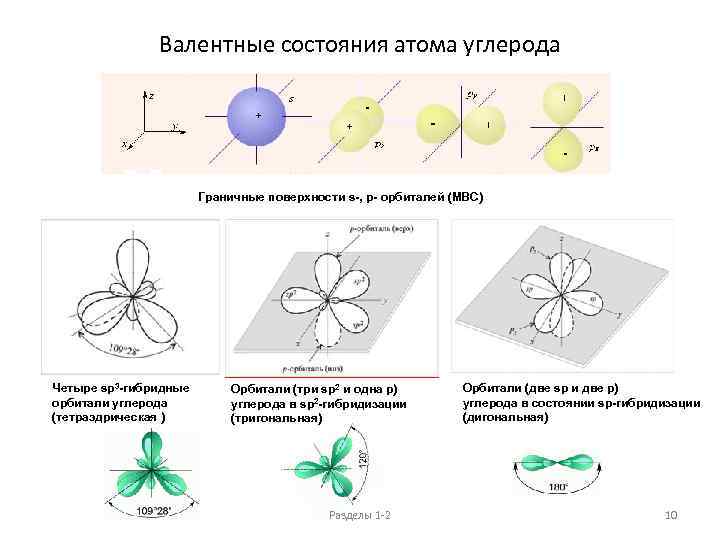 Валентные состояния атома углерода Граничные поверхности s-, p- орбиталей (МВС) Четыре sp 3 -гибридные орбитали углерода (тетраэдрическая ) Орбитали (три sp 2 и одна р) углерода в sp 2 -гибридизации (тригональная) Разделы 1 -2 Орбитали (две sp и две р) углерода в состоянии sp-гибридизации (дигональная) 10
Валентные состояния атома углерода Граничные поверхности s-, p- орбиталей (МВС) Четыре sp 3 -гибридные орбитали углерода (тетраэдрическая ) Орбитали (три sp 2 и одна р) углерода в sp 2 -гибридизации (тригональная) Разделы 1 -2 Орбитали (две sp и две р) углерода в состоянии sp-гибридизации (дигональная) 10
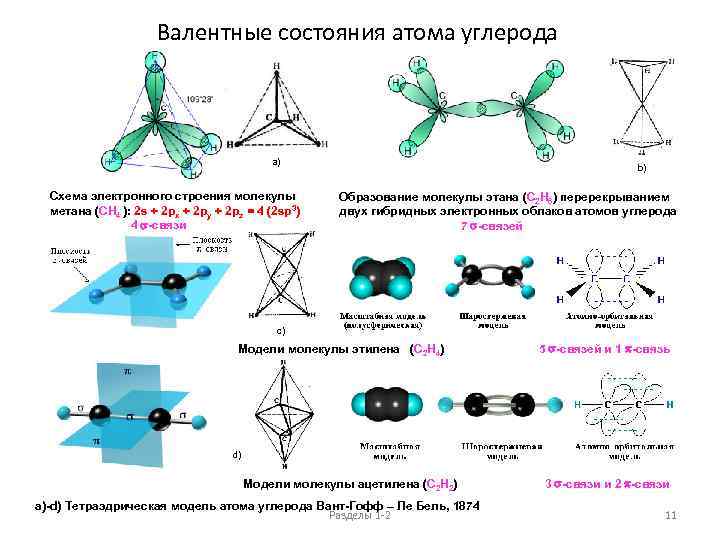 Валентные состояния атома углерода a) Схема электронного строения молекулы метана (CH 4 ): 2 s + 2 px + 2 py + 2 pz = 4 (2 sp 3) 4 s-связи b) Образование молекулы этана (C 2 H 6) перерекрыванием двух гибридных электронных облаков атомов углерода 7 s-связей c) Модели молекулы этилена (C 2 H 4) 5 s-связей и 1 p-связь d) Модели молекулы ацетилена (C 2 H 2) 3 s-связи и 2 p-связи a)-d) Тетраэдрическая модель атома углерода Вант-Гофф – Ле Бель, 1874 Разделы 1 -2 11
Валентные состояния атома углерода a) Схема электронного строения молекулы метана (CH 4 ): 2 s + 2 px + 2 py + 2 pz = 4 (2 sp 3) 4 s-связи b) Образование молекулы этана (C 2 H 6) перерекрыванием двух гибридных электронных облаков атомов углерода 7 s-связей c) Модели молекулы этилена (C 2 H 4) 5 s-связей и 1 p-связь d) Модели молекулы ацетилена (C 2 H 2) 3 s-связи и 2 p-связи a)-d) Тетраэдрическая модель атома углерода Вант-Гофф – Ле Бель, 1874 Разделы 1 -2 11
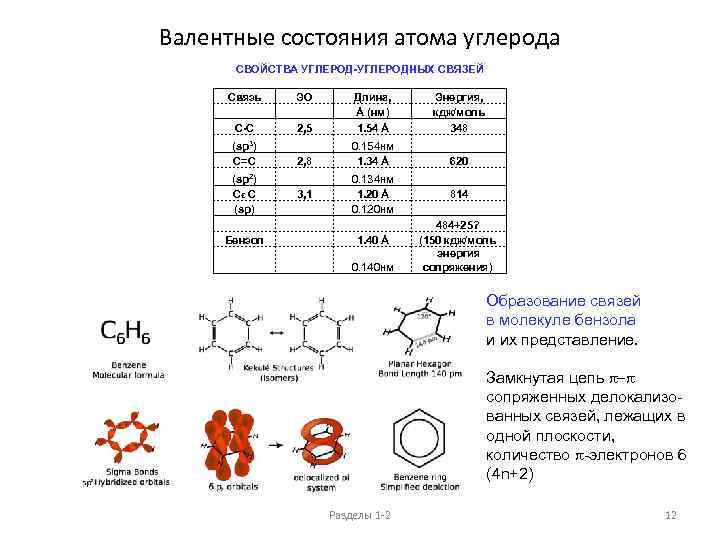 Валентные состояния атома углерода СВОЙСТВА УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ Связь C-C ЭО 2, 5 Энергия, кдж/моль 348 2, 8 0. 154 нм 1. 34 Å 620 3, 1 0. 134 нм 1. 20 Å 0. 120 нм 1. 40 Å 814 484+25? (150 кдж/моль энергия сопряжения) (sp 3) C=C (sp 2) Cє C (sp) Бензол Длина, Å (нм) 1. 54 Å 0. 140 нм Образование связей в молекуле бензола и их представление. Замкнутая цепь p-p сопряженных делокализованных связей, лежащих в одной плоскости, количество p-электронов 6 (4 n+2) Разделы 1 -2 12
Валентные состояния атома углерода СВОЙСТВА УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ Связь C-C ЭО 2, 5 Энергия, кдж/моль 348 2, 8 0. 154 нм 1. 34 Å 620 3, 1 0. 134 нм 1. 20 Å 0. 120 нм 1. 40 Å 814 484+25? (150 кдж/моль энергия сопряжения) (sp 3) C=C (sp 2) Cє C (sp) Бензол Длина, Å (нм) 1. 54 Å 0. 140 нм Образование связей в молекуле бензола и их представление. Замкнутая цепь p-p сопряженных делокализованных связей, лежащих в одной плоскости, количество p-электронов 6 (4 n+2) Разделы 1 -2 12
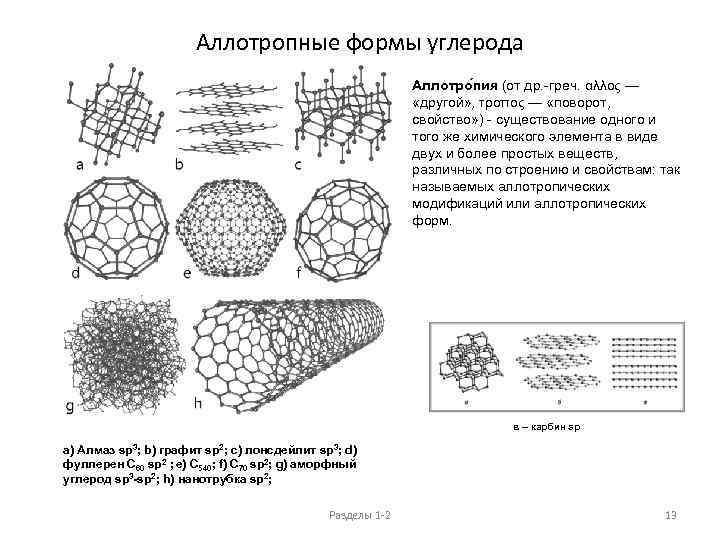 Аллотропные формы углерода Аллотро пия (от др. -греч. αλλος — «другой» , τροπος — «поворот, свойство» ) - существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм. в – карбин sp a) Алмаз sp 3; b) графит sp 2; c) лонсдейлит sp 3; d) фуллерен С 60 sp 2 ; e) С 540; f) С 70 sp 2; g) аморфный углерод sp 3 -sp 2; h) нанотрубка sp 2; Разделы 1 -2 13
Аллотропные формы углерода Аллотро пия (от др. -греч. αλλος — «другой» , τροπος — «поворот, свойство» ) - существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм. в – карбин sp a) Алмаз sp 3; b) графит sp 2; c) лонсдейлит sp 3; d) фуллерен С 60 sp 2 ; e) С 540; f) С 70 sp 2; g) аморфный углерод sp 3 -sp 2; h) нанотрубка sp 2; Разделы 1 -2 13
 Аллотропные формы углерода Нано-почки Разделы 1 -2 14
Аллотропные формы углерода Нано-почки Разделы 1 -2 14
 Аллотропные формы углерода Графен (sp 2) является двумерным кристаллом, состоящим из одиночного слоя атомов углерода, собранных в гексагональную решётку. Расстояние С-С 0. 142 нм, толщина графенового слоя 0. 54 -1 нм За новаторские эксперименты с графеном Нобелевская премия 2010 года по физике присуждена Андрею Гейму и Константину Новосёлову. Разделы 1 -2 15
Аллотропные формы углерода Графен (sp 2) является двумерным кристаллом, состоящим из одиночного слоя атомов углерода, собранных в гексагональную решётку. Расстояние С-С 0. 142 нм, толщина графенового слоя 0. 54 -1 нм За новаторские эксперименты с графеном Нобелевская премия 2010 года по физике присуждена Андрею Гейму и Константину Новосёлову. Разделы 1 -2 15
 Аллотропные формы углерода Диаметр 0. 71 нм Фуллерен С 60 Фуллерен C 60 - усеченный икосаэдр, 60 вершин, которого занимают атомы углерода, имеет 20 шестиугольных и 12 пятиугольных граней. 60 p-электронов гибридизация sp 2. 27 Фуллерен С 60 в кристаллической форме Чистый фуллерен С 60 в растворе толуола 1 -2 Разделы 16
Аллотропные формы углерода Диаметр 0. 71 нм Фуллерен С 60 Фуллерен C 60 - усеченный икосаэдр, 60 вершин, которого занимают атомы углерода, имеет 20 шестиугольных и 12 пятиугольных граней. 60 p-электронов гибридизация sp 2. 27 Фуллерен С 60 в кристаллической форме Чистый фуллерен С 60 в растворе толуола 1 -2 Разделы 16
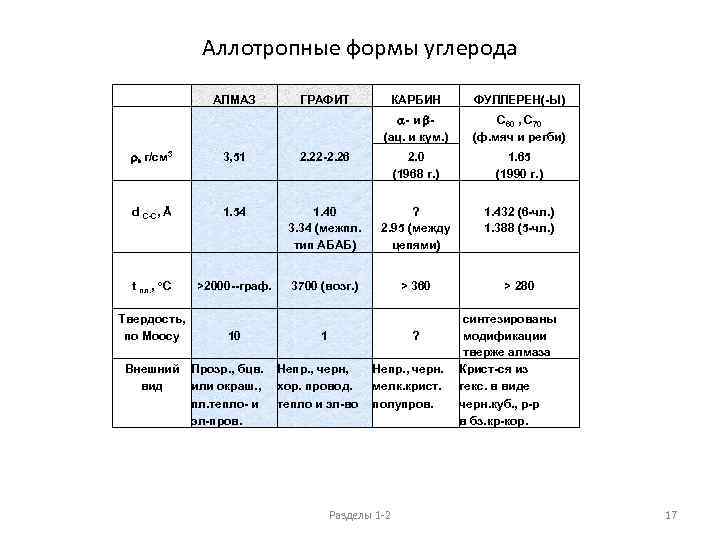 Аллотропные формы углерода АЛМАЗ r, г/см 3 d C-C, Å ГРАФИТ 3, 51 1. 54 пл. тепло- и эл-пров. С 60 , С 70 (ф. мяч и регби) 2. 0 (1968 г. ) 1. 65 (1990 г. ) 2. 22 -2. 26 ФУЛЛЕРЕН(-Ы) a- и b- (ац. и кум. ) 1. 40 3. 34 (межпл. тип AБAБ) ? 2. 95 (между цепями) t пл. , о. С >2000 --граф. 3700 (возг. ) Твердость, по Моосу 10 1 Внешний Прозр. , бцв. Непр. , черн, вид или окраш. , хор. провод. КАРБИН тепло и эл-во 1. 432 (6 -чл. ) 1. 388 (5 -чл. ) > 360 > 280 Непр. , черн. мелк. крист. синтезированы модификации тверже алмаза Крист-ся из гекс. в виде полупров. черн. куб. , р-р в бз. кр-кор. ? Разделы 1 -2 17
Аллотропные формы углерода АЛМАЗ r, г/см 3 d C-C, Å ГРАФИТ 3, 51 1. 54 пл. тепло- и эл-пров. С 60 , С 70 (ф. мяч и регби) 2. 0 (1968 г. ) 1. 65 (1990 г. ) 2. 22 -2. 26 ФУЛЛЕРЕН(-Ы) a- и b- (ац. и кум. ) 1. 40 3. 34 (межпл. тип AБAБ) ? 2. 95 (между цепями) t пл. , о. С >2000 --граф. 3700 (возг. ) Твердость, по Моосу 10 1 Внешний Прозр. , бцв. Непр. , черн, вид или окраш. , хор. провод. КАРБИН тепло и эл-во 1. 432 (6 -чл. ) 1. 388 (5 -чл. ) > 360 > 280 Непр. , черн. мелк. крист. синтезированы модификации тверже алмаза Крист-ся из гекс. в виде полупров. черн. куб. , р-р в бз. кр-кор. ? Разделы 1 -2 17
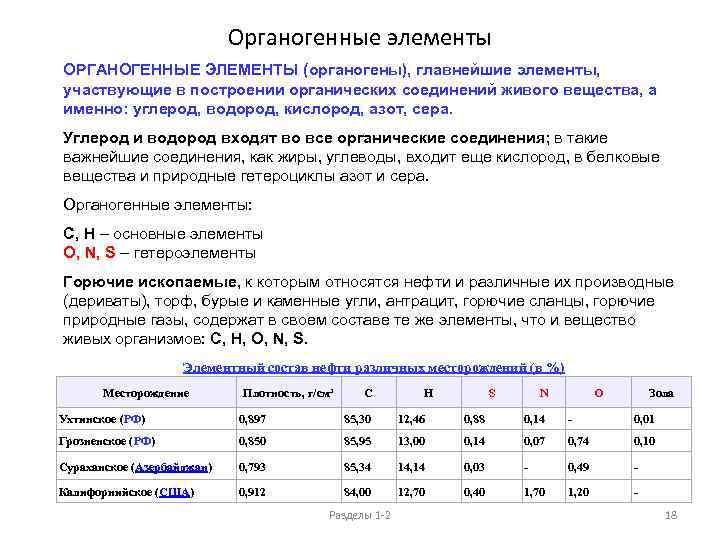 Органогенные элементы ОРГАНОГЕННЫЕ ЭЛЕМЕНТЫ (органогены), главнейшие элементы, участвующие в построении органических соединений живого вещества, а именно: углерод, водород, кислород, азот, сера. Углерод и водород входят во все органические соединения; в такие важнейшие соединения, как жиры, углеводы, входит еще кислород, в белковые вещества и природные гетероциклы азот и сера. Органогенные элементы: C, H – основные элементы O, N, S – гетероэлементы Горючие ископаемые, к которым относятся нефти и различные их производные (дериваты), торф, бурые и каменные угли, антрацит, горючие сланцы, горючие природные газы, содержат в своем составе те же элементы, что и вещество живых организмов: C, H, O, N, S. Элементный состав нефти различных месторождений (в %) Месторождение Плотность, г/см³ С Н S N O Зола Ухтинское (РФ) 0, 897 85, 30 12, 46 0, 88 0, 14 - 0, 01 Грозненское (РФ) 0, 850 85, 95 13, 00 0, 14 0, 07 0, 74 0, 10 Сураханское (Азербайджан) 0, 793 85, 34 14, 14 0, 03 - 0, 49 - Калифорнийское (США) 0, 912 84, 00 12, 70 0, 40 1, 70 1, 20 - Разделы 1 -2 18
Органогенные элементы ОРГАНОГЕННЫЕ ЭЛЕМЕНТЫ (органогены), главнейшие элементы, участвующие в построении органических соединений живого вещества, а именно: углерод, водород, кислород, азот, сера. Углерод и водород входят во все органические соединения; в такие важнейшие соединения, как жиры, углеводы, входит еще кислород, в белковые вещества и природные гетероциклы азот и сера. Органогенные элементы: C, H – основные элементы O, N, S – гетероэлементы Горючие ископаемые, к которым относятся нефти и различные их производные (дериваты), торф, бурые и каменные угли, антрацит, горючие сланцы, горючие природные газы, содержат в своем составе те же элементы, что и вещество живых организмов: C, H, O, N, S. Элементный состав нефти различных месторождений (в %) Месторождение Плотность, г/см³ С Н S N O Зола Ухтинское (РФ) 0, 897 85, 30 12, 46 0, 88 0, 14 - 0, 01 Грозненское (РФ) 0, 850 85, 95 13, 00 0, 14 0, 07 0, 74 0, 10 Сураханское (Азербайджан) 0, 793 85, 34 14, 14 0, 03 - 0, 49 - Калифорнийское (США) 0, 912 84, 00 12, 70 0, 40 1, 70 1, 20 - Разделы 1 -2 18
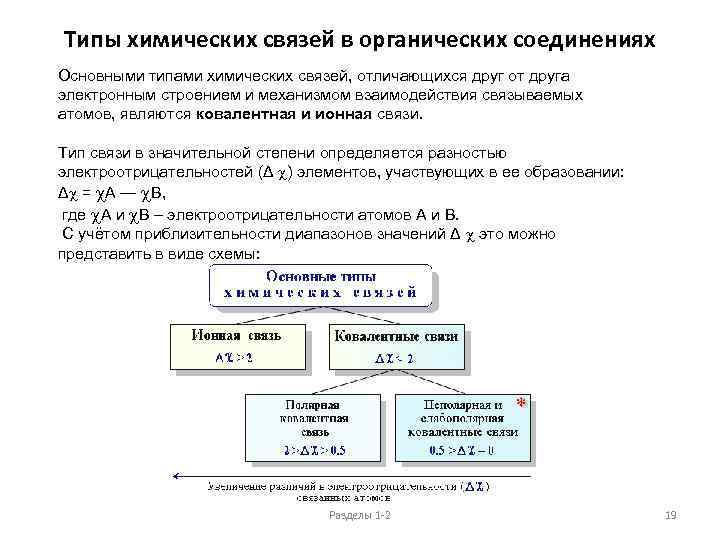 Типы химических связей в органических соединениях Основными типами химических связей, отличающихся друг от друга электронным строением и механизмом взаимодействия связываемых атомов, являются ковалентная и ионная связи. Тип связи в значительной степени определяется разностью электроотрицательностей (Δ ) элементов, участвующих в ее образовании: Δ = А — В, где А и В – электроотрицательности атомов А и В. С учётом приблизительности диапазонов значений Δ это можно представить в виде схемы: Разделы 1 -2 19
Типы химических связей в органических соединениях Основными типами химических связей, отличающихся друг от друга электронным строением и механизмом взаимодействия связываемых атомов, являются ковалентная и ионная связи. Тип связи в значительной степени определяется разностью электроотрицательностей (Δ ) элементов, участвующих в ее образовании: Δ = А — В, где А и В – электроотрицательности атомов А и В. С учётом приблизительности диапазонов значений Δ это можно представить в виде схемы: Разделы 1 -2 19
 Типы химических связей в органических соединениях Электроотрицательность (ЭО) Электроотрицательность - это способность атома притягивать к себе валентные электроны других атомов. Шкала электротрицательностей по Полингу Li 1, 0 Na 0, 9 Cs 0, 7 Be 1, 6 Mg 1, 3 B 2, 0 Al 1, 6 H 2, 1 C 2, 5 Si 1, 9 N 3, 0 P 2, 2 O 3, 5 S 2, 6 F 4, 0 Cl 3, 2 Прим. Электроотрицательность углерода в состоянии sp 2 и sp 3 гибридизации составляет 2, 8 и 3, 1 соответственно. Разделы 1 -2 20
Типы химических связей в органических соединениях Электроотрицательность (ЭО) Электроотрицательность - это способность атома притягивать к себе валентные электроны других атомов. Шкала электротрицательностей по Полингу Li 1, 0 Na 0, 9 Cs 0, 7 Be 1, 6 Mg 1, 3 B 2, 0 Al 1, 6 H 2, 1 C 2, 5 Si 1, 9 N 3, 0 P 2, 2 O 3, 5 S 2, 6 F 4, 0 Cl 3, 2 Прим. Электроотрицательность углерода в состоянии sp 2 и sp 3 гибридизации составляет 2, 8 и 3, 1 соответственно. Разделы 1 -2 20
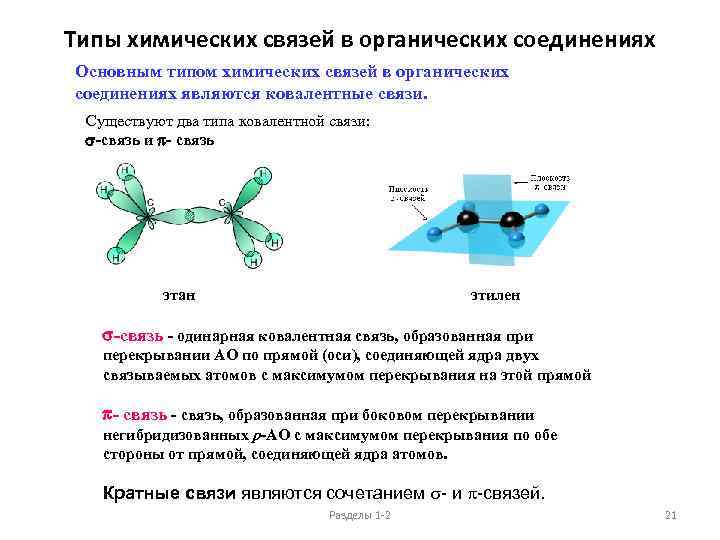 Типы химических связей в органических соединениях Основным типом химических связей в органических соединениях являются ковалентные связи. Существуют два типа ковалентной связи: s-связь и p- связь этан этилен s-связь - одинарная ковалентная связь, образованная при перекрывании АО по прямой (оси), соединяющей ядра двух связываемых атомов с максимумом перекрывания на этой прямой p- связь, образованная при боковом перекрывании негибридизованных p-АО с максимумом перекрывания по обе стороны от прямой, соединяющей ядра атомов. Кратные связи являются сочетанием s- и p-связей. Разделы 1 -2 21
Типы химических связей в органических соединениях Основным типом химических связей в органических соединениях являются ковалентные связи. Существуют два типа ковалентной связи: s-связь и p- связь этан этилен s-связь - одинарная ковалентная связь, образованная при перекрывании АО по прямой (оси), соединяющей ядра двух связываемых атомов с максимумом перекрывания на этой прямой p- связь, образованная при боковом перекрывании негибридизованных p-АО с максимумом перекрывания по обе стороны от прямой, соединяющей ядра атомов. Кратные связи являются сочетанием s- и p-связей. Разделы 1 -2 21
 Типы химических связей в органических соединениях Важными количественными характеристиками ковалентной связи являются энергия связи, ее длина и дипольный момент. Энергия связи – энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов. Энергия связи характеризует ее прочность. Длина связи – расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь. Дипольный момент связи (μ) – векторная величина, характеризующая полярность связи (измеряется в дебаях D или кулон-метрах: 1 D = 3, 4· 10 -30 Кл·м). Энергия связи увеличивается в ряду: простая < двойная < тройная Длина связи растет в обратном порядке: тройная < двойная < простая Разделы 1 -2 22
Типы химических связей в органических соединениях Важными количественными характеристиками ковалентной связи являются энергия связи, ее длина и дипольный момент. Энергия связи – энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов. Энергия связи характеризует ее прочность. Длина связи – расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь. Дипольный момент связи (μ) – векторная величина, характеризующая полярность связи (измеряется в дебаях D или кулон-метрах: 1 D = 3, 4· 10 -30 Кл·м). Энергия связи увеличивается в ряду: простая < двойная < тройная Длина связи растет в обратном порядке: тройная < двойная < простая Разделы 1 -2 22
 Типы химических связей в органических соединениях Донорно-акцепторная связь Ковалентная связь, образующаяся за счет пары электронов одного из атомов, т. е. по донорно-акцепторному механизму, называется дoнорно-акцeпторной. Например, такая связь образуется между атомом азота в молекуле метиламина CH 3 NH 2 и протоном H+ кислоты HCl: Атом азота отдает свою электронную пару для образования связи и выступает в роли донора, а протон предоставляет вакантную орбиталь, играя роль акцептора. Атом-донор при этом приобретает положительный заряд. Донорно-акцeпторная связь отличается только способом образования; по свойствам она одинакова с остальными ковалентными связями. Разделы 1 -2 23
Типы химических связей в органических соединениях Донорно-акцепторная связь Ковалентная связь, образующаяся за счет пары электронов одного из атомов, т. е. по донорно-акцепторному механизму, называется дoнорно-акцeпторной. Например, такая связь образуется между атомом азота в молекуле метиламина CH 3 NH 2 и протоном H+ кислоты HCl: Атом азота отдает свою электронную пару для образования связи и выступает в роли донора, а протон предоставляет вакантную орбиталь, играя роль акцептора. Атом-донор при этом приобретает положительный заряд. Донорно-акцeпторная связь отличается только способом образования; по свойствам она одинакова с остальными ковалентными связями. Разделы 1 -2 23
 Типы химических связей в органических соединениях Водородные связи (Н-связи) Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др. ), испытывает недостаток электронов и поэтому способен взаимодействовать с неподеленной парой электронов другого электроотрицательного атома этой же или другой молекулы. В результате возникает водородная связь, которая графически обозначается тремя точками: Эта связь значительно слабее других химических связей (энергия ее образования 1040 к. Дж/моль) и в основном определяется электростатическим и донорноакцепторным взаимодействиями. Н-связи влияют на физические и химические свойства вещества. Силы электростатического притяжения разноименных концов диполей полярных связей (О-Н, N-H и т. п. ) довольно слабы и действуют лишь на малых расстояниях. Водород, обладая наименьшим атомным радиусом, позволяет сблизиться таким диполям настолько, что силы притяжения становятся заметными. Никакой другой элемент с большим атомным радиусом не способен к образованию подобных связей. Разделы 1 -2 24
Типы химических связей в органических соединениях Водородные связи (Н-связи) Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др. ), испытывает недостаток электронов и поэтому способен взаимодействовать с неподеленной парой электронов другого электроотрицательного атома этой же или другой молекулы. В результате возникает водородная связь, которая графически обозначается тремя точками: Эта связь значительно слабее других химических связей (энергия ее образования 1040 к. Дж/моль) и в основном определяется электростатическим и донорноакцепторным взаимодействиями. Н-связи влияют на физические и химические свойства вещества. Силы электростатического притяжения разноименных концов диполей полярных связей (О-Н, N-H и т. п. ) довольно слабы и действуют лишь на малых расстояниях. Водород, обладая наименьшим атомным радиусом, позволяет сблизиться таким диполям настолько, что силы притяжения становятся заметными. Никакой другой элемент с большим атомным радиусом не способен к образованию подобных связей. Разделы 1 -2 24
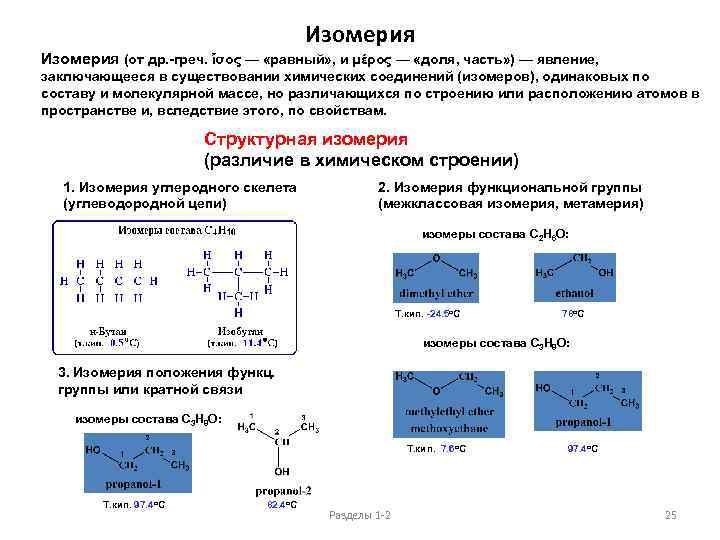 Изомерия (от др. -греч. ἴσος — «равный» , и μέρος — «доля, часть» ) — явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам. Структурная изомерия (различие в химическом строении) 1. Изомерия углеродного скелета (углеводородной цепи) 2. Изомерия функциональной группы (межклассовая изомерия, метамерия) изомеры состава C 2 H 6 O: Т. кип. -24. 5 о. С 78 о. С изомеры состава C 3 H 8 O: 3. Изомерия положения функц. группы или кратной связи изомеры состава C 3 H 8 O: Т. кип. 7. 6 о. С 97. 4 о. С Т. кип. 97. 4 о. С 82. 4 о. С Разделы 1 -2 25
Изомерия (от др. -греч. ἴσος — «равный» , и μέρος — «доля, часть» ) — явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам. Структурная изомерия (различие в химическом строении) 1. Изомерия углеродного скелета (углеводородной цепи) 2. Изомерия функциональной группы (межклассовая изомерия, метамерия) изомеры состава C 2 H 6 O: Т. кип. -24. 5 о. С 78 о. С изомеры состава C 3 H 8 O: 3. Изомерия положения функц. группы или кратной связи изомеры состава C 3 H 8 O: Т. кип. 7. 6 о. С 97. 4 о. С Т. кип. 97. 4 о. С 82. 4 о. С Разделы 1 -2 25
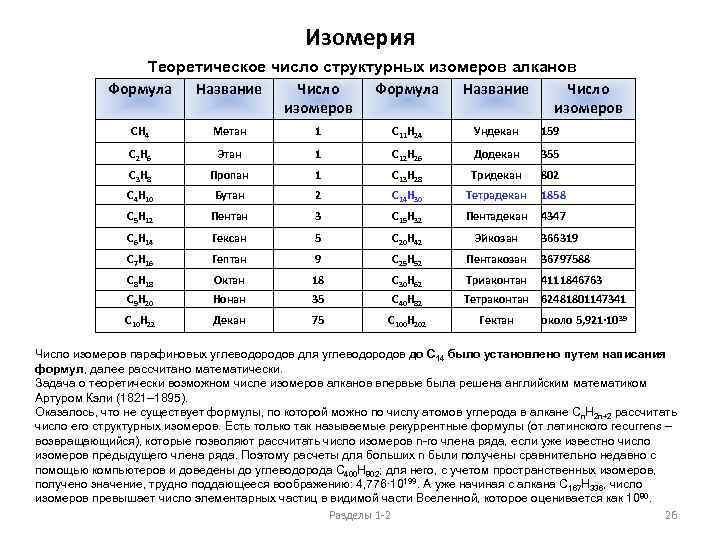 Изомерия Теоретическое число структурных изомеров алканов Формула Название Число изомеров СН 4 Метан 1 С 11 Н 24 Ундекан 159 С 2 Н 6 Этан 1 С 12 Н 26 Додекан 355 С 3 Н 8 Пропан 1 С 13 Н 28 Тридекан 802 С 4 Н 10 Бутан 2 С 14 Н 30 Тетрадекан 1858 С 5 Н 12 Пентан 3 С 15 Н 32 Пентадекан 4347 С 6 Н 14 Гексан 5 С 20 Н 42 Эйкозан С 7 Н 16 Гептан 9 С 25 Н 52 Пентакозан 36797588 С 8 Н 18 Октан 18 С 30 Н 62 Триаконтан 4111846763 С 9 Н 20 Нонан 35 С 40 Н 82 Тетраконтан 62481801147341 С 10 Н 22 Декан 75 С 100 Н 202 Гектан 366319 около 5, 921· 10 39 Число изомеров парафиновых углеводородов для углеводородов до С 14 было установлено путем написания формул, далее рассчитано математически. Задача о теоретически возможном числе изомеров алканов впервые была решена английским математиком Артуром Кэли (1821– 1895). Оказалось, что не существует формулы, по которой можно по числу атомов углерода в алкане Сn. H 2 n+2 рассчитать число его структурных изомеров. Есть только так называемые рекуррентные формулы (от латинского recurrens – возвращающийся), которые позволяют рассчитать число изомеров n-го члена ряда, если уже известно число изомеров предыдущего члена ряда. Поэтому расчеты для больших n были получены сравнительно недавно с помощью компьютеров и доведены до углеводорода С 400 Н 802; для него, с учетом пространственных изомеров, получено значение, трудно поддающееся воображению: 4, 776· 10199. А уже начиная с алкана С 167 Н 336, число изомеров превышает число элементарных частиц в видимой части Вселенной, которое оценивается как 1080. Разделы 1 -2 26
Изомерия Теоретическое число структурных изомеров алканов Формула Название Число изомеров СН 4 Метан 1 С 11 Н 24 Ундекан 159 С 2 Н 6 Этан 1 С 12 Н 26 Додекан 355 С 3 Н 8 Пропан 1 С 13 Н 28 Тридекан 802 С 4 Н 10 Бутан 2 С 14 Н 30 Тетрадекан 1858 С 5 Н 12 Пентан 3 С 15 Н 32 Пентадекан 4347 С 6 Н 14 Гексан 5 С 20 Н 42 Эйкозан С 7 Н 16 Гептан 9 С 25 Н 52 Пентакозан 36797588 С 8 Н 18 Октан 18 С 30 Н 62 Триаконтан 4111846763 С 9 Н 20 Нонан 35 С 40 Н 82 Тетраконтан 62481801147341 С 10 Н 22 Декан 75 С 100 Н 202 Гектан 366319 около 5, 921· 10 39 Число изомеров парафиновых углеводородов для углеводородов до С 14 было установлено путем написания формул, далее рассчитано математически. Задача о теоретически возможном числе изомеров алканов впервые была решена английским математиком Артуром Кэли (1821– 1895). Оказалось, что не существует формулы, по которой можно по числу атомов углерода в алкане Сn. H 2 n+2 рассчитать число его структурных изомеров. Есть только так называемые рекуррентные формулы (от латинского recurrens – возвращающийся), которые позволяют рассчитать число изомеров n-го члена ряда, если уже известно число изомеров предыдущего члена ряда. Поэтому расчеты для больших n были получены сравнительно недавно с помощью компьютеров и доведены до углеводорода С 400 Н 802; для него, с учетом пространственных изомеров, получено значение, трудно поддающееся воображению: 4, 776· 10199. А уже начиная с алкана С 167 Н 336, число изомеров превышает число элементарных частиц в видимой части Вселенной, которое оценивается как 1080. Разделы 1 -2 26
 Изомерия Указанное в таблице число изомеров для большинства алканов значительно возрастет, если рассматривать также зеркально-симметричные молекулы – стереоизомеры: , например, для гептана – с 9 до 11, для декана – с 75 до 136. Число структурных изомеров предельных углеводородов представляет практический интерес только для первых членов ряда. Даже для сравнительно простого алкана, содержащего всего полтора десятка атомов углерода, подавляющее число изомеров не получено и вряд ли будет когда-либо синтезировано. Например, последние из теоретически возможных 75 изомеров декана были синтезированы лишь к 1968 г. И сделано это было для практических целей – чтобы иметь более полный набор стандартных соединений, по которым можно идентифицировать различные углеводороды, например, те, что встречаются в нефти. Кстати, в различных видах нефти были обнаружены все 18 возможных изомеров октана. Но самое интересное, что, начиная с гептадекана С 17 Н 36, сначала лишь некоторые из теоретически возможного числа изомеров, затем – многие, и, наконец, почти все являются ярким примером «бумажной химии» , т. е. не могут существовать в действительности. Дело в том, что по мере роста числа атомов углерода в молекулах разветвленных изомеров возникают серьезные проблемы пространственной упаковки. Ведь математики рассматривали атомы углерода и водорода как точки, тогда как на самом деле они имеют конечный радиус. Так, метановый «шарик» имеет на «поверхности» 4 атома водорода, которые свободно на ней размещаются. В неопентане C(CH 3)4 на «поверхности» уже 12 атомов водорода, расположенные значительно ближе друг к другу; но для них еще есть место для размещения. А вот у алкана [C(CH 3)3]4 (С 17 Н 36) на поверхности становится мало места для размещения всех 36 атомов водорода в 12 метильных группах; это легко проверить, если нарисовать плоское изображение (а еще лучше – слепить объемную модель из пластилина и спичек) для подобных изомеров, соблюдая постоянство длин связей С–С и С–Н и всех углов между ними). С ростом n проблемы размещения возникают и для атомов углерода. В результате, несмотря на то, что число возможных изомеров с ростом n увеличивается очень быстро, доля «бумажных» изомеров растет значительно быстрее. Проведенная с помощью компьютеров оценка показала, что с ростом n отношение числа действительно возможных изомеров к числу «бумажных» быстро стремится к нулю. Именно поэтому расчет точного числа изомеров предельных углеводородов для больших n, которое когда-то вызывало значительный интерес, сейчас имеет для химиков лишь теоретическое значение. Алкан с самыми длинными молекулами был синтезирован английскими химиками в 1985 г. Это нонаконтатриктан С 390 Н 782. Разделы 1 -2 27
Изомерия Указанное в таблице число изомеров для большинства алканов значительно возрастет, если рассматривать также зеркально-симметричные молекулы – стереоизомеры: , например, для гептана – с 9 до 11, для декана – с 75 до 136. Число структурных изомеров предельных углеводородов представляет практический интерес только для первых членов ряда. Даже для сравнительно простого алкана, содержащего всего полтора десятка атомов углерода, подавляющее число изомеров не получено и вряд ли будет когда-либо синтезировано. Например, последние из теоретически возможных 75 изомеров декана были синтезированы лишь к 1968 г. И сделано это было для практических целей – чтобы иметь более полный набор стандартных соединений, по которым можно идентифицировать различные углеводороды, например, те, что встречаются в нефти. Кстати, в различных видах нефти были обнаружены все 18 возможных изомеров октана. Но самое интересное, что, начиная с гептадекана С 17 Н 36, сначала лишь некоторые из теоретически возможного числа изомеров, затем – многие, и, наконец, почти все являются ярким примером «бумажной химии» , т. е. не могут существовать в действительности. Дело в том, что по мере роста числа атомов углерода в молекулах разветвленных изомеров возникают серьезные проблемы пространственной упаковки. Ведь математики рассматривали атомы углерода и водорода как точки, тогда как на самом деле они имеют конечный радиус. Так, метановый «шарик» имеет на «поверхности» 4 атома водорода, которые свободно на ней размещаются. В неопентане C(CH 3)4 на «поверхности» уже 12 атомов водорода, расположенные значительно ближе друг к другу; но для них еще есть место для размещения. А вот у алкана [C(CH 3)3]4 (С 17 Н 36) на поверхности становится мало места для размещения всех 36 атомов водорода в 12 метильных группах; это легко проверить, если нарисовать плоское изображение (а еще лучше – слепить объемную модель из пластилина и спичек) для подобных изомеров, соблюдая постоянство длин связей С–С и С–Н и всех углов между ними). С ростом n проблемы размещения возникают и для атомов углерода. В результате, несмотря на то, что число возможных изомеров с ростом n увеличивается очень быстро, доля «бумажных» изомеров растет значительно быстрее. Проведенная с помощью компьютеров оценка показала, что с ростом n отношение числа действительно возможных изомеров к числу «бумажных» быстро стремится к нулю. Именно поэтому расчет точного числа изомеров предельных углеводородов для больших n, которое когда-то вызывало значительный интерес, сейчас имеет для химиков лишь теоретическое значение. Алкан с самыми длинными молекулами был синтезирован английскими химиками в 1985 г. Это нонаконтатриктан С 390 Н 782. Разделы 1 -2 27
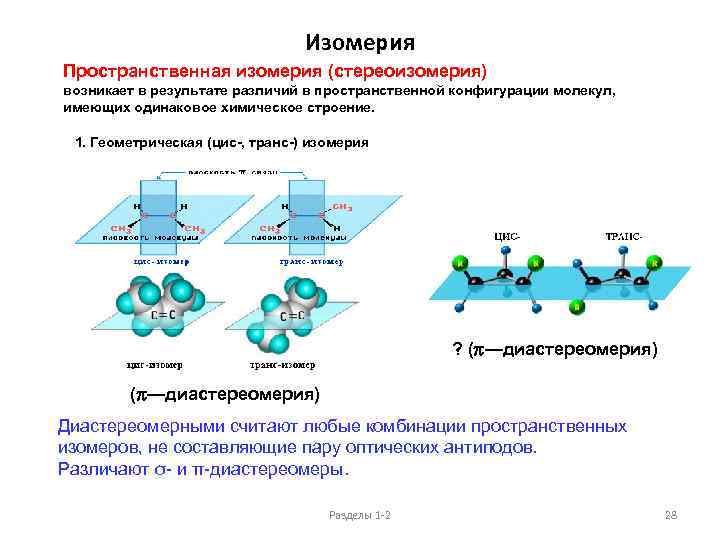 Изомерия Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. 1. Геометрическая (цис-, транс-) изомерия изомеры состава C 4 H 8: ? (p—диастереомерия) Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ- и π-диастереомеры. Разделы 1 -2 28
Изомерия Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. 1. Геометрическая (цис-, транс-) изомерия изомеры состава C 4 H 8: ? (p—диастереомерия) Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ- и π-диастереомеры. Разделы 1 -2 28
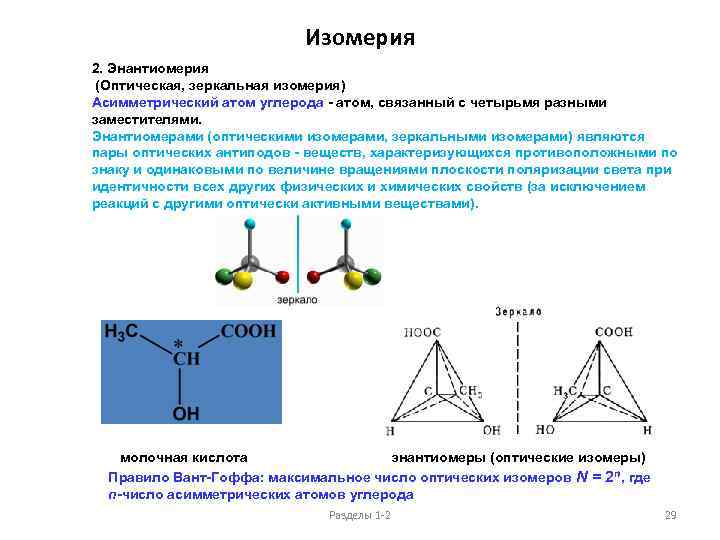 Изомерия 2. Энантиомерия (Оптическая, зеркальная изомерия) Асимметрический атом углерода - атом, связанный с четырьмя разными заместителями. Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов - веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами). молочная кислота энантиомеры (оптические изомеры) Правило Вант-Гоффа: максимальное число оптических изомеров N = 2 n, где n-число асимметрических атомов углерода Разделы 1 -2 29
Изомерия 2. Энантиомерия (Оптическая, зеркальная изомерия) Асимметрический атом углерода - атом, связанный с четырьмя разными заместителями. Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов - веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами). молочная кислота энантиомеры (оптические изомеры) Правило Вант-Гоффа: максимальное число оптических изомеров N = 2 n, где n-число асимметрических атомов углерода Разделы 1 -2 29
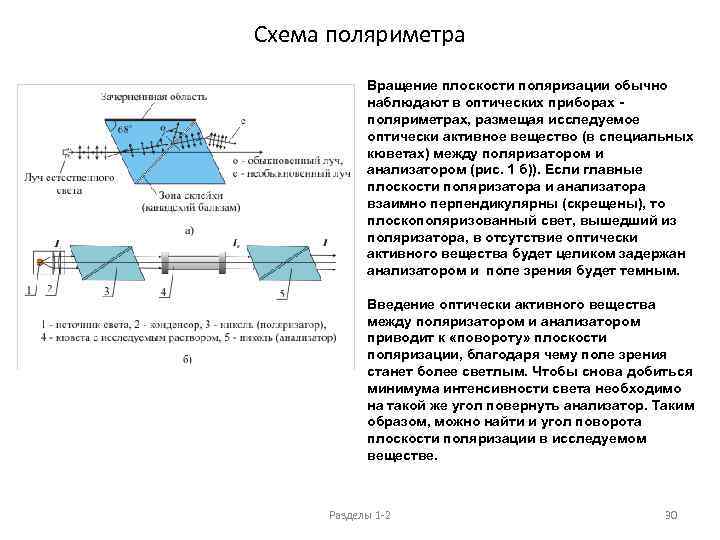 Схема поляриметра Вращение плоскости поляризации обычно наблюдают в оптических приборах - поляриметрах, размещая исследуемое оптически активное вещество (в специальных кюветах) между поляризатором и анализатором (рис. 1 б)). Если главные плоскости поляризатора и анализатора взаимно перпендикулярны (скрещены), то плоскополяризованный свет, вышедший из поляризатора, в отсутствие оптически активного вещества будет целиком задержан анализатором и поле зрения будет темным. Введение оптически активного вещества между поляризатором и анализатором приводит к «повороту» плоскости поляризации, благодаря чему поле зрения станет более светлым. Чтобы снова добиться минимума интенсивности света необходимо на такой же угол повернуть анализатор. Таким образом, можно найти и угол поворота плоскости поляризации в исследуемом веществе. Разделы 1 -2 30
Схема поляриметра Вращение плоскости поляризации обычно наблюдают в оптических приборах - поляриметрах, размещая исследуемое оптически активное вещество (в специальных кюветах) между поляризатором и анализатором (рис. 1 б)). Если главные плоскости поляризатора и анализатора взаимно перпендикулярны (скрещены), то плоскополяризованный свет, вышедший из поляризатора, в отсутствие оптически активного вещества будет целиком задержан анализатором и поле зрения будет темным. Введение оптически активного вещества между поляризатором и анализатором приводит к «повороту» плоскости поляризации, благодаря чему поле зрения станет более светлым. Чтобы снова добиться минимума интенсивности света необходимо на такой же угол повернуть анализатор. Таким образом, можно найти и угол поворота плоскости поляризации в исследуемом веществе. Разделы 1 -2 30
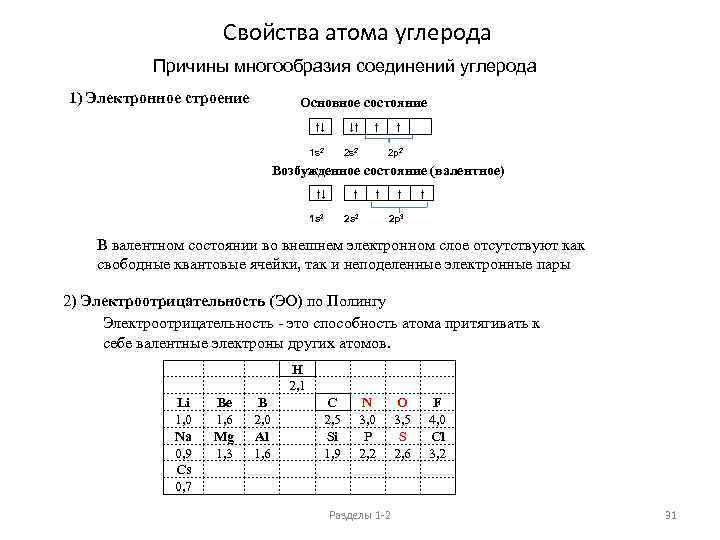 Свойства атома углерода Причины многообразия соединений углерода 1) Электронное строение Основное состояние ↑↓ ↓↑ 1 s 2 ↑ 2 p 2 Возбужденное состояние (валентное) ↑↓ ↑ ↑ 1 s 2 ↑ 2 p 3 В валентном состоянии во внешнем электронном слое отсутствуют как свободные квантовые ячейки, так и неподеленные электронные пары 2) Электроотрицательность (ЭО) по Полингу Электроотрицательность - это способность атома притягивать к себе валентные электроны других атомов. Li 1, 0 Na 0, 9 Cs 0, 7 Be 1, 6 Mg 1, 3 B 2, 0 Al 1, 6 H 2, 1 C 2, 5 Si 1, 9 N 3, 0 P 2, 2 O 3, 5 S 2, 6 Разделы 1 -2 F 4, 0 Cl 3, 2 31
Свойства атома углерода Причины многообразия соединений углерода 1) Электронное строение Основное состояние ↑↓ ↓↑ 1 s 2 ↑ 2 p 2 Возбужденное состояние (валентное) ↑↓ ↑ ↑ 1 s 2 ↑ 2 p 3 В валентном состоянии во внешнем электронном слое отсутствуют как свободные квантовые ячейки, так и неподеленные электронные пары 2) Электроотрицательность (ЭО) по Полингу Электроотрицательность - это способность атома притягивать к себе валентные электроны других атомов. Li 1, 0 Na 0, 9 Cs 0, 7 Be 1, 6 Mg 1, 3 B 2, 0 Al 1, 6 H 2, 1 C 2, 5 Si 1, 9 N 3, 0 P 2, 2 O 3, 5 S 2, 6 Разделы 1 -2 F 4, 0 Cl 3, 2 31
 Свойства атома углерода Причины многообразия соединений углерода Расположение углерода (в состоянии sp 3 -гибридизации ) посередине шкалы ЭО приводит к тому, что он образует ковалентные связи со всеми реакционноспособными элементами периодической системы, стоящими от него слева, в том числе, водородом; справа - кислород, азот, галогены; и снизу - кремний, германий, олово, свинец. 3) Невозможность донорно-акцепторного взаимодействия обусловливает примерно одинаковую прочность связей (одинарных) с водородом, у которого нет неподеленных электронных пар, и с другими атомами, имеющими неподеленные пары, а также связей С-С. 4) Формирование цепей. . . С-С-С. . . энергетически более выгодно, чем молекул С 2, в которых углерод двухвалентен и образует менее прочную p-связь, чем sсвязь в цепях. . . С-С-С… 5) Четырехвалентность углерода представляет широкие возможности для разветвлений цепей углеродных атомов (изомерии), образования циклических структур. Разделы 1 -2 32
Свойства атома углерода Причины многообразия соединений углерода Расположение углерода (в состоянии sp 3 -гибридизации ) посередине шкалы ЭО приводит к тому, что он образует ковалентные связи со всеми реакционноспособными элементами периодической системы, стоящими от него слева, в том числе, водородом; справа - кислород, азот, галогены; и снизу - кремний, германий, олово, свинец. 3) Невозможность донорно-акцепторного взаимодействия обусловливает примерно одинаковую прочность связей (одинарных) с водородом, у которого нет неподеленных электронных пар, и с другими атомами, имеющими неподеленные пары, а также связей С-С. 4) Формирование цепей. . . С-С-С. . . энергетически более выгодно, чем молекул С 2, в которых углерод двухвалентен и образует менее прочную p-связь, чем sсвязь в цепях. . . С-С-С… 5) Четырехвалентность углерода представляет широкие возможности для разветвлений цепей углеродных атомов (изомерии), образования циклических структур. Разделы 1 -2 32
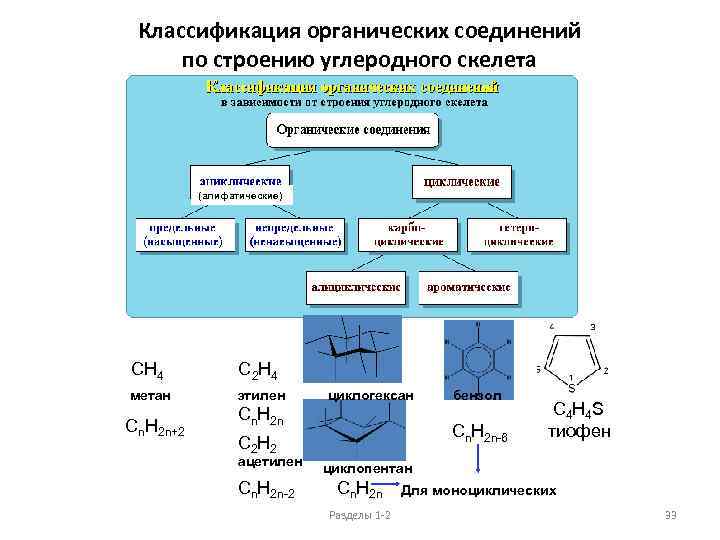 Классификация органических соединений по строению углеродного скелета (алифатические) CH 4 C 2 H 4 метан этилен циклогексан бензол Cn. H 2 n+2 C 4 H 4 S Cn. H 2 n-6 тиофен Cn. H 2 n C 2 H 2 ацетилен циклопентан Cn. H 2 n-2 Cn. H 2 n Разделы 1 -2 Для моноциклических 33
Классификация органических соединений по строению углеродного скелета (алифатические) CH 4 C 2 H 4 метан этилен циклогексан бензол Cn. H 2 n+2 C 4 H 4 S Cn. H 2 n-6 тиофен Cn. H 2 n C 2 H 2 ацетилен циклопентан Cn. H 2 n-2 Cn. H 2 n Разделы 1 -2 Для моноциклических 33
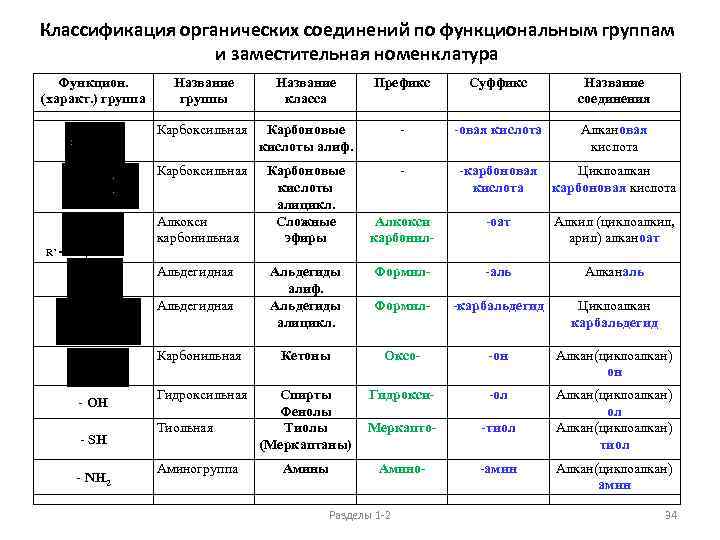 Классификация органических соединений по функциональным группам и заместительная номенклатура Функцион. (характ. ) группа Название группы Название класса Префикс Суффикс Название соединения Карбоксильная Карбоновые кислоты алиф. - -овая кислота Алкановая кислота Карбоксильная Карбоновые кислоты алицикл. Сложные эфиры - Алкокси карбонильная -карбоновая Циклоалкан кислота карбоновая кислота Алкокси карбонил- -оат Алкил (циклоалкил, арил) алканоат Альдегиды алиф. Альдегиды алицикл. Формил- -аль Алканаль Формил- -карбальдегид Циклоалкан карбальдегид Карбонильная Кетоны Оксо- -он Алкан(циклоалкан) он Гидроксильная Спирты Фенолы Тиолы (Меркаптаны) Гидрокси- -ол Меркапто- -тиол Алкан(циклоалкан) тиол Амино- -амин R’ = Alk, Ar Альдегидная - OH - SH - NH 2 Тиольная Аминогруппа Амины Разделы 1 -2 Алкан(циклоалкан) амин 34
Классификация органических соединений по функциональным группам и заместительная номенклатура Функцион. (характ. ) группа Название группы Название класса Префикс Суффикс Название соединения Карбоксильная Карбоновые кислоты алиф. - -овая кислота Алкановая кислота Карбоксильная Карбоновые кислоты алицикл. Сложные эфиры - Алкокси карбонильная -карбоновая Циклоалкан кислота карбоновая кислота Алкокси карбонил- -оат Алкил (циклоалкил, арил) алканоат Альдегиды алиф. Альдегиды алицикл. Формил- -аль Алканаль Формил- -карбальдегид Циклоалкан карбальдегид Карбонильная Кетоны Оксо- -он Алкан(циклоалкан) он Гидроксильная Спирты Фенолы Тиолы (Меркаптаны) Гидрокси- -ол Меркапто- -тиол Алкан(циклоалкан) тиол Амино- -амин R’ = Alk, Ar Альдегидная - OH - SH - NH 2 Тиольная Аминогруппа Амины Разделы 1 -2 Алкан(циклоалкан) амин 34
 Гомологические ряды Гомологический ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — т. н. «гомологическую разность» . Чаще всего это метиленовые звенья: … —СН 2—… Простейший пример гомологического ряда — низшие гомологи алканов (общая формула Сn. H 2 n+2): метан CH 4, этан C 2 H 6, пропан С 3 H 8 и т. д. В гомологических рядах наблюдается закономерное изменение свойств от младших членов ряда к старшим, однако такая закономерность может нарушаться, в первую очередь, в начале ряда. В случае подобия углеродных скелетов соединений, то есть отсутствия изомерии, формулу гомологичных соединений можно записать как X—(СН 2)n —Y, соединения с различным числом n метиленовых звеньев являются гомологами и принадлежат к одному классу соединений (например, H— (СН 2)n—COOH — алифатические карбоновые кислоты). Разделы 1 -2 35
Гомологические ряды Гомологический ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — т. н. «гомологическую разность» . Чаще всего это метиленовые звенья: … —СН 2—… Простейший пример гомологического ряда — низшие гомологи алканов (общая формула Сn. H 2 n+2): метан CH 4, этан C 2 H 6, пропан С 3 H 8 и т. д. В гомологических рядах наблюдается закономерное изменение свойств от младших членов ряда к старшим, однако такая закономерность может нарушаться, в первую очередь, в начале ряда. В случае подобия углеродных скелетов соединений, то есть отсутствия изомерии, формулу гомологичных соединений можно записать как X—(СН 2)n —Y, соединения с различным числом n метиленовых звеньев являются гомологами и принадлежат к одному классу соединений (например, H— (СН 2)n—COOH — алифатические карбоновые кислоты). Разделы 1 -2 35
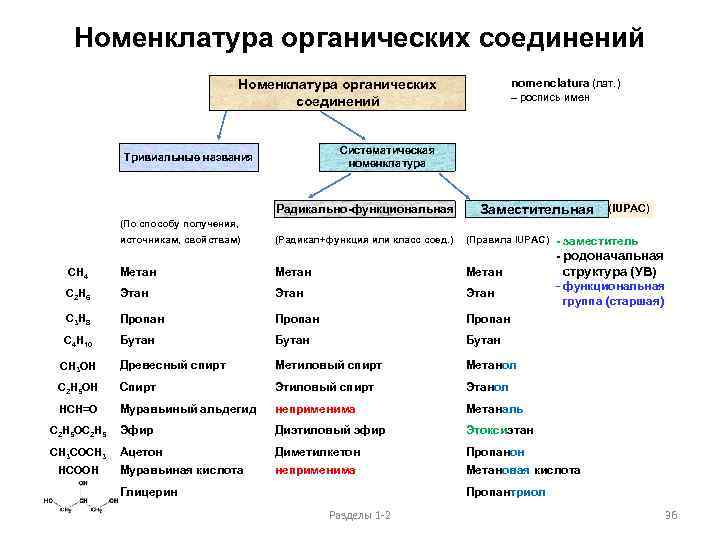 Номенклатура органических соединений nomenclatura (лат. ) Номенклатура органических соединений – роспись имен Систематическая номенклатура Тривиальные названия Радикально-функциональная Заместительная (IUPAC) (По способу получения, источникам, свойствам) (Радикал+функция или класс соед. ) (Правила IUPAC) - заместитель - родоначальная CH 4 Метан C 2 H 6 Этан структура (УВ) - функциональная C 3 H 8 Пропан C 4 H 10 Бутан CH 3 OH Древесный спирт Метиловый спирт Метанол C 2 H 5 OH Спирт Этиловый спирт Этанол HCH=O Муравьиный альдегид неприменима Метаналь Диэтиловый эфир Этоксиэтан Ацетон Диметилкетон Пропанон Муравьиная кислота неприменима Метановая кислота C 2 H 5 OC 2 H 5 Эфир CH 3 COCH 3 HCООH Глицерин группа (старшая) Пропантриол Разделы 1 -2 36
Номенклатура органических соединений nomenclatura (лат. ) Номенклатура органических соединений – роспись имен Систематическая номенклатура Тривиальные названия Радикально-функциональная Заместительная (IUPAC) (По способу получения, источникам, свойствам) (Радикал+функция или класс соед. ) (Правила IUPAC) - заместитель - родоначальная CH 4 Метан C 2 H 6 Этан структура (УВ) - функциональная C 3 H 8 Пропан C 4 H 10 Бутан CH 3 OH Древесный спирт Метиловый спирт Метанол C 2 H 5 OH Спирт Этиловый спирт Этанол HCH=O Муравьиный альдегид неприменима Метаналь Диэтиловый эфир Этоксиэтан Ацетон Диметилкетон Пропанон Муравьиная кислота неприменима Метановая кислота C 2 H 5 OC 2 H 5 Эфир CH 3 COCH 3 HCООH Глицерин группа (старшая) Пропантриол Разделы 1 -2 36
 Тривиальные названия алканов Метан (а также метанол, метилен и т. д. ) имеют общий корень «мет» , который в химии обозначает группировку, содержащую один атом углерода: метил СН 3, метилен (метилиден) СН 2, метин (метилидин) СН. Первым таким веществом исторически был метиловый (он же древесный) спирт, метанол, который раньше получали сухой перегонкой древесины. Его название происходит от греческих слов methy – опьянять вино и hile – лес (так сказать, «древесное вино» ). Этан (а также эфир, этанол, алкоголь, алкан) имеют общее происхождение. Древнегреческие философы словом aither называли некую субстанцию, которая пронизывает космос. Когда алхимики в 8 в. получили легко испаряющуюся жидкость из винного спирта и серной кислоты, ее назвали серным эфиром. В 19 в. выяснили, что серный эфир (по-английски ether) относится к так называемым простым эфирам и содержит группировку из двух атомов углерода – такую же, как и этиловый спирт (этанол); эту группировку назвали этилом (ethyl). От «этила» произошло и название этана. Названия «пропан» и «бутан» происходят от названий соответствующих кислот – пропионовой и бутановой (масляной). Пропионовая кислота – «первая» (т. е. с самой короткой цепью), которая встречается в жирах, и ее название произведено от греч. protos – первый и pion – жир. Бутан и бутановая кислота (англ. butyric acid) – от греч. butyron – масло; в русском языке бутиратами называются соли и эфиры масляной кислоты. Эта кислота выделяется при прогоркании масла. Разделы 1 -2 37
Тривиальные названия алканов Метан (а также метанол, метилен и т. д. ) имеют общий корень «мет» , который в химии обозначает группировку, содержащую один атом углерода: метил СН 3, метилен (метилиден) СН 2, метин (метилидин) СН. Первым таким веществом исторически был метиловый (он же древесный) спирт, метанол, который раньше получали сухой перегонкой древесины. Его название происходит от греческих слов methy – опьянять вино и hile – лес (так сказать, «древесное вино» ). Этан (а также эфир, этанол, алкоголь, алкан) имеют общее происхождение. Древнегреческие философы словом aither называли некую субстанцию, которая пронизывает космос. Когда алхимики в 8 в. получили легко испаряющуюся жидкость из винного спирта и серной кислоты, ее назвали серным эфиром. В 19 в. выяснили, что серный эфир (по-английски ether) относится к так называемым простым эфирам и содержит группировку из двух атомов углерода – такую же, как и этиловый спирт (этанол); эту группировку назвали этилом (ethyl). От «этила» произошло и название этана. Названия «пропан» и «бутан» происходят от названий соответствующих кислот – пропионовой и бутановой (масляной). Пропионовая кислота – «первая» (т. е. с самой короткой цепью), которая встречается в жирах, и ее название произведено от греч. protos – первый и pion – жир. Бутан и бутановая кислота (англ. butyric acid) – от греч. butyron – масло; в русском языке бутиратами называются соли и эфиры масляной кислоты. Эта кислота выделяется при прогоркании масла. Разделы 1 -2 37
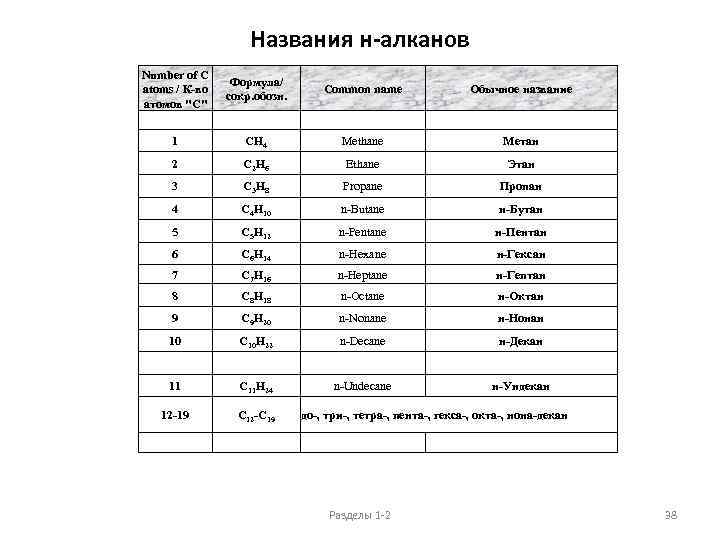 Названия н-алканов Number of C atoms / К-во атомов "С" Формула/ сокр. обозн. Common name Обычное название 1 CH 4 Methane Метан 2 C 2 H 6 Ethane Этан 3 C 3 H 8 Propane Пропан 4 C 4 H 10 n-Butane н-Бутан 5 C 5 H 12 n-Pentane н-Пентан 6 C 6 H 14 n-Hexane н-Гексан 7 C 7 H 16 n-Heptane н-Гептан 8 C 8 H 18 n-Octane н-Октан 9 C 9 H 20 n-Nonane н-Нонан 10 C 10 H 22 n-Decane н-Декан 11 C 11 H 24 n-Undecane н-Ундекан 12 -19 C 12 -C 19 до-, три-, тетра-, пента-, гекса-, окта-, нона-декан Разделы 1 -2 38
Названия н-алканов Number of C atoms / К-во атомов "С" Формула/ сокр. обозн. Common name Обычное название 1 CH 4 Methane Метан 2 C 2 H 6 Ethane Этан 3 C 3 H 8 Propane Пропан 4 C 4 H 10 n-Butane н-Бутан 5 C 5 H 12 n-Pentane н-Пентан 6 C 6 H 14 n-Hexane н-Гексан 7 C 7 H 16 n-Heptane н-Гептан 8 C 8 H 18 n-Octane н-Октан 9 C 9 H 20 n-Nonane н-Нонан 10 C 10 H 22 n-Decane н-Декан 11 C 11 H 24 n-Undecane н-Ундекан 12 -19 C 12 -C 19 до-, три-, тетра-, пента-, гекса-, окта-, нона-декан Разделы 1 -2 38
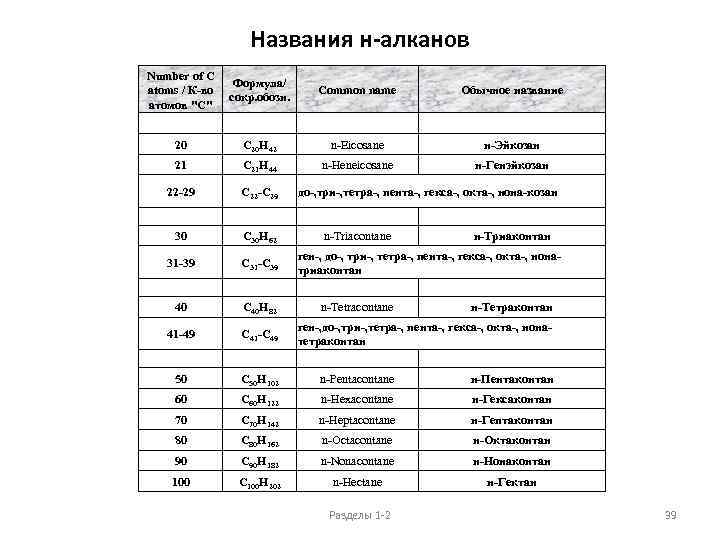 Названия н-алканов Number of C Формула/ atoms / К-во сокр. обозн. атомов "С" Common name Обычное название 20 C 20 H 42 n-Eicosane н-Эйкозан 21 C 21 H 44 n-Heneicosane н-Генэйкозан 22 -29 C 22 -C 29 30 C 30 H 62 31 -39 C 31 -C 39 40 C 40 H 82 41 -49 C 41 -C 49 50 C 50 H 102 n-Pentacontane н-Пентаконтан 60 C 60 H 122 n-Hexacontane н-Гексаконтан 70 C 70 H 142 n-Heptacontane н-Гептаконтан 80 C 80 H 162 n-Octacontane н-Октаконтан 90 C 90 H 182 n-Nonacontane н-Нонаконтан 100 C 100 H 202 n-Hectane н-Гектан до-, три-, тетра-, пента-, гекса-, окта-, нона-козан n-Triacontane н-Триаконтан ген-, до-, три-, тетра-, пента-, гекса-, окта-, нонатриаконтан n-Tetracontane н-Тетраконтан ген-, до-, три-, тетра-, пента-, гекса-, окта-, нонатетраконтан Разделы 1 -2 39
Названия н-алканов Number of C Формула/ atoms / К-во сокр. обозн. атомов "С" Common name Обычное название 20 C 20 H 42 n-Eicosane н-Эйкозан 21 C 21 H 44 n-Heneicosane н-Генэйкозан 22 -29 C 22 -C 29 30 C 30 H 62 31 -39 C 31 -C 39 40 C 40 H 82 41 -49 C 41 -C 49 50 C 50 H 102 n-Pentacontane н-Пентаконтан 60 C 60 H 122 n-Hexacontane н-Гексаконтан 70 C 70 H 142 n-Heptacontane н-Гептаконтан 80 C 80 H 162 n-Octacontane н-Октаконтан 90 C 90 H 182 n-Nonacontane н-Нонаконтан 100 C 100 H 202 n-Hectane н-Гектан до-, три-, тетра-, пента-, гекса-, окта-, нона-козан n-Triacontane н-Триаконтан ген-, до-, три-, тетра-, пента-, гекса-, окта-, нонатриаконтан n-Tetracontane н-Тетраконтан ген-, до-, три-, тетра-, пента-, гекса-, окта-, нонатетраконтан Разделы 1 -2 39
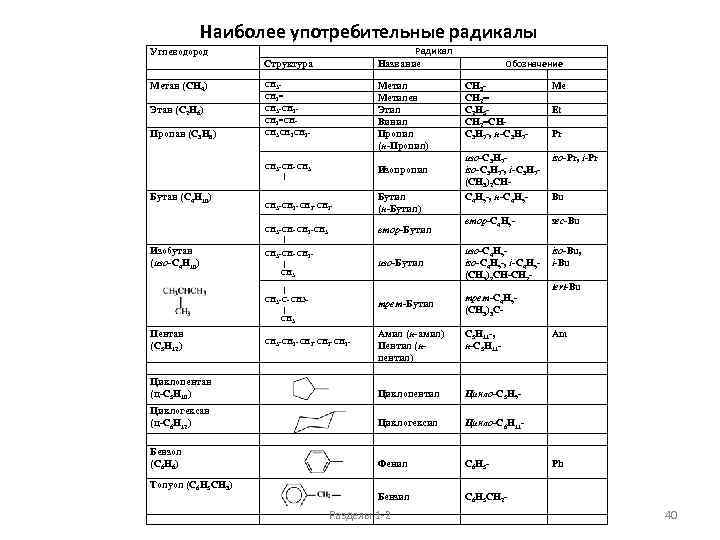 Наиболее употребительные радикалы Радикал Название Углеводород Структура Метан (СН 4) СН 3 СН 2= СН 3 -СН 2=СН- СН 3 СН 2= С 2 Н 5 СН 2=СНС 3 Н 7 -, н-С 3 Н 7 - Me изо-С 3 Н 7 iso-С 3 Н 7 -, i-С 3 Н 7(СН 3)2 СН- iso-Pr, i-Pr С 4 Н 9 -, н-С 4 Н 9 - Bu втор-С 4 Н 9 - sec-Bu изо-Бутил изо-С 4 Н 9 iso-С 4 Н 9 -, i-С 4 Н 9(СН 3)2 СН-СН 2 - iso-Bu, i-Bu | СН 3 -С-СН 3 | СН 3 трет-Бутил трет-С 4 Н 9(СН 3)3 С- СН 3 -СН 2 -СН 2 - Амил (н-амил) Пентил (нпентил) С 5 Н 11 -, н-С 5 Н 11 - Циклопентан (ц-С 5 Н 10) Циклопентил Цикло-С 5 Н 9 - Циклогексан (ц-С 6 Н 12) Циклогексил Цикло-С 6 Н 11 - Бензол (С 6 Н 6) Фенил C 6 H 5 - Бензил C 6 H 5 CH 2 - Этан (С 2 Н 6) Пропан (С 3 Н 8) Метилен Этил Винил Пропил (н-Пропил) Обозначение СН 3 СН 2 - СН 3 -СН-СН 3 | Бутан (С 4 Н 10) Изопропил СН 3 -СН 2 -СН 2 - Бутил (н-Бутил) втор-Бутил СН 3 -СН-CН 2 -СН 3 | Изобутан (изо-С 4 Н 10) Пентан (С 5 Н 12) Толуол (C 6 H 5 CH 3) СН 3 -СН-СН 2 | СН 3 Разделы 1 -2 Et Pr tert-Bu Am Ph 40
Наиболее употребительные радикалы Радикал Название Углеводород Структура Метан (СН 4) СН 3 СН 2= СН 3 -СН 2=СН- СН 3 СН 2= С 2 Н 5 СН 2=СНС 3 Н 7 -, н-С 3 Н 7 - Me изо-С 3 Н 7 iso-С 3 Н 7 -, i-С 3 Н 7(СН 3)2 СН- iso-Pr, i-Pr С 4 Н 9 -, н-С 4 Н 9 - Bu втор-С 4 Н 9 - sec-Bu изо-Бутил изо-С 4 Н 9 iso-С 4 Н 9 -, i-С 4 Н 9(СН 3)2 СН-СН 2 - iso-Bu, i-Bu | СН 3 -С-СН 3 | СН 3 трет-Бутил трет-С 4 Н 9(СН 3)3 С- СН 3 -СН 2 -СН 2 - Амил (н-амил) Пентил (нпентил) С 5 Н 11 -, н-С 5 Н 11 - Циклопентан (ц-С 5 Н 10) Циклопентил Цикло-С 5 Н 9 - Циклогексан (ц-С 6 Н 12) Циклогексил Цикло-С 6 Н 11 - Бензол (С 6 Н 6) Фенил C 6 H 5 - Бензил C 6 H 5 CH 2 - Этан (С 2 Н 6) Пропан (С 3 Н 8) Метилен Этил Винил Пропил (н-Пропил) Обозначение СН 3 СН 2 - СН 3 -СН-СН 3 | Бутан (С 4 Н 10) Изопропил СН 3 -СН 2 -СН 2 - Бутил (н-Бутил) втор-Бутил СН 3 -СН-CН 2 -СН 3 | Изобутан (изо-С 4 Н 10) Пентан (С 5 Н 12) Толуол (C 6 H 5 CH 3) СН 3 -СН-СН 2 | СН 3 Разделы 1 -2 Et Pr tert-Bu Am Ph 40
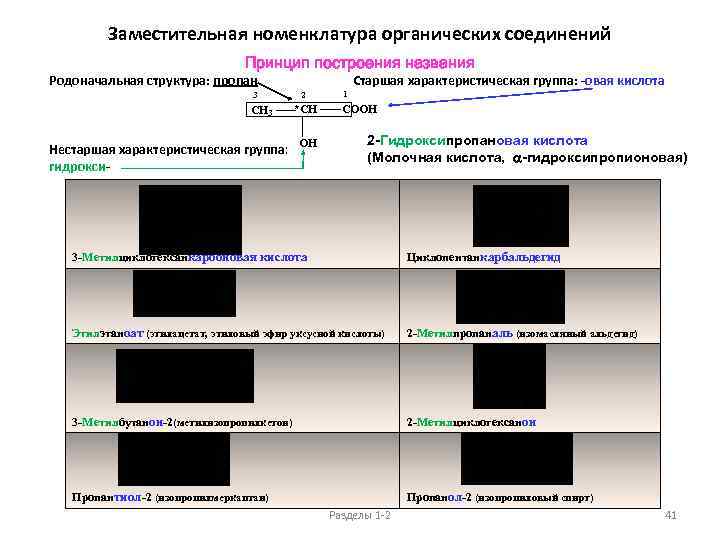 Заместительная номенклатура органических соединений Принцип построения названия Родоначальная структура: пропан Старшая характеристическая группа: -овая кислота 3 2 *CH CH 3 Нестаршая характеристическая группа: гидрокси- OH 1 COOH 2 -Гидроксипропановая кислота (Молочная кислота, a-гидроксипропионовая) 3 -Метилциклогексанкарбоновая кислота Циклопентанкарбальдегид Этилэтаноат (этилацетат, этиловый эфир уксусной кислоты) 2 -Метилпропаналь (изомасляный альдегид) 3 -Метилбутанон-2(метилизопропилкетон) 2 -Метилциклогексанон Пропантиол-2 (изопропилмеркаптан) Пропанол-2 (изопропиловый спирт) Разделы 1 -2 41
Заместительная номенклатура органических соединений Принцип построения названия Родоначальная структура: пропан Старшая характеристическая группа: -овая кислота 3 2 *CH CH 3 Нестаршая характеристическая группа: гидрокси- OH 1 COOH 2 -Гидроксипропановая кислота (Молочная кислота, a-гидроксипропионовая) 3 -Метилциклогексанкарбоновая кислота Циклопентанкарбальдегид Этилэтаноат (этилацетат, этиловый эфир уксусной кислоты) 2 -Метилпропаналь (изомасляный альдегид) 3 -Метилбутанон-2(метилизопропилкетон) 2 -Метилциклогексанон Пропантиол-2 (изопропилмеркаптан) Пропанол-2 (изопропиловый спирт) Разделы 1 -2 41


