Молбиология_Лекция_16_2009.pptx
- Количество слайдов: 28

Введение в молекулярную биологию и генную инженерию Лекция 16. Молекулярная диагностика

Содержание лекции 16: Введение 16. 1. Методы иммунодиагностики 16. 2. Системы ДНК диагностики 16. 3. Геномная дактилоскопия 16. 4. 16. 5. Заключение

Молекулярная диагностика Успехи современной медицины и сельского хозяйства зависят от того, удается ли обнаруживать специфические вирусы, бактерии, грибы, паразитические микроорганизмы, белки и низкомолекулярные соединения в организме человека или животных, в растениях, воде или почве. Например, профилактику и лечение любого инфекционного заболевания значительно облегчает ранняя и точная идентификация вызвавшего патогенного микроорганизма. Для проведения многих диагностических процедур необходимо сначала вырастить культуру потенциально патогенного микроорганизма и лишь затем проанализировать спектр его физиологических свойств. Хотя подобные тесты весьма эффективны и обладают достаточно высокой специфичностью, они часто занимают много времени и являются дорогостоящими.

Сравнение некоторых методов диагностики инфекционных заболеваний

В настоящее методы молекулярной диагностики применяются не только для обнаружения различных микроорганизмов и для выявления заражения паразитами, но и для выявления мутантных генов. Методы молекулярной диагностики нашли широкое применение в судебной медицине и научных исследованиях. Требования, предъявляемые к методам диагностики: 1. Высокая специфичность. 2. Высокая чувствительность. 3. Простота и низкая стоимость.

16. 1. Методы иммунодиагностики • ELISA – метод • Получение моноклональных антител

ELISA – ферментный иммуносорбентный анализ • Образец, в котором хотят обнаружить специ фическую молекулу или микроорганизм, фиксируют на твердой подложке, например на пластиковой микротитровальной плашке, обычно имеющей 96 лунок (А). • К фиксированному образцу добавляют анти тело, специфичное к маркерной молекуле (первое антитело), затем промывают лунку, чтобы удалить несвязавшиеся молекулы пер вого антитела (Б). • Добавляют второе антитело, которое специ фически связывается с первым антителом и не взаимодействует с маркерной молекулой (В). К этому антителу присоединен фермент (например, щелочная фосфатаза, пероксидаза или уреаза), катализирующий превращение неокрашенного субстрата в окрашенный продукт. Промывают лунку, чтобы удалить несвязавшиеся молекулы конъюгата второе антитело фермент. • Добавляют неокрашенный субстрат (Г). • Проводят качественное или количественное определение окрашенного продукта.
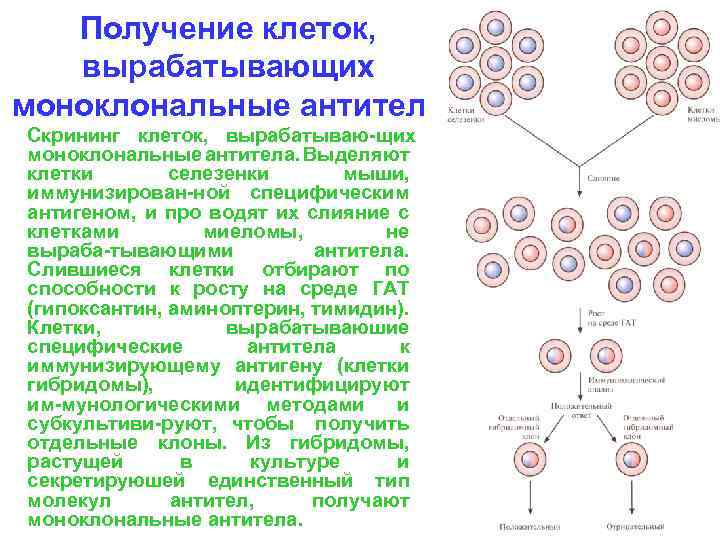
Получение клеток, вырабатывающих моноклональные антитела Скрининг клеток, вырабатываю щих моноклональные антитела. Выделяют клетки селезенки мыши, иммунизирован ной специфическим антигеном, и про водят их слияние с клетками миеломы, не выраба тывающими антитела. Слившиеся клетки отбирают по способности к росту на среде ГАТ (гипоксантин, аминоптерин, тимидин). Клетки, вырабатываюшие специфические антитела к иммунизирующему антигену (клетки гибридомы), идентифицируют им мунологическими методами и субкультиви руют, чтобы получить отдельные клоны. Из гибридомы, растущей в культуре и секретируюшей единственный тип молекул антител, получают моноклональные антитела.

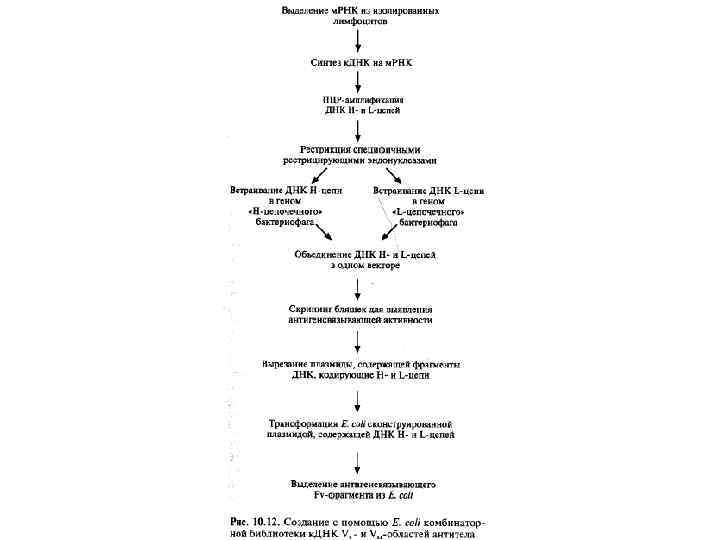
Производство антител с помощью E. coli

Использование моноклональных антител для выявления различных соединений и заболеваний

16. 2. Системы ДНК диагностики В основе многих быстрых и надежных диагностических методов лежит гибридизация нуклеиновых кислот спаривание двух комплементарных сегментов разных молекул ДНК. Процедура в общих чертах состоит в следующем: • Фиксация одноцепочечной ДНК мишени на мембранном фильтре. • Нанесение меченой одноцепочечной ДНК зонда, которая при определенных условиях (температуре и ионной силе) спаривается с ДНК мишенью. • Промывание фильтра для удаления избытка несвязавшейся меченой ДНК зонда. • Детекция гибридных молекул зонд/мишень. В диагностических тестах, основанных на гибридизации нуклеиновых кислот, ключевыми являются три компонента: ДНК зонд, ДНК мишень и метод детекции гибридизационного сигнала. Система детекции должна быть в высшей степени специфичной и высокочувствительной.
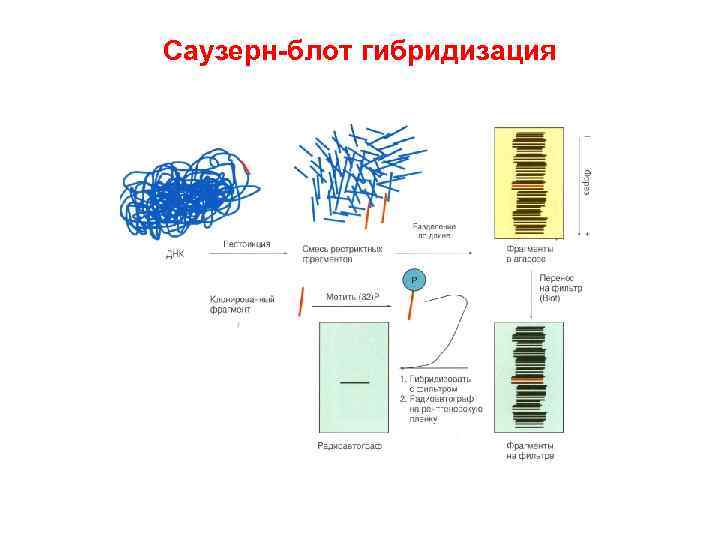
Саузерн блот гибридизация
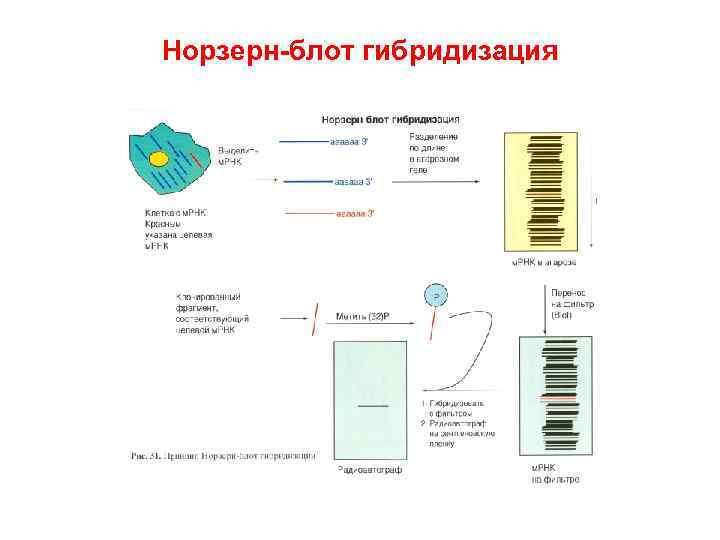
Норзерн блот гибридизация

Нерадиоактивные методы детекции • В большинстве лабораторий для гибридизации используют зонды, меченные каким либо радиоактивным изотопом, чаще всего 32 P. Такие зонды обладают высокой удельной радиоактивностью и обеспечивают хорошее отношение сигнал/шум. Радиоактивно меченный зонд наносят на фильтр с фиксированной на нем ДНК мишенью, проводят гибридизацию, отмывают несвязавшуюся ДНК зонд и детектируют метку с помощью радиоавтографии. • Однако 32 P является короткоживущим изотопом, испускающим высокоэнергетическое излучение; при работе с ним необходимо использо вать специальное оборудование и обеспечивать безопасную утилизацию отходов. • Чтобы обойти эти трудности, были созданы нерадиоактивные системы детекции. Для усиления гибридизационного сигнала в этом случае используется ферментативное превращение хромогенного или хемилюминесцентного субстрата: первый из них под действием фермента изменяет окраску, а второй испускает свет. В большинстве подобных систем применяются ДНК зонды, содержащие биотинилированные нуклеотиды. Гибридизация и детекция сигнала проводятся более или менее стандартным образом.
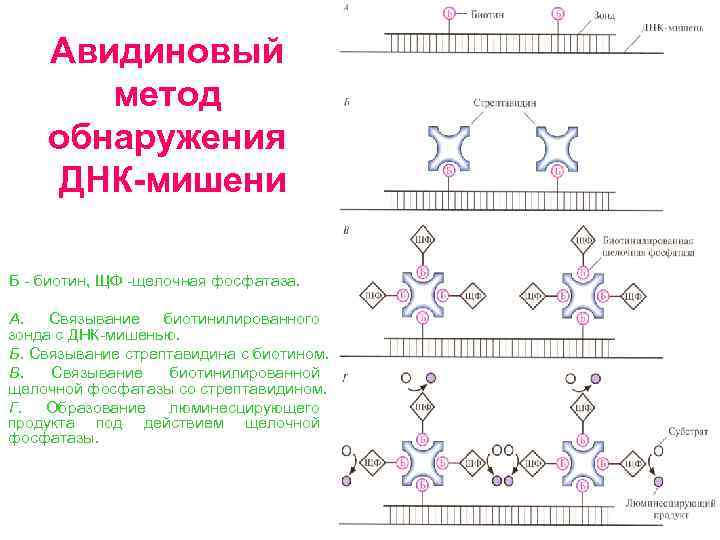
Авидиновый метод обнаружения ДНК мишени Б биотин, ЩФ щелочная фосфатаза. А. Связывание биотинилированного зонда с ДНК мишенью. Б. Связывание стрептавидина с биотином. В. Связывание биотинилированной щелочной фосфатазы со стрептавидином. Г. Образование люминесцирующего продукта под действием щелочной фосфатазы.

Процедура авидинового метода • Зонд, меченный биотином, гибридизуют с ДНК мишенью (А). • Промывают фильтр для удаления избытка несвязавшегося зонда. • Добавляют авидин (белок куриного яйца) или стрептавидин (бактериальный аналог авидина) (Б). • Добавляют биотинилированный фермент щелочную фосфатазу или пероксидазу хрена (В). • В зависимости от используемого фермента добавляют хромогенный или хемилюминесцентный субстрат и регистрируют изменение окраски либо люминесценцию, сопровождающую превращение субстрата в продукт (Г). • В качестве альтернативы после гибридизации ДНК с биотинилированным зондом можно добавлять уже готовый комплекс стрептавидин фермент, имеющий сайт связывания с биотином.
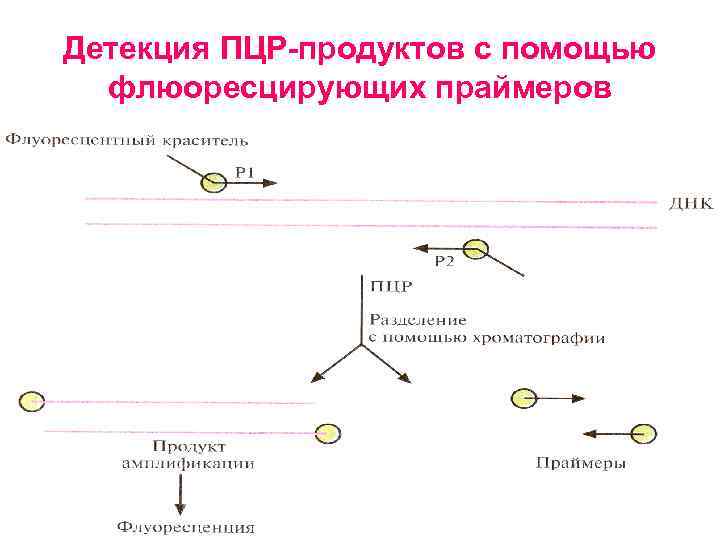
Детекция ПЦР продуктов с помощью флюоресцирующих праймеров
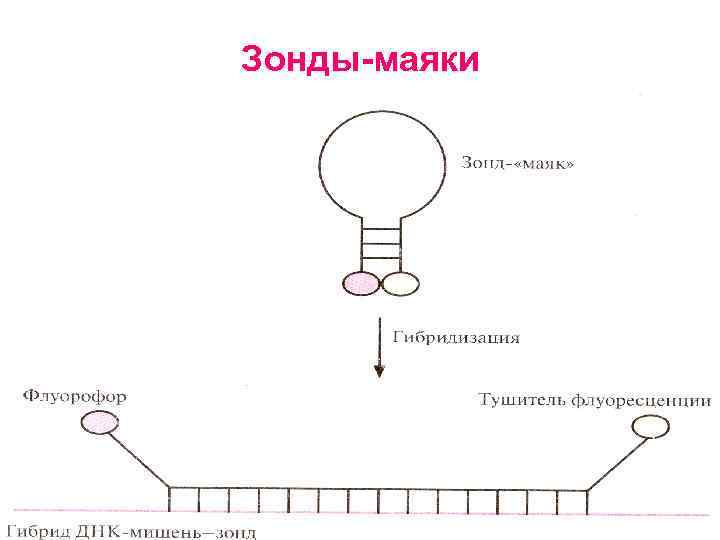
Зонды маяки
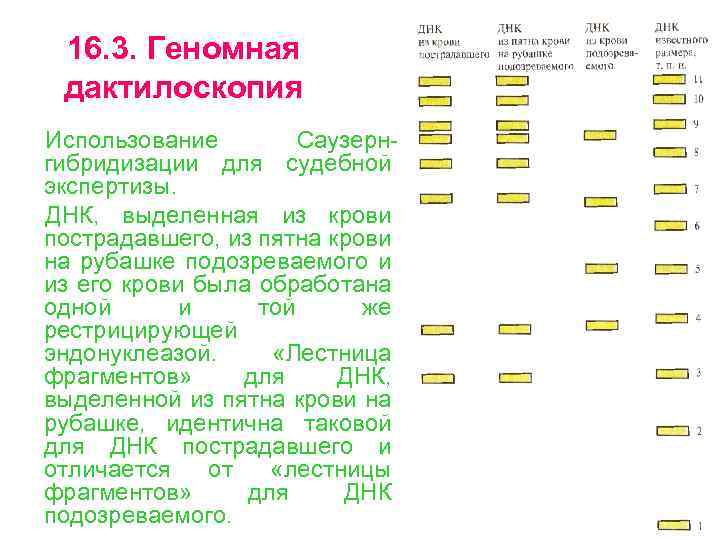
16. 3. Геномная дактилоскопия Использование Саузерн гибридизации для судебной экспертизы. ДНК, выделенная из крови пострадавшего, из пятна крови на рубашке подозреваемого и из его крови была обработана одной и той же рестрицирующей эндонуклеазой. «Лестница фрагментов» для ДНК, выделенной из пятна крови на рубашке, идентична таковой для ДНК пострадавшего и отличается от «лестницы фрагментов» для ДНК подозреваемого.
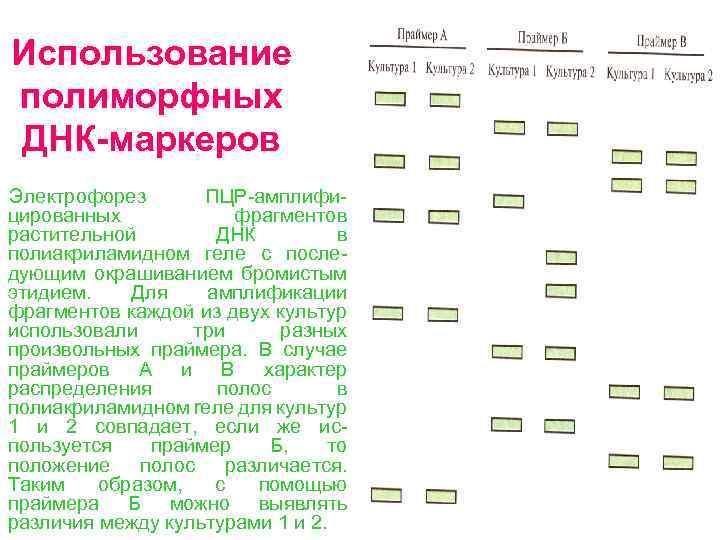
Использование полиморфных ДНК маркеров Электрофорез ПЦР амплифи цированных фрагментов растительной ДНК в полиакриламидном геле с после дующим окрашиванием бромистым этидием. Для амплификации фрагментов каждой из двух культур использовали три разных произвольных праймера. В случае праймеров А и В характер распределения полос в полиакриламидном reле для культур 1 и 2 совпадает, если же ис пользуется праймер Б, то положение полос различается. Таким образом, с помощью праймера Б можно выявлять различия между культурами 1 и 2.

16. 4. Обнаружение мутаций
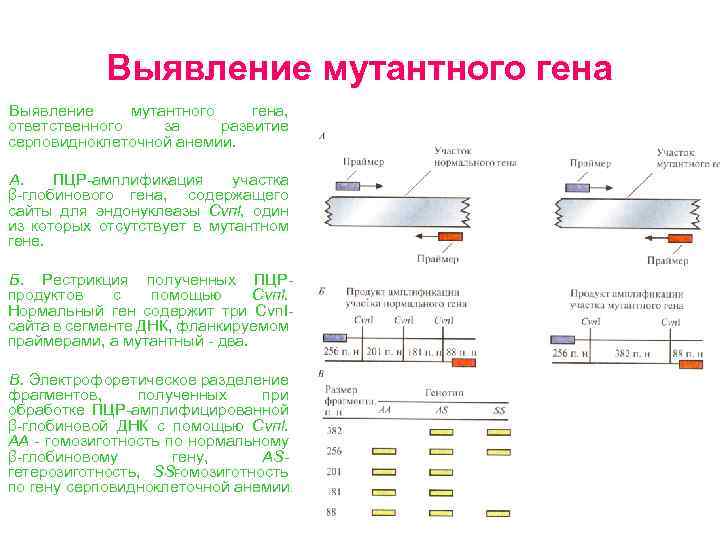
Выявление мутантного гена, ответственного за развитие серповидноклеточной анемии. А. ПЦР амплификация участка β глобинового гена, содержащего сайты для эндонуклеазы Cvпl, один из которых отсутствует в мутантном гене. Б. Рестрикция полученных ПЦР продуктов с помощью Cvпl. Нормальный ген содержит три Сvп. I сайта в сегменте ДНК, фланкируемом праймерами, а мутантный два. В. Электрофоретическое разделение фрагментов, полученных при обработке ПЦР амплифицированной β глобиновой ДНК с помощью Cvпl. АА гомозиготность по нормальному β глобиновому гену, AS гетерозиготность, SS омозиготность г по гену серповидноклеточной анемии.

Метод ПЦР/ЛОЗ Б биотин; Д дигоксигенин; ЩФ щелочная фосфатаза; СА стрептавидин.

Обнаружение точковой мутации с помощью флуоресцентно меченных ПЦР праймеров • А. Используя праймеры Р 1 и Р 2, амплифицируют ДНК дикого типа. Мутантная ДНК при помощи данных праймеров не амплифицируется из за несоответствия ей праймера Р 1. 5' конец праймера Р 1 помечен родамином, праймер Р 2 немечены. Й. • Б. Используя праймеры Р 3 и Р 2, амплифицируют мутантную ДНК; ДНК дикого типа в этом случае не амплифицируется. 5' конец праймера Р 3 помечен флуоресцеином, праймер Р 2 немечены. Й. Знаки «+» и « » соответствуют сайту дикого типа и мутантному сайту. В случае генотипов «+/+» , «+/ » и « / » образуются ПЦР продукты, содержащие только родамин, смесь родамина и флуоресцеина и только флуоресцеин, и соответственно наблюдается красная, желтая и зеленая флуоресценция.
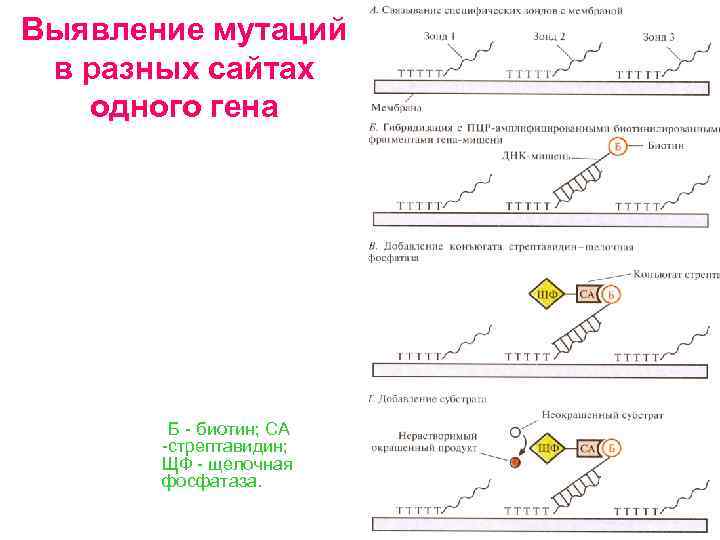
Выявление мутаций в разных сайтах одного гена Б биотин; СА стрептавидин; ЩФ щелочная фосфатаза.

Заключение Молекулярная диагностика – быстро развивающееся направление. Его принципы в основном сформулированы. Существуют два типа методов: один основан на специфическом взаимодействии антител с конкретным веществом, формирующем антигены и входящим в состав инфекционного агента, другой – на идентификации специфических нуклеотидных последовательностей. Использование ПЦР позволяет значительно поднять чувствительность методов обнаружения ДНК патогенных организмов и выявления мутантных генов.

Молекулярные методы диагностики продолжают развиваться и совершенствоваться. Ставится задача, исходя из особенностей генома каждого человека, предсказать вероятность появления у него в будущем определенных физиологических нарушений и заболеваний.
Молбиология_Лекция_16_2009.pptx