Введение,ФК.Вет. 2012..ppt
- Количество слайдов: 63

Введение в фармакологию ОБЩАЯ ФАРМАКОЛОГИЯ Основы фармакокинетики лекарственных средств

Фармакология (pharmacon - лекарство; logos – учение) – наука о лекарствах. Фармакология это наука о взаимодействии химических соединений с живыми организмами и о путях изыскания новых лекарственных средств.
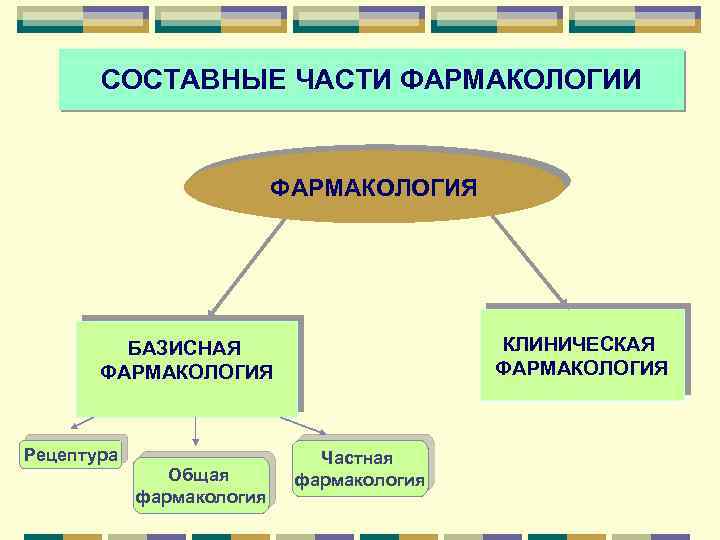
СОСТАВНЫЕ ЧАСТИ ФАРМАКОЛОГИЯ КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ БАЗИСНАЯ ФАРМАКОЛОГИЯ Рецептура Общая фармакология Частная фармакология

Базисная фармакология дисциплина, изучающая фармакологические эффекты и молекулярный механизм действия лекарственных средств, систематизирующая информацию о фармакологических группах и лекарственных препаратах в рамках каждой группы.

Клиническая фармакология дисциплина, занимающаяся изучением взаимодействия лекарственных веществ с организмом человека, животных преимущественно в условиях патологии Рациональная фармакотерапия Стандарты лечения Фармакоэпидемиология Фармакоэкономика Фармакобезопасность Клинические исследования

СОСТАВНЫЕ ЧАСТИ БАЗИСНОЙ ФАРМАКОЛОГИИ: Рецептура – раздел фармакологии о правилах выписывания в рецептах лекарственных форм и препаратов. Общая фармакология – изучает общие закономерности взаимодействия лекарственных веществ с живым организмом. Частная фармакология – рассматривает конкретные фармакологические группы или конкретный лекарственный препарат.
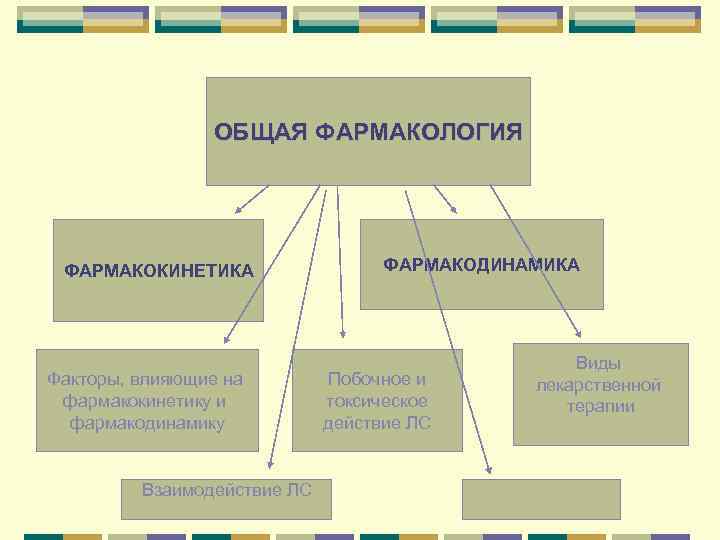
ОБЩАЯ ФАРМАКОЛОГИЯ ФАРМАКОКИНЕТИКА Факторы, влияющие на фармакокинетику и фармакодинамику Взаимодействие ЛС ФАРМАКОДИНАМИКА Побочное и токсическое действие ЛС Виды лекарственной терапии

Фармакокинетика – влияние организма на лекарственное ве-во Изучает вопросы всасывания, распределения, депонирования, превращения и выведения лекарственных ве-в из организма. Фармакодинамика - влияние лекарственных ве-в на организм Изучает фармакологические эффекты, механизмы действия, локализацию действия и виды действия лекарственных ве-в

Основы фармакокинетики лекарственных средств

Все фармакокинетические процессы в организме (всасывание с места доставки, распределение, метаболизм, выведение) связаны с проникновением – переносом - лекарственных ве-в через клеточную (цитоплазматическую) мембрану

Перенос ЛС в организме (механизмы транспорта) Пассивная диффузия в липидах и фильтрация (водная диффузия) Облегченная диффузия в липидах Активный перенос Микровезикулярный транспорт (пиноцитоз)

Водная диффузия, фильтрация (детерминанты переноса) Физико -химические свойства ЛС (растворимость в воде и липидах, м. м. , степень ионизации, связь с биополимерами) Структура барьеров Градиент концентрации Скорость кровотока

Структура барьеров лимитирующий фактор – поры, их размеры и количество Эпителиальные покровы (слизистая ЖКТ, полость рта и др. ) – проницаемы только для очень малых молекул, таких как Li, метанол. Капилляры – фильтруются и диффундируют вещества с м. м. 20 -30 тысяч. Капилляры мозга – водных пор не имеют, кроме гипофиза, эпифиза, area postrema, хориоидального сплетения, медиальной возвышенности. Плацента – водных пор не имеет.

ВЫВОДЫ: 1. Всасывание гидрофильных, ионизированных веществ через эпителий слизистых оболочек ограничено 2. Эти соединения могут свободно входить и выходить из кровеносного русла по законам диффузии (кроме…) 3. Их выведение осуществляется почками

Диффузия в липидах Основной механизм переноса через клеточную мембрану (эпителий, клетки органов - мишеней) Осуществляется пассивно. Ø Движущая сила – броуновское движение молекул Основные условия - растворимость в липидах - градиент концентрации Ø Ø Ограничения – очень низкая растворимость в воде (такие молекулы не образуют общей фазы с водой вне мембраны)

ВЫВОДЫ: 1. Диффузии в липидах легко подвергаются жирорастворимые неполярные вещества, трудно – гидрофильные вещества и ионы 2. Жирорастворимые неполярные вещества хорошо проходят через ГЭБ и плаценту 3. В почках они подвергаются обратной реабсорбции в кровь

Степень ионизации (классификация ЛС) ЛС (электролиты – слабые кислоты или основания), которые могут быть электрически заряженными или незаряженными в зависимости от р. Н окружающей среды !!! ЛС электрически незаряженные вне зависимости от р. Н среды ЛС с постоянным зарядом вне зависимости от р. Н среды

Движение через мембраны веществ с переменной ионизацией в биосредах Слабые кислоты : НА А- + Н+ Слабые основания: ВН+ В + Н+ В кислой среде увеличивается ионизация оснований, а в щелочной среде – ионизация кислых соединений. Также надо учитывать показатель р. Ка –отрицательный логарифм константы ионизации (численно = р. Н, при котором ионизированна 50% молекул соединения) Уравнение Гендерсона-Гассельбаха: протонированной формы p. Ka - p. H = log ------------------непротонированной формы

Например: Для ацетилсалициловой кислоты p. Ka =3, 5. Можно предположить, что при р. Н 4, 5 ацетилсалициловая кта будет мало диссоциировать, однако подставив значения в формулу мы получаем следующее Следовательно, при р. Н 4, 5 ацетилсалициловая к-та почти полностью диссоциирована

Зависимость степени ионизации от разности p. Ka – p. H для кислот и оснований дефицит протонов % ионизации Избыток протонов кислота 50% основание - 2 - 1 0 +1 +2 p. Ka – p. H

р. Ка лекарственных веществ Лекарственное вещество р. Ка Слабые кислоты Ампициллин Ацетилсалициловая кислота Парацетамол Фенитоин Фенобарбитал Фуросемид 2, 5 3, 5 9, 5 8, 3 7, 4 3, 9 Слабые основания Атропин Диазепам Кодеин Хлордиазепоксид Хлорпромазин Эфедрин 9, 7 3, 3 8, 2 4, 6 9, 3 9, 6

Облегченная диффузия (мембраны 2 -го типа) • Осуществляется транспортными системами по градиенту концентрации, без затрат энергии Холин, вит. В 12, рибофлавин, тиамин, некоторые четвертичные катионы с маленькой м. м. в нейронах Активный транспорт (мембраны 3 -го типа: ) • Осуществляется специальными транспортными системами с затратой энергии - Na+, К+ , Fe, Ca, глюкоза, галактоза, аминокислоты в ЖКТ - всасывание и выведение ионизированных веществ в почечных канальцах - накопление йода щитовидной железой - перенос анионов в кишечном эпителии - противоопухолевые препараты (6 -меркаптопурин, 5 -фторурацил, циторабин) Пиноцитоз - транспорт макромолекул: белков, жирных кислот, жирорастворимых витаминов (А, Д, Е, К)

Основные факторы, влияющие на перенос веществ в организме. 1. Свойства вещества: - растворимость в Н 2 О липидах - ионизация - молекулярная масса - взаимодействие с биополимерами 2. Градиент концентрации 3. Скорость кровотока (скорость перфузии органов) 4. Площадь поверхности переноса (легкие> кишечник > желудок) 5. С повышением р. Н всасывание оснований увеличивается, а кислот снижается. При независимой от р. Н ионизации (тубокурарин) скорость всасывания при изменении р. Н не изменяется 6. Влияние р. Н на экскрецию в почках обратно

ПУТИ ВВЕДЕНИЯ ЛС В ОРГАНИЗМ Для системного действия существуют способы введения: Энтеральный: Парентреральный: - оральный - в/в, п/к, в/м, в/а - сублингвальный - ингаляционный - ректальный - субарахноидальный - через зонд - трансдермальный - внутрикостный

ПУТИ ВВЕДЕНИЯ ЛС В ОРГАНИЗМ Для местного действия существуют способы введения: • накожный (эпикутанный) • на слизистые оболочки (полость рта, пазух, носа, горла, бронхов, желудка, мочевого пузыря, влагалища, прямой кишки и т. п. ) • в полости (брюшная, плевральная, суставная) • в ткани (инфильтрационная анестезия) • внутрикожно (терминальная анестезия)

Энтеральный путь введения А. Per os Преимущества: • • простота введения большая поверхность всасывания различие р. Н по ходу ЖКТ относительная легкость управления терапией Недостатки: • • относительно медленная скорость наступления эффекта деструкция веществ, пресистемная элиминация зависимость от приема пищи зависимость всасывания от других препаратов (влияние на эвакуацию, р. Н, перистальтику, кровоток) • местное раздражающее и повреждающее действие

Энтеральный путь введения Б. Сублингвальный способ – минует портальную систему – обеспечивает быстрое всасывание и скорость наступления эффекта В. Ректальный способ – идет частично в обход пресистемной элиминации (на 50% всасывается в системе нижней полой вены) – раздражающее действие

Парентеральный способ введения Преимущества: • быстрота введения ( в/в – 13 секунд необходимо для доставки • • до места действия, в/м – 5– 10 минут) возможность применения средств, плохо переносимых ЖКТ доставка в обход пресистемной элиминации точность дозировки возможность применения в бессознательном состоянии, при нарушении глотания, рвоте, диарее Недостатки: • • • необходимость стерильных условий требуется квалифицированный персонал повреждение тканей, стенки сосудов опасность эмболии затруднителен для курсов хронических заболеваний

ГЛАВНЫЕ СОСТАВЛЯЮЩИЕ ФАРМАКОКИНЕТИКИ Всасывание Распределение биодоступность выведение (метаболизм) объем распределения Cl, Kel, t½

Биодоступность – количество неизмененного вещества, попавшего в общий кровоток, в процентном отношении к введенному количеству. AUC per os F = -------- х 100% AUC в/в

Биодоступность (F) - определяет полноту и скорость поступления вещества в организм (кровоток) при внесистемных способах введения. C конц. Cmax 1 в/в AUC per os 2 per os F = -------- < 1 AUC в/в C действ. . 3 per os t время

Два вещества считаются биоэквивалентными если они обладают одинаковой биодоступностью, одинаковым пиком действия, характером и величиной фармакологического эффекта.

Составляющие биодоступности: • скорость всасывания (Cmax, Tmax, Cmax/AUC) • полнота всасывания • пресистемная элиминация При парентеральных способах введения - F = 100% Препараты с F > 70% относятся к средствам с высокой биодоступностью F < 30% - ?

Лекарственные формы и скорость абсорбции ЛФ для энтерального применения растворы суспензии капсулы таблетки табл. в обол. табл. с контрол. высвобож дением

Распределение ЛС в организме Универсальная особенность – неравномерность распределения Отсеки распределения: 1. Внеклеточное пространство (плазма, межкл. жидкость) 2. Клетки (цитоплазма, мембраны органелл) 3. Жировая ткань 4. Костная ткань Лиганды: - рецепторы - белки крови (альбумины, гликопротеиды) - белки тканей - полисахариды межуточной ткани - нуклеопротеиды

Детерминанты распределения ЛС в организме: • Свойства вещества • Структура барьеров • Кровоток • Взаимодействие с лигандами

Объем распределения (Vd) – кажущееся водное пространство, которое должен занять препарат при концентрации, равной концентрации его в плазме. Единицы измерения: л(мл) или л/кг Метод определения Vd: Пример: Определить объем распределения антипирина, если при его внутривенном введении в дозе 1 г (D) в плазме крови создалась концентрация(Co) 25 мкг/мл. D 1 г Vd = ---------- = 40 л Co 25 мкг/мл

Вода тела (60% массы) в организме распределяется следующим образом: V(л) % веса тела Внеклеточная жидкость 13 -16 18 -22 Интерстициальная жидкость 10 -13 14 -18 Плазма 3 4 Трансклеточная Н 2 О (секреты) 0. 7 -2 1 -3 Общая Н 2 о тела 40 -46 55 -65

Варианты объёма распределения доза Vd = D/C = VH 2 O (Vd I) доза Vd = D/C < VH 2 O (Vd II) доза Vd = D/C > VH 2 O (Vd III)

Варианты объема распределения: 1 -й вариант: Vd = V H 2 O (пример с антипирином) означает, что препарат равномерно распределяется в водных отсеках. Клиническое значение: • дозирование препарата должно осуществляться с учетом массы тела • в случае передозировки препарата объективным диагностическим критерием служит определение его содержания в плазме крови • гемодиализ при интоксикациях – эффективная мера • на доклиническом этапе нет смысла проводить исследования по его накоплению в различных органах и тканях

Варианты объема распределения: 2 -й вариант: Vd < VH 2 O – секвестрация в плазме и межклеточной жидкости Клиническое значение: • дозирование препарата осуществляется относительно «идеальной массы тела» без учета излишков веса • интоксикации препаратами с очень маленьким объемом распределения редки.

Варианты объема распределения: 3 -й вариант: Vd > VH 2 O – секвестрация в тканях ( депонирование, в частности) Клиническое значение: • дозирование препарата осуществляется с учетом массы тела • в случае интоксикации определение его концентрации в плазме крови не является объективным критерием • гемодиализ неэффективен • препараты способны к материальной кумуляции • доклинические исследования должны включать эксперименты по «поиску» мест депонирования препарата

Фармакокинетические модели доза водные отсеки элиминация 1. Однокамерная модель • Двукамерная (2 -частевая) модель секвестрация в ткани

Факторы, влияющие на Vd 1. На скорость распределения: - проницаемость мембран - скорость кровотока центральная камера: кровь и хорошо кровоснабжаемые органы(почки, мозг, легкие, надпоч. , печень, сердце, селезенка, ЩЖ) периферическая камера: мышцы, слизистые обол. , кожа, жировая, костная ткани, волосы, ногти 2. На степень распределения: - липофильность/гидрофильность - степень ионизации - степень связывания с белками крови - внутриклеточное связывание

Элиминация ЛС Клиренс - отношение скорости элиминации (всеми доступными путями) к концентрации вещества в биологических жидкостях (плазме) ØКлиренс - константа, индивидуальная для каждого вещества скорость V элимин. к-во/ время объем Cl = --------------------- = мл/час (л/час) концентр. к-во/объем время ØКлиренс – объем распределения, освобождающийся от вещества за единицу времени. ØКлиренс – главный параметр для управления режимом дозирования ØКлиренс аддитивен: Clобщ. = Clпоч. + Clпеч. + CL др.

Основные показатели элиминации (продолжение) Константа элиминации вещества (Кel)- доля вещества, элиминирующая в единицу времени Cl мл доля Кel = —— =------ = ---- Vd мин ·мл мин Период полувыведения (t½ ) – время, за которое концентрация препарата снизилась вдвое Ln 2 0, 693 0, 7 0, 7 Vd Кel = ------- t½ = ------t½ Cl

Клиническое значение t½ Служит для определения интервала дозирования препаратов Можно прогнозировать время наступления эффекта при назначении ПД препарата Служит ориентиром для установления времени прекращения действия и выведения препарата из организма

Почечный клиренс ЛС Механизмы: • фильтрация ( м. м. < 65000) • активная секреция в проксимальных канальцах • реабсорбция Фильтрация – основной механизм выведения ü фильтруются не связанные с белками формы ЛС. Зависит от фильтрационной способности почек и кровотока ü Лимитирующий фактор – размер молекул (м. м. не более 65000) ü Скорость фильтрации оценивают по клиренсу креатинина (норма – 120 мл/мин) ü Гемодиализ «воспроизводит» процесс гломерулярной фильтрации

Почечный клиренс (продолжение) Секреция ü осуществляется в проксимальных тубулах с участием переносчиков ü энергозависима ( активный процесс) против градиента концентрации ü эффективна для ионизированных соединений ü конкуренция за переносчики между ЛС ü угнетается ингибиторами энергетического обмена ü лимитируеися возможностями транспортных систем ü об участии канальциевой секреции судят по влиянию пробеницида на ф/кинетику исследуемого средства Реабсорбция ü осуществляется в дистальных канальцах ü реабсорбируются неполярные липофильные вещества ü важное значение играет р. Н мочи

Печеночный клиренс Включает два процесса: А. биотрансформация Б. выделение нетрансформированных веществ в желчь А. Биотрансформация Цель: превращение неполярных ( чужеродных) веществ в полярные 2 фазы: 1 -я фаза 2 -я фаза Метаболическая трансформация Конъюгация • окисления • восстановления (ГК, СК, глицин, • алкилирования и деалкилирования метильные гр. ) • гидролиза Участник –цитохром системы Р 446 -455

Печеночный клиренс (продолжение) Б. Секреция ЛС в желчь Механизмы транспорта - простая диффузия - активный транспорт (в меньшей степени) Факторы, влияющие на экскрецию ЛС в желчь: - высокая м. м. (> 250000 ) - состояние функции печени и ЖВП - связь с биополимерами печеночной клетки - скорость печеночного кровотока Секретируются: кислоты, основания, неионогенные вещества Энтерогепатическая циркуляция

Роль метаболических процессов Увеличивается гидрофильность ЛВ Снижается фармакологическая активность Снижается эффективность ЛВ Исключение: пролекарства (prodrugs)

Основные сценарии элиминации ЛС (итог): 1. 2. 3. Гидрофильные соединения выводятся почками в неизмененном виде Липофильные полярные соединения – выводятся с желчью в кишечник. Могут подвергаться энтерогепатической циркуляции Липофильные неполярные соединения – реабсорбируются в почках, поступают в кровоток и подвергаются печеночному метаболизму, приобретая гидрофильные свойства, чтобы выделиться почками

Ситуации, изменяющие клиренс ЛС в организме: • Взаимодействие ЛС ü ü ü конкуренция за секреторные механизмы конкуренция за метаболические процессы неспецифическая индукция метаболических процессов ингибирование систем метаболизма ЛС конкуренция за связь с белками • Болезни ü печени ü почек ü ЖКТ ü эндокринных органов ( приводят к снижению Vd, Cl) 3. Индивидуальные особенности (генетические, природные).

Принципы дозирования Переменные: 1. Разовая доза – количество вещества, вводимое в организм за один прием 2. Способ введения – адекватен целям 3. Интервал введения 4. Время достижения стационарной концентрации 5. Время полной элиминации после прекращения введения Основные методы введения ЛС: • • постоянный внутривенный с контролем скорости введения прерывистый ( оральный, подкожный, внутримышечный, в/в) Цели введения: достижение стационарной концентрации вещества в организме и поддержание ее необходимый период.

Непрерывное в/в введение Стационарная концентрация (Css) достигается тогда, когда скорость введения препарата равна скорости выведения. D/ΔT Css = ---- Cl Цель непрерывного введения: • купирование острых неотложных состояний • поддержание эффекта в течение определенного времени

Прерывистое введение С С min tox С max Css Диапазон тер. конц. С min 1 2 3 4 5 Число t 1/2

Прерывистое введение Подходы для управления Css : Css прямо пропорциональна дозе и обратно пропорциональна интервалу Т между введениями. F · D Css = ----- Cl · T F – биодоступность T – интервал между дозами ( время) D – доза, вводимая за интервал времени Cl - клиренс Css – средняя стационарная концентрация.

Различают 2 вида доз: • Вводная ( нагрузочная) – доза, которая одномомент- но обеспечивает уровень Css LD ( вводная доза) = Css· Vd/ F ! Нагрузочная доза нужна для достижение объема распределения в действующей концентрации • Поддерживающая – доза, необходимая для поддержания действующей концентрации в интервалы времени между введениями ПД (поддерживающая) = Css· Cl · T/ F !Она компенсирует потери клиренса за интервал между введениями

Выводы: 1. Точка стационарности достигается на 4 – 5 t 1/2 2. Время достижения Css и время элиминации равны 3. Время достижения Css зависит от дозы Клиническое значение выводов: - прогнозируемость времени наступления эффекта - пропуск одной дозы приводит к снижению концентрации на 50%, а для ее достижения понадобится 3 – 4 t ½ - прогнозируемость сроков выведения препарата из организма возможность увеличения безопасности -

Режим дозирования ЛС – доза вещества, вводимая за интервал времени Факторы, влияющие на РД: q Фармакокинетика ЛС ( F, t 1/2, Cl) q Активностьтоксичность ЛС (терапевтический индекс, побочные эффекты, взаимосвязь доза-эффект) q Клинические факторы (состояние больного, возраст, масса тела, сопутствующие заболевания, условия лечения, длительность лечения) q Другие факторы (путь введения, лекарственная форма, переносимость, цена и т. д. )

Период полувыведения и дозирование ЛС ЛС с t½ менее 30 мин - ЛС с малой терапевтической широтой – постоянное инфузионное введение - ЛС со средней и большой терапевтической широтой – можно использовать большие интервалы введения, соответственно назначая большие дозы препарата (бензилпенициллина калиевая и натриевая соли) - можно назначать однократно с целью купирования приступов

• ЛС с t½ более 30 минут и менее 8 ч • определяются щиротой ТД и удобством приема: ЛС со средней и большой широтой ТД – используются интервалы введения, равные 1 - 3 t½ ЛС с малой широтой ТД дозируются с интервалом введения 1 t½, либо чаще, возможно инфузионно • ЛС с t½ более 24 часов - назначаются 1 раз в сутки - удобство для пациента - использование нагрузочных доз чревато появлением побочных эффектов • ЛС с контролируемым высвобождением - обеспечивают постоянную концентрацию в крови - обеспечивают постоянную скорость поступления
Введение,ФК.Вет. 2012..ppt