Химия и строение простых белков.ppt
- Количество слайдов: 68

Введение в биохимию. Химия и строение простых белков План 1. Предмет и задачи биохимии. 2. Значением биохимии для медицины 3. Аминокислоты и пептиды. Биологическое значение 4. Химия и строение простых белков. Аминокислоты по строению являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу. Аминокислоты - это строительные блоки белковых молекул, но необходимость их изучения кроется не только в данной функции. Несколько из них являются источником для образования нейромедиаторов в ЦНС (гистамин, серотонин, гаммааминомасляная кислота, дофамин, норадреналин), другие сами являются нейромедиаторами (глицин, глутаминоваякислота).

Те или иные группы аминокислот необходимы для синтеза пуриновых и пиримидиновых оснований без которых нет нуклеиновых кислот, используются для синтеза низкомолекулярных биологически важных соединений (креатин, карнитин, карнозин, ансерин и др. ). Аминокислота тирозин целиком входит в состав гормонов щитовидной железы и мозгового вещества надпочечников. С нарушением обмена аминокислот связан ряд наследственных и приобретенных заболеваний, сопровождающихся серьезными проблемами в развитии организма (цистиноз, гомоцистеинемия лейциноз тирозинемии и др). Самым известным примером является фенилкетонурия

Аминокислоты используются в качестве лекарств Метионин, незаменимая кислота, содержит мобильную метильную группу, которая может передаваться на другие соединения. Благодаря этому она участвует в синтезе холина, фосфолипидов, обмене витаминов В 12 и фолиевой кислоты. В реакциях биосинтеза белка метионин является инициирующей аминокислотой. Он участвует в процессах обезвреживания токсинов в печени. Метионин ("Ациметион") и его активные производные (как вещество "адеметионин" в составе препарата "Гептрал") используют для профилактики и лечения различных заболеваний печени как липотропный фактор препятствующий накоплению жира, при токсических поражениях печени, при атеросклерозе и в качестве антидепрессанта для улучшения синтеза нейромедиаторов.

Глутаминовая кислота – является предшественником гамма-аминомасляной кислоты (ГАМК), являющейся тормозным медиатором нервной системы. Сам глутамат также является нейромедиатором, стимулирующим передачу возбуждения в синапсах ЦНС. Кроме этого, глутамат участвует в обезвреживании аммиака, синтезе пуриновых и пиримидиновых оснований, играет ведущую роль в обмене других аминокислот, что активно используется в спортивной медицине. Потребность организма в глутаминовой кислоте намного выше потребности в остальных аминокислотах. Глицин является медиатором ЦНС тормозного действия. Улучшает метаболизм в тканях мозга. Оказывает успокаивающее действие. Нормализует сон, уменьшает повышенную раздражительность, депрессивные состояния. Цистеин участвует в метаболизме хрусталика глаза. Зачастую нарушения хрусталика связаны с недостатком цистеина, поэтому цистеин применяют на начальных стадиях катаракты.

Гистидин – условно незаменимая аминокислота. Используется при лечении гепатитов, язв желудка и двенадцатиперстной кишки. Церебролизин – гидролизат вещества мозга свиньи, содержащий низкомолекулярные пептиды (15%) и аминокислоты (85%). Используется при нарушениях функций ЦНС, мозговых травмах, кровоизлияниях, вегетативных дистониях и т. п.
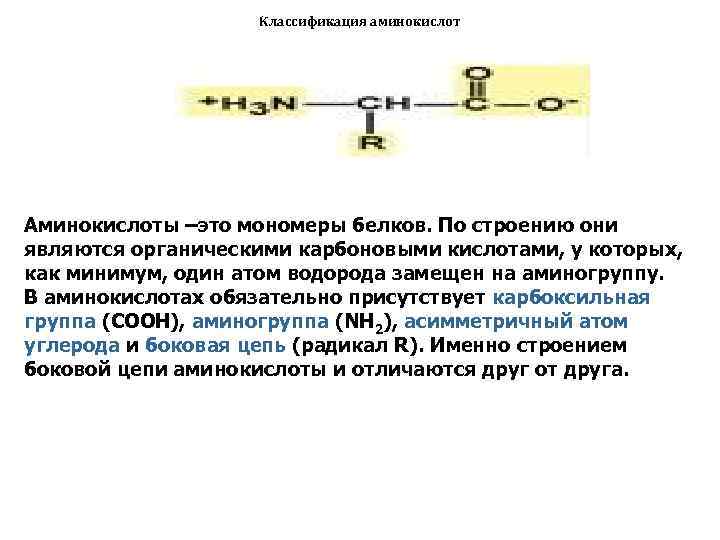
Классификация аминокислот Аминокислоты –это мономеры белков. По строению они являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу. В аминокислотах обязательно присутствует карбоксильная группа (СООН), аминогруппа (NH 2), асимметричный атом углерода и боковая цепь (радикал R). Именно строением боковой цепи аминокислоты и отличаются друг от друга.

Из-за разнообразного строения и свойств классификация аминокислот может быть различной, в зависимости от выбранного качества аминокислот. Аминокислоты подразделяются: 1. В зависимости от положения аминогруппы по отношению к С 2 (α-углеродный атом) на α-аминокислоты, β-аминокислоты и др. 2. По абсолютной конфигурации молекулы на L- и Dстереоизомеры. 3. По оптической активности в отношении плоскости поляризованного света – на право- и левовращающие. 4. По участию аминокислот в синтезе белков – протеиногенные и непротеиногенные. 5. По строению бокового радикала – ароматические, алифатические, содержащие дополнительные СООН- и NH 2 группы. 6. По кислотно-основным свойствам – нейтральные, кислые, основные. 7. По необходимости для организма – заменимые и незаменимые.

Двадцать аминокислот необходимы для синтеза белка Среди многообразия аминокислот только 20 участвует во внутриклеточном синтезе белков (протеиногенные аминокислоты). Также в организме человека обнаружено еще около 40 непротеиногенных аминокислот. Все протеиногенные аминокислоты являются α-аминокислотами.
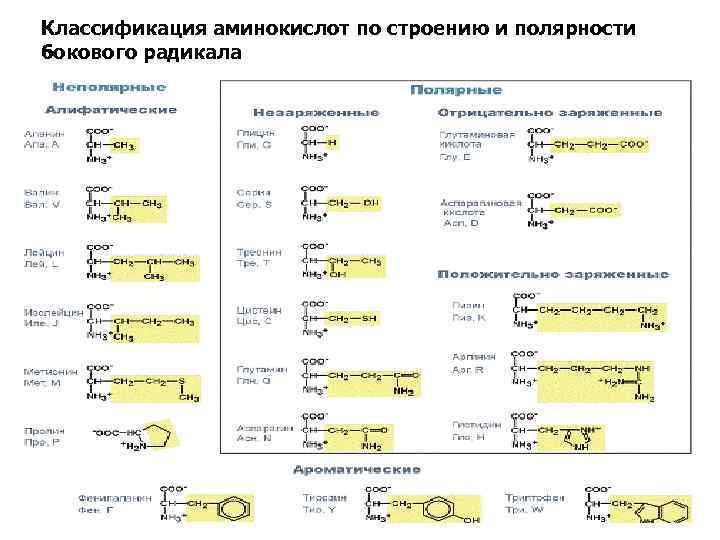
Классификация аминокислот по строению и полярности бокового радикала



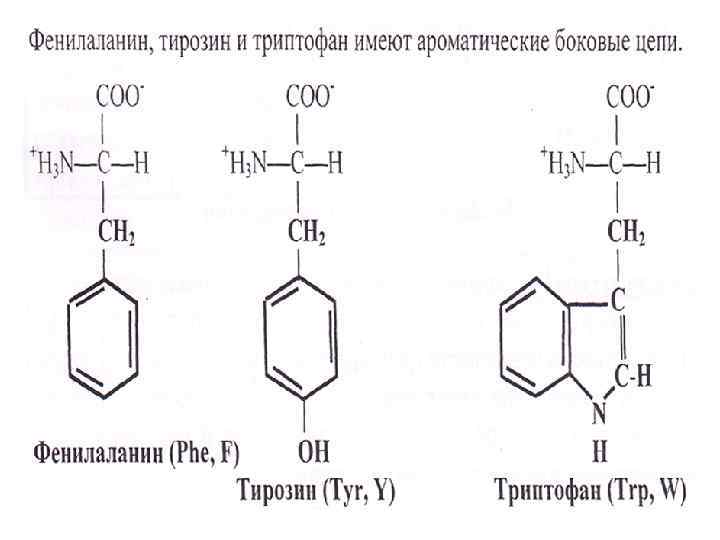


По кислотно-основным свойствам подразделяют: • нейтральные (большинство), • кислые (аспарагиновая и глутаминовая кислоты) и • основные (лизин, аргинин, гистидин) аминокислоты По незаменимости: 1. Незаменимые аминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин). 2. К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием соответствующей аминокислоты. 3. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т. е. их синтез происходит в недостаточном количестве, особенно это касается детей.
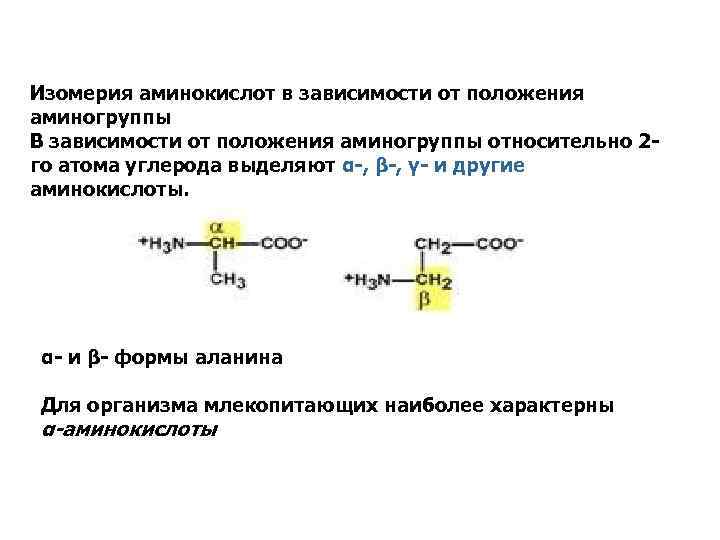
Изомерия аминокислот в зависимости от положения аминогруппы В зависимости от положения аминогруппы относительно 2 го атома углерода выделяют α-, β-, γ- и другие аминокислоты. α- и β- формы аланина Для организма млекопитающих наиболее характерны α-аминокислоты
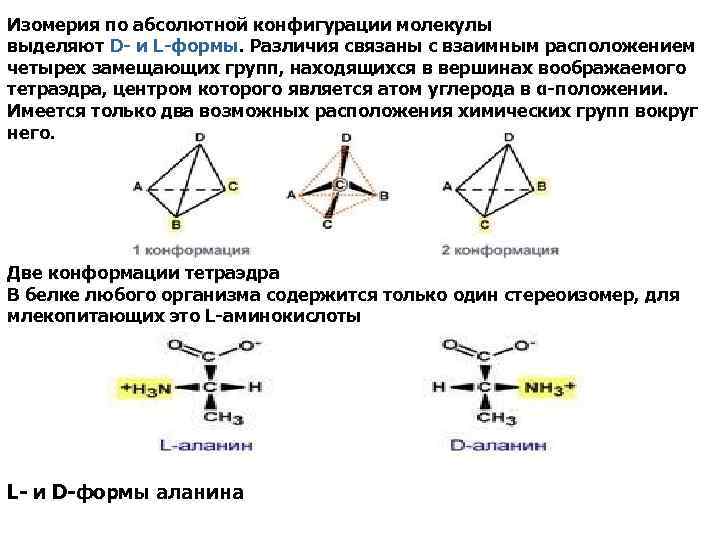
Изомерия по абсолютной конфигурации молекулы выделяют D- и L-формы. Различия связаны с взаимным расположением четырех замещающих групп, находящихся в вершинах воображаемого тетраэдра, центром которого является атом углерода в α-положении. Имеется только два возможных расположения химических групп вокруг него. Две конформации тетраэдра В белке любого организма содержится только один стереоизомер, для млекопитающих это L-аминокислоты L- и D-формы аланина

Однако оптические изомеры претерпевают самопроизвольную неферментативную рацемизацию, т. е. L -форма переходит в D-форму. Данное обстоятельство используется для определения возраста, например, костной ткани зуба (в криминалистике, археологии).
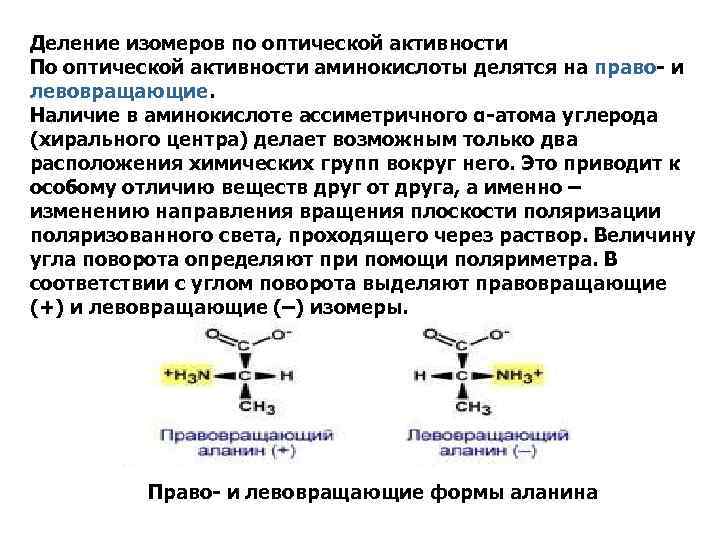
Деление изомеров по оптической активности По оптической активности аминокислоты делятся на право- и левовращающие. Наличие в аминокислоте ассиметричного α-атома углерода (хирального центра) делает возможным только два расположения химических групп вокруг него. Это приводит к особому отличию веществ друг от друга, а именно – изменению направления вращения плоскости поляризации поляризованного света, проходящего через раствор. Величину угла поворота определяют при помощи поляриметра. В соответствии с углом поворота выделяют правовращающие (+) и левовращающие (–) изомеры. Право- и левовращающие формы аланина

Деление на L- и D-формы не соответствует делению на право- и левовращающие. Для одних аминокислот L-формы (или D-формы) являются правовращающими, для других – левовращающими. Например, L-аланин – правовращающий, а L-фенилаланин – левовращающий. При смешивании L- и D-форм одной аминокислоты образуется рацемическая смесь, не обладающая оптической активностью.

Амфотерность - основное свойство аминокислот. Это означает, что вещество сочетает в себе свойства как кислот, так и оснований. В водном растворе аминокислоты одновременно ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов.

Величина р. Н, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, p. I). Значение изоэлектрической точки зависит от строения радикала аминокислоты: • ИЭТ большинства аминокислот располагается в диапазоне р. Н от 5, 5 (фенилаланин) до 6, 3 (пролин), • ИЭТ кислых аминокислот - для глутамата 3, 2, для аспартата 2, 8, • ИЭТ основных аминокислот - для гистидина 7, 6, для аргинина 10, 8, для лизина 9, 7.

Заряд аминокислот зависит от величины р. Н среды и от строения их радикала. При снижении концентрации ионов водорода в растворе (защелачивание среды) повышается их отрыв от аминогруппы и карбоксигруппы аминокислот. Иными словами, от аминокислоты отрывается положительный заряд и она становится отрицательно заряженной. Когда р. Н снижается (закисление среды), то имеющиеся в растворе ионы Н+ присоединяются к амино- и карбоксигруппам – заряд становится положительным. Отправным пунктом для понимания причин появления заряда у конкретной аминокислоты является величина изоэлектрической точки. Необходимо добавить одну очень существенную вещь – изменение р. Н рассматривается относительно изоэлектрической точки. Если р. Н ниже ИЭТ – заряд аминокислоты становится положительным, если р. Н выше – отрицательным.
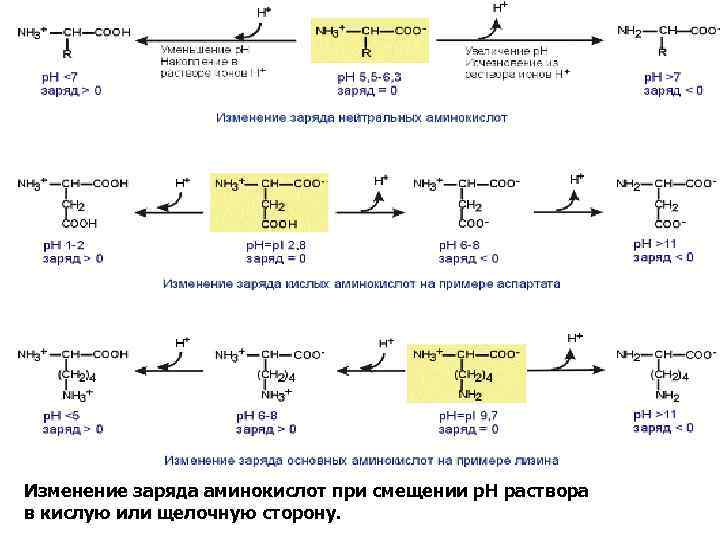
Изменение заряда аминокислот при смещении р. Н раствора в кислую или щелочную сторону.
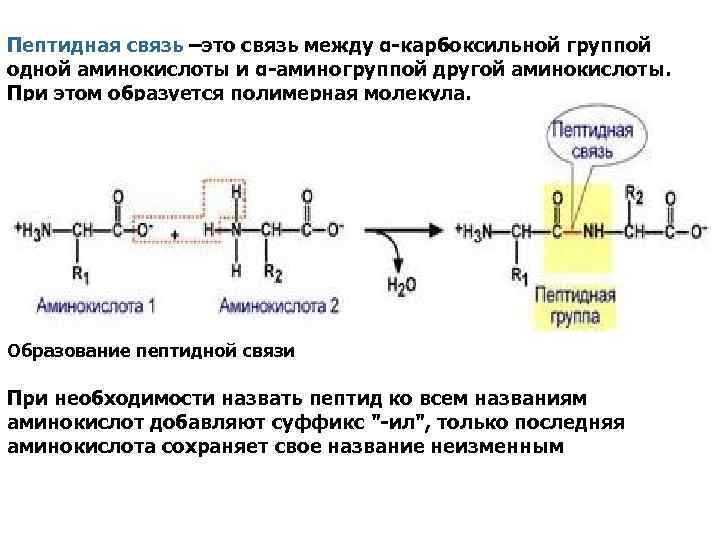
Пептидная связь –это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты. При этом образуется полимерная молекула. Образование пептидной связи При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс "-ил", только последняя аминокислота сохраняет свое название неизменным
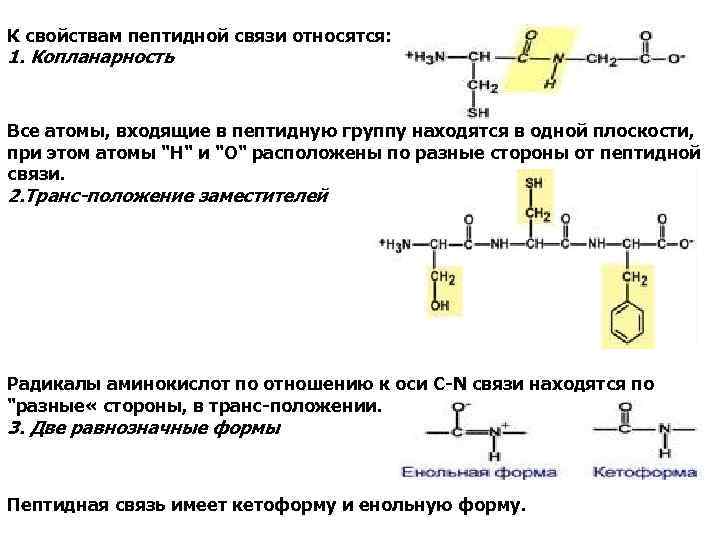
К свойствам пептидной связи относятся: 1. Копланарность Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи. 2. Транс-положение заместителей Радикалы аминокислот по отношению к оси C-N связи находятся по "разные « стороны, в транс-положении. 3. Две равнозначные формы Пептидная связь имеет кетоформу и енольную форму.
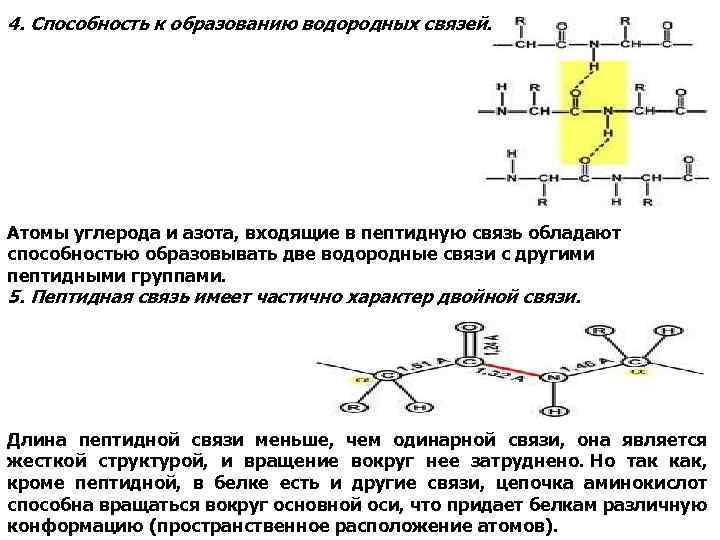
4. Способность к образованию водородных связей. Атомы углерода и азота, входящие в пептидную связь обладают способностью образовывать две водородные связи с другими пептидными группами. 5. Пептидная связь имеет частично характер двойной связи. Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
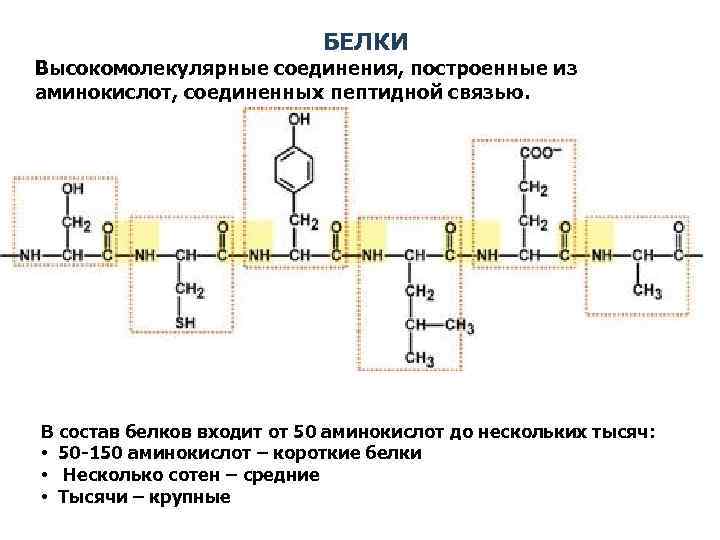
БЕЛКИ Высокомолекулярные соединения, построенные из аминокислот, соединенных пептидной связью. В состав белков входит от 50 аминокислот до нескольких тысяч: • 50 -150 аминокислот – короткие белки • Несколько сотен – средние • Тысячи – крупные

Функции белков Ферментативная Все ферменты являются белками кроме рибозимов Структурная Белки формируют вещество соединительной ткани – коллаген, эластин, кератин, протеогликаны. Непосредственно участвуют в построении рибосом, мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности) Гормональная Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Часть из них являются белками, например, инсулин и глюкагон.

Рецепторная заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток. Транспортная осуществляется перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (транспорт кислорода), трансферрин (транспорт железа) или через мембраны - Na+, К+-АТФаза Са 2+-АТФаза. Резервная Накопление яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени. Сократительная тубулин, актин, миозин. Защитная иммуноглобулины крови, при повреждении тканей - белки свертывающей системы крови. Механическую защиту и поддержку клеток осуществляют протеогликаны.

Молекулярная масса белков – от 5 тыс. до нескольких млн дальтон. Для определения массы белков используют методы: 1. Осаждение белка в растворе 2. Гель хроматография 3. Гель фильтрация 4. Электрофорез

Пептиды Короткие (от 2 -х до нескольких десятков) аминокислот. Биологически активны, регулируют сон, настроение и эмоции. Формирование молекулы белка Образующаяся при соединении аминокислот в полипептид -, первичная структура. Последовательность аминокислот программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка.

Если мутация не носит летальный характер, а приспособительный или хотя бы нейтральный, то может передаться по наследству и остаться в популяции. В результате возникают новые белки с похожими функциями. Такое явление называется полиморфизм белков. При серповидно-клеточной анемии в шестом положении βцепи гемоглобина происходит замена глутаминовой кислоты на валин. Это приводит к синтезу гемоглобина S (Hb. S), который полимеризуется и образует кристаллы. В результате эритроциты деформируются, приобретают форму серпа, теряют эластичность и прохождении через капилляры разрушаются. Это в итоге приводит к анемии.

Форма белковой молекулы Глобулярные (альбумины, глобулины) Фибриллярные (кератины , фибрин, коллаген, эластин) Гомологичные белки – выполняют одинаковые функции у разных организмов (похожи по вторичной и третичной структурам, по своему физиологическому действию, однако отличаются по первичной структуре)

Белки имеют огромную массу молекулы, но невыпадают в осадок, т. к. содержат многочисленные заряженные и полярные группы. Вокруг них формируются гидратная оболочка, которая удерживает белок в растворе. Белки называют полиэлектролитами, т. к. в них много ионогенных группировок.
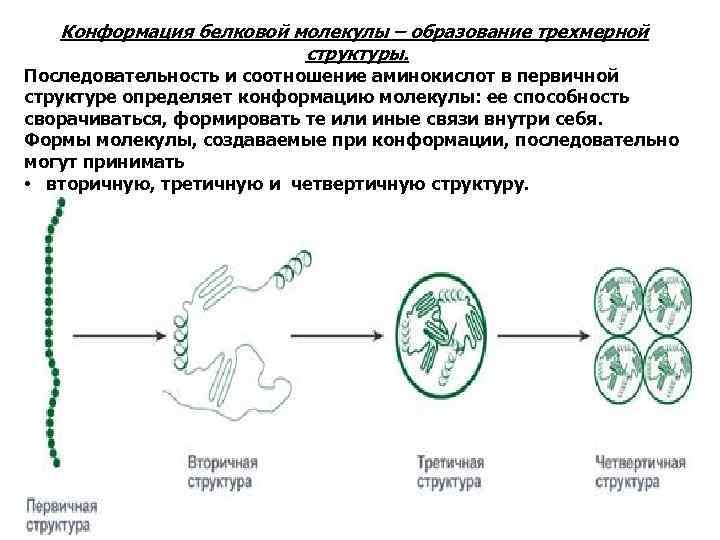
Конформация белковой молекулы – образование трехмерной структуры. Последовательность и соотношение аминокислот в первичной структуре определяет конформацию молекулы: ее способность сворачиваться, формировать те или иные связи внутри себя. Формы молекулы, создаваемые при конформации, последовательно могут принимать • вторичную, третичную и четвертичную структуру.

Вторичная структура образуется в результате взаимодействия пептидных групп с образованием между ними водородных связей. Тип вторичной структуры зависит: • от устойчивости пептидной связи, • подвижности связи между центральным атомом углерода и углеродом пептидной группы, • размером аминокислотного радикала. Можно выделить два возможных варианта вторичной структуры: • α-спираль (α-структура) и • β-складчатый слой (β-структура). В одном белке, как правило, присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
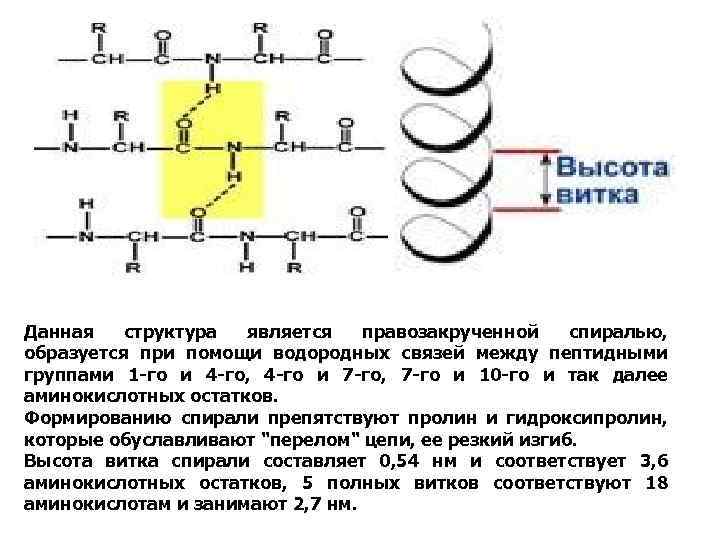
Данная структура является правозакрученной спиралью, образуется при помощи водородных связей между пептидными группами 1 -го и 4 -го, 4 -го и 7 -го, 7 -го и 10 -го и так далее аминокислотных остатков. Формированию спирали препятствуют пролин и гидроксипролин, которые обуславливают "перелом" цепи, ее резкий изгиб. Высота витка спирали составляет 0, 54 нм и соответствует 3, 6 аминокислотных остатков, 5 полных витков соответствуют 18 аминокислотам и занимают 2, 7 нм.
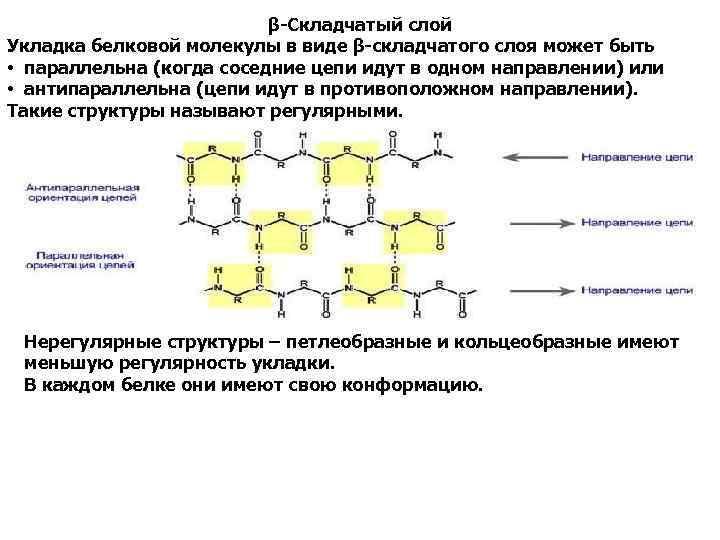
β-Складчатый слой Укладка белковой молекулы в виде β-складчатого слоя может быть • параллельна (когда соседние цепи идут в одном направлении) или • антипараллельна (цепи идут в противоположном направлении). Такие структуры называют регулярными. Нерегулярные структуры – петлеобразные и кольцеобразные имеют меньшую регулярность укладки. В каждом белке они имеют свою конформацию.

Разные типы вторичных структур в белках 1. Только α-спирали (миоглобин и гемоглобин) 2. Белки с α-спиралиями и β-структурами (лактат дегидрогеназа и фосфоглицерат киназа) 3. Только β-структуры (иммуноглобулины, супероксиддисмутаза) 4. Белки имеют незначительное количество регуляторных вторичных структур
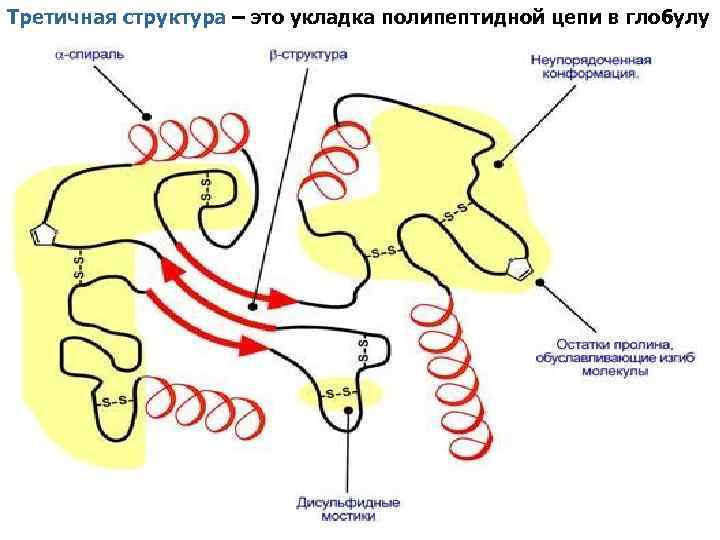
Третичная структура – это укладка полипептидной цепи в глобулу

Аминокислоты образуют связи между своими функциональными группами (радикалами): • водородные – между НО-, СООН-, NH 2 -группами радикалов аминокислот, • дисульфидные – между остатками цистеина, • гидрофобные – между остатками алифатических и ароматических аминокислот, • ионные – между СОО–-группами глутамата и аспартата и NH 3+группами лизина и аргинина, • Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой. • Такие агрегаты стабилизируются водородными связями, ионными связями и электростатическими взаимодействиями между остатками аминокислот, находящимися на поверхности глобулы. • Подобные белки называются олигомерами, а их индивидуальные цепи – протомерами (мономерами, субъединицами). Если белки содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т. д.

• гемоглобин состоит из 4 субъединиц – 2 α-субъединицы и 2 βсубъединицы в гемоглобине взрослых, 2 α-субъединицы и 2 βсубъединицы в фетальном гемоглобине. • Лактатдегидрогеназа включает 4 субъединицы – Н (heart) и М (muscle) в разных сочетаниях: Н 4, Н 3 М 1, Н 2 М 2, Н 1 М 3, М 4. Всего 5 изоферментов. • Креатинкиназа – состоит из 2 субъединиц – В (brain) и М (muscle) в разных сочетаниях: ВВ, ВМ, ММ. Всего 3 изофермента. • Взаимодействие протомеров друг с другом осуществляется по принципу комплементарности, т. е. их поверхность подходит другу по геометрической форме и по функциональным группам аминокислот (возникновение ионных и водородных связей). • Так как субъединицы в олигомерах очень тесно взаимодействуют между собой, то любое изменение конформации какой-либо одной субъединицы обязательно влечет за собой изменение других субъединиц. Этот эффект называется кооперативное взаимодействие. Например, у гемоглобина такое взаимодействие субъединиц в легких ускоряет в 300 раз присоединение кислорода к гемоглобину. В тканях отдача кислорода также ускоряется в 300 раз.

Схема кооперативного взаимодействия субъединиц в гемоглобине. Присоединение в легких первой молекулы кислорода к одной из субъединиц гемоглобина изменяет ее конформацию. В результате она начинает влиять на следующую субъединицу, облегчая присоединение к ней кислорода. После этого они вдвоем влияют на третью субъединицу и так далее. В тканях первая молекула кислорода отделяется от своей субъединицы не очень легко, вторая уже быстрее и так далее.

К свойствам белков относят • амфотерность, • растворимость, • способность к денатурации, • коллоидные свойства.

Амфотерность Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH 3+) группы. Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении р. Н, и отрицательно при его увеличении. Если р. Н раствора соответствует изоэлектрической точке белка, то заряд белка равен 0. Если в пептиде или белке преобладают кислые аминокислоты (глутамат и аспартат), то при нейтральных р. Н заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне р. Н 4, 8 -5, 4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот. Если в белке преобладают основные аминокислоты (лизин и аргинин) – при нейтральных р. Н заряд положительный и обусловлен этими, положительно заряженными, аминокислотами. Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т. е. способность поддерживать неизменным р. Н крови, основаны на способности присоединять ионы Н + при закислении среды или отдавать их при защелачивании. С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) или использовать изменение величины р. Н раствора для осаждения какого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обуславливает их способность к высаливанию, что удобно для выделения белков в нативной конформации.
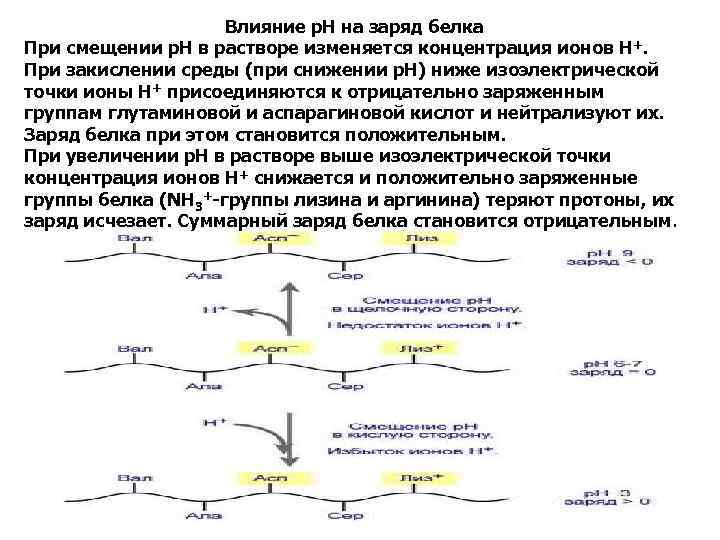
Влияние р. Н на заряд белка При смещении р. Н в растворе изменяется концентрация ионов Н +. При закислении среды (при снижении р. Н) ниже изоэлектрической точки ионы Н+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным. При увеличении р. Н в растворе выше изоэлектрической точки концентрация ионов Н+ снижается и положительно заряженные группы белка (NH 3+-группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
Растворимость Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется: • наличием заряда и взаимоотталкиванием заряженных молекул белка, • наличием гидратной оболочки – чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка. Например, 100 г белка альбумина связывает 30 -50 г воды. • Растворы белков - коллоидные растворы • Свойства белковых растворов определяются большими размерами молекул, т. е. белки являются коллоидными частицами и образуют коллоидные растворы. • К свойствам белковых растворов относятся: • 1. Рассеивание света вследствие дифракции на коллоидных частицах – опалесценция. Особенно это заметно при прохождении луча света через белковый раствор, когда виден светящийся конус (эффект Тиндаля). • 2. Белковые растворы в отличие от истинных обладают малой скоростью диффузии.

• 3. Неспособность белковых частиц проникать через мембраны, поры которых меньше диаметра белков (полунепроницаемые мембраны). Это используется в диализе. Очистка белковых препаратов от посторонних примесей лежит в основе работы "искусственной почки" при лечении острой почечной недостаточности. • 4. Создание онкотического давления, то есть перемещение воды в сторону более высокой концентрации белка, что проявляется, например, как формирование отеков при повышении проницаемости сосудистой стенки. • 5. Высокая вязкость в результате сил сцепления между крупными молекулами, что проявляется, например, при образовании гелей и студней. Удаление белков из раствора Так как растворимость белков зависит от заряда и наличия гидратной оболочки, то исчезновение одного или обоих этих факторов ведет к осаждению белка и потере его функций. Некоторые способы осаждения позволяют впоследствии восстановить нативные свойства и работоспособность белков. Обратимость осаждения белков обусловлена сохранением первичной структуры белка. Восстановление физико-химических и биологических свойств белка называется ренативация (ренатурация). Иногда для ренативации достаточно просто удалить повреждающий агент.

Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции. 1. Физическая денатурация Вызывается повышением температуры, ультрафиолетовым и микроволновым излучением, механическими воздействиями, ионизацией заряженными частицами. 2. Химическая денатурация Зависит от природы денатурирующего реагента: • кислоты и щелочи образуют водородные связи с пептидными группами, • органические растворители образуют водородные связи и вызывают дегидратацию, • алкалоиды образуют связи с полярными группами и разрывают систему водородных и ионных связей, • тяжелые металлы взаимодействуют с заряженными радикалами, нейтрализуют отрицательные заряды и разрывают систему водородных и ионных связей.

Высаливание добавление к раствору белка нейтральных солей (Na 2 SO 4, (NH 4)2 SO 4). Механизм высаливания заключается во взаимодействии анионов (SO 42 -) и катионов (Na+, NH 4+) с зарядами белка (группы NH 4+ и COO–). В результате заряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно резко уменьшается гидратная оболочка. Все это приводит к "слипанию" молекул и осаждению. Так как белки плазмы крови отличаются по размерам, заряду, строению, то можно подобрать такие количества соли, которые вызовут осаждение менее устойчивых белков, пока другие еще будут растворены. Например, подобным образом раньше определяли соотношение альбумины/глобулины в плазме крови. Альбумины, как более полярные молекулы, остаются в растворенном состоянии при 50% насыщении раствора нейтральными солями, в то время как глобулины в этих условиях уже осаждаются. В норме соотношение альбумины/глобулины в плазме крови равно 1, 2 -1, 8.

Осаждение водоотнимающими средствами При добавлении водоотнимающих средств (ацетон, этанол) происходит отнятие у белка гидратной оболочки, но не заряда. Растворимость несколько снижается, но денатурации не наступает. Например, в этом заключается антисептическое действие этанола. Изменение р. Н Мягкое изменение р. Н до изоэлектрической точки белка ведет к исчезновению заряда, сопутствующему уменьшению гидратной оболочки и, как следствие, снижению растворимости молекулы.

Классификация белков В соответствии с биологическими функциями выделяют: • структурные белки (коллаген, кератин), • ферментативные (пепсин, амилаза), • транспортные (трансферрин, альбумин, гемоглобин), • пищевые (белки яйца, злаков), • сократительные и двигательные (актин, миозин, тубулин), • защитные (иммуноглобулины, тромбин, фибриноген), • регуляторные (соматотропный гормон, адренокортикотропный гормон, инсулин).

Классификация по строению В зависимости от формы молекулы выделяют • глобулярные и • фибриллярные белки.

По количеству белковых цепей в одной молекуле выделяют • мономерные белки, которые имеют одну субъединицу (протомер) и • полимерные белки, имеющие несколько субъединиц. Например, к мономерным белкам относятся альбумин, миоглобин, к полимерным - гемоглобин (4 субъединицы), лактатдегидрогеназа (4 субъединицы), креатинкиназа (2 субъединицы),

По химическому составу все белки подразделяют на • простые и • сложные. Простые белки содержат в структуре только аминокислоты (альбумины, глобулины, гистоны, протамины). Сложные белки, кроме аминокислот, имеют небелковые компоненты (нуклеопротеины, фосфопротеины, металлопротеины, липопротеины, хромопротеины, гликопротеины).

Простые белки Структура простых белков представлена только полипептидной цепью (альбумин, инсулин). Однако необходимо понимать, что многие простые белки (например, альбумин) не существуют в "чистом" виде, они всегда связаны с какими-либо небелковыми веществами. Их относят к простым белкам только по той причине, что связи с небелковой группой слабые. Альбумины – это группа схожих белков плазмы крови с молекулярной массой около 40 к. Да, содержат много глутаминовой кислоты и поэтому имеют кислые свойства и высокий отрицательный заряд при физиологических р. Н. Легко адсорбируют полярные и неполярные молекулы, являются, белком-транспортером в крови для многих веществ, в первую очередь для билирубина и длинноцепочечных жирных кислот

Глобулины Группа разнообразных белков плазмы крови с молекулярной массой до 100 к. Да, слабокислые или нейтральные. Они слабо гидратированы, по сравнению с альбуминами меньше устойчивы в растворе и легче осаждаются, что используется в клинической диагностике в "осадочных" пробах (тимоловая, Вельтмана). Часто содержат углеводные компоненты. При электрофорезе глобулины сыворотки крови разделяются, как минимум, на 4 фракции – α 1 -глобулины, α 2 -глобулины, β-глобулины и γ-глобулины. Картина электрофореза белков сыворотки крови

Так как глобулины включают в себя разнообразные белки, то их функции многочисленны. Часть α-глобулинов обладает антипротеазной активностью, что защищает белки крови от преждевременного разрушения, например, α 1 -антитрипсин, α 1 -антихимотрипсин, α 2 -макроглобулин. Некоторые глобулины способны к связыванию определенных веществ: трансферрин (переносит ионы железа), церулоплазмин (содержит ионы меди), гаптоглобин (переносчик гемоглобина), гемопексин (транспорт гема). γ-Глобулины являются антителами и обеспечивают иммунную защиту организма.

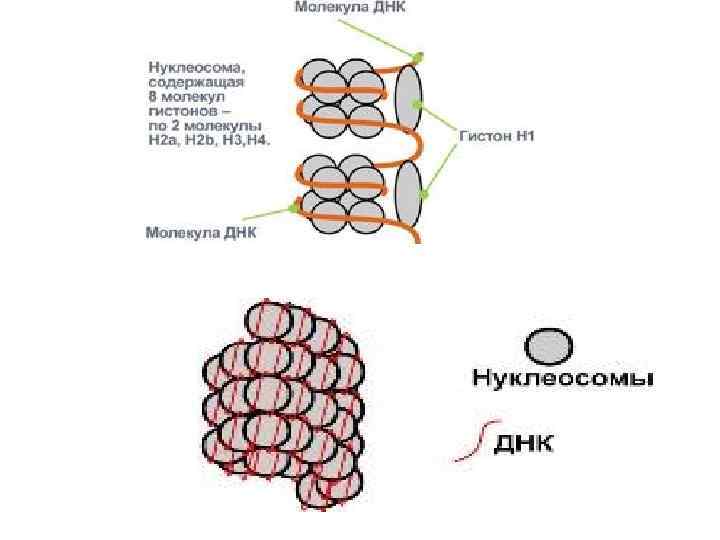
Гистоны – внутриядерные белки массой около 24 к. Да. Обладают выраженными основными свойствами, поэтому при физиологических значениях р. Н заряжены положительно и связываются с ДНК, образуя дезоксирибонуклеопротеины. Существуют 5 типов гистонов – очень богатый лизином (29%) гистон Н 1, другие гистоны Н 2 а, H 2 b, НЗ, Н 4 богаты лизином и аргинином (в сумме до 25%). Радикалы аминокислот в составе гистонов могут быть метилированы, ацетилированы или фосфорилированы. Это изменяет суммарный заряд и другие свойства белков. Можно выделить две функции гистонов: 1. Регуляция активности генома, а именно – они препятствуют транскрипции. 2. Структурная – стабилизируют пространственную структуру ДНК.

Протамины Это белки массой от 4 к. Да до 12 к. Да, у ряда организмов (рыбы) они являются заменителями гистонов, есть в спермиях. Отличаются резко увеличенным содержанием аргинина (до 80%). Протамины присутствуют в клетках, не способных к делению. Их функция как у гистонов – структурная.

Коллаген Фибриллярный белок с уникальной структурой. Составляет основу межклеточного вещества соединительной ткани сухожилий, кости, хряща, кожи, но имеется, конечно, и в других тканях. Обычно содержит моносахаридные (галактоза) и дисахаридные (галактоза-глюкоза) остатки, соединенные с ОН-группами некоторых остатков гидроксилизина. Полипептидная цепь коллагена включает 1000 аминокислот и состоит из повторяющегося триплета [Гли-А-В], где А и В – любые, кроме глицина, аминокислоты. В основном это аланин, его доля составляет 11%, доля пролина и гидроксипролина – 21%. Таким образом, на другие аминокислоты приходится всего 33%. Структура пролина и гидроксипролина не позволяет образовать α-спиральную структуру, из-за этого образуется левозакрученная спираль, где на один виток приходится 3 аминокислотных остатка.

При синтезе коллагена первостепенное значение имеет гидроксилирование лизина и пролина, включенных в состав первичной цепи, осуществляемое при участии аскорбиновой кислоты. Синтезированная молекула коллагена построена из 3 полипептидных цепей, сплетенных между собой в плотный жгут – тропоколлаген (длина 300 нм, диаметр 1, 6 нм). Полипептидные цепи прочно связаны между собой через εаминогруппы остатков лизина. Тропоколлаген формирует крупные коллагеновые фибриллы диаметром 10 -300 нм. Поперечная исчерченность фибриллы обусловлена смещением молекул тропоколлагена друг относительно друга на 1/4 их длины. В коже фибриллы образуют нерегулярно сплетенную и очень густую сеть. Например, выделанная кожа представляет собой почти чистый коллаген.


Эластин По строению в общих чертах эластин схож с коллагеном. Находится в связках, эластичном слое сосудов. Структурной единицей является тропоэластин с молекулярной массой 72 к. Да и длиной 800 аминокислотных остатков. В нем гораздо больше лизина, валина, аланина и меньше гидроксипролина. Отсутствие пролина обуславливает наличие спиральных эластичных участков. Характерной особенностью эластина является наличие своеобразной структуры – десмозина, который своими 4 -мя группами объединяет белковые цепи в системы, способные растягиваться во всех направлениях. α-Аминогруппы и α-карбоксильные группы десмозина включаются в образование пептидных связей одного или нескольких белков
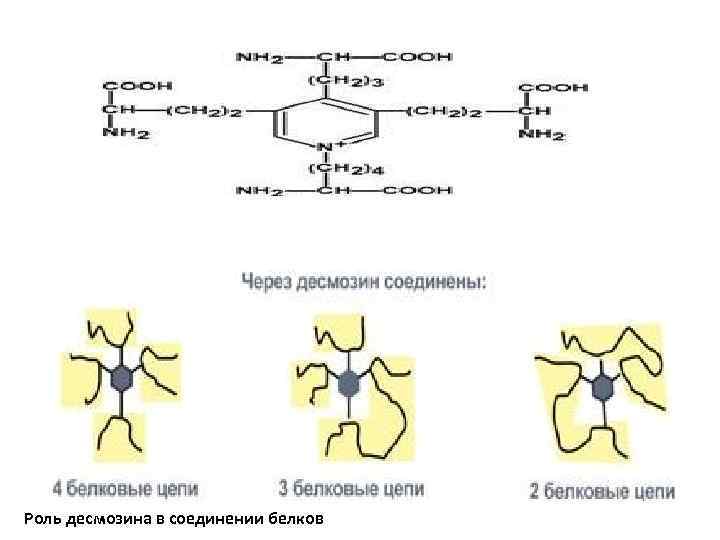
Роль десмозина в соединении белков
Химия и строение простых белков.ppt