1 введение.ppt
- Количество слайдов: 53
 Введение. Предмет органической химии Определение I: органическая химия – это химия соединений углерода. Исключения : оксид углерода (II) CO, оксид углерода (IV) CO 2, угольная кислота H 2 CO 3 и ее соли, сероуглерод CS 2, синильная кислота HCN и ее соли и т. д. Определение II: органическая химия — это химия углеводородов и их производных. Исключения :
Введение. Предмет органической химии Определение I: органическая химия – это химия соединений углерода. Исключения : оксид углерода (II) CO, оксид углерода (IV) CO 2, угольная кислота H 2 CO 3 и ее соли, сероуглерод CS 2, синильная кислота HCN и ее соли и т. д. Определение II: органическая химия — это химия углеводородов и их производных. Исключения :
 Введение. Теория строения органических соединений Основные достижения органической химии первой половины и середины XIX века: 1828 г. — синтез мочевины (Велер); 1842 г. — синтез анилина (Зинин); 1845 г. — синтез уксусной кислоты (Кольбе); 1854 г. — синтез жиров (Бертло); 1861 г. — синтез углеводоподобного соединения (Бутлеров); 1868 г. — синтез ализарина — красителя природного происхождения (Гребе и Либерман). Первое положение теории А. М. Бутлерова. В молекулах органических веществ атомы соединяются друг с другом в определенной последовательности, согласно их валентности. Последовательность соединения атомов в молекуле называется химическим строением (структурой).
Введение. Теория строения органических соединений Основные достижения органической химии первой половины и середины XIX века: 1828 г. — синтез мочевины (Велер); 1842 г. — синтез анилина (Зинин); 1845 г. — синтез уксусной кислоты (Кольбе); 1854 г. — синтез жиров (Бертло); 1861 г. — синтез углеводоподобного соединения (Бутлеров); 1868 г. — синтез ализарина — красителя природного происхождения (Гребе и Либерман). Первое положение теории А. М. Бутлерова. В молекулах органических веществ атомы соединяются друг с другом в определенной последовательности, согласно их валентности. Последовательность соединения атомов в молекуле называется химическим строением (структурой).
 Введение. Теория строения органических соединений Второе положение теории А. М. Бутлерова. Свойства веществ зависят не только от состава, но и от химического и пространственного строения их молекул. Вещества, имеющие одинаковый качественный и количественный состав, но разное строение и свойства, называются изомерами. Молекулы изомеров изображаются одинаковыми эмпирическими, но разными структурными формулами. Явление образования изомеров называется изомерией. Изомерия Структурная Пространственная Межклассовая
Введение. Теория строения органических соединений Второе положение теории А. М. Бутлерова. Свойства веществ зависят не только от состава, но и от химического и пространственного строения их молекул. Вещества, имеющие одинаковый качественный и количественный состав, но разное строение и свойства, называются изомерами. Молекулы изомеров изображаются одинаковыми эмпирическими, но разными структурными формулами. Явление образования изомеров называется изомерией. Изомерия Структурная Пространственная Межклассовая
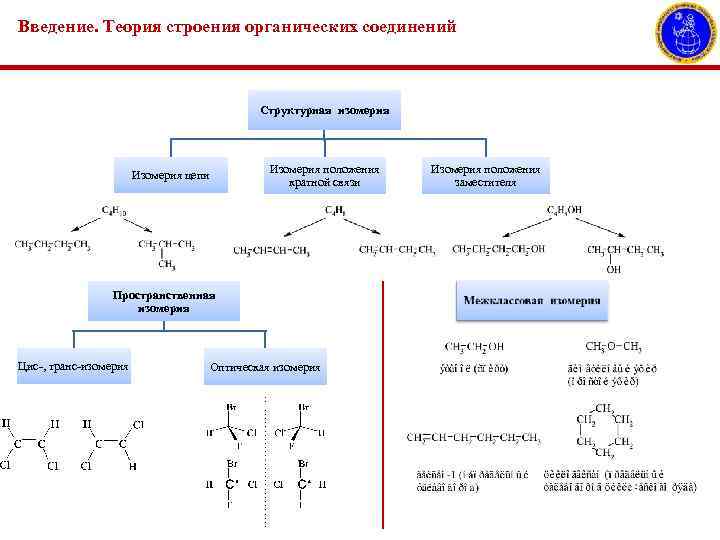 Введение. Теория строения органических соединений Структурная изомерия Изомерия цепи Изомерия положения кратной связи Пространственная изомерия Цис-, транс-изомерия Оптическая изомерия Изомерия положения заместителя
Введение. Теория строения органических соединений Структурная изомерия Изомерия цепи Изомерия положения кратной связи Пространственная изомерия Цис-, транс-изомерия Оптическая изомерия Изомерия положения заместителя
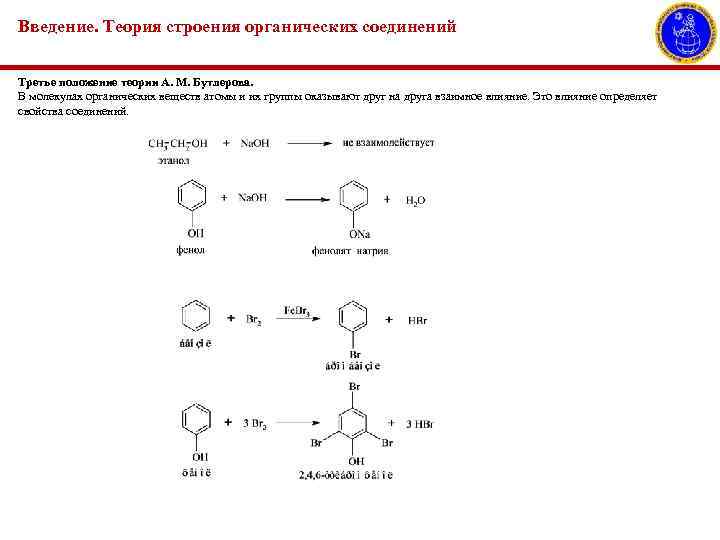 Введение. Теория строения органических соединений Третье положение теории А. М. Бутлерова. В молекулах органических веществ атомы и их группы оказывают друг на друга взаимное влияние. Это влияние определяет свойства соединений.
Введение. Теория строения органических соединений Третье положение теории А. М. Бутлерова. В молекулах органических веществ атомы и их группы оказывают друг на друга взаимное влияние. Это влияние определяет свойства соединений.
 Куб Неккера
Куб Неккера
 Введение. Химическая связь Виды химической связи Ковалентная Ионная Природа ковалентной связи. Уравнение Шредингера: , где – оператор Гамильтона; Е – полная энергия системы; – молекулярная волновая функция. Метод молекулярных орбиталей (МО ЛКАО) где и – взаимодействующие атомные орбитали атомов А и В; a и b – вклады атомных орбиталей и в молекулярную орбиталь. Металлическая Водородная
Введение. Химическая связь Виды химической связи Ковалентная Ионная Природа ковалентной связи. Уравнение Шредингера: , где – оператор Гамильтона; Е – полная энергия системы; – молекулярная волновая функция. Метод молекулярных орбиталей (МО ЛКАО) где и – взаимодействующие атомные орбитали атомов А и В; a и b – вклады атомных орбиталей и в молекулярную орбиталь. Металлическая Водородная
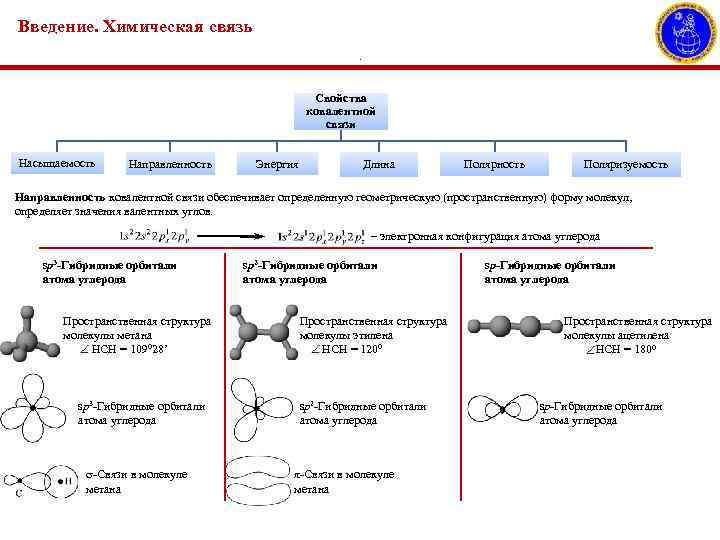 Введение. Химическая связь. Свойства ковалентной связи Насыщаемость Направленность Энергия Длина Полярность Поляризуемость Направленность ковалентной связи обеспечивает определенную геометрическую (пространственную) форму молекул, определяет значения валентных углов. – электронная конфигурация атома углерода sp 3 -Гибридные орбитали атома углерода Пространственная структура молекулы метана НСН = 109028’ sp 3 -Гибридные орбитали атома углерода -Связи в молекуле метана sp 2 -Гибридные орбитали атома углерода Пространственная структура молекулы этилена НСН = 1200 sp 2 -Гибридные орбитали атома углерода π-Связи в молекуле метана sp-Гибридные орбитали атома углерода Пространственная структура молекулы ацетилена НСН = 1800 sp-Гибридные орбитали атома углерода
Введение. Химическая связь. Свойства ковалентной связи Насыщаемость Направленность Энергия Длина Полярность Поляризуемость Направленность ковалентной связи обеспечивает определенную геометрическую (пространственную) форму молекул, определяет значения валентных углов. – электронная конфигурация атома углерода sp 3 -Гибридные орбитали атома углерода Пространственная структура молекулы метана НСН = 109028’ sp 3 -Гибридные орбитали атома углерода -Связи в молекуле метана sp 2 -Гибридные орбитали атома углерода Пространственная структура молекулы этилена НСН = 1200 sp 2 -Гибридные орбитали атома углерода π-Связи в молекуле метана sp-Гибридные орбитали атома углерода Пространственная структура молекулы ацетилена НСН = 1800 sp-Гибридные орбитали атома углерода
 Введение. Химическая связь Энергия ковалентной связи, количественно характеризующая ее прочность, определяется как энергия, необходимая для разрыва связи. Длиной ковалентной связи называется равновесное расстояние между центрами связанных атомов. Длина связи тем меньше чем больше ее кратность и чем больший вклад в гибридную орбиталь, участвующую в образовании связи, вносит s-орбиталь. Номер точки на рис. Связь Гибридизация Длина связи, нм Энергия связи, к. Дж/моль 1 sp 3—sp 3 0, 154 355, 3 2 sp 3—sp 2 0, 152— 0, 153 375, 8 3 sp 2—sp 2 0, 148 409, 64 4 sp 2—sp 2 0, 134 555, 9 5 sp 2—sp 0, 143 - 6 sp—sp 0, 138 - 7 sp—sp 0, 121 838, 3 Связь Одинарная Двойная Тройная B 0, 088 0, 076 - C 0, 077 0, 060 N 0, 070 0, 060 0, 055 O 0, 066 0, 055 - F 0, 064 -
Введение. Химическая связь Энергия ковалентной связи, количественно характеризующая ее прочность, определяется как энергия, необходимая для разрыва связи. Длиной ковалентной связи называется равновесное расстояние между центрами связанных атомов. Длина связи тем меньше чем больше ее кратность и чем больший вклад в гибридную орбиталь, участвующую в образовании связи, вносит s-орбиталь. Номер точки на рис. Связь Гибридизация Длина связи, нм Энергия связи, к. Дж/моль 1 sp 3—sp 3 0, 154 355, 3 2 sp 3—sp 2 0, 152— 0, 153 375, 8 3 sp 2—sp 2 0, 148 409, 64 4 sp 2—sp 2 0, 134 555, 9 5 sp 2—sp 0, 143 - 6 sp—sp 0, 138 - 7 sp—sp 0, 121 838, 3 Связь Одинарная Двойная Тройная B 0, 088 0, 076 - C 0, 077 0, 060 N 0, 070 0, 060 0, 055 O 0, 066 0, 055 - F 0, 064 -
 Введение. Химическая связь Полярность ковалентных связей и молекул. Полярными называются такие ковалентные связи, у которых центры тяжести положительных и отрицательных зарядов не совпадают. - неполярные связи Дипольный момент – мера полярности связи: q — электрический заряд; — расстояние между центрами тяжести положительных и отрицательных зарядов. 1 D = 10 -18 ед. дип. мом. СГС = 3, 34 · 10 -30 К·м. Связь , D H—C H—N C—O C—N C—F C—Cl 0, 2 1, 4 1, 1 0, 4 1, 83 2, 06 = эл. + ат. + пер. + неп. где эл. — вклад в дипольный момент, обусловленный смещением электронов в сторону более электроотрицательного атома; ат. — вклад в дипольный момент, возникающий при образовании гибридной орбитали; пер. — вклад в дипольный момент, возникающий, если область перекрывания орбиталей расположена не посередине связей вследствие особенности их геометрии; неп. — вклад в дипольный момент за счет орбитали неподеленной электронной пары.
Введение. Химическая связь Полярность ковалентных связей и молекул. Полярными называются такие ковалентные связи, у которых центры тяжести положительных и отрицательных зарядов не совпадают. - неполярные связи Дипольный момент – мера полярности связи: q — электрический заряд; — расстояние между центрами тяжести положительных и отрицательных зарядов. 1 D = 10 -18 ед. дип. мом. СГС = 3, 34 · 10 -30 К·м. Связь , D H—C H—N C—O C—N C—F C—Cl 0, 2 1, 4 1, 1 0, 4 1, 83 2, 06 = эл. + ат. + пер. + неп. где эл. — вклад в дипольный момент, обусловленный смещением электронов в сторону более электроотрицательного атома; ат. — вклад в дипольный момент, возникающий при образовании гибридной орбитали; пер. — вклад в дипольный момент, возникающий, если область перекрывания орбиталей расположена не посередине связей вследствие особенности их геометрии; неп. — вклад в дипольный момент за счет орбитали неподеленной электронной пары.
 Введение. Химическая связь Электроотрицательность — это количественная характеристика способности атома в молекуле притягивать к себе электроны с химической связи. Шкала электроотрицательности Полинга: Шкала электроотрицательности Малликена: где EА—В, EA—A и EA—B — энергии ковалентных связей в двухатомных молекулах A-B, A-A и B-B. где и — электроотрицательности атомов А и В. Положив и Полинг вычислил значения где – первый потенциал ионизации (энергия, которую необходимо затратить на отрыв первого электрона от атома ; – сродство к электрону (энергия , выделяющаяся присоединении первого электрона к атому). Орбитальная электроотрицательность: электроотрицательности всех элементов. < < H (2, 1) Li (1) Be (1, 5) Na Mg (1, 2) (0, 9) B (2) Al (1, 5) C (2, 5) Si (1, 8) N (3, 0) O (3, 5) F (4) P (2, 1) S (2, 5) Cl(3, 0) Группа СООН 3, 4 3, 2 СН 3 СF 3 CCl 3 CBr 3 2, 9 2, 5 3, 0 2, 9 2, 7 Поляризуемость молекул и ковалентных связей. Поляризуемостью молекулы называют ее способность к поляризации, т. е. к изменению положения ядер и состояния электронного облака под влиянием внешнего электрического поля. Зависимость рефракции атомов и связей от положения элемента в периоде Атом N O F R Связь 2, 744 1, 764 0, 81 C—N 1, 57 C—O 1, 54 C—F 1. 44 R В группе с увеличением порядкового номера наблюдается снижение поляризуемости: RF = 0, 81; RCl = 5, 844; RBr = 8, 741; RI = 13, 954. Поляризуемость атома зависит от его состояния и окружения: RCl = 9, 30 (Cl-); RCl = 6, 68 (HCl); RCl = 5, 84 (Cl 2).
Введение. Химическая связь Электроотрицательность — это количественная характеристика способности атома в молекуле притягивать к себе электроны с химической связи. Шкала электроотрицательности Полинга: Шкала электроотрицательности Малликена: где EА—В, EA—A и EA—B — энергии ковалентных связей в двухатомных молекулах A-B, A-A и B-B. где и — электроотрицательности атомов А и В. Положив и Полинг вычислил значения где – первый потенциал ионизации (энергия, которую необходимо затратить на отрыв первого электрона от атома ; – сродство к электрону (энергия , выделяющаяся присоединении первого электрона к атому). Орбитальная электроотрицательность: электроотрицательности всех элементов. < < H (2, 1) Li (1) Be (1, 5) Na Mg (1, 2) (0, 9) B (2) Al (1, 5) C (2, 5) Si (1, 8) N (3, 0) O (3, 5) F (4) P (2, 1) S (2, 5) Cl(3, 0) Группа СООН 3, 4 3, 2 СН 3 СF 3 CCl 3 CBr 3 2, 9 2, 5 3, 0 2, 9 2, 7 Поляризуемость молекул и ковалентных связей. Поляризуемостью молекулы называют ее способность к поляризации, т. е. к изменению положения ядер и состояния электронного облака под влиянием внешнего электрического поля. Зависимость рефракции атомов и связей от положения элемента в периоде Атом N O F R Связь 2, 744 1, 764 0, 81 C—N 1, 57 C—O 1, 54 C—F 1. 44 R В группе с увеличением порядкового номера наблюдается снижение поляризуемости: RF = 0, 81; RCl = 5, 844; RBr = 8, 741; RI = 13, 954. Поляризуемость атома зависит от его состояния и окружения: RCl = 9, 30 (Cl-); RCl = 6, 68 (HCl); RCl = 5, 84 (Cl 2).
 Введение. Соединения без химической связи (супрамолекулярные соединения) Клатра ты (от лат. clatratus — обрешеченный, закрытый решеткой) — соединения включения. Образованы включением молекул вещества ( «гостя» ) в полости кристаллической решётки, образованной молекулами другого типа ( «хозяевами» ) (решётчатые клатраты), либо в полость одной большой молекулы-хозяина (молекулярные клатраты). Обязательное условие – соответствие формы и размеров молекул гостей форме и размерам молекул хозяев. Включенные молекулы (решетчатые клатраты) удерживаются в соединении за счет того, что не имеют выхода в окружающую среду. Решетчатые клатраты: • клеточные, (например, клатраты гидрохинона); • газовые гидраты; • канальные (например, клатраты мочевины, тиомочевины); • слоистые (например, соединения графита). Молекулярные клатраты: • кавитаты, имеющие полость в виде канала или клетки (например, соединения циклодекстрина или амилозы с иодом; • адикулаты, у которых полость напоминае корзину.
Введение. Соединения без химической связи (супрамолекулярные соединения) Клатра ты (от лат. clatratus — обрешеченный, закрытый решеткой) — соединения включения. Образованы включением молекул вещества ( «гостя» ) в полости кристаллической решётки, образованной молекулами другого типа ( «хозяевами» ) (решётчатые клатраты), либо в полость одной большой молекулы-хозяина (молекулярные клатраты). Обязательное условие – соответствие формы и размеров молекул гостей форме и размерам молекул хозяев. Включенные молекулы (решетчатые клатраты) удерживаются в соединении за счет того, что не имеют выхода в окружающую среду. Решетчатые клатраты: • клеточные, (например, клатраты гидрохинона); • газовые гидраты; • канальные (например, клатраты мочевины, тиомочевины); • слоистые (например, соединения графита). Молекулярные клатраты: • кавитаты, имеющие полость в виде канала или клетки (например, соединения циклодекстрина или амилозы с иодом; • адикулаты, у которых полость напоминае корзину.
 Введение. Соединения без химической связи (супрамолекулярные соединения) Соединения с топологической (механической связью). Катенаны Ротаксаны
Введение. Соединения без химической связи (супрамолекулярные соединения) Соединения с топологической (механической связью). Катенаны Ротаксаны
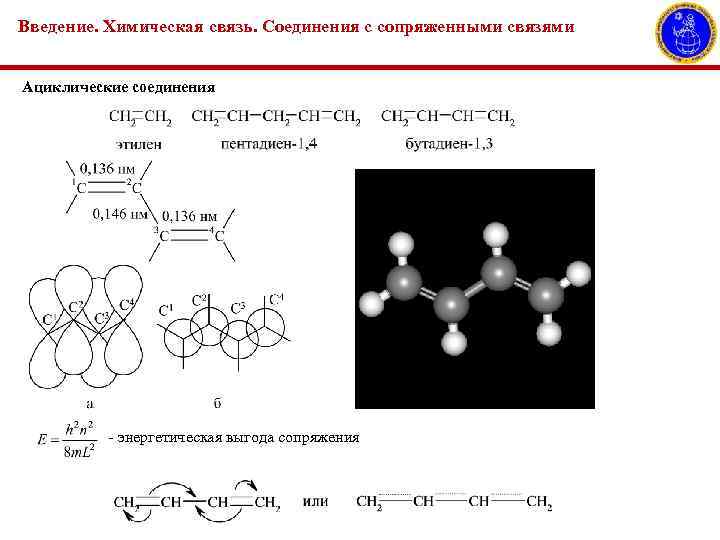 Введение. Химическая связь. Соединения с сопряженными связями Ациклические соединения - энергетическая выгода сопряжения
Введение. Химическая связь. Соединения с сопряженными связями Ациклические соединения - энергетическая выгода сопряжения
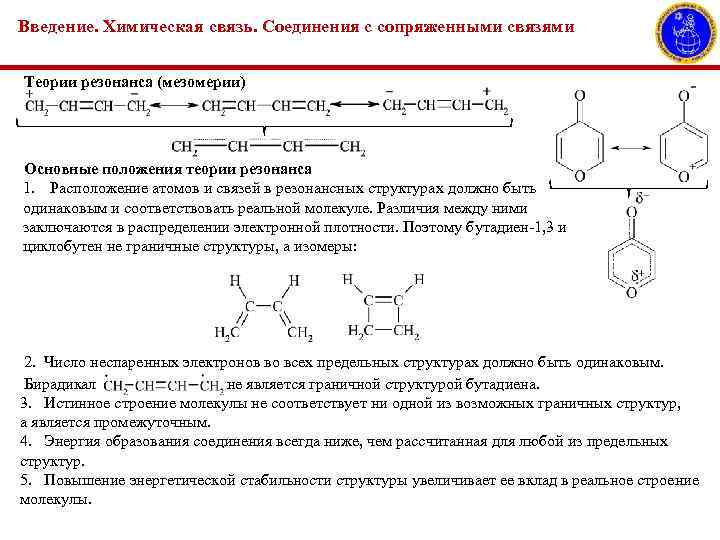 Введение. Химическая связь. Соединения с сопряженными связями Теории резонанса (мезомерии) Основные положения теории резонанса 1. Расположение атомов и связей в резонансных структурах должно быть одинаковым и соответствовать реальной молекуле. Различия между ними заключаются в распределении электронной плотности. Поэтому бутадиен-1, 3 и циклобутен не граничные структуры, а изомеры: 2. Число неспаренных электронов во всех предельных структурах должно быть одинаковым. Бирадикал не является граничной структурой бутадиена. 3. Истинное строение молекулы не соответствует ни одной из возможных граничных структур, а является промежуточным. 4. Энергия образования соединения всегда ниже, чем рассчитанная для любой из предельных структур. 5. Повышение энергетической стабильности структуры увеличивает ее вклад в реальное строение молекулы.
Введение. Химическая связь. Соединения с сопряженными связями Теории резонанса (мезомерии) Основные положения теории резонанса 1. Расположение атомов и связей в резонансных структурах должно быть одинаковым и соответствовать реальной молекуле. Различия между ними заключаются в распределении электронной плотности. Поэтому бутадиен-1, 3 и циклобутен не граничные структуры, а изомеры: 2. Число неспаренных электронов во всех предельных структурах должно быть одинаковым. Бирадикал не является граничной структурой бутадиена. 3. Истинное строение молекулы не соответствует ни одной из возможных граничных структур, а является промежуточным. 4. Энергия образования соединения всегда ниже, чем рассчитанная для любой из предельных структур. 5. Повышение энергетической стабильности структуры увеличивает ее вклад в реальное строение молекулы.
 Введение. Химическая связь. Соединения с сопряженными связями Особенности свойств соединений с сопряженными связями по сравнению с их несопряженными аналогами: — сдвиг в длинноволновую область максимумов поглощения и испускания в электронных спектрах; — увеличение поляризуемости; — снижение потенциала ионизации; — образование 1, 4 -продуктов в реакциях присоединения. ΔЕ ΔЕэтилен = 712 кдж/моль, λ = 162, 5 нм ΔЕбутадиен = 540 кдж/моль, λ = 217 нм ΔЕоктатетраен = 393 кдж/моль, λ = 302 нм Сопряжение π-π или n-π ΔЕ
Введение. Химическая связь. Соединения с сопряженными связями Особенности свойств соединений с сопряженными связями по сравнению с их несопряженными аналогами: — сдвиг в длинноволновую область максимумов поглощения и испускания в электронных спектрах; — увеличение поляризуемости; — снижение потенциала ионизации; — образование 1, 4 -продуктов в реакциях присоединения. ΔЕ ΔЕэтилен = 712 кдж/моль, λ = 162, 5 нм ΔЕбутадиен = 540 кдж/моль, λ = 217 нм ΔЕоктатетраен = 393 кдж/моль, λ = 302 нм Сопряжение π-π или n-π ΔЕ
 Введение. Химическая связь. Соединения с сопряженными связями Циклические соединения с сопряженными связями (аннулены): - неароматические, в молекулах которых суммарная энергия π-электронов (Еπ) при раскрытии цикла не изменяется. - ароматические, у которых Еπ при раскрытии цикла повышается. - антиароматические, у которых Еπ при раскрытии цикла понижается.
Введение. Химическая связь. Соединения с сопряженными связями Циклические соединения с сопряженными связями (аннулены): - неароматические, в молекулах которых суммарная энергия π-электронов (Еπ) при раскрытии цикла не изменяется. - ароматические, у которых Еπ при раскрытии цикла повышается. - антиароматические, у которых Еπ при раскрытии цикла понижается.
 Введение. Взаимное влияние атомов и групп атомов в молекулах органических соединений Изменение состояния связей под влиянием заместителя Влияние заместителя передается при участии σ-связей Влияние электрически заряженного заместителя передается не только при участии связей, но и через пространство Влияние заместителя передается по цепи сопряженных связей Индукционный эффект, I-эффект (+I, -I) Эффект поля, F-эффект (+F, -F) Эффект сопряжения, С-эффект (+С, -С), мезомерный эффект (+М, -М) Полярный эффект, Индукционный эффект, I-эффект (+I, -I),
Введение. Взаимное влияние атомов и групп атомов в молекулах органических соединений Изменение состояния связей под влиянием заместителя Влияние заместителя передается при участии σ-связей Влияние электрически заряженного заместителя передается не только при участии связей, но и через пространство Влияние заместителя передается по цепи сопряженных связей Индукционный эффект, I-эффект (+I, -I) Эффект поля, F-эффект (+F, -F) Эффект сопряжения, С-эффект (+С, -С), мезомерный эффект (+М, -М) Полярный эффект, Индукционный эффект, I-эффект (+I, -I),
 Введение. Взаимное влияние атомов и групп атомов в молекулах органических соединений Индукционный эффект (I-эффект) Обозначение индукционного эффекта: стрелочка вдоль линии связи. X K× 105 терм. CH 3 1, 34 I 66, 8 H 1, 76 Br 125, 5 CH 2=CH 4, 62 Cl 135, 9 C 6 H 5 4, 88 F 259, 6 CH 3 O 29, 4 CN 356 (классич. )
Введение. Взаимное влияние атомов и групп атомов в молекулах органических соединений Индукционный эффект (I-эффект) Обозначение индукционного эффекта: стрелочка вдоль линии связи. X K× 105 терм. CH 3 1, 34 I 66, 8 H 1, 76 Br 125, 5 CH 2=CH 4, 62 Cl 135, 9 C 6 H 5 4, 88 F 259, 6 CH 3 O 29, 4 CN 356 (классич. )
 Введение. Взаимное влияние атомов и групп атомов в молекулах органических соединений -I-эффект: CN- > F- > Cl- > Br- > I- > CH 3 O- > C 6 H 5 - > CH 2=CH- >H-I-эффект: -N+(CH 3)2 - > -N(CH 3)2 -I-эффект: CH C- > CH 2=CH- > CH 3 -CH 2 Соединение (газ), D CH 3 Cl 1, 87 CH 3 CH 2 Cl 2, 05 CH 3 CH 2 Cl 2, 10 (CH 3)2 CHCl 2, 15 (CH 3)3 CCl 2, 13 +I-эффект: Me- > (CH 3)3 - > (CH 3)2 CH- > CH 3 CH 2 - > CH 3 - +I-эффект: > > Соединение Кдисс. 105 CH 3 CH 2 -COOH 1, 50 CH 3 CH 2 CHCl-COOH 139 CH 3 CHCl. CH 2 -COOH 8, 9 CH 2 Cl. CH 2 -COOH 3, 0
Введение. Взаимное влияние атомов и групп атомов в молекулах органических соединений -I-эффект: CN- > F- > Cl- > Br- > I- > CH 3 O- > C 6 H 5 - > CH 2=CH- >H-I-эффект: -N+(CH 3)2 - > -N(CH 3)2 -I-эффект: CH C- > CH 2=CH- > CH 3 -CH 2 Соединение (газ), D CH 3 Cl 1, 87 CH 3 CH 2 Cl 2, 05 CH 3 CH 2 Cl 2, 10 (CH 3)2 CHCl 2, 15 (CH 3)3 CCl 2, 13 +I-эффект: Me- > (CH 3)3 - > (CH 3)2 CH- > CH 3 CH 2 - > CH 3 - +I-эффект: > > Соединение Кдисс. 105 CH 3 CH 2 -COOH 1, 50 CH 3 CH 2 CHCl-COOH 139 CH 3 CHCl. CH 2 -COOH 8, 9 CH 2 Cl. CH 2 -COOH 3, 0
 Введение. Взаимное влияние атомов и групп атомов в молекулах органических соединений Эффект сопряжения (С-эффект), мезомерный эффект (М-эффект) - недостаточность представлений об индукционном эффекте При наличии в составе молекулы системы сопряженных связей или гетероатомов, имеющих неподеленные электронные пары, связанных простой связью с кратной связью или с бензольным фрагментом, заместитель может оказывать влияние на распределение -электронного облака: Обозначение эффекта сопряжения: изогнутые стрелки с атома на связь, со связи на связь. со связи на атом. Атомы и группы атомов, подающие при сопряжении -электроны (электронодоноры), проявляют +С-эффект. Атомы и группы атомов, оттягивающие на себя -электронное облако (электроноакцепторы), проявляют –С-эффект. Группировки -С=С-, -N=N- и др. , стоящие около заместителей, проявляющих +С или –С-эффект играют роль проводников электронного влияния. +С-эффект проявляют заместители, имеющие занятую высоколежащую орбиталь (-О-) и заместители, имеющие атомы с неподеленными электронными парами. В II периоде +С-эффект уменьшается с увеличением заряда ядра. В группе уменьшается с ростом размера орбиталей. +С: -N(CH 3)2 > -NHCH 3 > -NH 2 > -OCH 3 > -OH > -F > -Cl > -Br
Введение. Взаимное влияние атомов и групп атомов в молекулах органических соединений Эффект сопряжения (С-эффект), мезомерный эффект (М-эффект) - недостаточность представлений об индукционном эффекте При наличии в составе молекулы системы сопряженных связей или гетероатомов, имеющих неподеленные электронные пары, связанных простой связью с кратной связью или с бензольным фрагментом, заместитель может оказывать влияние на распределение -электронного облака: Обозначение эффекта сопряжения: изогнутые стрелки с атома на связь, со связи на связь. со связи на атом. Атомы и группы атомов, подающие при сопряжении -электроны (электронодоноры), проявляют +С-эффект. Атомы и группы атомов, оттягивающие на себя -электронное облако (электроноакцепторы), проявляют –С-эффект. Группировки -С=С-, -N=N- и др. , стоящие около заместителей, проявляющих +С или –С-эффект играют роль проводников электронного влияния. +С-эффект проявляют заместители, имеющие занятую высоколежащую орбиталь (-О-) и заместители, имеющие атомы с неподеленными электронными парами. В II периоде +С-эффект уменьшается с увеличением заряда ядра. В группе уменьшается с ростом размера орбиталей. +С: -N(CH 3)2 > -NHCH 3 > -NH 2 > -OCH 3 > -OH > -F > -Cl > -Br
 Введение. Взаимное влияние атомов и групп атомов в молекулах органических соединений -C-эффект проявляют заместители, имеющие низколежащую вакантную орбиталь (+С, В) и заместители, имеющие -связи между атомами с разной электроотрицательностью, если при этом группа присоединена к остатку молекулы менее электроотрицательным атомом. Чем больше разность электроотрицательностей, тем больше –С-эффект. -С: -NO 2 > -C N > -CO-OC 2 H 5 > -CO-CH 3 При распространении I-эффекта происходит его постепенное затухание. При распространении С-эффекта происходит альтернирование зарядов: Совместное распространение I- и С-эффектов: -NO 2: -I, -C -C N: -I, -C -Hal: -I, +C, |-I| > |+C| -OH, NH 2, OCH 3, NHCH 3, N(CH 3)2: |-I| < |+C|
Введение. Взаимное влияние атомов и групп атомов в молекулах органических соединений -C-эффект проявляют заместители, имеющие низколежащую вакантную орбиталь (+С, В) и заместители, имеющие -связи между атомами с разной электроотрицательностью, если при этом группа присоединена к остатку молекулы менее электроотрицательным атомом. Чем больше разность электроотрицательностей, тем больше –С-эффект. -С: -NO 2 > -C N > -CO-OC 2 H 5 > -CO-CH 3 При распространении I-эффекта происходит его постепенное затухание. При распространении С-эффекта происходит альтернирование зарядов: Совместное распространение I- и С-эффектов: -NO 2: -I, -C -C N: -I, -C -Hal: -I, +C, |-I| > |+C| -OH, NH 2, OCH 3, NHCH 3, N(CH 3)2: |-I| < |+C|
 Введение. Кислотно-основные свойства органических соединений Лавуазье (1778): все кислоты содержат кислород. Деви (1810) и Гейлюссак (1814): все кислоты содержат водород. Либих (1839): кислоты – соединения, содержащие водород, который может быть замещен на металл. Теория Аррениуса (1887): Кислота – это соединение, которое при диссоциации в воде в качестве катионов образует только ионы водорода. Основание – это соединение, которое при диссоциации в воде в качестве катионов образует только ионы гидроксила. Процесс нейтрализации: H+ + OH – = H 2 O Достоинства теории Аррениуса: Недостатки теории Аррениуса: • стало понятным постоянное значение теплоты • теория применима только к водным нейтрализации сильной кислоты сильным растворам; основанием (57, 7 к. Д/Моль); • ограничение понятия «кислота» • объяснены многие химические свойства кислот; соединениями, содержащими водород; • позволяет количественно определять силу • ограничение понятия «основание» кислот и оснований по их константам диссоциации: соединениями, содержащими гидроксильные группы. • объясняет каталитические свойства кислот.
Введение. Кислотно-основные свойства органических соединений Лавуазье (1778): все кислоты содержат кислород. Деви (1810) и Гейлюссак (1814): все кислоты содержат водород. Либих (1839): кислоты – соединения, содержащие водород, который может быть замещен на металл. Теория Аррениуса (1887): Кислота – это соединение, которое при диссоциации в воде в качестве катионов образует только ионы водорода. Основание – это соединение, которое при диссоциации в воде в качестве катионов образует только ионы гидроксила. Процесс нейтрализации: H+ + OH – = H 2 O Достоинства теории Аррениуса: Недостатки теории Аррениуса: • стало понятным постоянное значение теплоты • теория применима только к водным нейтрализации сильной кислоты сильным растворам; основанием (57, 7 к. Д/Моль); • ограничение понятия «кислота» • объяснены многие химические свойства кислот; соединениями, содержащими водород; • позволяет количественно определять силу • ограничение понятия «основание» кислот и оснований по их константам диссоциации: соединениями, содержащими гидроксильные группы. • объясняет каталитические свойства кислот.
 Введение. Кислотно-основные свойства органических соединений Протонная теория Бренстеда-Лоури (1923): 1. Кислота – соединение, стремящееся отдать протоны, основание – соединение, стремящееся присоединить протоны. 2. Основания: основания по Аррениусу (имеющие гидроксильные группы) + другие (аммиак, пиридин и другие). 3. Кислоты по Аррениусу являются кислотами и в протонной теории. 4. Расширение понятия «кислота» : кислота сохраняет свои свойства как в присутствии, так и в отсутствие растворителя. HCl – кислота потому, что она может отдать протон, а не потому, что она отдает его в водном растворе. 5. В равновесии хлорид –ион – тоже основание, т. к. может присоединить протон. Сl– – основание, сопряженное с HCl, а Сl– и HCl – сопряженная пара. 6. При диссоциации в растворителе роль основания играет растворитель: вода – основание. 7. Одно и то же вещество в зависимости от условий взаимодействия может быть как кислотой, так и основанием (амфотерность): 8. Общий вид кислотно-основного равновесия: . А 1 – кислота, сопряженная с основанием В 2, В 1 – основание, сопряженное с кислотой А 2. 9. Ограничения теории: связь с переносом протона.
Введение. Кислотно-основные свойства органических соединений Протонная теория Бренстеда-Лоури (1923): 1. Кислота – соединение, стремящееся отдать протоны, основание – соединение, стремящееся присоединить протоны. 2. Основания: основания по Аррениусу (имеющие гидроксильные группы) + другие (аммиак, пиридин и другие). 3. Кислоты по Аррениусу являются кислотами и в протонной теории. 4. Расширение понятия «кислота» : кислота сохраняет свои свойства как в присутствии, так и в отсутствие растворителя. HCl – кислота потому, что она может отдать протон, а не потому, что она отдает его в водном растворе. 5. В равновесии хлорид –ион – тоже основание, т. к. может присоединить протон. Сl– – основание, сопряженное с HCl, а Сl– и HCl – сопряженная пара. 6. При диссоциации в растворителе роль основания играет растворитель: вода – основание. 7. Одно и то же вещество в зависимости от условий взаимодействия может быть как кислотой, так и основанием (амфотерность): 8. Общий вид кислотно-основного равновесия: . А 1 – кислота, сопряженная с основанием В 2, В 1 – основание, сопряженное с кислотой А 2. 9. Ограничения теории: связь с переносом протона.
 Введение. Кислотно-основные свойства органических соединений Электронная теория Льюиса (1923): Объединила все известные к тому времени теории кислот и оснований. Критерии, необходимые и достаточные для классификации кислот и оснований: • если кислота и основание могут взаимодействовать друг с другом, то процесс взаимодействия или нейтрализации протекает быстро; • кислота или основание вытесняют более слабую кислоту или основание из их соединений; • кислоты и основания можно титровать одно другим в присутствии окрашенных веществ, называемых индикаторами; • кислоты и основания играют очень важную роль в ускорении химических процессов вследствие своего каталитического действия. Свойства кислот и оснований связаны с их электронной структурой, а кислотно-основное взаимодействие – с образованием донорно-акцепторной связи. Основание – соединение (молекула или ион), способное предоставить пару электронов для образования ковалентной связи: все анионы, аммиак и амины, вода, спирты, галогены. Кислота – соединение (молекула или ион), способное принять пару электронов для образования ковалентной связи: H+, ионы металлов (Ag+, Fe 3+), оксиды некоторых неметаллов (например, SO 3, Si. O 2), ряд солей (Al. Cl 3), а также такие вещества как BF 3. Кислотно-основное взаимодействие по Льюису: H+ + OH– → H 2 O Al. Cl 3 + Cl− → Al. Cl 4− BF 3 + F− → BF 4− BF 3 + NH 3 → BF 3 NH 3 PCl 5 + Cl− → PCl 6−
Введение. Кислотно-основные свойства органических соединений Электронная теория Льюиса (1923): Объединила все известные к тому времени теории кислот и оснований. Критерии, необходимые и достаточные для классификации кислот и оснований: • если кислота и основание могут взаимодействовать друг с другом, то процесс взаимодействия или нейтрализации протекает быстро; • кислота или основание вытесняют более слабую кислоту или основание из их соединений; • кислоты и основания можно титровать одно другим в присутствии окрашенных веществ, называемых индикаторами; • кислоты и основания играют очень важную роль в ускорении химических процессов вследствие своего каталитического действия. Свойства кислот и оснований связаны с их электронной структурой, а кислотно-основное взаимодействие – с образованием донорно-акцепторной связи. Основание – соединение (молекула или ион), способное предоставить пару электронов для образования ковалентной связи: все анионы, аммиак и амины, вода, спирты, галогены. Кислота – соединение (молекула или ион), способное принять пару электронов для образования ковалентной связи: H+, ионы металлов (Ag+, Fe 3+), оксиды некоторых неметаллов (например, SO 3, Si. O 2), ряд солей (Al. Cl 3), а также такие вещества как BF 3. Кислотно-основное взаимодействие по Льюису: H+ + OH– → H 2 O Al. Cl 3 + Cl− → Al. Cl 4− BF 3 + F− → BF 4− BF 3 + NH 3 → BF 3 NH 3 PCl 5 + Cl− → PCl 6−
 Введение. Кислотно-основные свойства органических соединений Ониевые Теория Усановича (1939): В основе теории лежит представление о том, что всякое кислотно-основное взаимодействие — это реакция солеобразования. Кислота — это частица, которая может отщеплять катионы, включая протон, или присоединять анионы, включая электрон. Основание — частица, которая может присоединять протон и другие катионы или отдавать электрон и другие анионы. Кислоты и основания — это не классы соединений; кислотность и основность — это функции вещества. Будет ли вещество кислотой или основанием, зависит от партнера. Недостаткам: • слишком общий характер; • недостаточно чёткая определённость формулировки понятий «кислота» и «основание» ; • не описывает неионогенные кислотно-основные превращения; • не позволяет делать количественные предсказания. Типы органических кислот и оснований: Основания: Кислоты: оксониевые -О-Н кислоты: спирты, фенолы, карбоновые амониевые кислоты, вода и др. ; сульфониевые -S-H кислоты: тиолы, тиоловые кислоты, фосфониевые сероводород и др. ; ……………… -N-H кислоты: амины, амиды кислот, аммиак π-основания π-связь и др. ; вторичные основания -С-Н кислоты: соединения разных классов, содержащие С-Н группы радом ЭА.
Введение. Кислотно-основные свойства органических соединений Ониевые Теория Усановича (1939): В основе теории лежит представление о том, что всякое кислотно-основное взаимодействие — это реакция солеобразования. Кислота — это частица, которая может отщеплять катионы, включая протон, или присоединять анионы, включая электрон. Основание — частица, которая может присоединять протон и другие катионы или отдавать электрон и другие анионы. Кислоты и основания — это не классы соединений; кислотность и основность — это функции вещества. Будет ли вещество кислотой или основанием, зависит от партнера. Недостаткам: • слишком общий характер; • недостаточно чёткая определённость формулировки понятий «кислота» и «основание» ; • не описывает неионогенные кислотно-основные превращения; • не позволяет делать количественные предсказания. Типы органических кислот и оснований: Основания: Кислоты: оксониевые -О-Н кислоты: спирты, фенолы, карбоновые амониевые кислоты, вода и др. ; сульфониевые -S-H кислоты: тиолы, тиоловые кислоты, фосфониевые сероводород и др. ; ……………… -N-H кислоты: амины, амиды кислот, аммиак π-основания π-связь и др. ; вторичные основания -С-Н кислоты: соединения разных классов, содержащие С-Н группы радом ЭА.
 Введение. Кислотно-основные свойства органических соединений. Водородная связь Кислотно-основное взаимодействие многостадийно. Одна из промежуточных стадий – образование водородной связи: Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. Протоноакцепторы: O, N, Hal, S и другие атомы, соединения с π-связями: Протонодоноры: соединения, у которых протон связан с атомами O, S, Se, Te, N, P, Hal и др. : H 2 O, H 2 S, H 2 Te, HHal, NH 3 Природа водородной связи: электростатическая или донорно-акцепторная - ? ? ?
Введение. Кислотно-основные свойства органических соединений. Водородная связь Кислотно-основное взаимодействие многостадийно. Одна из промежуточных стадий – образование водородной связи: Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. Протоноакцепторы: O, N, Hal, S и другие атомы, соединения с π-связями: Протонодоноры: соединения, у которых протон связан с атомами O, S, Se, Te, N, P, Hal и др. : H 2 O, H 2 S, H 2 Te, HHal, NH 3 Природа водородной связи: электростатическая или донорно-акцепторная - ? ? ?
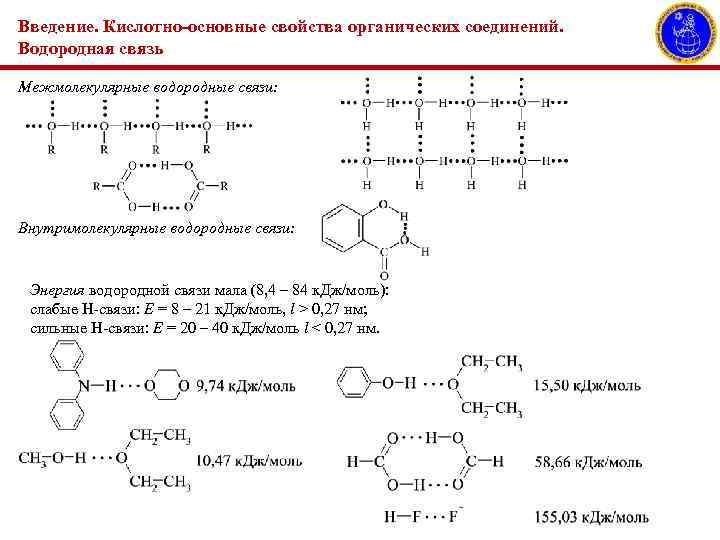 Введение. Кислотно-основные свойства органических соединений. Водородная связь Межмолекулярные водородные связи: Внутримолекулярные водородные связи: Энергия водородной связи мала (8, 4 – 84 к. Дж/моль): слабые Н-связи: Е = 8 – 21 к. Дж/моль, l ˃ 0, 27 нм; сильные Н-связи: Е = 20 – 40 к. Дж/моль l < 0, 27 нм.
Введение. Кислотно-основные свойства органических соединений. Водородная связь Межмолекулярные водородные связи: Внутримолекулярные водородные связи: Энергия водородной связи мала (8, 4 – 84 к. Дж/моль): слабые Н-связи: Е = 8 – 21 к. Дж/моль, l ˃ 0, 27 нм; сильные Н-связи: Е = 20 – 40 к. Дж/моль l < 0, 27 нм.
 Введение. Кислотно-основные свойства органических соединений. Водородная связь влияет на реакционную способность, кислотно-основные и физические свойства органических соединений (растворимость, температуры плавления, кипения, полярность).
Введение. Кислотно-основные свойства органических соединений. Водородная связь влияет на реакционную способность, кислотно-основные и физические свойства органических соединений (растворимость, температуры плавления, кипения, полярность).
 Введение. Основы стереохимии Все валентные углы в молекуле метана равны и составляют 109º 28. В молекуле любого гомолога метана цепочка углеродных атомов образует последовательность тетраэдров, соединенных друг с другом простыми связями С—С длиной 0, 154 нм. Энергия связи С—С составляет 355, 3 к. Дж/моль. Молекула октана Стереохимия — часть химии, посвященная изучению пространственного строения молекул и влияния этого строения на физические и химические свойства веществ, на направление и скорость их реакций. Объектами изучения в стереохимии являются, главным образом, органические вещества, а из неорганических — в основном, комплексные и внутрикомплексные (хелатные) соединения.
Введение. Основы стереохимии Все валентные углы в молекуле метана равны и составляют 109º 28. В молекуле любого гомолога метана цепочка углеродных атомов образует последовательность тетраэдров, соединенных друг с другом простыми связями С—С длиной 0, 154 нм. Энергия связи С—С составляет 355, 3 к. Дж/моль. Молекула октана Стереохимия — часть химии, посвященная изучению пространственного строения молекул и влияния этого строения на физические и химические свойства веществ, на направление и скорость их реакций. Объектами изучения в стереохимии являются, главным образом, органические вещества, а из неорганических — в основном, комплексные и внутрикомплексные (хелатные) соединения.
 Введение. Основы стереохимии Можно представить множество форм молекулы этана, отличающихся друг от друга взаимным поворотом углеродных тетраэдров вокруг соединяющей их связи углерод – углерод. Мерой поворота является торсионный (диэдральный) угол φ. Молекула этана. Торсионный угол. Такие различные формы молекул называются «конформациями» . Конформациями называют неидентичные расположения атомов в молекуле, полученные при вращении вокруг одной или нескольких простых связей без их разрыва. Конформерами, или поворотными изомерами, называют молекулы, находящиеся в наиболее устойчивых конформациях, при незначительном отклонении от которых атомы самопроизвольно возвращаются в первоначальное положение.
Введение. Основы стереохимии Можно представить множество форм молекулы этана, отличающихся друг от друга взаимным поворотом углеродных тетраэдров вокруг соединяющей их связи углерод – углерод. Мерой поворота является торсионный (диэдральный) угол φ. Молекула этана. Торсионный угол. Такие различные формы молекул называются «конформациями» . Конформациями называют неидентичные расположения атомов в молекуле, полученные при вращении вокруг одной или нескольких простых связей без их разрыва. Конформерами, или поворотными изомерами, называют молекулы, находящиеся в наиболее устойчивых конформациях, при незначительном отклонении от которых атомы самопроизвольно возвращаются в первоначальное положение.
 Введение. Основы стереохимии Конформации этана, проекции: перспективные, Ньюмена Заслоненные конформации – четные: φ = 0, 2, 4, 6. Заторможенные конформации – нечетные: φ = 1, 3, 5. где E 0 — энергетический барьер. В случае этана – 13 к. Дж/моль Энергетический барьер не связан с отталкиванием атомов водорода, поскольку их ван-дерваальсовы радиусы слишком малы для этого. Очевидно, он возникает вследствие отталкивания электронов на σ-орбиталях связей углерод – водород у соседних атомов углерода.
Введение. Основы стереохимии Конформации этана, проекции: перспективные, Ньюмена Заслоненные конформации – четные: φ = 0, 2, 4, 6. Заторможенные конформации – нечетные: φ = 1, 3, 5. где E 0 — энергетический барьер. В случае этана – 13 к. Дж/моль Энергетический барьер не связан с отталкиванием атомов водорода, поскольку их ван-дерваальсовы радиусы слишком малы для этого. Очевидно, он возникает вследствие отталкивания электронов на σ-орбиталях связей углерод – водород у соседних атомов углерода.
 Введение. Основы стереохимии Изомеры, являющиеся зеркальными отображениями, называются оптическими антиподами, или энантиомерами. Конфигурация – пространственная мера атомов в молекуле, которая отличает стереоизомеры (пространственные изомеры). Другими словами – это изомерия, между которой не происходит различия в структуре. В отсутствие асимметрических факторов энантиомеры обладают одинаковыми физическими и химическими свойствами. Однако при облучении плоско- или циркулярнополяризованным светом, воздействии асимметрических реагентов или растворителей между оптическими антиподами появляются различия, что дает возможность для их идентификации и разделения. Оптическая активность
Введение. Основы стереохимии Изомеры, являющиеся зеркальными отображениями, называются оптическими антиподами, или энантиомерами. Конфигурация – пространственная мера атомов в молекуле, которая отличает стереоизомеры (пространственные изомеры). Другими словами – это изомерия, между которой не происходит различия в структуре. В отсутствие асимметрических факторов энантиомеры обладают одинаковыми физическими и химическими свойствами. Однако при облучении плоско- или циркулярнополяризованным светом, воздействии асимметрических реагентов или растворителей между оптическими антиподами появляются различия, что дает возможность для их идентификации и разделения. Оптическая активность
![Введение. Основы стереохимии Удельным вращением [α] называется угол вращения плоскости поляризации жидкостью или раствором, Введение. Основы стереохимии Удельным вращением [α] называется угол вращения плоскости поляризации жидкостью или раствором,](https://present5.com/presentation/20560984_180130155/image-34.jpg) Введение. Основы стереохимии Удельным вращением [α] называется угол вращения плоскости поляризации жидкостью или раствором, содержащим в 1 мл 1 г оптически активного вещества при длине слоя 1 дм. Удельное вращение для жидкости: α – измеренный угол вращения; l – длина кюветы, дм; d – плотность, г/мл. Удельное вращение для растворов: α – измеренный угол вращения; l – длина кюветы, дм; с – плотность, г/мл. Удельное вращение зависит от температуры, растворителя, длины волны. Поэтому обязательно указание на условия измерений: (+) винная кислота Проекционные формулы Фишера
Введение. Основы стереохимии Удельным вращением [α] называется угол вращения плоскости поляризации жидкостью или раствором, содержащим в 1 мл 1 г оптически активного вещества при длине слоя 1 дм. Удельное вращение для жидкости: α – измеренный угол вращения; l – длина кюветы, дм; d – плотность, г/мл. Удельное вращение для растворов: α – измеренный угол вращения; l – длина кюветы, дм; с – плотность, г/мл. Удельное вращение зависит от температуры, растворителя, длины волны. Поэтому обязательно указание на условия измерений: (+) винная кислота Проекционные формулы Фишера
 Введение. Основы стереохимии D, L-номенклатура Диастереомеры Изомерные хлоряблочные кислоты Тпл. , о. С 173 167 [ ] -31, 3 +31, 3 +9, 4 -9, 4 Рацемат II Тпл. , о. С 146
Введение. Основы стереохимии D, L-номенклатура Диастереомеры Изомерные хлоряблочные кислоты Тпл. , о. С 173 167 [ ] -31, 3 +31, 3 +9, 4 -9, 4 Рацемат II Тпл. , о. С 146
 Введение. Основы стереохимии Хиральностью называют свойство объекта не совмещаться со своим зеркальным изображением. Причины появления оптической изомерии: • наличие в молекуле ассиметрично замещенного атома; • асимметрическое замещение вокруг оси; • асимметрическое расположение атомов групп атомов по обе стороны определенной плоскости; • наличие в молекуле спиральной структуры. Типы хиральности: центральная спиральная планарная аксиальная
Введение. Основы стереохимии Хиральностью называют свойство объекта не совмещаться со своим зеркальным изображением. Причины появления оптической изомерии: • наличие в молекуле ассиметрично замещенного атома; • асимметрическое замещение вокруг оси; • асимметрическое расположение атомов групп атомов по обе стороны определенной плоскости; • наличие в молекуле спиральной структуры. Типы хиральности: центральная спиральная планарная аксиальная
 Введение. Основы химической кинетики Химическая кинетика – учение о скоростях различных процессов (химических реакций, процессов растворения, кристаллизации, парообразования и т. д. ) и их механизмах, определяющих скорость процесса. Типы органических реакций Реакции присоединения. Реакции замещения. Химические реакции Элементарные (одностадийные) Сложные Реакции отщепления (элиминирования). Реакции разложения. Одно из первых определений: механизм химической реакции — это набор последовательных стадий сложного процесса. Реакции изомеризации. Реакции полимеризации. Реакции конденсации и поликонденсации. Современное определение механизма реакции: механизм реакции – это описание всех состояний, через которые проходит реагирующая система от реагентов к продуктам.
Введение. Основы химической кинетики Химическая кинетика – учение о скоростях различных процессов (химических реакций, процессов растворения, кристаллизации, парообразования и т. д. ) и их механизмах, определяющих скорость процесса. Типы органических реакций Реакции присоединения. Реакции замещения. Химические реакции Элементарные (одностадийные) Сложные Реакции отщепления (элиминирования). Реакции разложения. Одно из первых определений: механизм химической реакции — это набор последовательных стадий сложного процесса. Реакции изомеризации. Реакции полимеризации. Реакции конденсации и поликонденсации. Современное определение механизма реакции: механизм реакции – это описание всех состояний, через которые проходит реагирующая система от реагентов к продуктам.
 Введение. Основы химической кинетики Классификация реакций и реагентов по способу разрыва и образования химической связи. Гетеролитический (ионный) механизм – разрыв связи – образование связи Частицы, предоставляющие электронную пару, называют нуклеофилами, а реакции – нуклеофильного замещения, присоединения или отщепления. К нуклеофилам относят частицы, имеющие занятую орбиталь с достаточно высокой энергией (неподеленная пара электронов): Hal–, OH–, OR–, SR–, RCOO–, NH 3, H 2 O, CN–, R– и т. д. Частицы, предоставляющие свободную орбиталь, называются электрофилами, а реакции – электрофильными. К электрофильным реагентам относят частицы, имеющие достаточно низкую по энергии свободную орбиталь: H+, R+, Al. Hal, Hal+, BF 3, R–C+=O и т. д. Гомолитический (свободнорадикальный) механизм – разрыв связи – образование связи Частицы с неспаренными электронами – свободные радикалы. Согласованные процессы (многоцентровые): одновременный разрыв и образование связей за счет синхронного перемещения электронной плотности.
Введение. Основы химической кинетики Классификация реакций и реагентов по способу разрыва и образования химической связи. Гетеролитический (ионный) механизм – разрыв связи – образование связи Частицы, предоставляющие электронную пару, называют нуклеофилами, а реакции – нуклеофильного замещения, присоединения или отщепления. К нуклеофилам относят частицы, имеющие занятую орбиталь с достаточно высокой энергией (неподеленная пара электронов): Hal–, OH–, OR–, SR–, RCOO–, NH 3, H 2 O, CN–, R– и т. д. Частицы, предоставляющие свободную орбиталь, называются электрофилами, а реакции – электрофильными. К электрофильным реагентам относят частицы, имеющие достаточно низкую по энергии свободную орбиталь: H+, R+, Al. Hal, Hal+, BF 3, R–C+=O и т. д. Гомолитический (свободнорадикальный) механизм – разрыв связи – образование связи Частицы с неспаренными электронами – свободные радикалы. Согласованные процессы (многоцентровые): одновременный разрыв и образование связей за счет синхронного перемещения электронной плотности.
 Введение. Основы химической кинетики Скорость химической реакции Молекулярность и порядок реакции где – мгновенная скорость реакции; n – количество молей одного из участников реакции; – время. Число молекул, участвующих в элементарном акте химического взаимодействия, называется молекулярностью реакции. Показатели степеней при концентрациях реагентов называются порядками реакции по этим реагентам, а их сумма — общим или суммарным порядком реакции. 2 N 2 O 5(г. ) = 4 NO 2(г. ) + O 2(г. ) v = k c. N 2 O 5 Зависимость скорости реакции от концентраций реагирующих веществ Основной закон химической кинетики Скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Для реакции a. A + b. B +. . . = d. D + e. E +. . . математическая запись этого закона (кинетическое уравнение имеет вид , где – концентрация реагента, взятая в соответствующей степени, k – константа скорости реакции. C 2 H 6 = C 2 H 4 + H 2 v = k c. C 2 H 6 [k] = с-1 H 2 + I 2 = 2 HI v = k c. H 2 c. I 2 [k] = моль-1 л с-1 v = k c. RCOOR'
Введение. Основы химической кинетики Скорость химической реакции Молекулярность и порядок реакции где – мгновенная скорость реакции; n – количество молей одного из участников реакции; – время. Число молекул, участвующих в элементарном акте химического взаимодействия, называется молекулярностью реакции. Показатели степеней при концентрациях реагентов называются порядками реакции по этим реагентам, а их сумма — общим или суммарным порядком реакции. 2 N 2 O 5(г. ) = 4 NO 2(г. ) + O 2(г. ) v = k c. N 2 O 5 Зависимость скорости реакции от концентраций реагирующих веществ Основной закон химической кинетики Скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Для реакции a. A + b. B +. . . = d. D + e. E +. . . математическая запись этого закона (кинетическое уравнение имеет вид , где – концентрация реагента, взятая в соответствующей степени, k – константа скорости реакции. C 2 H 6 = C 2 H 4 + H 2 v = k c. C 2 H 6 [k] = с-1 H 2 + I 2 = 2 HI v = k c. H 2 c. I 2 [k] = моль-1 л с-1 v = k c. RCOOR'
 Введение. Основы химической кинетики Зависимость скорости реакции от температуры Уравнение Аррениуса Правило Вант-Гоффа При повышении температуры на каждые десять градусов скорость гомогенной химической реакции увеличивается в 2 - 4 раза. где и – скорости реакции при температурах Т 1 и Т 2; γ – коэффициент, равный 2 4. Молекулярно-кинетический подход Кривые распределения молекул в газовой фазе по их кинетической энергии (распределение Максвелла) N = Noe-Eа/RT k = Ae-Eакт. /RT, где Еакт. — энергия активации; А — предэкспоненциальный фактор. Энергии активации некоторых химических реакций. Реакция CH 3 CH 4+H CH 4 C+2 H 2 CH 3 CHO CH 4+CO Еакт. , к. Дж 42 335 190 Реакция 2 HI H 2+I 2 2 NH 3 N 2+3 H 2 2 NO+O 2 Еакт. , к. Дж 184 326 111 lnk ln. A Еакт. /R 1/T
Введение. Основы химической кинетики Зависимость скорости реакции от температуры Уравнение Аррениуса Правило Вант-Гоффа При повышении температуры на каждые десять градусов скорость гомогенной химической реакции увеличивается в 2 - 4 раза. где и – скорости реакции при температурах Т 1 и Т 2; γ – коэффициент, равный 2 4. Молекулярно-кинетический подход Кривые распределения молекул в газовой фазе по их кинетической энергии (распределение Максвелла) N = Noe-Eа/RT k = Ae-Eакт. /RT, где Еакт. — энергия активации; А — предэкспоненциальный фактор. Энергии активации некоторых химических реакций. Реакция CH 3 CH 4+H CH 4 C+2 H 2 CH 3 CHO CH 4+CO Еакт. , к. Дж 42 335 190 Реакция 2 HI H 2+I 2 2 NH 3 N 2+3 H 2 2 NO+O 2 Еакт. , к. Дж 184 326 111 lnk ln. A Еакт. /R 1/T
 Введение. Основы химической кинетики Катализаторам свойственны следующие особенности: • катализатор не влияет на общую стехиометрию реакции; • катализатор не может инициировать реакций, протеворечащих законам термодинамики. Он ускоряет только ту реакцию, которая может протекать и без него; Катализатор — вещество, которое повышает скорость химической реакции, но само не расходуется в этом процессе. • катализатор одинаково ускоряет прямую и обратную реакции, увеличивая скорость достижения равновесия. Однако катализатор не изменяет положение равновесия, не влияя, следовательно, на выход реакции; • катализатор может увеличивать скорость одной реакции, но не увеличивать скрость другой, сходной с ней реакции, • катализатор принимает химическое участие в реакции. Он расходуется на одной стадии реакции и выделяется на какой-либо последующей стадии. Катализ Гомогенный Гетерогенный
Введение. Основы химической кинетики Катализаторам свойственны следующие особенности: • катализатор не влияет на общую стехиометрию реакции; • катализатор не может инициировать реакций, протеворечащих законам термодинамики. Он ускоряет только ту реакцию, которая может протекать и без него; Катализатор — вещество, которое повышает скорость химической реакции, но само не расходуется в этом процессе. • катализатор одинаково ускоряет прямую и обратную реакции, увеличивая скорость достижения равновесия. Однако катализатор не изменяет положение равновесия, не влияя, следовательно, на выход реакции; • катализатор может увеличивать скорость одной реакции, но не увеличивать скрость другой, сходной с ней реакции, • катализатор принимает химическое участие в реакции. Он расходуется на одной стадии реакции и выделяется на какой-либо последующей стадии. Катализ Гомогенный Гетерогенный
 Введение. Основы химической кинетики Теория переходного состояния (теория абсолютных скоростей реакций) была разработана Эйрингом, Эвансом и Поляни. В ее основе лежит предположение о том, что при переходе от реагентов к продуктам реагирующая система должна пройти через некоторый энергетический барьер. Состояние, соответствующее вершине барьера называется активированным комплексом или переходным состоянием. В этом случае энергия активации должна была бы быть не меньше энергии диссоциации связи R—H. Однако, как правило, Еакт. <<Едисс. Поверхность потенциальной энергии гомолитической реакции RH + X· R· + HX. Зависимость потенциальной энергии двухатомной молекулы от межатомного расстояния. Кривая протекания химической реакции RH + X· R· + HX.
Введение. Основы химической кинетики Теория переходного состояния (теория абсолютных скоростей реакций) была разработана Эйрингом, Эвансом и Поляни. В ее основе лежит предположение о том, что при переходе от реагентов к продуктам реагирующая система должна пройти через некоторый энергетический барьер. Состояние, соответствующее вершине барьера называется активированным комплексом или переходным состоянием. В этом случае энергия активации должна была бы быть не меньше энергии диссоциации связи R—H. Однако, как правило, Еакт. <<Едисс. Поверхность потенциальной энергии гомолитической реакции RH + X· R· + HX. Зависимость потенциальной энергии двухатомной молекулы от межатомного расстояния. Кривая протекания химической реакции RH + X· R· + HX.
 Введение. Основы химической кинетики Два важных вывода: • тепловые эффекты прямой и обратной реакций в одинаковых условиях равны по величине и противоположны по знаку; • принцип макроскопической обратимости: в идентичных условиях прямая и обратная реакции протекают по одному и тому же механизму. где k – константа скорости реакции; – константа Больцмана; h – постоянная Планка; – трансмиссионный фактор (аналог трансмиссионного фактора в уравнении Аррениуса); Gакт. – энергия активации.
Введение. Основы химической кинетики Два важных вывода: • тепловые эффекты прямой и обратной реакций в одинаковых условиях равны по величине и противоположны по знаку; • принцип макроскопической обратимости: в идентичных условиях прямая и обратная реакции протекают по одному и тому же механизму. где k – константа скорости реакции; – константа Больцмана; h – постоянная Планка; – трансмиссионный фактор (аналог трансмиссионного фактора в уравнении Аррениуса); Gакт. – энергия активации.
 Введение. Основы химической кинетики Термодинамический и кинетический контроль состава продуктов реакции определяют зависимость состава продуктов реакции от скорости реакции или от состава компонентов. Кинетический контроль: 1. Если реакции протекают необратимо и если продукты реакций стабильны и не расходуются дальше. П 1 П 2 2. Если реакции обратимы, а скорости образования продуктов существенно выше скоростей установления равновесий. П 2 П 1 Термодинамический контроль: Если реакции обратимы, а скорости достижения равновесий соизмеримы со скоростями реакций.
Введение. Основы химической кинетики Термодинамический и кинетический контроль состава продуктов реакции определяют зависимость состава продуктов реакции от скорости реакции или от состава компонентов. Кинетический контроль: 1. Если реакции протекают необратимо и если продукты реакций стабильны и не расходуются дальше. П 1 П 2 2. Если реакции обратимы, а скорости образования продуктов существенно выше скоростей установления равновесий. П 2 П 1 Термодинамический контроль: Если реакции обратимы, а скорости достижения равновесий соизмеримы со скоростями реакций.
 Введение. Основы химической кинетики Постулат Хэммонда: Увеличение экзотермичности процесса приближает переходное состояние к исходному, а увеличение эндотермичности – к конечному состоянию. Экзотермический процесс: структура переходного состояния напоминает структуру исходного. Эндотермический процесс: структура переходного состояния напоминает структуру конечного. Незначительный тепловой эффект и большая энергия активации: переходное состояние значительно отличается как от исходного, так и от конечного состояний.
Введение. Основы химической кинетики Постулат Хэммонда: Увеличение экзотермичности процесса приближает переходное состояние к исходному, а увеличение эндотермичности – к конечному состоянию. Экзотермический процесс: структура переходного состояния напоминает структуру исходного. Эндотермический процесс: структура переходного состояния напоминает структуру конечного. Незначительный тепловой эффект и большая энергия активации: переходное состояние значительно отличается как от исходного, так и от конечного состояний.
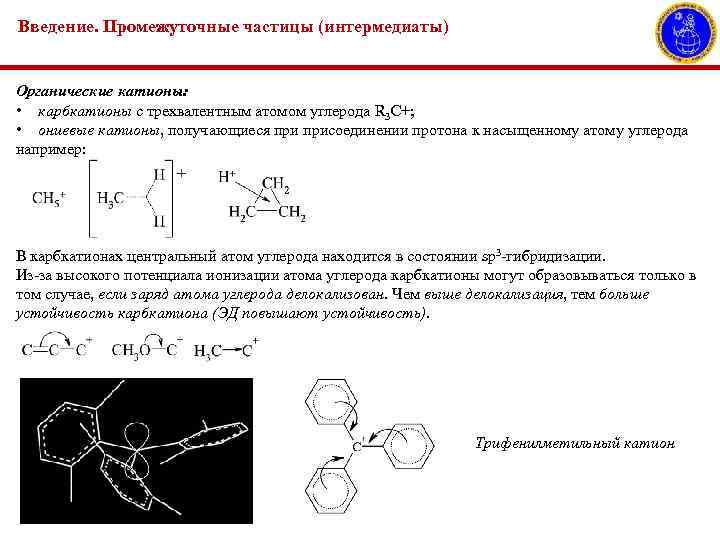 Введение. Промежуточные частицы (интермедиаты) Органические катионы: • карбкатионы с трехвалентным атомом углерода R 3 C+; • ониевые катионы, получающиеся присоединении протона к насыщенному атому углерода например: В карбкатионах центральный атом углерода находится в состоянии sp 3 -гибридизации. Из-за высокого потенциала ионизации атома углерода карбкатионы могут образовываться только в том случае, если заряд атома углерода делокализован. Чем выше делокализация, тем больше устойчивость карбкатиона (ЭД повышают устойчивость). Трифенилметильный катион
Введение. Промежуточные частицы (интермедиаты) Органические катионы: • карбкатионы с трехвалентным атомом углерода R 3 C+; • ониевые катионы, получающиеся присоединении протона к насыщенному атому углерода например: В карбкатионах центральный атом углерода находится в состоянии sp 3 -гибридизации. Из-за высокого потенциала ионизации атома углерода карбкатионы могут образовываться только в том случае, если заряд атома углерода делокализован. Чем выше делокализация, тем больше устойчивость карбкатиона (ЭД повышают устойчивость). Трифенилметильный катион
 Введение. Промежуточные частицы (интермедиаты) Карбанионы – отрицательно заряженные частицы, содержащие атом углерода с неподеленной электронной парой; этот атом соединен с другими атомами тремя - или - и -связями. Два вида карбанионов: • плоскостного строения (sp 2 -гибридизация); • пирамидального строения (sp 3 -гибридизация). Чем больше делокализован отрицательный заряд, тем выше устойчивость карбаниона (ЭА повышают устойчивость. ) Флуоренил-анион Трифенилметильный анион Циклопентадиениел-анион
Введение. Промежуточные частицы (интермедиаты) Карбанионы – отрицательно заряженные частицы, содержащие атом углерода с неподеленной электронной парой; этот атом соединен с другими атомами тремя - или - и -связями. Два вида карбанионов: • плоскостного строения (sp 2 -гибридизация); • пирамидального строения (sp 3 -гибридизация). Чем больше делокализован отрицательный заряд, тем выше устойчивость карбаниона (ЭА повышают устойчивость. ) Флуоренил-анион Трифенилметильный анион Циклопентадиениел-анион
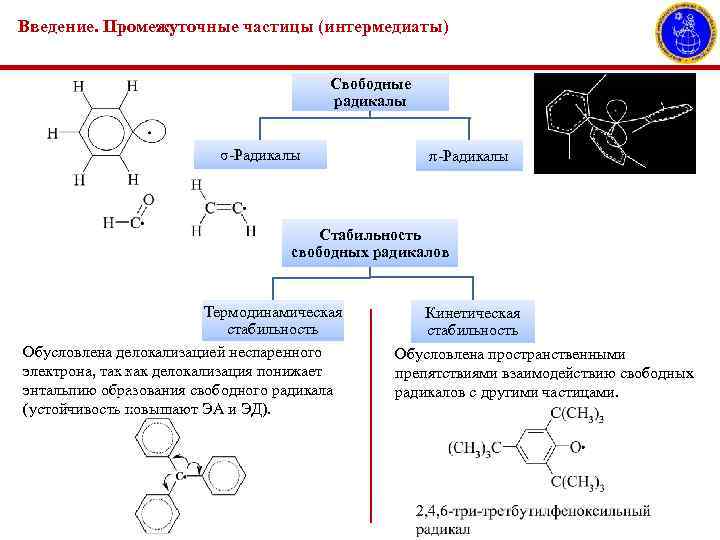 Введение. Промежуточные частицы (интермедиаты) Свободные радикалы σ-Радикалы π-Радикалы Стабильность свободных радикалов Термодинамическая стабильность Обусловлена делокализацией неспаренного электрона, так как делокализация понижает энтальпию образования свободного радикала (устойчивость повышают ЭА и ЭД). Кинетическая стабильность Обусловлена пространственными препятствиями взаимодействию свободных радикалов с другими частицами.
Введение. Промежуточные частицы (интермедиаты) Свободные радикалы σ-Радикалы π-Радикалы Стабильность свободных радикалов Термодинамическая стабильность Обусловлена делокализацией неспаренного электрона, так как делокализация понижает энтальпию образования свободного радикала (устойчивость повышают ЭА и ЭД). Кинетическая стабильность Обусловлена пространственными препятствиями взаимодействию свободных радикалов с другими частицами.
 Введение. Растворители и их роль в химических процессах Преимущества проведения реакций в жидкой фазе или в растворах: • гомолитические реакции протекают быстрее и при более низкой температуре, чем в газовой фазе; • гетеролитические реакции в газовой фазе не происходят. Характер молекулярного движения в твердых телах, жидкостях и газах: твердое тело жидкость газ Упорядоченность жидкости: • носит статистический характер; • имеет ближний порядок. Взаимодействие растворенное вещество – растворитель: сольватация, сольватная оболочка.
Введение. Растворители и их роль в химических процессах Преимущества проведения реакций в жидкой фазе или в растворах: • гомолитические реакции протекают быстрее и при более низкой температуре, чем в газовой фазе; • гетеролитические реакции в газовой фазе не происходят. Характер молекулярного движения в твердых телах, жидкостях и газах: твердое тело жидкость газ Упорядоченность жидкости: • носит статистический характер; • имеет ближний порядок. Взаимодействие растворенное вещество – растворитель: сольватация, сольватная оболочка.
 Введение. Растворители и их роль в химических процессах Типы межмолекулярных взаимодействий. 1. Неспецифические взаимодействия: 1. 1. Ориентационное взаимодействие (диполь-дипольное, ион-дипольное) 1. 2. Индукционное взаимодействие 1. 3. Дисперсионное взаимодействие Молекулы с кратными связями, тем более с цепочками сопряжения. 2. Специфические взаимодействия: 2. 1. Водородная связь; 2. 2. Донорно-акцепторное взаимодействие. Важнейшие константы растворителей: • дипольный момент; • поляризуемость; • диэлектрическая проницаемость; • температура кипения.
Введение. Растворители и их роль в химических процессах Типы межмолекулярных взаимодействий. 1. Неспецифические взаимодействия: 1. 1. Ориентационное взаимодействие (диполь-дипольное, ион-дипольное) 1. 2. Индукционное взаимодействие 1. 3. Дисперсионное взаимодействие Молекулы с кратными связями, тем более с цепочками сопряжения. 2. Специфические взаимодействия: 2. 1. Водородная связь; 2. 2. Донорно-акцепторное взаимодействие. Важнейшие константы растворителей: • дипольный момент; • поляризуемость; • диэлектрическая проницаемость; • температура кипения.
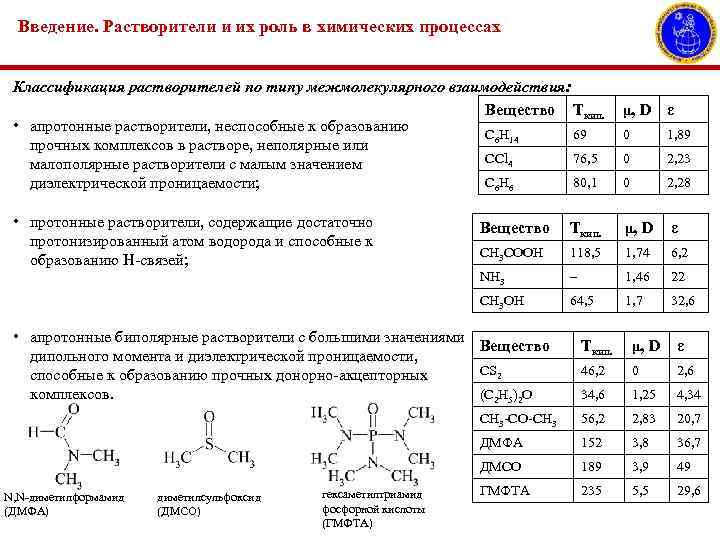 Введение. Растворители и их роль в химических процессах Классификация растворителей по типу межмолекулярного взаимодействия: Вещество Ткип. • апротонные растворители, неспособные к образованию C 6 H 14 69 прочных комплексов в растворе, неполярные или CCl 4 76, 5 малополярные растворители с малым значением C 6 H 6 80, 1 диэлектрической проницаемости; • протонные растворители, содержащие достаточно протонизированный атом водорода и способные к образованию Н-связей; μ, D ε 0 1, 89 0 2, 23 0 2, 28 Вещество Ткип. μ, D ε CH 3 COOH 118, 5 1, 74 6, 2 NH 3 – 1, 46 22 CH 3 OH 64, 5 1, 7 32, 6 • апротонные биполярные растворители с большими значениями Вещество дипольного момента и диэлектрической проницаемости, СS 2 способные к образованию прочных донорно-акцепторных комплексов. (C 2 H 5)2 O 46, 2 0 2, 6 34, 6 1, 25 4, 34 56, 2 2, 83 20, 7 152 3, 8 36, 7 ДМСО гексаметилтриамид фосфорной кислоты (ГМФТА) ε ДМФА диметилсульфоксид (ДМСО) μ, D CH 3 -CO-CH 3 N, N-диметилформамид (ДМФА) Ткип. 189 3, 9 49 ГМФТА 235 5, 5 29, 6
Введение. Растворители и их роль в химических процессах Классификация растворителей по типу межмолекулярного взаимодействия: Вещество Ткип. • апротонные растворители, неспособные к образованию C 6 H 14 69 прочных комплексов в растворе, неполярные или CCl 4 76, 5 малополярные растворители с малым значением C 6 H 6 80, 1 диэлектрической проницаемости; • протонные растворители, содержащие достаточно протонизированный атом водорода и способные к образованию Н-связей; μ, D ε 0 1, 89 0 2, 23 0 2, 28 Вещество Ткип. μ, D ε CH 3 COOH 118, 5 1, 74 6, 2 NH 3 – 1, 46 22 CH 3 OH 64, 5 1, 7 32, 6 • апротонные биполярные растворители с большими значениями Вещество дипольного момента и диэлектрической проницаемости, СS 2 способные к образованию прочных донорно-акцепторных комплексов. (C 2 H 5)2 O 46, 2 0 2, 6 34, 6 1, 25 4, 34 56, 2 2, 83 20, 7 152 3, 8 36, 7 ДМСО гексаметилтриамид фосфорной кислоты (ГМФТА) ε ДМФА диметилсульфоксид (ДМСО) μ, D CH 3 -CO-CH 3 N, N-диметилформамид (ДМФА) Ткип. 189 3, 9 49 ГМФТА 235 5, 5 29, 6
 Введение. Растворители и их роль в химических процессах Влияние смены растворителя на положение равновесия отсюда Изменение положения равновесия при смене растворителя обусловлено, главным образом, разностью энергий сольватации веществ, находящихся в равновесии. Влияние смены растворителя на скорость реакции I II Координата реакции I I II II Координата реакции
Введение. Растворители и их роль в химических процессах Влияние смены растворителя на положение равновесия отсюда Изменение положения равновесия при смене растворителя обусловлено, главным образом, разностью энергий сольватации веществ, находящихся в равновесии. Влияние смены растворителя на скорость реакции I II Координата реакции I I II II Координата реакции
 I II
I II


